Zagrożenie dla anestezjologów w czasie pandemii COVID-19

Z danych opublikowanych w „Occupational Medicine” dotyczących zgonów lekarzy z powodu COVID-19, wynika że anestezjolodzy stanowili 2,4 proc. zmarłych, podczas gdy lekarze rodzinni i lekarze stanów nagłych – aż 42,1 proc. Za główną przyczynę śmierci uznano brak wystarczającego zabezpieczenia w środki ochrony osobistej.
Artykuł Magdaleny Wujtewicz, Anny Dylczyk-Sommer, Aleksandra Aszkiełowicza, Jana Stefaniaka, Szymona Zdanowskiego, Radosława Owczuka z Kliniki Anestezjologii i Intensywnej Terapii Gdańskiego Uniwersytetu Medycznego:
– Informacje uzyskane po fali zakażeń wirusem SARS-CoV w 2003 r. pokazały, że ryzyko zakażenia jest większe w grupie osób przeprowadzających intubację tchawicy i jest ono prawdopodobnie większe u prowadzących wentylację ręczną przed intubacją, wykonujących tracheostomię oraz u prowadzących wentylację nieinwazyjną w porównaniu z ryzykiem u pozostałego personelu medycznego1. Na podstawie danych dotyczących pandemii SARS-CoV-2 można wnioskować, że pomimo dużego narażenia na zakaźny aerozol, śmiertelność wśród anestezjologów i lekarzy oddziałów anestezjologii i intensywnej terapii jest relatywnie mała w stosunku do innych specjalności czy też całości personelu medycznego. W jednym z wczesnych opracowań z Wuhan, opartych na informacjach dotyczących pierwszych 138 pacjentów z COVID-19, 29 proc. zakażonych stanowił personel szpitala, ale spośród tej grupy jedynie 5 proc. (2 przypadki) to pracownicy oddziałów intensywnej terapii, a 17,5 proc. zakażonych pracowników medycznych (7 przypadków) pracowało na oddziale ratunkowym2. W początkowej fazie pojawiania się zapaleń płuc o etiologii SARS-CoV-2 w szpitalu Tongji w Wuhan zakażeniu uległy cztery osoby przeprowadzające znieczulenie (ang. anaesthesia providers), z czego dwie zaraziły się w pracy. Od czasu wprowadzenia zasad ochrony osobistej w styczniu 2020 r. do czasu opublikowania cytowanego artykułu (26 marca 2020 r.) żadna kolejna osoba zaangażowana w udzielanie świadczeń w zakresie anestezji nie uległa tam zakażeniu3.
Na podstawie danych dotyczących zgonów lekarzy z powodu COVID-19 dostępnych w Internecie do 15 kwietnia 2020 r. Ing i wsp.4 opublikowali raport dotyczący 254 zmarłych na całym świecie lekarzy. Anestezjolodzy stanowili 2,4 proc. zmarłych, podczas gdy lekarze rodzinni (ang. general practitioners) i lekarze stanów nagłych (ang. emergency room doctors) – aż 42,1 proc.. Za główną przyczynę zgonów uznano brak wystarczającego zabezpieczenia w środki ochrony osobistej.
Do połowy października 2020 r. we Włoszech z powodu COVID-19 zmarło 181 lekarzy – czynni zawodowo anestezjolodzy i „intensywiści” stanowili 4,4 proc.5. Z kolei w Rosji i byłych republikach radzieckich spośród 859 zmarłych wszystkich pracowników służby zdrowia co najmniej 54 lekarzy to anestezjolodzy i „reanimatorzy” (6,3 proc.) – trzeba zaznaczyć, że są to dane nieoficjalne, publikowane przez bliskich zmarłych na dedykowanej stronie internetowej6.
W Polsce także nie ma oficjalnych danych odnośnie do śmiertelności wśród anestezjologów, ale 2 listopada 2020 r. w prasie medycznej ukazał się artykuł powołujący się na informacje otrzymane z resortu zdrowia, według których w Polsce zmarło 16 lekarzy; nie podano podziału na specjalności. Nie podano również, czy do zakażeń doszło w czasie pełnienia obowiązków zawodowych czy poza miejscem zatrudnienia7.
Niniejsze opracowanie ma na celu przybliżenie problemu narażenia lekarzy anestezjologów zapewniających świadczenia z zakresu anestezjologii i intensywnej terapii na zakażenie wirusem SARS-CoV-2 oraz przypomnienie zasad bezpiecznej pracy w tych warunkach.
Różne drogi transmisji wirusa SARS-CoV-2 a narażenie anestezjologa
Głównymi drogami szerzenia się wirusa SARSCoV-2 są droga kropelkowa i powietrzna i jednocześnie to one stanowią największe zagrożenie dla anestezjologa. Mniej istotna, choć nie do pominięcia ze względu na przebywanie w otoczeniu zakażonego pacjenta, jest droga powierzchniowo-kontaktowa8. Wytyczne Wydziału Bezpieczeństwa i Zdrowia Zawodowego Departamentu Pracy USA (Occupational Safety and Health Administration of Department of Labor of United States – OSHA)9 wyróżniają cztery gradacje ryzyka zakażenia SARS-CoV-2: małe, średnie, duże i bardzo duże. Anestezjolog pracujący z chorymi z COVID-19 jest narażony w stopniu dużym (kontakt z chorym w warunkach bez tworzenia się aerozolu) i bardzo dużym (udział w procedurach prowadzących do powstania aerozolu). Wiadomo także, że źródłem zakażenia są również osoby bezobjawowe10.
Droga szerzenia się wirusa determinuje działania mające na celu zmniejszenie ryzyka zakażenia. Narażenie można zmniejszyć poprzez stosowanie odpowiedniego rodzaju środków ochrony indywidualnej (ŚOI) i przestrzeganie procedur wewnątrzszpitalnych, minimalizowanie liczby procedur związanych ze zwiększonym narażeniem i skracanie czasu trwania narażenia oraz nasilenia generowania i rozprzestrzeniania się aerozolu11.
Podstawowe znaczenie w zapobieganiu zakażeniu ma prawidłowe nakładanie i zdejmowanie ŚOI12. Na stronie konsultanta krajowego w dziedzinie anestezjologii i intensywnej terapii dostępne jest polskie tłumaczenie europejskich zaleceń13.
Wytyczne OSHA kładą nacisk na racjonalne postępowanie z chorym z podejrzeniem lub z potwierdzonym COVID-19. Sugerują wydzielenie stref czystych i skażonych, wykonywanie jak największej liczby procedur poza strefą skontaminowaną, ograniczenie kontaktu z pacjentem do niezbędnego minimum i wykonywanie przy pacjencie najpierw czynności, które niosą ze sobą małe ryzyko kontaminacji, a dopiero w dalszej kolejności tych o dużym ryzyku9.
Wyniki testów diagnostycznych w kierunku SARS-CoV-2 w kontekście ryzyka dla anestezjologa
Rozpoznanie zakażenia możliwe jest wyłącznie na podstawie dodatniego wyniku RT-PCR (reverse trancription polymerase chain reaction) lub, w przypadku osób objawowych, na podstawie dostatecznie czułego i specyficznego testu antygenowego. Prezentowanie objawów COVID-19, dodatni wywiad epidemiologiczny lub badania radiologiczne sugerujące wystąpienie COVID-19, w zależności od konfiguracji, klasyfikują chorych jako podejrzanych lub prawdopodobnie chorych14–17. Jeżeli u pacjenta potwierdzono zakażenie, sytuacja jest jasna i w kontakcie z nim trzeba przestrzegać zasad bezpieczeństwa. Anestezjolog musi jednak zdawać sobie sprawę, że zarówno pacjent bezobjawowy, jak i taki, u którego uzyskano wynik ujemny, nie oznacza braku zagrożenia, gdyż:
• ujemny wynik testu RT-PCR nie świadczy o tym, że chory nie replikuje wirusa – wynik może być fałszywie ujemny18;
• odsetek bezobjawowych nosicieli wirusa SARSCoV-2, którzy nigdy nie rozwinęli objawów, wynosi ok. 20 proc.19.
Zdaniem autorów cytowanego przeglądu piśmiennictwa i metaanalizy wcześniejsze dane mówiące o odsetku wynoszącym ok. 45 proc. obejmowały także pacjentów kwalifikujących się do kategorii „przedobjawowych”;
• analiza matematyczna wykonana przez Kucirka i wsp.20 wykazała, że mediana odsetków wyników fałszywie ujemnych w dniu wystąpienia objawów wynosi 38 proc., a u 54 proc. chorych znajdujących się w grupie ryzyka zakażenia, którzy rozwinęli COVID-19, w początkowo pobranych materiałach nie wykryto obecności wirusa,
• podczas gdy specyficzność testu PCR wynosi w przybliżeniu 100 proc., to czułość różni się w zależności od badanego materiału i według niektórych źródeł może wynosić dla wymazu z gardła zaledwie 32 proc., z nosa – 63 proc., dla plwociny – 72 proc., a dla popłuczyn oskrzelikowo-pęcherzykowych – 93 proc.
Kluczową rolę odgrywa czas pobrania w kontekście fazy choroby i prawidłowe pobranie, zwłaszcza w przypadku wymazu z nosogardła. W odniesieniu do bezobjawowych nosicieli dane są skąpe21, 22.
Według wytycznych Amerykańskiego Towarzystwa Chorób Zakaźnych (Infectious Diseases Society of America – IDSA) średnia czułość badania PCR dla próbek pobranych z górnych dróg oddechowych (ślina, wymazy z ust, nosa i gardła) wynosi 76 proc. (95 proc. CI: 51–100 proc.), a dla materiału z dolnych dróg oddechowych (plwocina, aspirat tchawiczy, popłuczyny oskrzelikowo-pęcherzykowe) 89 proc. (95 proc. CI: 84–94 proc.). W związku z powyższym, w przypadku ujemnego wyniku wymazu z górnych dróg oddechowych u pacjentów objawowych, ale z dużym prawdopodobieństwem klinicznym zakażenia, wytyczne IDSA zalecają pobranie materiału z dolnych dróg oddechowych. Są to jednak wytyczne warunkowe, o bardzo małej sile dowodu. W przypadku górnych dróg oddechowych jako najbardziej czuły materiał wskazuje się wymaz z nosogardła oraz głęboki wymaz z nosa (ang. mid-turbinate swab), dla których czułość wynosi odpowiednio 97 proc. (95 proc. CI: 92–100 proc.) i 100 proc. (95 proc. CI: 93–100 proc.)23.
Ujemny wynik testu nie wyklucza więc zakażenia, a jedynie zmniejsza jego prawdopodobieństwo, pierwotnie określone za pomocą czynników epidemiologicznych, wywiadu dotyczącego ekspozycji oraz badania klinicznego i prawdopodobieństwa innego rozpoznania24.
Środowisko szpitalne jako czynnik narażenia anestezjologa
Anestezjolog, z racji specyfiki wykonywanych świadczeń, pracuje najczęściej w szpitalu, czyli w miejscu największego narażenia na zakażenie zarówno ze strony pacjentów objawowych, jak i bezobjawowych, a także ze strony bezobjawowych współpracowników. Anestezjolog wykonuje zadania, prowadząc znieczulenia, lecząc chorych na oddziale anestezjologii i intensywnej terapii (OAiIT), asekurując transport pacjentów, konsultując pacjentów w pogarszającym się stanie na różnych oddziałach szpitalnych czy też prowadząc resuscytację krążeniowo-oddechową. Spośród powyższych, jedynie w przypadku znieczuleń pacjentów, u których stwierdzono ujemny wynik badania w kierunku obecności SARS-CoV-2, anestezjolog teoretycznie powinien być względnie „bezpieczny”. W pozostałych okolicznościach ma on do czynienia z chorymi prezentującymi objawy zakażenia o największym nasileniu.
Ryzyko narażenia anestezjologa na zakażenie jest zróżnicowane w zależności od czynności wykonywanych przy pacjencie i miejsca ich wykonywania.
Ryzyko wynikające z procedury
Na podstawie przeglądu piśmiennictwa dotyczącego epidemii wirusa SARS-CoV w 2003 r. stwierdzono jednoznacznie, że dużym potencjałem zakażenia charakteryzują się przede wszystkim intubacja tchawicy, prawdopodobnie także wentylacja nieinwazyjna, tracheotomia i ręczna wentylacja z wykorzystaniem maski i worka samorozprężalnego. Uciśnięcia klatki piersiowej podczas resuscytacji, odsysanie z dróg oddechowych przed intubacją i po niej, manipulacje maską tlenową, bronchoskopia, zakładanie zgłębnika nosowo-żołądkowego i defibrylacja mogły wiązać się ze zwiększonym ryzykiem, ale nie był to związek istotny statystycznie. Inne działania, jak manipulowanie maską do wentylacji BiPAP (bilevel positive airway pressure), odsysanie z rurki intubacyjnej, odsysanie innych wydzielin, wentylacja mechaniczna, wentylacja ręczna po intubacji, wentylacja oscylacyjna, tlenoterapia z małym przepływem tlenu i wysokoprzepływowa, fizjoterapia ukierunkowana na zabiegi dotyczące klatki piersiowej oraz prowokowanie do uzyskania plwociny nie wiązały się ze zwiększonym ryzykiem.
Należy jednak odnieść się do tych wyników z dużą dozą ostrożności, gdyż w opinii autorów cytowanego opracowania jakość analizowanych badań była mała1. Rozsądne jest więc założenie, że wszystkie procedury prowadzące do tworzenia się aerozolu wiążą się z niebezpieczeństwem dla anestezjologa. Dlatego oprócz interwencji wymienionych powyżej zagrożenie dla anestezjologa stanowią także przypadkowe rozłączenie się układu pacjent–respirator oraz planowe lub przypadkowe usunięcie rurki intubacyjnej i resuscytacja pacjenta bez zabezpieczonych dróg oddechowych. W odniesieniu do odsysania z dróg oddechowych, zagrożenie to istnieje w przypadku niezabezpieczonych dróg oddechowych oraz gdy u poddanego wentylacji mechanicznej pacjenta nie stosuje się systemu odsysania w układzie zamkniętym25.
Ryzyko wynikające z miejsca wykonywania świadczenia
Anestezjolog na terenie szpitala wykonuje zadania w różnych lokalizacjach i okolicznościach. W zależności od rodzaju wykonywanej pracy stwierdzano różny stopień narażenia personelu medycznego na zakażenie2, 3. Warunki i typ świadczeń wykonywanych przez anestezjologa determinuje rodzaj narażenia, co szczegółowo opisano w dalszej części pracy. Wszędzie tam, gdzie narażenie trwa dłużej, ryzyko jest większe26, 27.
Różni się ono także w odniesieniu do sposobu i nasilenia tworzenia aerozolu28–30. Znaczenie ma także narażenie na kontakt ze skontaminowanymi powierzchniami, co znajduje odzwierciedlenie w zaleceniach dotyczących ostrożnego zdejmowania ŚOI12. O potencjalnym niebezpieczeństwie kontaktu ze skontaminowanymi powierzchniami świadczy fakt stwierdzenia replikacji wirusa w hodowlach (dotąd bardzo nielicznych) z materiału pobranego z tych powierzchni31.
Ocena pacjenta przed znieczuleniem
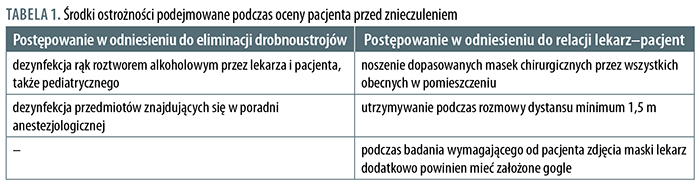
Najmniejsze ryzyko dotyczy kwalifikacji pacjenta do znieczulenia, ale nie znaczy to, że można zaniedbać środki ostrożności. Pacjenci powinni oczekiwać na wizytę z zachowaniem zasad dystansu społecznego, a najlepiej oczekiwać o określonej godzinie32. Zasady postępowania przedstawiono w tabeli 1.
Ryzyko związane z pracą na sali operacyjnej
Ryzyko tego typu wynika z przebywania anestezjologa w bezpośredniej bliskości dróg oddechowych zakażonego pacjenta. Sytuacje krytyczne dotyczą intubacji tchawicy, wentylacji ręcznej, tracheotomii/konikotomii w razie niepowodzenia intubacji i niemożności zapewnienia oksygenacji (przypadkowego) rozłączenia się układu oddechowego i ekstubacji tchawicy. Ta ostatnia okoliczność może być bardziej niebezpieczna niż sama intubacja ze względu na powrót odruchu kaszlowego, który podczas intubacji jest zniesiony. Nie bez znaczenia jest także ryzyko kontaminacji otoczenia podczas zabiegów torakochirurgicznych przebiegających z otwarciem dróg oddechowych; aby temu zapobiec, na czas otwarcia dróg oddechowych należy wstrzymać wentylację.
Ryzyko dla personelu bloku operacyjnego przebywającego aktualnie poza salą operacyjną wynika z transportowania zakażonych pacjentów korytarzem bloku oraz przypadkowego otwarcia na korytarz zewnętrznych drzwi śluzy sali operacyjnej, przy niezamkniętych drzwiach wewnętrznych.
Podstawową zasadą jest niewykonywanie zabiegów planowych u pacjentów zakażonych. Śmiertelność pooperacyjna pacjentów operowanych w trakcie infekcji COVID-19 określono na 20,4 proc., a powikłania pooperacyjne dotyczyły głównie układu oddechowego (51,2 proc.)33, 34. Z tego powodu, a także w kontekście narażenia personelu, jeżeli u chorego zakwalifikowanego do planowego zabiegu wynik jest dodatni albo pacjent odmawia poddania się testowi, operację planową trzeba odroczyć35–38. Jednocześnie w odniesieniu do pacjentów z ujemnym wynikiem PCR należy pamiętać, że ujemny wynik nie wyklucza zakażenia, a wirus jest wykrywany 1–2 dni przed wystąpieniem objawów39.
Preferowane jest znieczulenie regionalne, a nie ogólne, ze względu na unikanie instrumentacji dróg oddechowych. Znalazło to odzwierciedlenie w zaleceniach American Society of Regional Anesthesia and Pain Therapy (ASRA) i European Society of Regional Anesthesia and Pain Therapy (ESRA)40, 41.
Istnieją także argumenty za wyborem znieczulenia ogólnego. Podkreślany jest wówczas fakt otwartych dróg oddechowych u pacjenta poddanego znieczuleniu regionalnemu i ciągłej kontaminacji otoczenia, jak również to, że może zajść nagła konieczność intubacji tchawicy42.
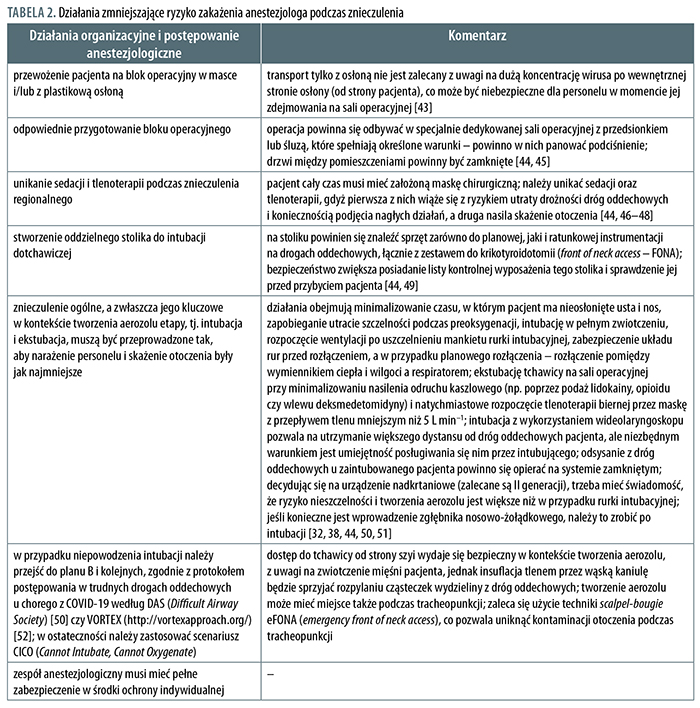
Działania zmniejszające ryzyko zakażenia anestezjologa podczas znieczulenia oraz komentarze przedstawiono w tabeli 2.
Ryzyko związane z pracą anestezjologa na OAIIT
Wszystkie wymienione wcześniej sytuacje tworzenia aerozolu są typowe dla OAiIT. Dodatkowo dochodzą jeszcze działania związane z odzwyczajeniem pacjenta od wentylacji mechanicznej czy ryzyko związane z transportem pacjenta na badania dodatkowe. Narażenie anestezjologa na OAiIT ma inną charakterystykę w porównaniu z narażeniem podczas znieczulenia, co wynika z kontaktu z więcej niż jednym chorym jednocześnie, z większym ryzykiem przypadkowego rozłączenia się układu oddechowego czy też usunięcia sztucznej drogi oddechowej, a także z potencjalną nagłą koniecznością wymiany rurki intubacyjnej/tracheotomijnej. Jeżeli zakażony pacjent oddycha samodzielnie, to stanowi on ciągłe źródło aerozolu.
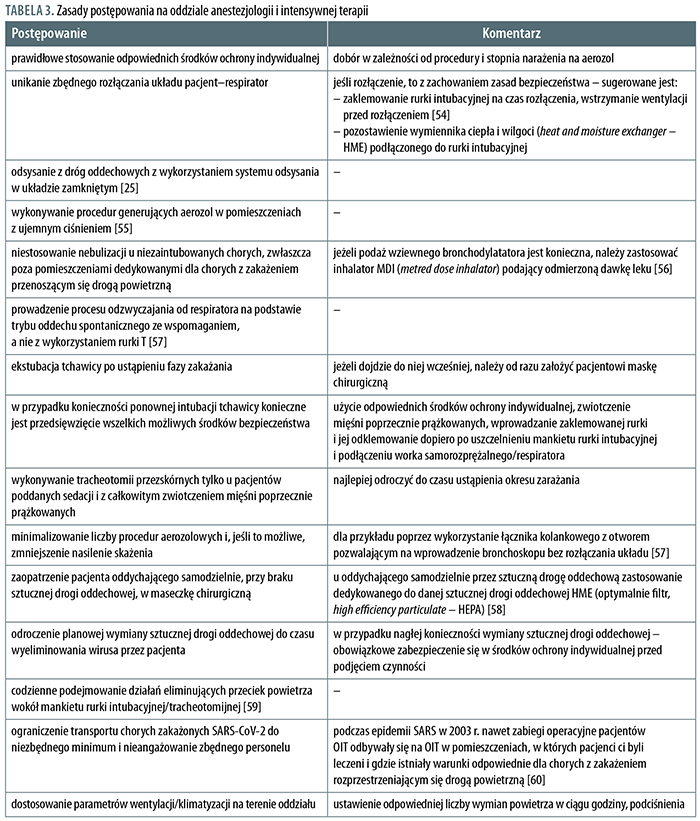
Działania prowadzące do zmniejszenia narażenia anestezjologa, a wynikające ściśle ze specyfiki OAiIT obejmują szereg zasad, które przedstawiono, wraz z komentarzami, w tabeli 3.
Co ciekawe, okazało się, że niebezpieczeństwa dla personelu OAiIT leczącego pacjentów z COVID-19 nie ograniczają się tylko do przestrzeni ściśle związanych z przebywaniem pacjentów. W badaniu z Wuhan jednym z najbardziej skontaminowanych przedmiotów poza obszarem leczenia pacjentów były myszki komputerowe – w 75 proc. i kosze na śmieci – w 60 proc. przypadków53.
Ryzyko dla anestezjologa związane z wewnątrzszpitalnym transportem chorych z COVID-19
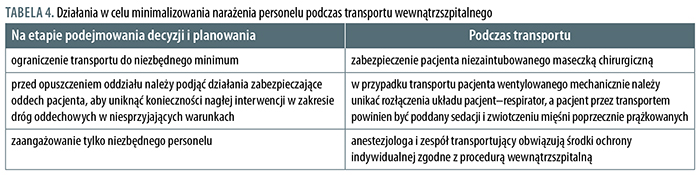
Anestezjolog bywa proszony o asekurację transportu pacjenta w ciężkim stanie, leczonego na innym niż OAIIT oddziale szpitala. Transport zaintubowanego chorego wiąże się z ryzykiem przypadkowego rozłączenia się układu oddechowego, a w odniesieniu do niezaintubowanego pacjenta – z ciągłym narażeniem na kontakt z wirusem obecnym w wydychanym powietrzu. Może także zajść konieczność podjęcia nagłej interwencji, np. resuscytacji krążeniowo-oddechowej czy intubacji tchawicy. Działania konieczne do podjęcia w odniesieniu do bezpiecznego transportu pacjentów zakażonych zostały ujęte w tabeli 4.
Ryzyko dla anestezjologa konsultującego pacjenta na terenie szpitala
Ze względu na niewystarczającą w ekstremalnej sytuacji liczbę stanowisk intensywnej terapii stanowią one zabezpieczenie dla pacjentów wymagających wentylacji mechanicznej. Pozostali pacjenci leczeni są poza OAiIT. O ile pacjenci OAiIT będący w fazie zakażania mają w większości przypadków zabezpieczone drogi oddechowe i paradoksalnie, poza sytuacjami związanymi z otwarciem tego układu, stanowią mniejsze zagrożenie dla anestezjologa, to w odniesieniu do pozostałych pacjentów sytuacja jest odwrotna. Chorzy z otwartymi drogami oddechowymi leczeni są na różnych oddziałach na terenie szpitala, mających zróżnicowane warunki lokalowe, sprzętowe i wentylacyjno-klimatyzacyjne, i stanowią bardzo duże zagrożenia dla personelu.
W razie pogorszenia się stanu pacjenta poza OAiIT konieczna staje się konsultacja anestezjologiczna, co wiąże się z narażeniem konsultującego na kontakt z aerozolem o nasileniu zależnym od wielu czynników. Zalecenia Agencji Oceny Technologii Medycznych i Taryfikacji (AOTMiT) z 25 kwietnia 2020 r.54 mówią o wykorzystaniu różnych metod prowadzących do poprawy oksygenacji poza OAiIT – tlenoterapii z zastosowaniem okularów tlenowych, maski czy dysz Venturiego, wysokoprzepływowej tlenoterapii donosowej lub wentylacji nieinwazyjnej (te dwie ostanie pod warunkiem m.in. zapewnienia minimalizacji transmisji drogą powietrzną). Tak leczony pacjent stanowi ciągłe źródło aerozolu, który różnie długo utrzymuje się w pomieszczeniu61.
Wszystkie techniki tlenoterapii biernej wiążą się z wytwarzaniem aerozolu. Nie wiadomo, na jaką odległość on się rozprzestrzenia w warunkach klinicznych, więc przy ich stosowaniu konieczna jest pełna ochrona personelu medycznego54. Wiadomo tylko, że w warunkach doświadczalnych, z podciśnieniem i nieuwzględniających oddychania, kaszlu itp., rozprzestrzenianie się aerozolu w przypadku tlenoterapii i wentylacji nieinwazyjnej nie przekracza 1 m i waha się od mniej niż 10 cm dla maski bez oddechu zwrotnego przy przepływie tlenu 12 L min–1 do 1 m dla kaniuli nosowej z przepływem tlenu 5 L min–162–65.
Działania mające na celu zmniejszenie narażenia personelu u pacjentów niezaintubowanych zebrał i przedstawił w artykule przeglądowym Kaur i wsp.66. W odróżnieniu od zaleceń AOTMiT, nie zaleca on masek Venturiego. Podobnie należy unikać masek bez oddechu zwrotnego, chyba że mają filtry na otworach wydechowych. W przypadku wysokoprzepływowej tlenoterapii donosowej ważny jest właściwy dobór rozmiaru kaniuli i założenie pacjentowi maseczki chirurgicznej. Zalecenia co do interfejsów wentylacji nieinwazyjnej nie odbiegają od zaleceń AOTMiT – najbezpieczniejszy dla otoczenia jest hełm, a następnie w kolejności maska twarzowa niewentylowana z układem dwuramiennym, maska twarzowa niewentylowana z układem jednoramiennym, maska wentylowana.
Różnice w zaleceniach mogą wynikać z tego, że w trakcie pandemii SARS-CoV-2 wiedza jest nabywana na bieżąco, dlatego pewne informacje opublikowane na początkowym jej etapie mogą ulec dezaktualizacji.
Ryzyko dla anestezjologa udzielającego świadczeń w szpitalu polowym i tymczasowym
Nowym wyzwaniem dla cywilnych anestezjologów może się okazać praca w warunkach szpitali polowych i tymczasowych. W czasie przygotowywania artykułu Wojsko Polskie dysponowało dwoma mobilnymi szpitalami polowymi (1. i 2. Wojskowy Szpital Polowy) i tworzone były stacjonarne szpitale cywilne, tzw. tymczasowe.
Szpitale polowe i tymczasowe okazały się skutecznym rozwiązaniem w wielu krajach doświadczających liczby zachorowań przekraczających możliwości tradycyjnych szpitali, a zalecenie dotyczące wykorzystywania struktur tymczasowych do opieki nad pacjentami z COVID-19 znalazło się w wytycznych WHO67, 68. Na świecie funkcjonują one w trzech głównych trybach: szpitale – izolatoria dla chorych o łagodnym i umiarkowanym nasileniu objawów (np. Szpitale Fangcang w Chinach69, 70), szpitale przeznaczone dla chorych wymagających intensywnej terapii oraz jednostki typu step-down, przeznaczone do rekonwalescencji pacjentów wypisanych z oddziałów intensywnej terapii71, 72. Niektóre z tymczasowych jednostek funkcjonują w trybie mieszanym. Oprócz zagrożeń dla anestezjologa wynikających z „typowego” narażenia na kontakt z patogenem zakaźnym dochodzi tu jeszcze aspekt pracy w dotychczas nieznanych warunkach i z nieznajomymi osobami. Może się to wiązać z problemami komunikacyjnymi czy też koniecznością odstępstw od wypracowanych na co dzień, realizowanych w znanym otoczeniu przyzwyczajeń i zachowań dających pewne, także psychiczne, poczucie bezpieczeństwa.
Narażenie anestezjologa podczas wewnątrzszpitalnej resuscytacji krążeniowo-oddechowej i środki bezpieczeństwa
Opracowane zostały wytyczne postępowania obowiązującego u chorych zakażonych wirusem SARS-CoV-273.
Ze względu na zwiększone ryzyko narażenia personelu w przypadku konieczności podjęcia nagłych działań, ogromne znaczenie ma wcześniejsza identyfikacja pacjentów w stanie mogącym prowadzić do zatrzymania krążenia. Powinno się też wcześnie zidentyfikować chorych, u których właściwa będzie decyzja o niepodejmowaniu resuscytacji.
Resuscytacja niezaintubowanego pacjenta wymaga pełnego zabezpieczenia w ŚOI; należy je zastosować przed rozpoczęciem uciśnięć klatki piersiowej i/lub udrożnieniem dróg oddechowych. Minimalne zabezpieczenie obejmuje maskę FFP3 (FFP2 lub N95, jeśli FFP3 nie jest dostępna), ochronę oczu i twarzy, fartuch z długimi rękawami i rękawice. Procedura szpitalna może wymagać większego zabezpieczenia, np. w dwie pary rękawic.
Defibrylację za pomocą automatycznego defibrylatora (automated external defibrilator – AED) lub defibrylatora klasycznego, jako procedurę o małym ryzyku generowania aerozolu, może wykonać personel medyczny zabezpieczony w fartuch z krótkim rękawem i rękawice, płynoodporną maseczkę chirurgiczną i ochronę oczu.
Podstawowe różnice w resuscytacji niezaintubowanego pacjenta z (podejrzeniem) COVID-19 w stosunku do „klasycznego” postępowania u dorosłych niezakażonych pacjentów przedstawiono w tabeli 5.

W przypadku pacjenta z zaintubowaną tchawicą, wentylowanego mechanicznie, ratownicy powinni nosić ŚOI chroniące przed cząstkami utrzymującymi się w powietrzu.
Modyfikacje „klasycznego” postępowania w stosunku do działań podejmowanych u dorosłych niezakażonych pacjentów przedstawiono w tabeli 5.
Czynniki osobnicze w kontekście narażenia anestezjologa na zachorowanie na COVID-19
Czynniki osobnicze stanowią zupełnie inny rodzaj ryzyka w porównaniu z omówionymi powyżej, nie można jednak go pominąć. W przypadku anestezjologa pracującego w ciągłym narażeniu na zakażenie wirusem SARS-CoV-2 osobnicze czynniki predysponujące nabierają większego znaczenia niż w przypadku populacji ogólnej. Mogą przyczynić się do nasilenia ciężkości COVID-19 lub zwiększenia ryzyka śmierci lekarza. Anestezjolog, tak jak każdy inny człowiek, może mieć choroby współistniejące. Kwestie ryzyka względnego i bezwzględnego dla anestezjologa i możliwości modyfikacji ryzyka bezwzględnego przedstawił Cook74.
Ryzyko osobnicze w przypadku każdego człowieka wynika z wieku, płci, chorób współistniejących i rasy. Wiek stanowi najważniejszy, pojedynczy czynnik ryzyka – wraz wiekiem zwiększa się ryzyko zgonu75. W odniesieniu do płci większe ryzyko zgonu mają mężczyźni76. W metaanalizie na podstawie 22 doniesień stwierdzono niemal dwukrotnie większą częstość występowania chorób współistniejących wśród przypadków śmiertelnych w porównaniu ze wszystkimi przypadksmi zachorowań. Najbardziej obciążającym schorzeniem okazało się nadciśnienie tętnicze, a następnie kolejno cukrzyca i choroby układu oddechowego77. Wiadomo, że w przypadku wielu innych chorób przewlekłych istnieje, niezależne od wieku człowieka, zwiększone ryzyko ciężkiego przebiegu COVID-19, a w przypadku jeszcze innych obciążeń ryzyko to może być zwiększone78. Z racji tego, że niektóre z chorób współistniejących pojawiają się wraz z wiekiem, starsi anestezjolodzy, szczególnie mężczyźni, są dodatkowo narażeni na cięższy przebieg choroby.
Demograficznym niemodyfikowalnym czynnikiem zwiększonego ryzyka zgonu jest rasa inna niż biała i dotyczy to także lekarzy, co opisano już po upływie pierwszych dwóch miesięcy od ogłoszenia pandemii w raporcie z Wielkiej Brytanii79. Ryzyko zgonu jest największe u przedstawicieli rasy czarnej, pochodzących z Afryki i Karaibów80.
Wnioski
Jak wynika z powyższych rozważań, realizowanie świadczeń z zakresu anestezjologii i intensywnej terapii wiąże się ze stałym, dużym lub bardzo dużym ryzykiem narażenia na zakażenie. Optymizmem napawa fakt relatywnie małej zachorowalności w tej grupie lekarzy, trzeba jednak podkreślić, że ma to związek z zachowywaniem odpowiednich środków ostrożności. Kluczowe jest właściwe stosowanie ŚOI oraz podejmowanie działań minimalizujących ryzyko zakażenia. Konieczne jest stosowanie się do lokalnie obowiązujących procedur wewnątrzszpitalnych. Obowiązuje zasada zapewnienia, w pierwszej kolejności, bezpieczeństwa sobie i współpracownikom. Jedynie dokładne przestrzeganie obowiązujących zaleceń i wytycznych, prawidłowa praca zespołowa i stosowanie ŚOI pozwolą na zmniejszenie ryzyka zakażenia się anestezjologa wirusem SARS-CoV-2.
Piśmiennictwo:
1. Tran K, Cimon K, Severn M, Pessoa-Silva CL, Conly J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PLoS One 2012; 7: e35797. doi: 10.1371/journal.pone.0035797.
2. Wang D, Hu B, Hu C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA 2020; 323: 1061-1069. doi: 10.1001/ jama.2020.1585.
3. Meng L, Qiu H, Wan L, et al. Intubation and ventilation amid the COVID-19 outbreak: Wuhan’s experience. Anesthesiology 2020; 132; 1317-1332. doi: 10.1097/ALN.0000000000003296.
4. Ing EB, Xu QA, Salimi A, et al. Physician deaths from corona virus (COVID-19) disease. Occup Med (Lond) 2020; 70: 370-374. doi: 10.1093/occmed/kqaa088.
5. FNOMCeO. Elenco dei Medici caduti nel corso dell’epidemia di Covid-19 [Internet]. 26th June 2020. Available from: https://portale.fnomceo. it/elenco-dei-medici-caduti-nel-corso-dellepidemia-di-covid-19/ (Accessed: 2.11.2020).
6. Memory List. List of doctors, nurses, nurses, laboratory assistants and other medical workers who died during the COVID pandemic. [Internet]. 2020. Available from: https://sites.google.com/view/covid-memory/ home?authuser=0 (Accessed: 2.11.2020).
7. Ważna M. Z powodu COVID-19 zmarło w Polsce 36 pracowników ochrony zdrowia [Internet]. 2020. Available from: https://www.medonet. pl/koronawirus/koronawirus-w-polsce,z-powodu-covid-19-zmarlow-polsce-36-pracownikow-ochrony-zdrowia,artykul,30464008.html (Accessed: 2.11.2020).
8. World Health Organization. Transmission of SARS-CoV-2: implications for infection prevention precautions. Scientific brief, 09 July 2020 [Internet]. 2020, p. 1–10. Available from: https://www.who.int/newsroom/commentaries/detail/transmission-of-sars-cov-2-implicationsfor-infection-prevention-precautions (Accessed: 2.11.2020).
9. United States Department of Labor. COVID-19 – Control and Prevention | Retail Workers and Employers in Critical and High CustomerVolume Environments | Occupational Safety and Health Administration [Internet]. 2020. Available from: https://www.osha.gov/SLTC/ covid-19/retail.html (Accessed: 2.11.2020).
10. European Centre for Disease Prevention and Control. Transmission of COVID-19 [Internet]. 2020. Available from: https://www.ecdc.europa. eu/en/covid-19/latest-evidence/transmission (Accessed: 2.11.2020).
11. Center for Disease Control (CDC). Interim Infection Prevention and Control Recommendations for Healthcare Personnel During the Coronavirus Disease 2019 (COVID- 19) Pandemic Additional Key Resources: 2 . Recommended infection prevention and control (IPC) practices when caring for a pa [Internet]. 2019, p. 1–11. Available from: https://www.cdc.gov/coronavirus/2019-ncov/hcp/infectioncontrol-recommendations.html (Accessed: 2.11.2020).
12. European Centre for Disease Prevention and Control. Personal protective equipment (PPE) needs in healthcare settings for the care of patients with suspected or confirmed novel coronavirus (2019-nCoV) [Internet]. European Centre for Disease Prevention and Control Guidelined 2020, p. 1–4. Available from: https://www.ecdc.europa. eu/en/publications-data/guidance-wearing-and-removing-personalprotective-equipment-healthcare-settings (Accessed: 2.11.2020).
13. KK AIT – Konsultant Krajowy w dziedzinie Anestezjologii i Intensywnej Terapii [Internet]. Available from: https://konsultantait. gumed.edu.pl/ (Accessed: 22.11.2020).
14. European Centre for Disease Prevention and Control. Case definition for coronavirus disease 2019 (COVID-19), as of 29 May 2020 [Internet]. Eur. Cent. Dis. Prev. Control – Surveill. 2020. Available from: https://www.ecdc.europa.eu/en/covid-19/surveillance/case-definition (Accessed: 2.11.2020). 15. World Health Organization. WHO COVID-19 Case definition [Internet]. 2020. Available from: https://www.who.int/publications/i/item/ WHO-2019-nCoV-Surveillance_Case_Definition-2020.1 (Accessed: 2.11.2020).
16. World Health Organization (WHO). Antigen-detection in the diagnosis of SARS-CoV-2 infection using rapid immunoassays [Internet]. Interim Guid 2020. Available from: https://www.who.int/ publications/i/item/antigen-detection-in-the-diagnosis-of-sars-cov2infection-using-rapid-immunoassays (Accessed: 16.11.2020).
17. Centers for Disease Control and Prevention. Interim Guidance for Rapid Antigen Testing for SARS-CoV-2. Cdc [Internet]. 2020; 1–7. Available from: https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antigen-tests-guidelines.html (Accessed: 16.11.2020).
18. Woloshin S, Patel N, Kesselheim AS. False negative tests for SARSCoV-2 infection – challenges and implications. N Engl J Med 2020; 383: e38. doi: 10.1056/nejmp2015897.
19. Buitrago-Garcia D, Egli-Gany D, Counotte MJ, et al. Occurrence and transmission potential of asymptomatic and presymptomatic SARSCoV-2 infections: a living systematic review and meta-analysis. PLoS Med 2020; 17: e1003346. doi: 10.1371/journal.pmed.1003346.
20. Kucirka LM, Lauer SA, Laeyendecker O, et al. Variation in false-negative rate of reverse transcriptase polymerase chain reaction-based SARSCoV-2 tests by time since exposure. Ann Intern Med 2020: M20-1495. doi: 10.7326/M20-1495.
21. Wyllie AL, Fournier J, Casanovas-Massana A, et al. Saliva or nasopharyngeal swab specimens for detection of SARS-CoV-2. N Engl J Med 2020; 383: 1283-1286. doi: 10.1056/nejmc2016359.
22. Wang W, Xu Y, Gao R, et al. Detection of SARS-CoV-2 in different types of clinical specimens. JAMA 2020; 323: 1843-1844. doi: 10.1001/ jama.2020.3786.
23. Hanson KE, Caliendo AM, Arias CA, et al. Infectious Diseases Society of America guidelines on the diagnosis of COVID-19, part 3: diagnostics. 2020. https://www.idsociety.org/practice-guideline/ covid-19-guideline-diagnostics/ (Accessed: 16.11.2020).
24. Watson J, Whiting PF, Brush JE. Interpreting a COVID-19 test result. BMJ 2020; 369: m1808. doi: 10.1136/bmj.m1808.
25. The Faculty of Intensive Care Medicine, The Intensive Care Society, The Association of Anaesthetists, The Royal College of Anaesthetists, The Difficult Airway Society. Airway management – ICM Anaesthesia COVID-19. 2020. Available at: https://icmanaesthesiacovid-19. org/covid-19-airway-management-principles (Accessed: 2.11.2020).
26. Ng OT, Marimuthu K, Koh V, et al. SARS-CoV-2 seroprevalence and transmission risk factors among high-risk close contacts: a retrospective cohort study. Lancet Infect Dis 2020. doi: 10.1016/s1473- 3099(20)30833-1.
27. Centers for Disease Control and Prevention (CDC). Scientic brief: SARS-CoV-2 and potential airborne transmission. Centers Dis Control Prev 2020. Available at: https://www.cdc.gov/coronavirus/2019- ncov/more/scientific-brief-sars-cov-2.html (Accessed: 23.11.2020).
28. Guallar MP, Meiriño R, Donat-Vargas C, Corral O, Jouvé N, Soriano V. Inoculum at the time of SARS-CoV-2 exposure and risk of disease severity. Int J Infect Dis 2020; 97: 290-292. doi: 10.1016/j.ijid.2020.06.035.
29. Hamner L, Dubbel P, Capron I, et al. High SARS-CoV-2 attack rate following exposure at a choir practice – Skagit County, Washington, March 2020. MMWR Morb Mortal Wkly Rep 2020; 69: 606-610. doi: 10.15585/mmwr.mm6919e6.
30. Alsved M, Matamis A, Bohlin R, et al. Exhaled respiratory particles during singing and talking. Aerosol Science and Technology 2020; 54: 1245-1248. doi: 10.1080/02786826.2020.1812502.
31. Santarpia JL, Rivera DN, Herrera VL, et al. Aerosol and surface contamination of SARS-CoV-2 observed in quarantine and isolation care. Sci Rep 2020; 10: 12732. doi: 10.1038/s41598-020-69286-3.
32. Velly L, Gayat E, Quintard H, et al. Guidelines: anaesthesia in the context of COVID-19 pandemic. Anaesth Crit Care Pain Med 2020; 39: 395-415. doi: 10.1016/j.accpm.2020.05.012.
33. Stahel PF. How to risk-stratify elective surgery during the COVID-19 pandemic? Patient Safety Surg 2020; 14: 8. doi: 10.1186/s13037-020- 00235-9.
34. Nepogodiev D, Bhangu A, Glasbey JC, et al. Mortality and pulmonary complications in patients undergoing surgery with perioperative SARS-CoV-2 infection: an international cohort study. Lancet 2020; 396: 27-38. doi: 10.1016/S0140-6736(20)31182-X.
35. American Society of Anesthesiologists, Anesthesia Patient Safety Foundation. COVID-19 and Anesthesia FAQ – Anesthesia Patient Safety Foundation. 2020. Available at: https://www.apsf.org/covid-19-and-anesthesiafaq/ (Accessed: 2.11.2020).
36. American Society of Anesthesiologists, Anesthesia Patient Safety Foundation. ASA-APSF Joint Statement on Non-Urgent Care During the COVID-19 Outbreak – Anesthesia Patient Safety Foundation. 2020. Available at: https://www.apsf.org/news-updates/asa-apsf-joint-statement-on-non-urgent-care-during-the-covid-19-outbreak/ (Accessed: 2.11.2020).
37. Bhangu A, Lawani I, Ng-Kamstra JS, et al. Global guidance for surgical care during the COVID-19 pandemic. Br J Surg 2020; 107: 1097- 1103. doi: 10.1002/bjs.11646.
38. Odor PM, Neun M, Bampoe S, Clark S, Heaton D, Hoogenboom EM, et al. Anaesthesia and COVID-19: infection control. Br J Anaesth 2020; 125: 16-24. doi: 10.1016/j.bja.2020.03.025.
39. World Health Organization. Report of the WHO-China joint mission on coronavirus disease 2019 (COVID-19). 2020. https://www.who. int/publications/i/item/report-of-the-who-china-joint-mission-oncoronavirus-disease-2019-(covid-19) (Accessed: 2.11.2020).
40. Sondekoppam RV, Lobo CA, Kolli S, Kalagara HK. Practice recommendations on neuraxial anesthesia and peripheral nerve blocks during the COVID-19 pandemic. A joint statement by the American Society of Regional Anesthesia and Pain Medicine (ASRA) and European Society of Regional Anesthesia and Pain Therapy (ESRA). 2020. Available at: https://www.asra.com/page/2905/practice-recommendations-on-neuraxial-anesthesia-and-peripheral-nerve-blocksdur (Accessed: 23.11.2020). 41. Uppal V, Sondekoppam RV, Landau R, El‐Boghdadly K, Narouze S, Kalagara HKP. Neuraxial anaesthesia and peripheral nerve blocks during the COVID‐19 pandemic: a literature review and practice recommendations. Anaesthesia 2020; 75: 1350-1363. doi: 10.1111/ anae.15105.
42. Singleton MN, Soffin EM. Daring discourse: are we ready to recommend neuraxial anesthesia and peripheral nerve blocks during the COVID-19 pandemic? A pro-con. Reg Anesth Pain Med 2020; 45: 831-834.
43. Begley JL, Lavery KE, Nickson CP, Brewster DJ. The aerosol box for intubation in coronavirus disease 2019 patients: an in‐situ simulation crossover study. Anaesthesia 2020; 75: 1014-1021. doi: 10.1111/ anae.15115.
44. Brewster DJ, Chrimes N, Do TBT, et al. Consensus statement: Safe Airway Society principles of airway management and tracheal intubation specific to the COVID-19 adult patient group. Med J Aust 2020; 212: 472-481. doi: 10.5694/mja2.50598.
45. Tian Y, Gong Y, Liu P, et al. Infection prevention strategy in operating room during coronavirus disease 2019 (COVID-19) outbreak. Chin Med Sci J 2020; 35: 114-120. doi: 10.24920/003739.
46. Zhong Q, Liu YY, Luo Q, et al. Spinal anaesthesia for patients with coronavirus disease 2019 and possible transmission rates in anaesthetists: retrospective, single-centre, observational cohort study. Br J Anaesth 2020; 124: 670-675.
47. Lie SA, Wong SW, Wong LT, Wong TGL, Chong SY. Practical considerations for performing regional anesthesia: lessons learned from the COVID-19 pandemic. Can J Anesth 2020; 67: 885-892. doi: 10.1007/ s12630-020-01637-0.
48. World Health Organization. Infection prevention and control during health care when novel coronavirus (nCoV) infection is suspected. 2020. Available at: https://www.who.int/publications/i/item/10665- 331495 (Accessed: 2.11.2020).
49. Soma M, Jacobson I, Brewer J, Blondin A, Davidson G, Singham S. Operative team checklist for aerosol generating procedures to minimise exposure of healthcare workers to SARS-CoV-2. Int J Pediatr Otorhinolaryngol 2020; 134: 110075. doi: 10.1016/j.ijporl.2020.110075.
50. Cook TM, El-Boghdadly K, McGuire B, McNarry AF, Patel A, Higgs A. Consensus guidelines for managing the airway in patients with COVID-19: guidelines from the Difficult Airway Society, the Association of Anaesthetists the Intensive Care Society, the Faculty of Intensive Care Medicine and the Royal College of Anaesthetist. Anaesthesia 2020; 75: 785-799. doi: 10.1111/anae.15054.
51. Tung A, Fergusson NA, Ng N, Hu V, Dormuth C, Griesdale DEG. Medications to reduce emergence coughing after general anaesthesia with tracheal intubation: a systematic review and network meta-analysis. Br J Anaesth 2020; 124: 480-495. doi: 10.1016/j.bja.2019.12.041.
52. Chrimes N. The Vortex: a universal ‘high-acuity implementation tool’ for emergency airway management. Br J Anaesth 2016; 117: i20-7. doi: 10.1093/bja/aew175.
53. Guo ZD, Wang ZY, Zhang SF, et al. Aerosol and surface distribution of severe acute respiratory syndrome coronavirus 2 in hospital wards, Wuhan, China, 2020. Emerg Infect Dis 2020; 26: 1586-1591. doi: 10.3201/eid2607.200885.
54. Agencja Oceny Technologii Medycznych i Taryfikacji. Zalecenia w COVID-19. Polskie zalecenia diagnostyczno-terapeutyczne oraz organizacyjne w zakresie opieki nad osobami zakażonymi lub narażonymi na zakażenie SARS-CoV-2. Wersja 1.1. 2020. Available at: https://www.aotm.gov.pl/media/2020/07/2020.04.25_zalecenia-covid19_v1.11-1.pdf.
55. Alhazzani W, Møller MH, Arabi YM, et al. Surviving Sepsis Campaign: guidelines on the management of critically ill adults with coronavirus disease 2019 (COVID-19). Intensive Care Med 2020; 46: 854-887. doi: 10.1007/s00134-020-06022-5.
56. Wax RS, Christian MD. Practical recommendations for critical care and anesthesiology teams caring for novel coronavirus (2019-nCoV) patients. Can J Anesth 2020; 67: 568-576. doi: 10.1007/s12630-020- 01591-x.
57. Chaudhry D, Govil D, Samavedam S, et al. Airway management and related procedures in critically ill COVID-19 patients: position statement of the Indian Society of Critical Care Medicine. Indian J Crit Care Med 2020; 24: 630-642. doi: 10.5005/jp-journals-10071-23471.
58. Brook I. Prevention of COVID-19 infection in neck breathers, including laryngectomees. Int Arch Otorhinolaryngol 2020; 24: 253-254. doi: 10.1055/s-0040-1713140.
59. Harrison L, Ramsden J. Tracheostomy guidance during the COVID-19 Pandemic. Entuk 2020, p. 8373. Available from: https://www.entuk. org/tracheostomy-guidance-during-covid-19-pandemic (Accessed: 2.11.2020).
60. Tien HC, Chughtai T, Jogeklar A, Cooper AB, Brenneman F. Elective and emergency surgery in patients with severe acute respiratory syndrome (SARS). Can J Surg 2005; 48: 71-74.
61. van Doremalen N, Bushmaker T, Morris DH, et al. Aerosol and surface stability of SARS-CoV-2 as compared with SARS-CoV-1. N Engl J Med 2020; 382: 1564-1567. doi: 10.1056/nejmc2004973.
62. Hui DSC, Chan MTV, Chow B. Aerosol dispersion during various respiratory therapies: a risk assessment model of nosocomial infection to health care workers. Hong Kong Med J 2014; 20: 9-13.
63. Hui DS, Chow BK, Lo T, et al. Exhaled air dispersion during noninvasive ventilation via helmets and a total facemask. Chest 2015; 147: 1336-1343.
64. Hui DS, Chow BK, Lo T, et al. Exhaled air dispersion during highflow nasal cannula therapy versus CPAP via different masks. Eur Respir J 2019; 53. doi: 10.1183/13993003.02339-2018.
65. Ferioli M, Cisternino C, Leo V, Pisani L, Palange P, Nava S. Protecting healthcare workers from sars-cov-2 infection: Practical indications. Eur Respir Rev 2020; 29: 1-10. doi: 10.1183/16000617.0068-2020.
66. Kaur R, Weiss TT, Perez A, et al. Practical strategies to reduce nosocomial transmission to healthcare professionals providing respiratory care to patients with COVID-19. Critical Care 2020; 24: 571. doi: 10.1186/s13054-020-03231-8.
67. World Health Organization. Praktyczne aspekty postępowania z pacjentem z COVID-19 w placówkach opieki zdrowotnej i w opiece środowiskowej. Pediatr Med Rodz 2020; 16: 27-32.
68. World Health Organization. Operational considerations for case management of COVID-19 in health facility and community: interim guidance, 19 March 2020. Geneva: World Health Organization; 2020.
69. Chen S, Zhang Z, Yang J, et al. Fangcang shelter hospitals: a novel concept for responding to public health emergencies. Lancet 2020; 395: 1305-1314. doi: 10.1016/S0140-6736(20)30744-3.
70. Hu CS. Analysis of COVID-19 cases and public measures in China. SN Compr Clin Med 2020; 2: 1306-1312. doi: 10.1007/s42399-020- 00426-6.
71. The 3 types of Covid-19 field hospitals (and what they mean for your organisation). Advisory Board 2020. Available at: https://www. advisory.com/research/global-forum-for-health-care-innovators/theforum/2020/04/field-hospitals (Accessed: 3.11.2020).
72. American Heart Association. Confronting coronavirus: how hospitals are transforming in coronavirus fight | AHA. Available at: https://www. aha.org/aha-center-health-innovation-market-scan/2020-04-08-confronting-coronavirus-how-hospitals-are (Accessed: 3.11.2020).
73. European Resuscitation Council. European Resuscitation Council COVID-19 Guidelines. 2020. Available at: https://www.erc.edu/covid.
74. Cook TM. Risk to health from COVID‐19 for anaesthetists and intensivists – a narrative review. Anaesthesia 2020;
75: 1494-1508. doi: 10.1111/anae.15220. 75. CDC. COVID-19 Hospitalization and Death by Age. Coronavirus Dis 2019 [Internet]. 2020. Available from: https://www.cdc.gov/ coronavirus/2019-ncov/covid-data/investigations-discovery/hospitalization-death-by-age.html (Accessed 3.11.2020).
76. Kelada M, Anto A, Dave K, Saleh SN. The role of sex in the risk of mortality from COVID-19 amongst adult patients: a systematic review. Cureus 2020; 12: e10114. doi: 10.7759/cureus.10114.
77. Gold MS, Sehayek D, Gabrielli S, Zhang X, McCusker C, Ben-Shoshan M. COVID-19 and comorbidities: a systematic review and meta-analysis. Postgrad Med 2020; 132: 749-755. doi: 10.1080/00325481.2020.1786964.
78. Centers for Disease Control and Prevention (CDC). Certain Medical Conditions and Risk for Severe COVID-19 Illness | CDC. 2020. Available at: https://www.cdc.gov/coronavirus/2019-ncov/need-extra-precautions/ people-with-medical-conditions.html (Accessed: 3.11.2020).
79. Platt L, Warwick R. Are some ethnic groups more vulnerable to COVID-19 than others? The Institute for Fiscal Studies. 2020. Available at: www.nuffieldfoundation.org (Accessed: 3.11.2020).
80. Public Health England. Beyond the Data: Understanding the Impact of COVID-19 on BAME Communities. 2020. Available at: www.facebook.com/PublicHealthEngland (Accessed: 3.11.2020).
Artykuł opublikowano w „Anestezjologii Intensywnej Terapia” 5/2020.
– Informacje uzyskane po fali zakażeń wirusem SARS-CoV w 2003 r. pokazały, że ryzyko zakażenia jest większe w grupie osób przeprowadzających intubację tchawicy i jest ono prawdopodobnie większe u prowadzących wentylację ręczną przed intubacją, wykonujących tracheostomię oraz u prowadzących wentylację nieinwazyjną w porównaniu z ryzykiem u pozostałego personelu medycznego1. Na podstawie danych dotyczących pandemii SARS-CoV-2 można wnioskować, że pomimo dużego narażenia na zakaźny aerozol, śmiertelność wśród anestezjologów i lekarzy oddziałów anestezjologii i intensywnej terapii jest relatywnie mała w stosunku do innych specjalności czy też całości personelu medycznego. W jednym z wczesnych opracowań z Wuhan, opartych na informacjach dotyczących pierwszych 138 pacjentów z COVID-19, 29 proc. zakażonych stanowił personel szpitala, ale spośród tej grupy jedynie 5 proc. (2 przypadki) to pracownicy oddziałów intensywnej terapii, a 17,5 proc. zakażonych pracowników medycznych (7 przypadków) pracowało na oddziale ratunkowym2. W początkowej fazie pojawiania się zapaleń płuc o etiologii SARS-CoV-2 w szpitalu Tongji w Wuhan zakażeniu uległy cztery osoby przeprowadzające znieczulenie (ang. anaesthesia providers), z czego dwie zaraziły się w pracy. Od czasu wprowadzenia zasad ochrony osobistej w styczniu 2020 r. do czasu opublikowania cytowanego artykułu (26 marca 2020 r.) żadna kolejna osoba zaangażowana w udzielanie świadczeń w zakresie anestezji nie uległa tam zakażeniu3.
Na podstawie danych dotyczących zgonów lekarzy z powodu COVID-19 dostępnych w Internecie do 15 kwietnia 2020 r. Ing i wsp.4 opublikowali raport dotyczący 254 zmarłych na całym świecie lekarzy. Anestezjolodzy stanowili 2,4 proc. zmarłych, podczas gdy lekarze rodzinni (ang. general practitioners) i lekarze stanów nagłych (ang. emergency room doctors) – aż 42,1 proc.. Za główną przyczynę zgonów uznano brak wystarczającego zabezpieczenia w środki ochrony osobistej.
Do połowy października 2020 r. we Włoszech z powodu COVID-19 zmarło 181 lekarzy – czynni zawodowo anestezjolodzy i „intensywiści” stanowili 4,4 proc.5. Z kolei w Rosji i byłych republikach radzieckich spośród 859 zmarłych wszystkich pracowników służby zdrowia co najmniej 54 lekarzy to anestezjolodzy i „reanimatorzy” (6,3 proc.) – trzeba zaznaczyć, że są to dane nieoficjalne, publikowane przez bliskich zmarłych na dedykowanej stronie internetowej6.
W Polsce także nie ma oficjalnych danych odnośnie do śmiertelności wśród anestezjologów, ale 2 listopada 2020 r. w prasie medycznej ukazał się artykuł powołujący się na informacje otrzymane z resortu zdrowia, według których w Polsce zmarło 16 lekarzy; nie podano podziału na specjalności. Nie podano również, czy do zakażeń doszło w czasie pełnienia obowiązków zawodowych czy poza miejscem zatrudnienia7.
Niniejsze opracowanie ma na celu przybliżenie problemu narażenia lekarzy anestezjologów zapewniających świadczenia z zakresu anestezjologii i intensywnej terapii na zakażenie wirusem SARS-CoV-2 oraz przypomnienie zasad bezpiecznej pracy w tych warunkach.
Różne drogi transmisji wirusa SARS-CoV-2 a narażenie anestezjologa
Głównymi drogami szerzenia się wirusa SARSCoV-2 są droga kropelkowa i powietrzna i jednocześnie to one stanowią największe zagrożenie dla anestezjologa. Mniej istotna, choć nie do pominięcia ze względu na przebywanie w otoczeniu zakażonego pacjenta, jest droga powierzchniowo-kontaktowa8. Wytyczne Wydziału Bezpieczeństwa i Zdrowia Zawodowego Departamentu Pracy USA (Occupational Safety and Health Administration of Department of Labor of United States – OSHA)9 wyróżniają cztery gradacje ryzyka zakażenia SARS-CoV-2: małe, średnie, duże i bardzo duże. Anestezjolog pracujący z chorymi z COVID-19 jest narażony w stopniu dużym (kontakt z chorym w warunkach bez tworzenia się aerozolu) i bardzo dużym (udział w procedurach prowadzących do powstania aerozolu). Wiadomo także, że źródłem zakażenia są również osoby bezobjawowe10.
Droga szerzenia się wirusa determinuje działania mające na celu zmniejszenie ryzyka zakażenia. Narażenie można zmniejszyć poprzez stosowanie odpowiedniego rodzaju środków ochrony indywidualnej (ŚOI) i przestrzeganie procedur wewnątrzszpitalnych, minimalizowanie liczby procedur związanych ze zwiększonym narażeniem i skracanie czasu trwania narażenia oraz nasilenia generowania i rozprzestrzeniania się aerozolu11.
Podstawowe znaczenie w zapobieganiu zakażeniu ma prawidłowe nakładanie i zdejmowanie ŚOI12. Na stronie konsultanta krajowego w dziedzinie anestezjologii i intensywnej terapii dostępne jest polskie tłumaczenie europejskich zaleceń13.
Wytyczne OSHA kładą nacisk na racjonalne postępowanie z chorym z podejrzeniem lub z potwierdzonym COVID-19. Sugerują wydzielenie stref czystych i skażonych, wykonywanie jak największej liczby procedur poza strefą skontaminowaną, ograniczenie kontaktu z pacjentem do niezbędnego minimum i wykonywanie przy pacjencie najpierw czynności, które niosą ze sobą małe ryzyko kontaminacji, a dopiero w dalszej kolejności tych o dużym ryzyku9.
Wyniki testów diagnostycznych w kierunku SARS-CoV-2 w kontekście ryzyka dla anestezjologa
Rozpoznanie zakażenia możliwe jest wyłącznie na podstawie dodatniego wyniku RT-PCR (reverse trancription polymerase chain reaction) lub, w przypadku osób objawowych, na podstawie dostatecznie czułego i specyficznego testu antygenowego. Prezentowanie objawów COVID-19, dodatni wywiad epidemiologiczny lub badania radiologiczne sugerujące wystąpienie COVID-19, w zależności od konfiguracji, klasyfikują chorych jako podejrzanych lub prawdopodobnie chorych14–17. Jeżeli u pacjenta potwierdzono zakażenie, sytuacja jest jasna i w kontakcie z nim trzeba przestrzegać zasad bezpieczeństwa. Anestezjolog musi jednak zdawać sobie sprawę, że zarówno pacjent bezobjawowy, jak i taki, u którego uzyskano wynik ujemny, nie oznacza braku zagrożenia, gdyż:
• ujemny wynik testu RT-PCR nie świadczy o tym, że chory nie replikuje wirusa – wynik może być fałszywie ujemny18;
• odsetek bezobjawowych nosicieli wirusa SARSCoV-2, którzy nigdy nie rozwinęli objawów, wynosi ok. 20 proc.19.
Zdaniem autorów cytowanego przeglądu piśmiennictwa i metaanalizy wcześniejsze dane mówiące o odsetku wynoszącym ok. 45 proc. obejmowały także pacjentów kwalifikujących się do kategorii „przedobjawowych”;
• analiza matematyczna wykonana przez Kucirka i wsp.20 wykazała, że mediana odsetków wyników fałszywie ujemnych w dniu wystąpienia objawów wynosi 38 proc., a u 54 proc. chorych znajdujących się w grupie ryzyka zakażenia, którzy rozwinęli COVID-19, w początkowo pobranych materiałach nie wykryto obecności wirusa,
• podczas gdy specyficzność testu PCR wynosi w przybliżeniu 100 proc., to czułość różni się w zależności od badanego materiału i według niektórych źródeł może wynosić dla wymazu z gardła zaledwie 32 proc., z nosa – 63 proc., dla plwociny – 72 proc., a dla popłuczyn oskrzelikowo-pęcherzykowych – 93 proc.
Kluczową rolę odgrywa czas pobrania w kontekście fazy choroby i prawidłowe pobranie, zwłaszcza w przypadku wymazu z nosogardła. W odniesieniu do bezobjawowych nosicieli dane są skąpe21, 22.
Według wytycznych Amerykańskiego Towarzystwa Chorób Zakaźnych (Infectious Diseases Society of America – IDSA) średnia czułość badania PCR dla próbek pobranych z górnych dróg oddechowych (ślina, wymazy z ust, nosa i gardła) wynosi 76 proc. (95 proc. CI: 51–100 proc.), a dla materiału z dolnych dróg oddechowych (plwocina, aspirat tchawiczy, popłuczyny oskrzelikowo-pęcherzykowe) 89 proc. (95 proc. CI: 84–94 proc.). W związku z powyższym, w przypadku ujemnego wyniku wymazu z górnych dróg oddechowych u pacjentów objawowych, ale z dużym prawdopodobieństwem klinicznym zakażenia, wytyczne IDSA zalecają pobranie materiału z dolnych dróg oddechowych. Są to jednak wytyczne warunkowe, o bardzo małej sile dowodu. W przypadku górnych dróg oddechowych jako najbardziej czuły materiał wskazuje się wymaz z nosogardła oraz głęboki wymaz z nosa (ang. mid-turbinate swab), dla których czułość wynosi odpowiednio 97 proc. (95 proc. CI: 92–100 proc.) i 100 proc. (95 proc. CI: 93–100 proc.)23.
Ujemny wynik testu nie wyklucza więc zakażenia, a jedynie zmniejsza jego prawdopodobieństwo, pierwotnie określone za pomocą czynników epidemiologicznych, wywiadu dotyczącego ekspozycji oraz badania klinicznego i prawdopodobieństwa innego rozpoznania24.
Środowisko szpitalne jako czynnik narażenia anestezjologa
Anestezjolog, z racji specyfiki wykonywanych świadczeń, pracuje najczęściej w szpitalu, czyli w miejscu największego narażenia na zakażenie zarówno ze strony pacjentów objawowych, jak i bezobjawowych, a także ze strony bezobjawowych współpracowników. Anestezjolog wykonuje zadania, prowadząc znieczulenia, lecząc chorych na oddziale anestezjologii i intensywnej terapii (OAiIT), asekurując transport pacjentów, konsultując pacjentów w pogarszającym się stanie na różnych oddziałach szpitalnych czy też prowadząc resuscytację krążeniowo-oddechową. Spośród powyższych, jedynie w przypadku znieczuleń pacjentów, u których stwierdzono ujemny wynik badania w kierunku obecności SARS-CoV-2, anestezjolog teoretycznie powinien być względnie „bezpieczny”. W pozostałych okolicznościach ma on do czynienia z chorymi prezentującymi objawy zakażenia o największym nasileniu.
Ryzyko narażenia anestezjologa na zakażenie jest zróżnicowane w zależności od czynności wykonywanych przy pacjencie i miejsca ich wykonywania.
Ryzyko wynikające z procedury
Na podstawie przeglądu piśmiennictwa dotyczącego epidemii wirusa SARS-CoV w 2003 r. stwierdzono jednoznacznie, że dużym potencjałem zakażenia charakteryzują się przede wszystkim intubacja tchawicy, prawdopodobnie także wentylacja nieinwazyjna, tracheotomia i ręczna wentylacja z wykorzystaniem maski i worka samorozprężalnego. Uciśnięcia klatki piersiowej podczas resuscytacji, odsysanie z dróg oddechowych przed intubacją i po niej, manipulacje maską tlenową, bronchoskopia, zakładanie zgłębnika nosowo-żołądkowego i defibrylacja mogły wiązać się ze zwiększonym ryzykiem, ale nie był to związek istotny statystycznie. Inne działania, jak manipulowanie maską do wentylacji BiPAP (bilevel positive airway pressure), odsysanie z rurki intubacyjnej, odsysanie innych wydzielin, wentylacja mechaniczna, wentylacja ręczna po intubacji, wentylacja oscylacyjna, tlenoterapia z małym przepływem tlenu i wysokoprzepływowa, fizjoterapia ukierunkowana na zabiegi dotyczące klatki piersiowej oraz prowokowanie do uzyskania plwociny nie wiązały się ze zwiększonym ryzykiem.
Należy jednak odnieść się do tych wyników z dużą dozą ostrożności, gdyż w opinii autorów cytowanego opracowania jakość analizowanych badań była mała1. Rozsądne jest więc założenie, że wszystkie procedury prowadzące do tworzenia się aerozolu wiążą się z niebezpieczeństwem dla anestezjologa. Dlatego oprócz interwencji wymienionych powyżej zagrożenie dla anestezjologa stanowią także przypadkowe rozłączenie się układu pacjent–respirator oraz planowe lub przypadkowe usunięcie rurki intubacyjnej i resuscytacja pacjenta bez zabezpieczonych dróg oddechowych. W odniesieniu do odsysania z dróg oddechowych, zagrożenie to istnieje w przypadku niezabezpieczonych dróg oddechowych oraz gdy u poddanego wentylacji mechanicznej pacjenta nie stosuje się systemu odsysania w układzie zamkniętym25.
Ryzyko wynikające z miejsca wykonywania świadczenia
Anestezjolog na terenie szpitala wykonuje zadania w różnych lokalizacjach i okolicznościach. W zależności od rodzaju wykonywanej pracy stwierdzano różny stopień narażenia personelu medycznego na zakażenie2, 3. Warunki i typ świadczeń wykonywanych przez anestezjologa determinuje rodzaj narażenia, co szczegółowo opisano w dalszej części pracy. Wszędzie tam, gdzie narażenie trwa dłużej, ryzyko jest większe26, 27.
Różni się ono także w odniesieniu do sposobu i nasilenia tworzenia aerozolu28–30. Znaczenie ma także narażenie na kontakt ze skontaminowanymi powierzchniami, co znajduje odzwierciedlenie w zaleceniach dotyczących ostrożnego zdejmowania ŚOI12. O potencjalnym niebezpieczeństwie kontaktu ze skontaminowanymi powierzchniami świadczy fakt stwierdzenia replikacji wirusa w hodowlach (dotąd bardzo nielicznych) z materiału pobranego z tych powierzchni31.
Ocena pacjenta przed znieczuleniem
Najmniejsze ryzyko dotyczy kwalifikacji pacjenta do znieczulenia, ale nie znaczy to, że można zaniedbać środki ostrożności. Pacjenci powinni oczekiwać na wizytę z zachowaniem zasad dystansu społecznego, a najlepiej oczekiwać o określonej godzinie32. Zasady postępowania przedstawiono w tabeli 1.

Ryzyko związane z pracą na sali operacyjnej
Ryzyko tego typu wynika z przebywania anestezjologa w bezpośredniej bliskości dróg oddechowych zakażonego pacjenta. Sytuacje krytyczne dotyczą intubacji tchawicy, wentylacji ręcznej, tracheotomii/konikotomii w razie niepowodzenia intubacji i niemożności zapewnienia oksygenacji (przypadkowego) rozłączenia się układu oddechowego i ekstubacji tchawicy. Ta ostatnia okoliczność może być bardziej niebezpieczna niż sama intubacja ze względu na powrót odruchu kaszlowego, który podczas intubacji jest zniesiony. Nie bez znaczenia jest także ryzyko kontaminacji otoczenia podczas zabiegów torakochirurgicznych przebiegających z otwarciem dróg oddechowych; aby temu zapobiec, na czas otwarcia dróg oddechowych należy wstrzymać wentylację.
Ryzyko dla personelu bloku operacyjnego przebywającego aktualnie poza salą operacyjną wynika z transportowania zakażonych pacjentów korytarzem bloku oraz przypadkowego otwarcia na korytarz zewnętrznych drzwi śluzy sali operacyjnej, przy niezamkniętych drzwiach wewnętrznych.
Podstawową zasadą jest niewykonywanie zabiegów planowych u pacjentów zakażonych. Śmiertelność pooperacyjna pacjentów operowanych w trakcie infekcji COVID-19 określono na 20,4 proc., a powikłania pooperacyjne dotyczyły głównie układu oddechowego (51,2 proc.)33, 34. Z tego powodu, a także w kontekście narażenia personelu, jeżeli u chorego zakwalifikowanego do planowego zabiegu wynik jest dodatni albo pacjent odmawia poddania się testowi, operację planową trzeba odroczyć35–38. Jednocześnie w odniesieniu do pacjentów z ujemnym wynikiem PCR należy pamiętać, że ujemny wynik nie wyklucza zakażenia, a wirus jest wykrywany 1–2 dni przed wystąpieniem objawów39.
Preferowane jest znieczulenie regionalne, a nie ogólne, ze względu na unikanie instrumentacji dróg oddechowych. Znalazło to odzwierciedlenie w zaleceniach American Society of Regional Anesthesia and Pain Therapy (ASRA) i European Society of Regional Anesthesia and Pain Therapy (ESRA)40, 41.
Istnieją także argumenty za wyborem znieczulenia ogólnego. Podkreślany jest wówczas fakt otwartych dróg oddechowych u pacjenta poddanego znieczuleniu regionalnemu i ciągłej kontaminacji otoczenia, jak również to, że może zajść nagła konieczność intubacji tchawicy42.
Działania zmniejszające ryzyko zakażenia anestezjologa podczas znieczulenia oraz komentarze przedstawiono w tabeli 2.

Ryzyko związane z pracą anestezjologa na OAIIT
Wszystkie wymienione wcześniej sytuacje tworzenia aerozolu są typowe dla OAiIT. Dodatkowo dochodzą jeszcze działania związane z odzwyczajeniem pacjenta od wentylacji mechanicznej czy ryzyko związane z transportem pacjenta na badania dodatkowe. Narażenie anestezjologa na OAiIT ma inną charakterystykę w porównaniu z narażeniem podczas znieczulenia, co wynika z kontaktu z więcej niż jednym chorym jednocześnie, z większym ryzykiem przypadkowego rozłączenia się układu oddechowego czy też usunięcia sztucznej drogi oddechowej, a także z potencjalną nagłą koniecznością wymiany rurki intubacyjnej/tracheotomijnej. Jeżeli zakażony pacjent oddycha samodzielnie, to stanowi on ciągłe źródło aerozolu.
Działania prowadzące do zmniejszenia narażenia anestezjologa, a wynikające ściśle ze specyfiki OAiIT obejmują szereg zasad, które przedstawiono, wraz z komentarzami, w tabeli 3.

Co ciekawe, okazało się, że niebezpieczeństwa dla personelu OAiIT leczącego pacjentów z COVID-19 nie ograniczają się tylko do przestrzeni ściśle związanych z przebywaniem pacjentów. W badaniu z Wuhan jednym z najbardziej skontaminowanych przedmiotów poza obszarem leczenia pacjentów były myszki komputerowe – w 75 proc. i kosze na śmieci – w 60 proc. przypadków53.
Ryzyko dla anestezjologa związane z wewnątrzszpitalnym transportem chorych z COVID-19
Anestezjolog bywa proszony o asekurację transportu pacjenta w ciężkim stanie, leczonego na innym niż OAIIT oddziale szpitala. Transport zaintubowanego chorego wiąże się z ryzykiem przypadkowego rozłączenia się układu oddechowego, a w odniesieniu do niezaintubowanego pacjenta – z ciągłym narażeniem na kontakt z wirusem obecnym w wydychanym powietrzu. Może także zajść konieczność podjęcia nagłej interwencji, np. resuscytacji krążeniowo-oddechowej czy intubacji tchawicy. Działania konieczne do podjęcia w odniesieniu do bezpiecznego transportu pacjentów zakażonych zostały ujęte w tabeli 4.

Ryzyko dla anestezjologa konsultującego pacjenta na terenie szpitala
Ze względu na niewystarczającą w ekstremalnej sytuacji liczbę stanowisk intensywnej terapii stanowią one zabezpieczenie dla pacjentów wymagających wentylacji mechanicznej. Pozostali pacjenci leczeni są poza OAiIT. O ile pacjenci OAiIT będący w fazie zakażania mają w większości przypadków zabezpieczone drogi oddechowe i paradoksalnie, poza sytuacjami związanymi z otwarciem tego układu, stanowią mniejsze zagrożenie dla anestezjologa, to w odniesieniu do pozostałych pacjentów sytuacja jest odwrotna. Chorzy z otwartymi drogami oddechowymi leczeni są na różnych oddziałach na terenie szpitala, mających zróżnicowane warunki lokalowe, sprzętowe i wentylacyjno-klimatyzacyjne, i stanowią bardzo duże zagrożenia dla personelu.
W razie pogorszenia się stanu pacjenta poza OAiIT konieczna staje się konsultacja anestezjologiczna, co wiąże się z narażeniem konsultującego na kontakt z aerozolem o nasileniu zależnym od wielu czynników. Zalecenia Agencji Oceny Technologii Medycznych i Taryfikacji (AOTMiT) z 25 kwietnia 2020 r.54 mówią o wykorzystaniu różnych metod prowadzących do poprawy oksygenacji poza OAiIT – tlenoterapii z zastosowaniem okularów tlenowych, maski czy dysz Venturiego, wysokoprzepływowej tlenoterapii donosowej lub wentylacji nieinwazyjnej (te dwie ostanie pod warunkiem m.in. zapewnienia minimalizacji transmisji drogą powietrzną). Tak leczony pacjent stanowi ciągłe źródło aerozolu, który różnie długo utrzymuje się w pomieszczeniu61.
Wszystkie techniki tlenoterapii biernej wiążą się z wytwarzaniem aerozolu. Nie wiadomo, na jaką odległość on się rozprzestrzenia w warunkach klinicznych, więc przy ich stosowaniu konieczna jest pełna ochrona personelu medycznego54. Wiadomo tylko, że w warunkach doświadczalnych, z podciśnieniem i nieuwzględniających oddychania, kaszlu itp., rozprzestrzenianie się aerozolu w przypadku tlenoterapii i wentylacji nieinwazyjnej nie przekracza 1 m i waha się od mniej niż 10 cm dla maski bez oddechu zwrotnego przy przepływie tlenu 12 L min–1 do 1 m dla kaniuli nosowej z przepływem tlenu 5 L min–162–65.
Działania mające na celu zmniejszenie narażenia personelu u pacjentów niezaintubowanych zebrał i przedstawił w artykule przeglądowym Kaur i wsp.66. W odróżnieniu od zaleceń AOTMiT, nie zaleca on masek Venturiego. Podobnie należy unikać masek bez oddechu zwrotnego, chyba że mają filtry na otworach wydechowych. W przypadku wysokoprzepływowej tlenoterapii donosowej ważny jest właściwy dobór rozmiaru kaniuli i założenie pacjentowi maseczki chirurgicznej. Zalecenia co do interfejsów wentylacji nieinwazyjnej nie odbiegają od zaleceń AOTMiT – najbezpieczniejszy dla otoczenia jest hełm, a następnie w kolejności maska twarzowa niewentylowana z układem dwuramiennym, maska twarzowa niewentylowana z układem jednoramiennym, maska wentylowana.
Różnice w zaleceniach mogą wynikać z tego, że w trakcie pandemii SARS-CoV-2 wiedza jest nabywana na bieżąco, dlatego pewne informacje opublikowane na początkowym jej etapie mogą ulec dezaktualizacji.
Ryzyko dla anestezjologa udzielającego świadczeń w szpitalu polowym i tymczasowym
Nowym wyzwaniem dla cywilnych anestezjologów może się okazać praca w warunkach szpitali polowych i tymczasowych. W czasie przygotowywania artykułu Wojsko Polskie dysponowało dwoma mobilnymi szpitalami polowymi (1. i 2. Wojskowy Szpital Polowy) i tworzone były stacjonarne szpitale cywilne, tzw. tymczasowe.
Szpitale polowe i tymczasowe okazały się skutecznym rozwiązaniem w wielu krajach doświadczających liczby zachorowań przekraczających możliwości tradycyjnych szpitali, a zalecenie dotyczące wykorzystywania struktur tymczasowych do opieki nad pacjentami z COVID-19 znalazło się w wytycznych WHO67, 68. Na świecie funkcjonują one w trzech głównych trybach: szpitale – izolatoria dla chorych o łagodnym i umiarkowanym nasileniu objawów (np. Szpitale Fangcang w Chinach69, 70), szpitale przeznaczone dla chorych wymagających intensywnej terapii oraz jednostki typu step-down, przeznaczone do rekonwalescencji pacjentów wypisanych z oddziałów intensywnej terapii71, 72. Niektóre z tymczasowych jednostek funkcjonują w trybie mieszanym. Oprócz zagrożeń dla anestezjologa wynikających z „typowego” narażenia na kontakt z patogenem zakaźnym dochodzi tu jeszcze aspekt pracy w dotychczas nieznanych warunkach i z nieznajomymi osobami. Może się to wiązać z problemami komunikacyjnymi czy też koniecznością odstępstw od wypracowanych na co dzień, realizowanych w znanym otoczeniu przyzwyczajeń i zachowań dających pewne, także psychiczne, poczucie bezpieczeństwa.
Narażenie anestezjologa podczas wewnątrzszpitalnej resuscytacji krążeniowo-oddechowej i środki bezpieczeństwa
Opracowane zostały wytyczne postępowania obowiązującego u chorych zakażonych wirusem SARS-CoV-273.
Ze względu na zwiększone ryzyko narażenia personelu w przypadku konieczności podjęcia nagłych działań, ogromne znaczenie ma wcześniejsza identyfikacja pacjentów w stanie mogącym prowadzić do zatrzymania krążenia. Powinno się też wcześnie zidentyfikować chorych, u których właściwa będzie decyzja o niepodejmowaniu resuscytacji.
Resuscytacja niezaintubowanego pacjenta wymaga pełnego zabezpieczenia w ŚOI; należy je zastosować przed rozpoczęciem uciśnięć klatki piersiowej i/lub udrożnieniem dróg oddechowych. Minimalne zabezpieczenie obejmuje maskę FFP3 (FFP2 lub N95, jeśli FFP3 nie jest dostępna), ochronę oczu i twarzy, fartuch z długimi rękawami i rękawice. Procedura szpitalna może wymagać większego zabezpieczenia, np. w dwie pary rękawic.
Defibrylację za pomocą automatycznego defibrylatora (automated external defibrilator – AED) lub defibrylatora klasycznego, jako procedurę o małym ryzyku generowania aerozolu, może wykonać personel medyczny zabezpieczony w fartuch z krótkim rękawem i rękawice, płynoodporną maseczkę chirurgiczną i ochronę oczu.
Podstawowe różnice w resuscytacji niezaintubowanego pacjenta z (podejrzeniem) COVID-19 w stosunku do „klasycznego” postępowania u dorosłych niezakażonych pacjentów przedstawiono w tabeli 5.

W przypadku pacjenta z zaintubowaną tchawicą, wentylowanego mechanicznie, ratownicy powinni nosić ŚOI chroniące przed cząstkami utrzymującymi się w powietrzu.
Modyfikacje „klasycznego” postępowania w stosunku do działań podejmowanych u dorosłych niezakażonych pacjentów przedstawiono w tabeli 5.
Czynniki osobnicze w kontekście narażenia anestezjologa na zachorowanie na COVID-19
Czynniki osobnicze stanowią zupełnie inny rodzaj ryzyka w porównaniu z omówionymi powyżej, nie można jednak go pominąć. W przypadku anestezjologa pracującego w ciągłym narażeniu na zakażenie wirusem SARS-CoV-2 osobnicze czynniki predysponujące nabierają większego znaczenia niż w przypadku populacji ogólnej. Mogą przyczynić się do nasilenia ciężkości COVID-19 lub zwiększenia ryzyka śmierci lekarza. Anestezjolog, tak jak każdy inny człowiek, może mieć choroby współistniejące. Kwestie ryzyka względnego i bezwzględnego dla anestezjologa i możliwości modyfikacji ryzyka bezwzględnego przedstawił Cook74.
Ryzyko osobnicze w przypadku każdego człowieka wynika z wieku, płci, chorób współistniejących i rasy. Wiek stanowi najważniejszy, pojedynczy czynnik ryzyka – wraz wiekiem zwiększa się ryzyko zgonu75. W odniesieniu do płci większe ryzyko zgonu mają mężczyźni76. W metaanalizie na podstawie 22 doniesień stwierdzono niemal dwukrotnie większą częstość występowania chorób współistniejących wśród przypadków śmiertelnych w porównaniu ze wszystkimi przypadksmi zachorowań. Najbardziej obciążającym schorzeniem okazało się nadciśnienie tętnicze, a następnie kolejno cukrzyca i choroby układu oddechowego77. Wiadomo, że w przypadku wielu innych chorób przewlekłych istnieje, niezależne od wieku człowieka, zwiększone ryzyko ciężkiego przebiegu COVID-19, a w przypadku jeszcze innych obciążeń ryzyko to może być zwiększone78. Z racji tego, że niektóre z chorób współistniejących pojawiają się wraz z wiekiem, starsi anestezjolodzy, szczególnie mężczyźni, są dodatkowo narażeni na cięższy przebieg choroby.
Demograficznym niemodyfikowalnym czynnikiem zwiększonego ryzyka zgonu jest rasa inna niż biała i dotyczy to także lekarzy, co opisano już po upływie pierwszych dwóch miesięcy od ogłoszenia pandemii w raporcie z Wielkiej Brytanii79. Ryzyko zgonu jest największe u przedstawicieli rasy czarnej, pochodzących z Afryki i Karaibów80.
Wnioski
Jak wynika z powyższych rozważań, realizowanie świadczeń z zakresu anestezjologii i intensywnej terapii wiąże się ze stałym, dużym lub bardzo dużym ryzykiem narażenia na zakażenie. Optymizmem napawa fakt relatywnie małej zachorowalności w tej grupie lekarzy, trzeba jednak podkreślić, że ma to związek z zachowywaniem odpowiednich środków ostrożności. Kluczowe jest właściwe stosowanie ŚOI oraz podejmowanie działań minimalizujących ryzyko zakażenia. Konieczne jest stosowanie się do lokalnie obowiązujących procedur wewnątrzszpitalnych. Obowiązuje zasada zapewnienia, w pierwszej kolejności, bezpieczeństwa sobie i współpracownikom. Jedynie dokładne przestrzeganie obowiązujących zaleceń i wytycznych, prawidłowa praca zespołowa i stosowanie ŚOI pozwolą na zmniejszenie ryzyka zakażenia się anestezjologa wirusem SARS-CoV-2.
Piśmiennictwo:
1. Tran K, Cimon K, Severn M, Pessoa-Silva CL, Conly J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PLoS One 2012; 7: e35797. doi: 10.1371/journal.pone.0035797.
2. Wang D, Hu B, Hu C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA 2020; 323: 1061-1069. doi: 10.1001/ jama.2020.1585.
3. Meng L, Qiu H, Wan L, et al. Intubation and ventilation amid the COVID-19 outbreak: Wuhan’s experience. Anesthesiology 2020; 132; 1317-1332. doi: 10.1097/ALN.0000000000003296.
4. Ing EB, Xu QA, Salimi A, et al. Physician deaths from corona virus (COVID-19) disease. Occup Med (Lond) 2020; 70: 370-374. doi: 10.1093/occmed/kqaa088.
5. FNOMCeO. Elenco dei Medici caduti nel corso dell’epidemia di Covid-19 [Internet]. 26th June 2020. Available from: https://portale.fnomceo. it/elenco-dei-medici-caduti-nel-corso-dellepidemia-di-covid-19/ (Accessed: 2.11.2020).
6. Memory List. List of doctors, nurses, nurses, laboratory assistants and other medical workers who died during the COVID pandemic. [Internet]. 2020. Available from: https://sites.google.com/view/covid-memory/ home?authuser=0 (Accessed: 2.11.2020).
7. Ważna M. Z powodu COVID-19 zmarło w Polsce 36 pracowników ochrony zdrowia [Internet]. 2020. Available from: https://www.medonet. pl/koronawirus/koronawirus-w-polsce,z-powodu-covid-19-zmarlow-polsce-36-pracownikow-ochrony-zdrowia,artykul,30464008.html (Accessed: 2.11.2020).
8. World Health Organization. Transmission of SARS-CoV-2: implications for infection prevention precautions. Scientific brief, 09 July 2020 [Internet]. 2020, p. 1–10. Available from: https://www.who.int/newsroom/commentaries/detail/transmission-of-sars-cov-2-implicationsfor-infection-prevention-precautions (Accessed: 2.11.2020).
9. United States Department of Labor. COVID-19 – Control and Prevention | Retail Workers and Employers in Critical and High CustomerVolume Environments | Occupational Safety and Health Administration [Internet]. 2020. Available from: https://www.osha.gov/SLTC/ covid-19/retail.html (Accessed: 2.11.2020).
10. European Centre for Disease Prevention and Control. Transmission of COVID-19 [Internet]. 2020. Available from: https://www.ecdc.europa. eu/en/covid-19/latest-evidence/transmission (Accessed: 2.11.2020).
11. Center for Disease Control (CDC). Interim Infection Prevention and Control Recommendations for Healthcare Personnel During the Coronavirus Disease 2019 (COVID- 19) Pandemic Additional Key Resources: 2 . Recommended infection prevention and control (IPC) practices when caring for a pa [Internet]. 2019, p. 1–11. Available from: https://www.cdc.gov/coronavirus/2019-ncov/hcp/infectioncontrol-recommendations.html (Accessed: 2.11.2020).
12. European Centre for Disease Prevention and Control. Personal protective equipment (PPE) needs in healthcare settings for the care of patients with suspected or confirmed novel coronavirus (2019-nCoV) [Internet]. European Centre for Disease Prevention and Control Guidelined 2020, p. 1–4. Available from: https://www.ecdc.europa. eu/en/publications-data/guidance-wearing-and-removing-personalprotective-equipment-healthcare-settings (Accessed: 2.11.2020).
13. KK AIT – Konsultant Krajowy w dziedzinie Anestezjologii i Intensywnej Terapii [Internet]. Available from: https://konsultantait. gumed.edu.pl/ (Accessed: 22.11.2020).
14. European Centre for Disease Prevention and Control. Case definition for coronavirus disease 2019 (COVID-19), as of 29 May 2020 [Internet]. Eur. Cent. Dis. Prev. Control – Surveill. 2020. Available from: https://www.ecdc.europa.eu/en/covid-19/surveillance/case-definition (Accessed: 2.11.2020). 15. World Health Organization. WHO COVID-19 Case definition [Internet]. 2020. Available from: https://www.who.int/publications/i/item/ WHO-2019-nCoV-Surveillance_Case_Definition-2020.1 (Accessed: 2.11.2020).
16. World Health Organization (WHO). Antigen-detection in the diagnosis of SARS-CoV-2 infection using rapid immunoassays [Internet]. Interim Guid 2020. Available from: https://www.who.int/ publications/i/item/antigen-detection-in-the-diagnosis-of-sars-cov2infection-using-rapid-immunoassays (Accessed: 16.11.2020).
17. Centers for Disease Control and Prevention. Interim Guidance for Rapid Antigen Testing for SARS-CoV-2. Cdc [Internet]. 2020; 1–7. Available from: https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antigen-tests-guidelines.html (Accessed: 16.11.2020).
18. Woloshin S, Patel N, Kesselheim AS. False negative tests for SARSCoV-2 infection – challenges and implications. N Engl J Med 2020; 383: e38. doi: 10.1056/nejmp2015897.
19. Buitrago-Garcia D, Egli-Gany D, Counotte MJ, et al. Occurrence and transmission potential of asymptomatic and presymptomatic SARSCoV-2 infections: a living systematic review and meta-analysis. PLoS Med 2020; 17: e1003346. doi: 10.1371/journal.pmed.1003346.
20. Kucirka LM, Lauer SA, Laeyendecker O, et al. Variation in false-negative rate of reverse transcriptase polymerase chain reaction-based SARSCoV-2 tests by time since exposure. Ann Intern Med 2020: M20-1495. doi: 10.7326/M20-1495.
21. Wyllie AL, Fournier J, Casanovas-Massana A, et al. Saliva or nasopharyngeal swab specimens for detection of SARS-CoV-2. N Engl J Med 2020; 383: 1283-1286. doi: 10.1056/nejmc2016359.
22. Wang W, Xu Y, Gao R, et al. Detection of SARS-CoV-2 in different types of clinical specimens. JAMA 2020; 323: 1843-1844. doi: 10.1001/ jama.2020.3786.
23. Hanson KE, Caliendo AM, Arias CA, et al. Infectious Diseases Society of America guidelines on the diagnosis of COVID-19, part 3: diagnostics. 2020. https://www.idsociety.org/practice-guideline/ covid-19-guideline-diagnostics/ (Accessed: 16.11.2020).
24. Watson J, Whiting PF, Brush JE. Interpreting a COVID-19 test result. BMJ 2020; 369: m1808. doi: 10.1136/bmj.m1808.
25. The Faculty of Intensive Care Medicine, The Intensive Care Society, The Association of Anaesthetists, The Royal College of Anaesthetists, The Difficult Airway Society. Airway management – ICM Anaesthesia COVID-19. 2020. Available at: https://icmanaesthesiacovid-19. org/covid-19-airway-management-principles (Accessed: 2.11.2020).
26. Ng OT, Marimuthu K, Koh V, et al. SARS-CoV-2 seroprevalence and transmission risk factors among high-risk close contacts: a retrospective cohort study. Lancet Infect Dis 2020. doi: 10.1016/s1473- 3099(20)30833-1.
27. Centers for Disease Control and Prevention (CDC). Scientic brief: SARS-CoV-2 and potential airborne transmission. Centers Dis Control Prev 2020. Available at: https://www.cdc.gov/coronavirus/2019- ncov/more/scientific-brief-sars-cov-2.html (Accessed: 23.11.2020).
28. Guallar MP, Meiriño R, Donat-Vargas C, Corral O, Jouvé N, Soriano V. Inoculum at the time of SARS-CoV-2 exposure and risk of disease severity. Int J Infect Dis 2020; 97: 290-292. doi: 10.1016/j.ijid.2020.06.035.
29. Hamner L, Dubbel P, Capron I, et al. High SARS-CoV-2 attack rate following exposure at a choir practice – Skagit County, Washington, March 2020. MMWR Morb Mortal Wkly Rep 2020; 69: 606-610. doi: 10.15585/mmwr.mm6919e6.
30. Alsved M, Matamis A, Bohlin R, et al. Exhaled respiratory particles during singing and talking. Aerosol Science and Technology 2020; 54: 1245-1248. doi: 10.1080/02786826.2020.1812502.
31. Santarpia JL, Rivera DN, Herrera VL, et al. Aerosol and surface contamination of SARS-CoV-2 observed in quarantine and isolation care. Sci Rep 2020; 10: 12732. doi: 10.1038/s41598-020-69286-3.
32. Velly L, Gayat E, Quintard H, et al. Guidelines: anaesthesia in the context of COVID-19 pandemic. Anaesth Crit Care Pain Med 2020; 39: 395-415. doi: 10.1016/j.accpm.2020.05.012.
33. Stahel PF. How to risk-stratify elective surgery during the COVID-19 pandemic? Patient Safety Surg 2020; 14: 8. doi: 10.1186/s13037-020- 00235-9.
34. Nepogodiev D, Bhangu A, Glasbey JC, et al. Mortality and pulmonary complications in patients undergoing surgery with perioperative SARS-CoV-2 infection: an international cohort study. Lancet 2020; 396: 27-38. doi: 10.1016/S0140-6736(20)31182-X.
35. American Society of Anesthesiologists, Anesthesia Patient Safety Foundation. COVID-19 and Anesthesia FAQ – Anesthesia Patient Safety Foundation. 2020. Available at: https://www.apsf.org/covid-19-and-anesthesiafaq/ (Accessed: 2.11.2020).
36. American Society of Anesthesiologists, Anesthesia Patient Safety Foundation. ASA-APSF Joint Statement on Non-Urgent Care During the COVID-19 Outbreak – Anesthesia Patient Safety Foundation. 2020. Available at: https://www.apsf.org/news-updates/asa-apsf-joint-statement-on-non-urgent-care-during-the-covid-19-outbreak/ (Accessed: 2.11.2020).
37. Bhangu A, Lawani I, Ng-Kamstra JS, et al. Global guidance for surgical care during the COVID-19 pandemic. Br J Surg 2020; 107: 1097- 1103. doi: 10.1002/bjs.11646.
38. Odor PM, Neun M, Bampoe S, Clark S, Heaton D, Hoogenboom EM, et al. Anaesthesia and COVID-19: infection control. Br J Anaesth 2020; 125: 16-24. doi: 10.1016/j.bja.2020.03.025.
39. World Health Organization. Report of the WHO-China joint mission on coronavirus disease 2019 (COVID-19). 2020. https://www.who. int/publications/i/item/report-of-the-who-china-joint-mission-oncoronavirus-disease-2019-(covid-19) (Accessed: 2.11.2020).
40. Sondekoppam RV, Lobo CA, Kolli S, Kalagara HK. Practice recommendations on neuraxial anesthesia and peripheral nerve blocks during the COVID-19 pandemic. A joint statement by the American Society of Regional Anesthesia and Pain Medicine (ASRA) and European Society of Regional Anesthesia and Pain Therapy (ESRA). 2020. Available at: https://www.asra.com/page/2905/practice-recommendations-on-neuraxial-anesthesia-and-peripheral-nerve-blocksdur (Accessed: 23.11.2020). 41. Uppal V, Sondekoppam RV, Landau R, El‐Boghdadly K, Narouze S, Kalagara HKP. Neuraxial anaesthesia and peripheral nerve blocks during the COVID‐19 pandemic: a literature review and practice recommendations. Anaesthesia 2020; 75: 1350-1363. doi: 10.1111/ anae.15105.
42. Singleton MN, Soffin EM. Daring discourse: are we ready to recommend neuraxial anesthesia and peripheral nerve blocks during the COVID-19 pandemic? A pro-con. Reg Anesth Pain Med 2020; 45: 831-834.
43. Begley JL, Lavery KE, Nickson CP, Brewster DJ. The aerosol box for intubation in coronavirus disease 2019 patients: an in‐situ simulation crossover study. Anaesthesia 2020; 75: 1014-1021. doi: 10.1111/ anae.15115.
44. Brewster DJ, Chrimes N, Do TBT, et al. Consensus statement: Safe Airway Society principles of airway management and tracheal intubation specific to the COVID-19 adult patient group. Med J Aust 2020; 212: 472-481. doi: 10.5694/mja2.50598.
45. Tian Y, Gong Y, Liu P, et al. Infection prevention strategy in operating room during coronavirus disease 2019 (COVID-19) outbreak. Chin Med Sci J 2020; 35: 114-120. doi: 10.24920/003739.
46. Zhong Q, Liu YY, Luo Q, et al. Spinal anaesthesia for patients with coronavirus disease 2019 and possible transmission rates in anaesthetists: retrospective, single-centre, observational cohort study. Br J Anaesth 2020; 124: 670-675.
47. Lie SA, Wong SW, Wong LT, Wong TGL, Chong SY. Practical considerations for performing regional anesthesia: lessons learned from the COVID-19 pandemic. Can J Anesth 2020; 67: 885-892. doi: 10.1007/ s12630-020-01637-0.
48. World Health Organization. Infection prevention and control during health care when novel coronavirus (nCoV) infection is suspected. 2020. Available at: https://www.who.int/publications/i/item/10665- 331495 (Accessed: 2.11.2020).
49. Soma M, Jacobson I, Brewer J, Blondin A, Davidson G, Singham S. Operative team checklist for aerosol generating procedures to minimise exposure of healthcare workers to SARS-CoV-2. Int J Pediatr Otorhinolaryngol 2020; 134: 110075. doi: 10.1016/j.ijporl.2020.110075.
50. Cook TM, El-Boghdadly K, McGuire B, McNarry AF, Patel A, Higgs A. Consensus guidelines for managing the airway in patients with COVID-19: guidelines from the Difficult Airway Society, the Association of Anaesthetists the Intensive Care Society, the Faculty of Intensive Care Medicine and the Royal College of Anaesthetist. Anaesthesia 2020; 75: 785-799. doi: 10.1111/anae.15054.
51. Tung A, Fergusson NA, Ng N, Hu V, Dormuth C, Griesdale DEG. Medications to reduce emergence coughing after general anaesthesia with tracheal intubation: a systematic review and network meta-analysis. Br J Anaesth 2020; 124: 480-495. doi: 10.1016/j.bja.2019.12.041.
52. Chrimes N. The Vortex: a universal ‘high-acuity implementation tool’ for emergency airway management. Br J Anaesth 2016; 117: i20-7. doi: 10.1093/bja/aew175.
53. Guo ZD, Wang ZY, Zhang SF, et al. Aerosol and surface distribution of severe acute respiratory syndrome coronavirus 2 in hospital wards, Wuhan, China, 2020. Emerg Infect Dis 2020; 26: 1586-1591. doi: 10.3201/eid2607.200885.
54. Agencja Oceny Technologii Medycznych i Taryfikacji. Zalecenia w COVID-19. Polskie zalecenia diagnostyczno-terapeutyczne oraz organizacyjne w zakresie opieki nad osobami zakażonymi lub narażonymi na zakażenie SARS-CoV-2. Wersja 1.1. 2020. Available at: https://www.aotm.gov.pl/media/2020/07/2020.04.25_zalecenia-covid19_v1.11-1.pdf.
55. Alhazzani W, Møller MH, Arabi YM, et al. Surviving Sepsis Campaign: guidelines on the management of critically ill adults with coronavirus disease 2019 (COVID-19). Intensive Care Med 2020; 46: 854-887. doi: 10.1007/s00134-020-06022-5.
56. Wax RS, Christian MD. Practical recommendations for critical care and anesthesiology teams caring for novel coronavirus (2019-nCoV) patients. Can J Anesth 2020; 67: 568-576. doi: 10.1007/s12630-020- 01591-x.
57. Chaudhry D, Govil D, Samavedam S, et al. Airway management and related procedures in critically ill COVID-19 patients: position statement of the Indian Society of Critical Care Medicine. Indian J Crit Care Med 2020; 24: 630-642. doi: 10.5005/jp-journals-10071-23471.
58. Brook I. Prevention of COVID-19 infection in neck breathers, including laryngectomees. Int Arch Otorhinolaryngol 2020; 24: 253-254. doi: 10.1055/s-0040-1713140.
59. Harrison L, Ramsden J. Tracheostomy guidance during the COVID-19 Pandemic. Entuk 2020, p. 8373. Available from: https://www.entuk. org/tracheostomy-guidance-during-covid-19-pandemic (Accessed: 2.11.2020).
60. Tien HC, Chughtai T, Jogeklar A, Cooper AB, Brenneman F. Elective and emergency surgery in patients with severe acute respiratory syndrome (SARS). Can J Surg 2005; 48: 71-74.
61. van Doremalen N, Bushmaker T, Morris DH, et al. Aerosol and surface stability of SARS-CoV-2 as compared with SARS-CoV-1. N Engl J Med 2020; 382: 1564-1567. doi: 10.1056/nejmc2004973.
62. Hui DSC, Chan MTV, Chow B. Aerosol dispersion during various respiratory therapies: a risk assessment model of nosocomial infection to health care workers. Hong Kong Med J 2014; 20: 9-13.
63. Hui DS, Chow BK, Lo T, et al. Exhaled air dispersion during noninvasive ventilation via helmets and a total facemask. Chest 2015; 147: 1336-1343.
64. Hui DS, Chow BK, Lo T, et al. Exhaled air dispersion during highflow nasal cannula therapy versus CPAP via different masks. Eur Respir J 2019; 53. doi: 10.1183/13993003.02339-2018.
65. Ferioli M, Cisternino C, Leo V, Pisani L, Palange P, Nava S. Protecting healthcare workers from sars-cov-2 infection: Practical indications. Eur Respir Rev 2020; 29: 1-10. doi: 10.1183/16000617.0068-2020.
66. Kaur R, Weiss TT, Perez A, et al. Practical strategies to reduce nosocomial transmission to healthcare professionals providing respiratory care to patients with COVID-19. Critical Care 2020; 24: 571. doi: 10.1186/s13054-020-03231-8.
67. World Health Organization. Praktyczne aspekty postępowania z pacjentem z COVID-19 w placówkach opieki zdrowotnej i w opiece środowiskowej. Pediatr Med Rodz 2020; 16: 27-32.
68. World Health Organization. Operational considerations for case management of COVID-19 in health facility and community: interim guidance, 19 March 2020. Geneva: World Health Organization; 2020.
69. Chen S, Zhang Z, Yang J, et al. Fangcang shelter hospitals: a novel concept for responding to public health emergencies. Lancet 2020; 395: 1305-1314. doi: 10.1016/S0140-6736(20)30744-3.
70. Hu CS. Analysis of COVID-19 cases and public measures in China. SN Compr Clin Med 2020; 2: 1306-1312. doi: 10.1007/s42399-020- 00426-6.
71. The 3 types of Covid-19 field hospitals (and what they mean for your organisation). Advisory Board 2020. Available at: https://www. advisory.com/research/global-forum-for-health-care-innovators/theforum/2020/04/field-hospitals (Accessed: 3.11.2020).
72. American Heart Association. Confronting coronavirus: how hospitals are transforming in coronavirus fight | AHA. Available at: https://www. aha.org/aha-center-health-innovation-market-scan/2020-04-08-confronting-coronavirus-how-hospitals-are (Accessed: 3.11.2020).
73. European Resuscitation Council. European Resuscitation Council COVID-19 Guidelines. 2020. Available at: https://www.erc.edu/covid.
74. Cook TM. Risk to health from COVID‐19 for anaesthetists and intensivists – a narrative review. Anaesthesia 2020;
75: 1494-1508. doi: 10.1111/anae.15220. 75. CDC. COVID-19 Hospitalization and Death by Age. Coronavirus Dis 2019 [Internet]. 2020. Available from: https://www.cdc.gov/ coronavirus/2019-ncov/covid-data/investigations-discovery/hospitalization-death-by-age.html (Accessed 3.11.2020).
76. Kelada M, Anto A, Dave K, Saleh SN. The role of sex in the risk of mortality from COVID-19 amongst adult patients: a systematic review. Cureus 2020; 12: e10114. doi: 10.7759/cureus.10114.
77. Gold MS, Sehayek D, Gabrielli S, Zhang X, McCusker C, Ben-Shoshan M. COVID-19 and comorbidities: a systematic review and meta-analysis. Postgrad Med 2020; 132: 749-755. doi: 10.1080/00325481.2020.1786964.
78. Centers for Disease Control and Prevention (CDC). Certain Medical Conditions and Risk for Severe COVID-19 Illness | CDC. 2020. Available at: https://www.cdc.gov/coronavirus/2019-ncov/need-extra-precautions/ people-with-medical-conditions.html (Accessed: 3.11.2020).
79. Platt L, Warwick R. Are some ethnic groups more vulnerable to COVID-19 than others? The Institute for Fiscal Studies. 2020. Available at: www.nuffieldfoundation.org (Accessed: 3.11.2020).
80. Public Health England. Beyond the Data: Understanding the Impact of COVID-19 on BAME Communities. 2020. Available at: www.facebook.com/PublicHealthEngland (Accessed: 3.11.2020).
Artykuł opublikowano w „Anestezjologii Intensywnej Terapia” 5/2020.
Źródło:
Anestezjologia Intensywna Terapia/Magdalena Anna Wujtewicz, Anna Dylczyk-Sommer, Aleksander Aszkiełowicz, Jan Stefaniak, Szymon Zdanowski i Radoslaw Owczuk
Anestezjologia Intensywna Terapia/Magdalena Anna Wujtewicz, Anna Dylczyk-Sommer, Aleksander Aszkiełowicz, Jan Stefaniak, Szymon Zdanowski i Radoslaw Owczuk



















