Czy leczenie hormonalne uratuje męski ród?
Dr n. med. Piotr Oczkowski, Oddział chirurgii onkologicznej i rekonstrukcyjnej z pododdziałem chemioterapii, SP ZOZ MSW, Łódź
Rak gruczołu krokowego jest drugim co do częstości występowania nowotworem złośliwym u mężczyzn w Polsce. Ustępuje pod tym względem jedynie rakowi płuca i prowadzi do 7,5% wszystkich zgonów związanych z rakiem. Wykrywalność raka gruczołu krokowego w ostatnich latach zwiększa się dzięki upowszechnieniu oznaczania stężenia swoistego antygenu sterczowego (PSA - prostate specific antygen) w surowicy krwi.
Wybór metody leczenia chorych z rakiem gruczołu krokowego zależy od stopnia zaawansowania klinicznego oraz od oczekiwanej długości życia chorych. Leczenie radykalne (leczenie chirurgiczne, radioterapia) stosowane jest u pacjentów z chorobą ograniczoną do gruczołu krokowego, u których spodziewany czas przeżycia wynosi 10 lat i więcej. W przypadku choroby zaawansowanej, podstawową metodą leczenia jest terapia hormonalna wykorzystująca androgenozależność raka gruczołu krokowego. Celem leczenia jest osiągnięcie stężenia kastracyjnego testosteronu w surowicy krwi pacjentów (<50ng/ml), którego pochodna dihydrotestosteron (DHT) indukuje proliferację komórek sterczowych. Osiągnięcie kastracyjnego stężenia testosteronu odbywa się poprzez zastosowanie kastracji chirurgicznej lub farmakologicznej z wykorzystaniem analogów gonadoliberyny (LHRH, luteinising hormone-releasing hormone).
Przez ostatnie kilka dekad, pacjentów z przerzutowym rakiem gruczołu krokowego i progresją choroby w trakcie leczenia analogami gonadoliberyny (aLHRH) klasyfikowano jako hormonoopornych, co pozwoliło zdefiniować rozwój oporności na chirurgiczne lub farmakologiczne leczenie kastracyjne i ogólnie na leczenie hormonalne. Po stwierdzeniu takiej sytuacji leczenie raka gruczołu krokowego ograniczano do stosowania chemioterapii pierwszego rzutu lub do leczenia hormonalnego drugiego rzutu.
W 1996 roku kanadyjskie badanie randomizowane III fazy NOV-222 wykazało korzystny efekt paliacyjny u około 30% pacjentów leczonych schematem mitoxantrone + prednizon w porównaniu z grupą pacjentów leczonych prednizonem (12% chorych). Obserwowano zmniejszenie intensywności bólu oraz zużycia leków przeciwbólowych, a także wydłużenie czasu trwania odpowiedzi (49 vs. 13 tygodni). Leczenie skojarzone nie miało jednakże wpływu na czas całkowitego przeżycia chorych (OS – overall survival).
W dwóch prospektywnych, randomizowanych badaniach klinicznych (TAX 327 i SWOG 99-16) pokazano, że docetaxel przedłuża życie pacjentów o 2–3 miesiące w porównaniu z mitoksantronem i poprawia jakość życia oraz kontrolę objawów u pacjentów, u których zaobserwowano progresję choroby w trakcie leczenia prowadzącego do zmniejszenia stężenia androgenów we krwi (ADT, androgen deprivation therapy). W 2004 roku przedstawiono rezultaty badania klinicznego TAX 327, w którym wykazano, że docetaxel (75mg/m2 i.v. co 3 tygodnie) w skojarzeniu z prednizonem (5mg p.o. 2 x dziennie), wydłuża czas całkowitego przeżycia chorych w porównaniu z grupą chorych leczonych schematem mitoxantrone+prednizon (18,9 vs. 16,5 miesięcy). Ponadto docetaxel wpływał na uzyskanie większego odsetka obiektywnych odpowiedzi (ORR – overall response rate 12% vs. 7%) i odpowiedzi w zakresie stężenia PSA na leczenie (45% vs. 32%) oraz miał wpływ na większy efekt paliacyjny w zakresie dolegliwości bólowych (35% vs. 22%) i poprawy jakości życia (QOL –quality of life 22% vs. 13%).
Do hormonalnych wariantów leczenia pacjentów z progresją w trakcie pierwotnego leczenia analogami gonadoliberyny należą: dietylstylbestrol, leki przeciwandrogenowe, kortykosteroidy podawane w niskich dawkach i ketokonazol. Wszystkie te metody charakteryzują się krótkim okresem odpowiedzi na leczenie, obserwowanej u 20–30% pacjentów oraz brakiem udowodnionego wpływu na przeżycie całkowite (OS, overall survival). Bezobjawowi pacjenci z progresją choroby w trakcie leczenia ADT, stwierdzaną na podstawie stężenia PSA, zazwyczaj są leczeni kilkoma metodami hormonalnymi przed wprowadzeniem standardowej chemioterapii pierwszego rzutu zawierającej docetaxel. Leki antyandrogenowe, takie jak bikalutamid, flutamid i nilutamid, są stosowane od ponad 30 lat w monoterapii lub w skojarzeniu z analogami LHRH w celu uzyskania maksymalnej blokady androgenowej (MAB, maximal androgen blockade). Wspomniane preparaty łączą się z receptorem androgenowym (AR, androgen receptor) uniemożliwiając przyłączanie DHT i upośledzając transkrypcję genów w komórce nowotworowej. Niemniej jednak pierwsza generacja leków antyandrogenowych pozwala jedynie na uzyskanie krótkotrwałej, niewielkiej odpowiedzi na leczenie (krótszej niż 4 miesiące) bez wpływu na czas całkowitego przeżycia (OS), co wydaje się w dużej mierze wynikać ze stosunkowo małego powinowactwa wspomnianych leków do AR w porównaniu z DHT oraz z ich częściowego działania agonistycznego. Aby przezwyciężyć wspomniane ograniczenia, prowadzone są badania nad lekami antyandrogenowymi nowej generacji, charakteryzującymi się wyższym powinowactwem z AR, brakiem działania agonistycznego oraz aktywnością przeciwnowotworową u pacjentów opornych na bikalutamid oraz u osób z komórkami raka gruczołu krokowego wykazującymi nadekspresję AR.
W ostatnim dziesięcioleciu duża liczba przekonujących danych laboratoryjnych i klinicznych całkowicie zmieniła sposób myślenia oraz podejście terapeutyczne do pacjentów z zaawansowanym rakiem gruczołu krokowego, u których dochodzi do progresji obserwowanej w trakcie farmakologicznego czy chirurgicznego leczenia kastracyjnego. Z tego też względu obecnie poprawnym terminem opisującym wspomnianą sytuację jest „rak gruczołu krokowego oporny na kastrację”(CRPC, castration-resistant prostate cancer), zastępując dotychczas stosowany termin „hormonooporny rak gruczołu krokowego”. Wcześniejsze pojęcie wynikało z doświadczenia klinicznego pokazującego złą odpowiedź na leczenie hormonalne drugiego rzutu po stwierdzeniu progresji choroby w trakcie ADT.
Centralną rolę szlaku sygnałowego AR w proliferacji i przeżyciu komórek raka gruczołu krokowego ukazuje w pośredni sposób zwiększenie ekspresji genów regulowanych przez androgeny, takich jak PSA, w przebiegu progresji choroby. Ponadto z danych klinicznych dotyczących nowych preparatów działających na AR wynika, że skuteczne leczenie ukierunkowane na szlak sygnałowy AR po stwierdzeniu oporności na kastrację prowadzi do uzyskania biochemicznej i radiologicznej odpowiedzi na terapię. To z kolei wskazuje, że reaktywacja szlaku sygnałowego AR stanowi zdarzenie biologiczne, leżące u podstaw progresji choroby pomimo kastracyjnych stężeń testosteronu. Progresja choroby do opornego na kastrację raka gruczołu krokowego (CRPC) jest heterogennym procesem zachodzącym u każdego chorego. Istnieją dwie przeciwstawne teorie wyjaśniające powstawanie CRPC. Najczęściej przyjmowanym modelem jest model adaptacyjny, który zakłada, że komórki CRPC powstają w wyniku zmian genetycznych w obrębie komórek androgenozależnych, do której dochodzi w trakcie ADT. Teoria druga, tzw. teoria klonalna, mówi, iż rozwój CRPC odzwierciedla proliferację populacji „uśpionych” komórek opornych na leczenie kastracyjne w obrębie androgenozależnego guza. Teoria klonalna sugeruje, iż ADT indukuje selektywny, nadmierny wzrost agresywnych, hormonoopornych klonów komórek raka gruczołu krokowego wykazujących ekspresję różnych właściwości komórkowych i molekularnych nieobecnych w wyjściowych androgenozależnych komórkach nowotworowych. Wspomniana teoria jest wspierana przez doświadczenia przedkliniczne i dane kliniczne pokazujące, że wiele ognisk raka gruczołu krokowego może charakteryzować się różną wrażliwością. Klony CRPC powstają w wyniku mutacji nabytych w trakcie progresji raka prowadzących do uzyskania przez komórki nowotworowe androgenoniezależności.
Kluczowym enzymem w procesie biosyntezy androgenów działających na receptor androgenowy (AR) w szlaku przemiany cholesterolu jest enzym o podwójnej aktywności 17-hydroksylazy i C17,20-liazy CYP17A1. Enzym ten należy do rodziny enzymów cytochromu P450. Końcowym produktem tych reakcji enzymatycznych jest testosteron, przekształcany w bardziej aktywną biologicznie formę jaką jest dihydrotestosteron (DHT).
Na podstawie obserwacji, zgodnie z którą u pacjentów z przerzutami raka gruczołu krokowego zwiększona jest aktywność CYP17A1, a w szczególności C17,20-liazy, opracowano nowe skuteczne leki działające przeciwko reaktywacji szlaku sygnałowego AR zależnego od wewnątrzguzowych androgenów. Ketokonazol, imidazolowy lek przeciwgrzybiczy, to odwracalny i nieswoisty inhibitor enzymu CYP17A1. Niemniej jednak małe powinowactwo opisywanego leku z CYP17A1 wymaga stosowania dużych dawek preparatu, co prowadzi z kolei do występowania znacznych skutków ubocznych ograniczając kliniczne zastosowanie wspomnianego związku.
Octan abirateronu jest selektywnym inhibitorem biosyntezy androgenów silnie hamującym cytochrom P450 c17(CYP17), który odgrywa zasadniczą rolę w biosyntezie testosteronu. Zmniejsza wytwarzanie androgenów przez nadnercza, jądra i komórki raka gruczołu krokowego, do 20 razy bardziej obniżając stężenie testosteronu we krwi w porównaniu z dotychczasowymi metodami kastracji chirurgicznej lub farmakologicznej.
W badaniach I i II fazy chorych z progresją raka gruczołu krokowego opornego na kastrację, wcześniej otrzymujących lub nieotrzymujących chemioterapii, włączano do leczenia octanem abirateronu, który stosowano zarówno w monoterapii jak i w skojarzeniu z małymi dawkami glikokortykoidów. U tych pacjentów wykazano aktywność przeciwnowotworową, a najczęstszymi zdarzeniami niepożądanymi towarzyszącymi zwiększeniu stężeń mineralokotrykoidów były hipokaliemia, zatrzymanie płynów w organizmie i nadciśnienie tętnicze. Wyżej wymienione działania niepożądane były akceptowalne i mogły być dodatkowo łagodzone podawaniem małych dawek glikokortykoidów.
W badaniu klinicznym III fazy COU-AA-301 oceniano czy leczenie octanem abirateronu może przedłużyć przeżycie całkowite chorych z opornym na kastrację rakiem gruczołu krokowego z przerzutami, wcześniej otrzymujących chemioterapię.
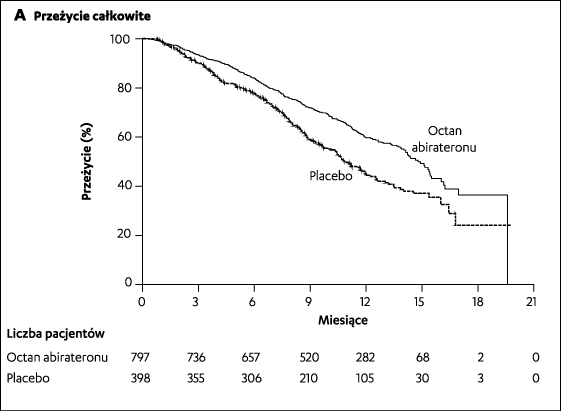
Ogółem zrandomizowano 1195 chorych. Pacjentów przydzielono losowo, w stosunku 2:1, do grupy otrzymującej octan abirateronu z prednizonem (797chorych) lub do grupy otrzymującej pacebo z prednizonem (398 chorych). Grupy były dobrze zrównoważone. U większości chorych (67%) stwierdzono radiologiczne cechy progresji nowotworu przed włączeniem do badania. Chorzy wcześniej otrzymywali chemioterapię zawierającą 1 lub 2 schematy leczenia cytotokstycznego. Pacjenci stosujący docetaksel nie musieli wykazywać progresji choroby, gdyż toksyczność tej choroby mogła skutkować przerwaniem leczenia. Pacjenci stosowali kastrację farmakologiczną (aLHRH) lub byli poddani kastracji chirurgicznej.
W trakcie badania chorzy otrzymywali 1g octanu abirateronu, podawanego w postaci czterech tabletek po 250 mg lub cztery tabletki placebo, przyjmowane raz na dobę co najmniej na godzinę przed lub 2 godziny po posiłku, wraz z prednizonem podawanym doustnie w dawce 5 mg dwa razy na dobę. Leczenie kontynuowano do czasu udokumentowania progresji nowotworu na podstawie stężenia PSA, wyników obrazowych i badania klinicznego.
Mediana czasu leczenia wyniosła 8 miesięcy w grupie otrzymującej octan abirateronu z prednizonem i 4 miesiące w grupie otrzymującej placebo. Mediana czasu obserwacji dla całej badanej populacji wyniosła 12,8 miesięcy.
Po okresie obserwacji, przeżycie całkowite (OS) w grupie leczonej octanem abirateronu z prednizonem było dłuższe niż w grupie placebo z prednizonem ( 14,8 vs 10,9 miesiąca, HR=0,65;95% przedział ufności 0,54-0,77;p<0,001) i wykazano znamienność statystyczną dla tego punktu końcowego. W populacji zaplanowanej do leczenia zmarło ogółem 552 chorych: 333 w grupie octanu abiarateronu (42%) i 219 w grupie placebo (55%). Leczenie octanem abirateronu z prednizonem zmniejszyło ryzyko zgonu o 35,4% w porównaniu z obserwowaną grupą placebo z prednizonem.
Wyniki analizy wszystkich drugorzędowych punktów końcowych potwierdziły wyższość octanu abirateronu nad placebo z uzyskaniem znamienności statystycznej:
• czas do wystąpienia progresji PSA (10,2 vs. 6,6 miesiąca, p<0,001)
• przeżycie wolne od progresji nowotworu ocenianego na podstawie badań obrazowych ( 5,6 vs. 3,6 miesiąca, p<0,001)
• odsetek odpowiedzi PSA (29 vs. 6%, p<0,001) wypadły korzystniej w grupie leczonej.
Opierając się na wynikach stężenia PSA stwierdzono, że leczenie octanem abirateronu zmniejszyło ryzyko progresji nowotworu o 42%. Na podstawie wyników badań obrazowych można mówić o zmniejszeniu ryzyka progresji nowotworu o 33%.
Odsetek pacjentów z paliacją objawów bólowych był znamiennie statystycznie wyższy w grupie leczonych octanem abirateronu niż w grupie placebo (44% vs 27%). Dla grupy leczonej octanem abirateronu zaobserwowano wydłużenie czasu do wystąpienia zdarzenia ze strony układu kostnego (9,9 vs. 4,9 miesiąca).
Najczęstszym zdarzeniem niepożądanym było zmęczenie, obserwowane równie często w obu grupach leczonych. Ponadto: ból kręgosłupa, nudności , zaparcia, ból kości, ból stawów. Nasilenie tych zdarzeń było 1 lub 2 stopnia i rzadko stwarzały konieczność przerwania podawania leku lub zmniejszenia jego dawki. Inne zdarzenia niepożądane występujące częściej w grupie leczonej octanem abirateronu to: zakażenia układu moczowego, zatrzymanie płynów i obrzęki, hipokaliemia, nadciśnienie tętnicze, choroby serca oraz nieprawidłowe wyniki badań czynnościowych wątroby. Główną przyczyną zgonów była progresja choroby nowotworowej.
Wyniki badania COU-AA-301 potwierdzają teorię, że przerzutowy rak gruczołu krokowego oporny na kastrację pozostaje nowotworem hormonozależnym. W świetle najnowszych doniesień można stwierdzić, że leczenie hormonalne może stanowić alternatywę dla leczenia cytostatycznego u tej grupy pacjentów. Otwiera się kolejna możliwość hamowania proliferacji komórek nowotworowych z wykorzystaniem leku hormonalnego o wysokiej skuteczności w wyniku supresji szlaku androgenowego. Leku hormonalnego, który przy korzystnym profilu toksyczności wykazuje dużą skuteczność przeciwnowotworową potwierdzoną w randomizowanym badaniu klinicznym III fazy. U pacjentów ze współistniejącymi chorobami internistycznymi, po wcześniejszym intensywnym leczeniu onkologicznym , których średnia wieku często przekracza 70 lat.
Octan abirateronu wydaje się być jaskółką oznajmiającą renesans leczenia hormonalnego u pacjentów z rakiem gruczołu krokowego opornym na kastrację.
Jest pierwszym z całej serii nowoczesnych preparatów hormonalnych, których skuteczność jest wciąż oceniana w obecnie trwających licznych badaniach klinicznych na świecie.
Na skuteczność, których czeka męski ród.
Rak gruczołu krokowego jest drugim co do częstości występowania nowotworem złośliwym u mężczyzn w Polsce. Ustępuje pod tym względem jedynie rakowi płuca i prowadzi do 7,5% wszystkich zgonów związanych z rakiem. Wykrywalność raka gruczołu krokowego w ostatnich latach zwiększa się dzięki upowszechnieniu oznaczania stężenia swoistego antygenu sterczowego (PSA - prostate specific antygen) w surowicy krwi.
Wybór metody leczenia chorych z rakiem gruczołu krokowego zależy od stopnia zaawansowania klinicznego oraz od oczekiwanej długości życia chorych. Leczenie radykalne (leczenie chirurgiczne, radioterapia) stosowane jest u pacjentów z chorobą ograniczoną do gruczołu krokowego, u których spodziewany czas przeżycia wynosi 10 lat i więcej. W przypadku choroby zaawansowanej, podstawową metodą leczenia jest terapia hormonalna wykorzystująca androgenozależność raka gruczołu krokowego. Celem leczenia jest osiągnięcie stężenia kastracyjnego testosteronu w surowicy krwi pacjentów (<50ng/ml), którego pochodna dihydrotestosteron (DHT) indukuje proliferację komórek sterczowych. Osiągnięcie kastracyjnego stężenia testosteronu odbywa się poprzez zastosowanie kastracji chirurgicznej lub farmakologicznej z wykorzystaniem analogów gonadoliberyny (LHRH, luteinising hormone-releasing hormone).
Przez ostatnie kilka dekad, pacjentów z przerzutowym rakiem gruczołu krokowego i progresją choroby w trakcie leczenia analogami gonadoliberyny (aLHRH) klasyfikowano jako hormonoopornych, co pozwoliło zdefiniować rozwój oporności na chirurgiczne lub farmakologiczne leczenie kastracyjne i ogólnie na leczenie hormonalne. Po stwierdzeniu takiej sytuacji leczenie raka gruczołu krokowego ograniczano do stosowania chemioterapii pierwszego rzutu lub do leczenia hormonalnego drugiego rzutu.
W 1996 roku kanadyjskie badanie randomizowane III fazy NOV-222 wykazało korzystny efekt paliacyjny u około 30% pacjentów leczonych schematem mitoxantrone + prednizon w porównaniu z grupą pacjentów leczonych prednizonem (12% chorych). Obserwowano zmniejszenie intensywności bólu oraz zużycia leków przeciwbólowych, a także wydłużenie czasu trwania odpowiedzi (49 vs. 13 tygodni). Leczenie skojarzone nie miało jednakże wpływu na czas całkowitego przeżycia chorych (OS – overall survival).
W dwóch prospektywnych, randomizowanych badaniach klinicznych (TAX 327 i SWOG 99-16) pokazano, że docetaxel przedłuża życie pacjentów o 2–3 miesiące w porównaniu z mitoksantronem i poprawia jakość życia oraz kontrolę objawów u pacjentów, u których zaobserwowano progresję choroby w trakcie leczenia prowadzącego do zmniejszenia stężenia androgenów we krwi (ADT, androgen deprivation therapy). W 2004 roku przedstawiono rezultaty badania klinicznego TAX 327, w którym wykazano, że docetaxel (75mg/m2 i.v. co 3 tygodnie) w skojarzeniu z prednizonem (5mg p.o. 2 x dziennie), wydłuża czas całkowitego przeżycia chorych w porównaniu z grupą chorych leczonych schematem mitoxantrone+prednizon (18,9 vs. 16,5 miesięcy). Ponadto docetaxel wpływał na uzyskanie większego odsetka obiektywnych odpowiedzi (ORR – overall response rate 12% vs. 7%) i odpowiedzi w zakresie stężenia PSA na leczenie (45% vs. 32%) oraz miał wpływ na większy efekt paliacyjny w zakresie dolegliwości bólowych (35% vs. 22%) i poprawy jakości życia (QOL –quality of life 22% vs. 13%).
Do hormonalnych wariantów leczenia pacjentów z progresją w trakcie pierwotnego leczenia analogami gonadoliberyny należą: dietylstylbestrol, leki przeciwandrogenowe, kortykosteroidy podawane w niskich dawkach i ketokonazol. Wszystkie te metody charakteryzują się krótkim okresem odpowiedzi na leczenie, obserwowanej u 20–30% pacjentów oraz brakiem udowodnionego wpływu na przeżycie całkowite (OS, overall survival). Bezobjawowi pacjenci z progresją choroby w trakcie leczenia ADT, stwierdzaną na podstawie stężenia PSA, zazwyczaj są leczeni kilkoma metodami hormonalnymi przed wprowadzeniem standardowej chemioterapii pierwszego rzutu zawierającej docetaxel. Leki antyandrogenowe, takie jak bikalutamid, flutamid i nilutamid, są stosowane od ponad 30 lat w monoterapii lub w skojarzeniu z analogami LHRH w celu uzyskania maksymalnej blokady androgenowej (MAB, maximal androgen blockade). Wspomniane preparaty łączą się z receptorem androgenowym (AR, androgen receptor) uniemożliwiając przyłączanie DHT i upośledzając transkrypcję genów w komórce nowotworowej. Niemniej jednak pierwsza generacja leków antyandrogenowych pozwala jedynie na uzyskanie krótkotrwałej, niewielkiej odpowiedzi na leczenie (krótszej niż 4 miesiące) bez wpływu na czas całkowitego przeżycia (OS), co wydaje się w dużej mierze wynikać ze stosunkowo małego powinowactwa wspomnianych leków do AR w porównaniu z DHT oraz z ich częściowego działania agonistycznego. Aby przezwyciężyć wspomniane ograniczenia, prowadzone są badania nad lekami antyandrogenowymi nowej generacji, charakteryzującymi się wyższym powinowactwem z AR, brakiem działania agonistycznego oraz aktywnością przeciwnowotworową u pacjentów opornych na bikalutamid oraz u osób z komórkami raka gruczołu krokowego wykazującymi nadekspresję AR.
W ostatnim dziesięcioleciu duża liczba przekonujących danych laboratoryjnych i klinicznych całkowicie zmieniła sposób myślenia oraz podejście terapeutyczne do pacjentów z zaawansowanym rakiem gruczołu krokowego, u których dochodzi do progresji obserwowanej w trakcie farmakologicznego czy chirurgicznego leczenia kastracyjnego. Z tego też względu obecnie poprawnym terminem opisującym wspomnianą sytuację jest „rak gruczołu krokowego oporny na kastrację”(CRPC, castration-resistant prostate cancer), zastępując dotychczas stosowany termin „hormonooporny rak gruczołu krokowego”. Wcześniejsze pojęcie wynikało z doświadczenia klinicznego pokazującego złą odpowiedź na leczenie hormonalne drugiego rzutu po stwierdzeniu progresji choroby w trakcie ADT.
Centralną rolę szlaku sygnałowego AR w proliferacji i przeżyciu komórek raka gruczołu krokowego ukazuje w pośredni sposób zwiększenie ekspresji genów regulowanych przez androgeny, takich jak PSA, w przebiegu progresji choroby. Ponadto z danych klinicznych dotyczących nowych preparatów działających na AR wynika, że skuteczne leczenie ukierunkowane na szlak sygnałowy AR po stwierdzeniu oporności na kastrację prowadzi do uzyskania biochemicznej i radiologicznej odpowiedzi na terapię. To z kolei wskazuje, że reaktywacja szlaku sygnałowego AR stanowi zdarzenie biologiczne, leżące u podstaw progresji choroby pomimo kastracyjnych stężeń testosteronu. Progresja choroby do opornego na kastrację raka gruczołu krokowego (CRPC) jest heterogennym procesem zachodzącym u każdego chorego. Istnieją dwie przeciwstawne teorie wyjaśniające powstawanie CRPC. Najczęściej przyjmowanym modelem jest model adaptacyjny, który zakłada, że komórki CRPC powstają w wyniku zmian genetycznych w obrębie komórek androgenozależnych, do której dochodzi w trakcie ADT. Teoria druga, tzw. teoria klonalna, mówi, iż rozwój CRPC odzwierciedla proliferację populacji „uśpionych” komórek opornych na leczenie kastracyjne w obrębie androgenozależnego guza. Teoria klonalna sugeruje, iż ADT indukuje selektywny, nadmierny wzrost agresywnych, hormonoopornych klonów komórek raka gruczołu krokowego wykazujących ekspresję różnych właściwości komórkowych i molekularnych nieobecnych w wyjściowych androgenozależnych komórkach nowotworowych. Wspomniana teoria jest wspierana przez doświadczenia przedkliniczne i dane kliniczne pokazujące, że wiele ognisk raka gruczołu krokowego może charakteryzować się różną wrażliwością. Klony CRPC powstają w wyniku mutacji nabytych w trakcie progresji raka prowadzących do uzyskania przez komórki nowotworowe androgenoniezależności.
Kluczowym enzymem w procesie biosyntezy androgenów działających na receptor androgenowy (AR) w szlaku przemiany cholesterolu jest enzym o podwójnej aktywności 17-hydroksylazy i C17,20-liazy CYP17A1. Enzym ten należy do rodziny enzymów cytochromu P450. Końcowym produktem tych reakcji enzymatycznych jest testosteron, przekształcany w bardziej aktywną biologicznie formę jaką jest dihydrotestosteron (DHT).
Na podstawie obserwacji, zgodnie z którą u pacjentów z przerzutami raka gruczołu krokowego zwiększona jest aktywność CYP17A1, a w szczególności C17,20-liazy, opracowano nowe skuteczne leki działające przeciwko reaktywacji szlaku sygnałowego AR zależnego od wewnątrzguzowych androgenów. Ketokonazol, imidazolowy lek przeciwgrzybiczy, to odwracalny i nieswoisty inhibitor enzymu CYP17A1. Niemniej jednak małe powinowactwo opisywanego leku z CYP17A1 wymaga stosowania dużych dawek preparatu, co prowadzi z kolei do występowania znacznych skutków ubocznych ograniczając kliniczne zastosowanie wspomnianego związku.
Octan abirateronu jest selektywnym inhibitorem biosyntezy androgenów silnie hamującym cytochrom P450 c17(CYP17), który odgrywa zasadniczą rolę w biosyntezie testosteronu. Zmniejsza wytwarzanie androgenów przez nadnercza, jądra i komórki raka gruczołu krokowego, do 20 razy bardziej obniżając stężenie testosteronu we krwi w porównaniu z dotychczasowymi metodami kastracji chirurgicznej lub farmakologicznej.
W badaniach I i II fazy chorych z progresją raka gruczołu krokowego opornego na kastrację, wcześniej otrzymujących lub nieotrzymujących chemioterapii, włączano do leczenia octanem abirateronu, który stosowano zarówno w monoterapii jak i w skojarzeniu z małymi dawkami glikokortykoidów. U tych pacjentów wykazano aktywność przeciwnowotworową, a najczęstszymi zdarzeniami niepożądanymi towarzyszącymi zwiększeniu stężeń mineralokotrykoidów były hipokaliemia, zatrzymanie płynów w organizmie i nadciśnienie tętnicze. Wyżej wymienione działania niepożądane były akceptowalne i mogły być dodatkowo łagodzone podawaniem małych dawek glikokortykoidów.
W badaniu klinicznym III fazy COU-AA-301 oceniano czy leczenie octanem abirateronu może przedłużyć przeżycie całkowite chorych z opornym na kastrację rakiem gruczołu krokowego z przerzutami, wcześniej otrzymujących chemioterapię.
Ogółem zrandomizowano 1195 chorych. Pacjentów przydzielono losowo, w stosunku 2:1, do grupy otrzymującej octan abirateronu z prednizonem (797chorych) lub do grupy otrzymującej pacebo z prednizonem (398 chorych). Grupy były dobrze zrównoważone. U większości chorych (67%) stwierdzono radiologiczne cechy progresji nowotworu przed włączeniem do badania. Chorzy wcześniej otrzymywali chemioterapię zawierającą 1 lub 2 schematy leczenia cytotokstycznego. Pacjenci stosujący docetaksel nie musieli wykazywać progresji choroby, gdyż toksyczność tej choroby mogła skutkować przerwaniem leczenia. Pacjenci stosowali kastrację farmakologiczną (aLHRH) lub byli poddani kastracji chirurgicznej.
W trakcie badania chorzy otrzymywali 1g octanu abirateronu, podawanego w postaci czterech tabletek po 250 mg lub cztery tabletki placebo, przyjmowane raz na dobę co najmniej na godzinę przed lub 2 godziny po posiłku, wraz z prednizonem podawanym doustnie w dawce 5 mg dwa razy na dobę. Leczenie kontynuowano do czasu udokumentowania progresji nowotworu na podstawie stężenia PSA, wyników obrazowych i badania klinicznego.
Mediana czasu leczenia wyniosła 8 miesięcy w grupie otrzymującej octan abirateronu z prednizonem i 4 miesiące w grupie otrzymującej placebo. Mediana czasu obserwacji dla całej badanej populacji wyniosła 12,8 miesięcy.
Po okresie obserwacji, przeżycie całkowite (OS) w grupie leczonej octanem abirateronu z prednizonem było dłuższe niż w grupie placebo z prednizonem ( 14,8 vs 10,9 miesiąca, HR=0,65;95% przedział ufności 0,54-0,77;p<0,001) i wykazano znamienność statystyczną dla tego punktu końcowego. W populacji zaplanowanej do leczenia zmarło ogółem 552 chorych: 333 w grupie octanu abiarateronu (42%) i 219 w grupie placebo (55%). Leczenie octanem abirateronu z prednizonem zmniejszyło ryzyko zgonu o 35,4% w porównaniu z obserwowaną grupą placebo z prednizonem.

Wyniki analizy wszystkich drugorzędowych punktów końcowych potwierdziły wyższość octanu abirateronu nad placebo z uzyskaniem znamienności statystycznej:
• czas do wystąpienia progresji PSA (10,2 vs. 6,6 miesiąca, p<0,001)
• przeżycie wolne od progresji nowotworu ocenianego na podstawie badań obrazowych ( 5,6 vs. 3,6 miesiąca, p<0,001)
• odsetek odpowiedzi PSA (29 vs. 6%, p<0,001) wypadły korzystniej w grupie leczonej.
Opierając się na wynikach stężenia PSA stwierdzono, że leczenie octanem abirateronu zmniejszyło ryzyko progresji nowotworu o 42%. Na podstawie wyników badań obrazowych można mówić o zmniejszeniu ryzyka progresji nowotworu o 33%.
Odsetek pacjentów z paliacją objawów bólowych był znamiennie statystycznie wyższy w grupie leczonych octanem abirateronu niż w grupie placebo (44% vs 27%). Dla grupy leczonej octanem abirateronu zaobserwowano wydłużenie czasu do wystąpienia zdarzenia ze strony układu kostnego (9,9 vs. 4,9 miesiąca).
Najczęstszym zdarzeniem niepożądanym było zmęczenie, obserwowane równie często w obu grupach leczonych. Ponadto: ból kręgosłupa, nudności , zaparcia, ból kości, ból stawów. Nasilenie tych zdarzeń było 1 lub 2 stopnia i rzadko stwarzały konieczność przerwania podawania leku lub zmniejszenia jego dawki. Inne zdarzenia niepożądane występujące częściej w grupie leczonej octanem abirateronu to: zakażenia układu moczowego, zatrzymanie płynów i obrzęki, hipokaliemia, nadciśnienie tętnicze, choroby serca oraz nieprawidłowe wyniki badań czynnościowych wątroby. Główną przyczyną zgonów była progresja choroby nowotworowej.
Wyniki badania COU-AA-301 potwierdzają teorię, że przerzutowy rak gruczołu krokowego oporny na kastrację pozostaje nowotworem hormonozależnym. W świetle najnowszych doniesień można stwierdzić, że leczenie hormonalne może stanowić alternatywę dla leczenia cytostatycznego u tej grupy pacjentów. Otwiera się kolejna możliwość hamowania proliferacji komórek nowotworowych z wykorzystaniem leku hormonalnego o wysokiej skuteczności w wyniku supresji szlaku androgenowego. Leku hormonalnego, który przy korzystnym profilu toksyczności wykazuje dużą skuteczność przeciwnowotworową potwierdzoną w randomizowanym badaniu klinicznym III fazy. U pacjentów ze współistniejącymi chorobami internistycznymi, po wcześniejszym intensywnym leczeniu onkologicznym , których średnia wieku często przekracza 70 lat.
Octan abirateronu wydaje się być jaskółką oznajmiającą renesans leczenia hormonalnego u pacjentów z rakiem gruczołu krokowego opornym na kastrację.
Jest pierwszym z całej serii nowoczesnych preparatów hormonalnych, których skuteczność jest wciąż oceniana w obecnie trwających licznych badaniach klinicznych na świecie.
Na skuteczność, których czeka męski ród.