Pomysłowość i kserokopiarka, czyli jak powstało osiągnięcie laureatów medycznego Nobla

W tym roku Nagroda Nobla w dziedzinie fizjologii i medycyny trafiła w ręce Katalin Kariko i Drew Weissmana. Otrzymali ją za odkrycia dotyczące modyfikacji zasad nukleotydowych, które doprowadziły do opracowania skutecznych szczepionek mRNA przeciw COVID-19. By zrozumieć znaczenie ich osiągnięcia, przybliżamy skróconą historię technologii mRNA.
Cząsteczki matrycowego kwasu nukleinowego (mRNA) odkryte w 1961 r. stanowią instrukcję, dzięki której komórka wie, jak wyprodukować dane białko. Pomysł, by takie instrukcje wprowadzać z zewnątrz do komórek w postaci odpowiednio zaprojektowanych mRNA datuje się na lata 70. ubiegłego wieku. W 1976 r. wymuszono w ten sposób w warunkach in vitro produkcję kaczej globiny przez ludzkie komórki, a w 1978 r. – króliczego białka przez mysie limfocyty. Pod koniec lat 80. doszło do intensyfikacji prac nad technologią mRNA, by na początku ostatniej dekady XX w. zaobserwować, że odpowiednio skonstruowane molekuły tego kwasu podane zwierzętom mogą działać jak szczepionka. Jednak sukcesom towarzyszyły poważne problemy uniemożliwiające uruchomienie badań klinicznych preparatów mRNA. Gdy mRNA wstrzykiwano w „nagiej” formie, bez żadnego nośnika, to okazywało się wysoce niestabilne i nie docierało do komórek. Gdy umieszczano je w kationowym nośniku lipidowym, to okazywał się on zbyt toksyczny dla zwierząt, by w ogóle myśleć o podawaniu takiego preparatu ludziom. Co więcej, mRNA dostarczone do organizmu układ odpornościowy rozpoznawał jako obce, co powodowało silną reakcję zapalną. Zamiast spełniać swoją funkcję, zbyt często było ono po prostu niszczone.
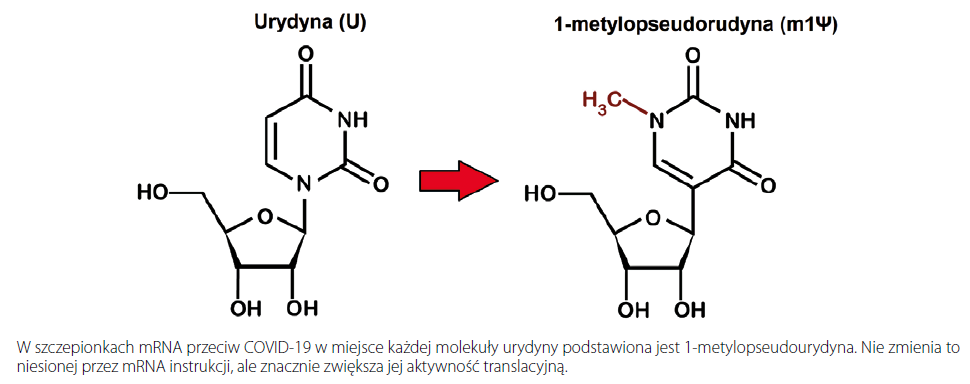
W 2005 r. Kariko i Weissman rozwiązali ten ostatni problem. Zamienili jedną z czterech cegiełek mRNA – nukleozyd urydynę, na jej analog – 1-metylopseudourydynę, która naturalnie występuje w transportujących RNA (tRNA). Dzięki temu zabiegowi znacząco zmniejszył się stan zapalny będący wynikiem wykrywania obcego RNA przez receptory Toll-podobne. W rezultacie istotnie zwiększyła się wydajność translacyjna mRNA – komórka produkowała więcej pożądanego białka. A to przecież bardzo istotne, jeżeli celem podania mRNA miałoby być wywołanie swoistej odpowiedzi humoralnej i komórkowej. Kariko i Weissman opublikowali swoje obserwacje na łamach czasopisma „Immunity” w 2005 r. i następnie opatentowali jako wynalazek. BioNTech i Moderna nawet jeszcze wtedy nie istniały.
Modyfikowane nukleozydy mRNA nie powiedziały ostatniego słowa
W czasach pandemii nie wszystkie firmy rozwijające technologię mRNA wykorzystały modyfikację Kariko i Weissmana. Preparat niemieckiego CureVac w swoim mRNA zawierał zwykłą urydynę. I to jedna z najbardziej prawdopodobnych przyczyn fiaska tego preparatu, który w trzeciej fazie badań klinicznych okazał się niewystarczająco skuteczny i nie został dopuszczony do użycia nigdzie na świecie. CureVac wyciągnął wnioski – obecnie pracując nad kolejnymi preparatami mRNA, korzysta z wynalazku Kariko i Weissmana.
A zatem gdyby nie dwójka tegorocznych noblistów, to szczepionki mRNA przeciw COVID-19 najpewniej nie uratowałyby przed zgonem milionów ludzi na całym świecie. Warto jednak podkreślić, że znaczenie ich odkrycia dla współczesnej medycyny może być wkrótce znacznie większe. W badaniach klinicznych znajdują się obecnie preparaty kandydujące do miana szczepionki mRNA przeciw wirusom grypy (w tym szczepionki uniwersalnej), cytomegalii, HIV, RSV i Epsteina–Barr. Na podobnym etapie testowania znajdują się też potencjalne terapeutyki mRNA przeciw czerniakowi, rakowi jajnika, piersi, prostaty, jelita grubego, płuc, a także glejakowi mózgu i nowotworom głowy i szyi. Możliwe, że pierwsze z nich doczekają się autoryzacji jeszcze w tej dekadzie. Co więcej, mRNA otwiera drzwi do spersonalizowanych terapii onkologicznych, w których to preparat jest projektowany na podstawie profilu mutacji konkretnego nowotworu określonego pacjenta. Są też plany, by spróbować wykorzystać odpowiednio zaprojektowane mRNA w zmniejszaniu aktywności chorób autoimmunologicznych.
Platforma mRNA może dać medycynie bardzo wiele i to na różnych polach. Osiągnięcie Kariko i Weissmana może więc przyczyniać się dalej do ratowania ludzkiego zdrowia, co dla laureatów jest z pewnością nagrodą cenniejszą niż Nobel. A przecież ta historia wcale nie musiała się tak potoczyć. Po uzyskaniu stopnia doktora pochodząca z Węgier Katalin Kariko nie mogła znaleźć zatrudnienia na żadnym europejskim uniwersytecie. Wyjechała do USA, gdzie pomimo wielokrotnych prób nie mogła przekonać instytucji grantowych do sfinansowania proponowanych przez nią badań nad mRNA. Część środowiska naukowego uważała jej pomysły za bezproduktywną stratę czasu i pieniędzy. Nie wspierał jej też Uniwersytet w Pensylwanii, gdzie pracowała – jego władze były rozczarowane badaniami i ostatecznie nie przedłużyły umowy z badaczką. Uwierzył w nią tylko Drew Weissman, którego Katalin Kariko miała spotkać przypadkowo przy kserokopiarce. Hasło „nigdy się nie poddawaj” pasuje do tej historii jak ulał.
Artykuł dr. hab. Piotra Rzymskiego z Zakładu Medycyny Środowiskowej Uniwersytetu Medycznego im. Karola Marcinkowskiego w Poznaniu opublikowano w Biuletynie Wielkopolskiej Izby Lekarskiej 9/2023.
Przeczytaj także: „Przyszłość szczepień przeciw COVID-19 – nowe rekomendacje”.
Biuletyn Wielkopolskiej Izby Lekarskiej/Piotr Rzymski