Zastosowanie substancji psychoaktywnych w leczeniu

Zwiększająca się liczba badań i publikacji potwierdzających skuteczność narkotyków w redukcji objawów depresyjno-lękowych wśród pacjentów opornych na standardowe leczenie może skutkować w przyszłości ich potencjalnym zastosowaniem w psychiatrii.
Artykuł Katarzyny Karaś, Katarzyny Groblińskiej, Krzysztofa Szczygła i Jerzego Samochowca z Katedry i Kliniki Psychiatrii Pomorskiego Uniwersytetu Medycznego w Szczecinie:
W ostatnim pięćdziesięcioleciu znaczenia nabrały badania nad wykorzystaniem substancji psychoaktywnych w leczeniu zaburzeń psychicznych. Liczne publikacje sugerują ich skuteczność w terapii wielu schorzeń, m.in. zaburzeń depresyjnych i lękowych, PTSD, uzależnienia od substancji psychoaktywnych, ADHD czy zespołu Tourette’a. Na szczególną uwagę zasługuje zastosowanie psychodelików, takich jak psylocybina i LSD, w terapii lęku i depresji związanych z chorobami terminalnymi. Nie są one bowiem obarczone działaniami niepożądanymi występującymi w przebiegu leczenia klasycznymi lekami antydepresyjnymi i przeciwpsychotycznymi, m.in. zespołu pozapiramidowego, dyskinezy, zaburzeń seksualnych, endokrynologicznych czy metabolicznych. Ich istotną zaletą jest natychmiastowy efekt terapeutyczny wywoływany np. przez esketaminę czy LSD. Podczas standardowego leczenia lekami przeciwdepresyjnymi oczekiwany efekt bywa zazwyczaj osiągany po wielu tygodniach stosowania, co może obniżać adherencję terapeutyczną i zniechęcać pacjentów do kontynuowania terapii. W artykule przedstawiono przegląd literatury dotyczącej leczenia chorób psychicznych z wykorzystaniem substancji psychoaktywnych. Omówiono takie aspekty, jak mechanizm działania, potencjalne zastosowanie i działania niepożądane substancji z grup klasycznych psychodelików, empatogenów, kannabinoli, stymulantów i dysocjantów. W przypadku niektórych omawianych substancji psychoaktywnych istnieją twarde dowody na ich skuteczność w terapii zaburzeń psychicznych. Ketamina jest substancją, której udowodniona naukowo efektywność w terapii zaburzeń depresyjnych zaowocowała wprowadzeniem jej na rynek jako nowej formy leczenia depresji.
Wprowadzenie
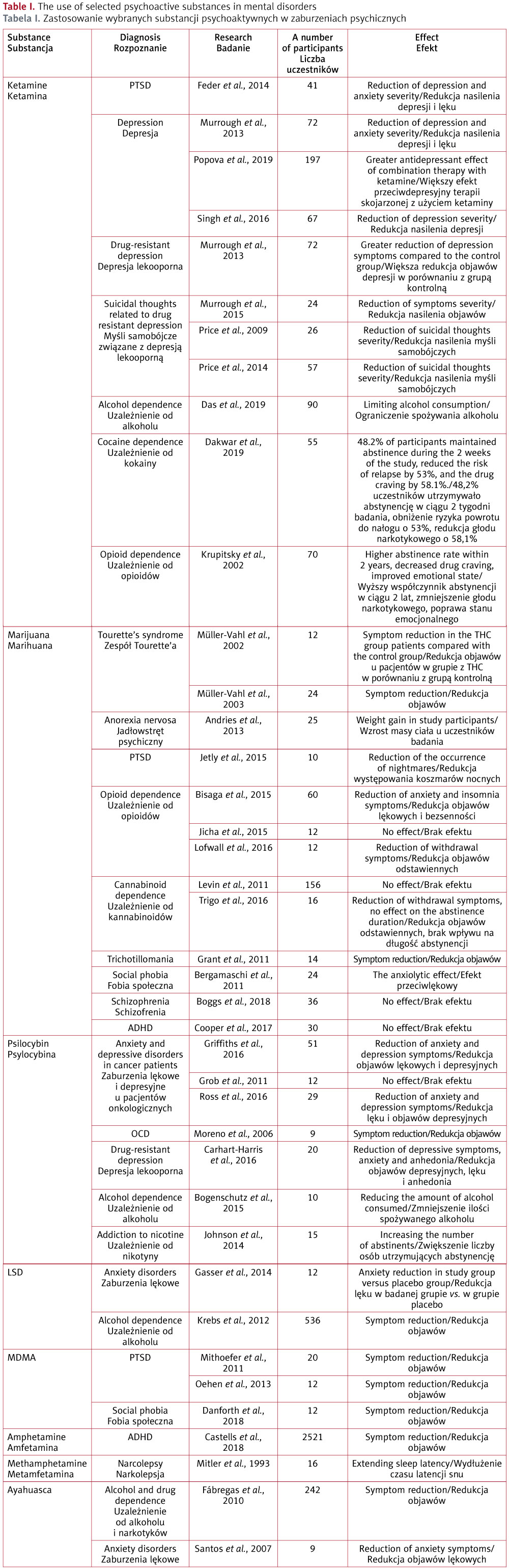
Ostatnio dużo uwagi poświęcono badaniom nad wykorzystywaniem substancji psychoaktywnych, zwanych potocznie narkotykami, w leczeniu zaburzeń psychicznych. W Polsce obowiązuje podział substancji psychoaktywnych na trzy grupy: do pierwszej należą alkohol, opiaty, leki uspokajające i nasenne, do drugiej – kannabinole i substancje halucynogenne (psychodeliki), do trzeciej – kokaina i inne stymulanty1. Do substancji psychodelicznych zaliczamy LSD (dietyloamid kwasu lizergowego), psylocybinę, DMT (dimetylotryptaminę) czy meskalinę, związane głownie z działaniem na receptor 5-HT2A, oraz empatogeny (MDMA, 3,4-metylenodioksymetamfetamina) oddziałujące na transmisję serotoninergiczną, dopaminergiczną i adrenergiczną2. Dotychczasowe prace wskazują na możliwą rolę substancji psychoaktywnych w zmianie transkrypcji neuronów i aktywowaniu innych szlaków komórkowych niż te aktywowane przez tradycyjne leki psychotropowe3. Substancje psychoaktywne, zanim stały się zakazane, były szeroko stosowane w psychiatrii, ich szkodliwość przyczyniła się jednak do zaniechania badań i terapii klinicznych. Co ciekawe, w ostatnich latach pojawiło się wiele badań oceniających wyżej wymienione substancje w leczeniu rożnych zaburzeń psychicznych, takich jak uzależnienia, zaburzenia depresyjne, lękowe i inne4 (tabela I). Prezentowana praca powstała na podstawie przeglądu wybranych artykułów z bazy bibliograficzno-abstraktowej PubMed. Wyszukując prace, autorzy używali takich terminów, jak „substancje psychoaktywne”, „leczenie”, „psychiatria”, „depresja”, „zaburzenia lękowe”, „PTSD”, „ADHD”, „choroby przewlekłe”.
LSD (dietyloamid kwasu lizergowego)
LSD należy do grupy klasycznych psychodelików. Silnie wiąże się z receptorami serotoninergicznymi 5-HT1A, 5-HT2A, 5-HT2C, dopaminergicznymi D2 i adrenergicznymi α2, natomiast słabiej z receptorami dopaminergicznymi D1, D3 i adrenergicznymi α15. Głównym mechanizmem działania LSD jest aktywacja transmisji glutaminergicznej kory czołowej, wtórna do stymulacji receptorów 5-HT2A6, a efekty psychotropowe, które wywołuje, są opisywane jako „doświadczenia mistyczne”7. Stosowanie LSD prowadzi do tolerancji o charakterze psychicznym8. Badanie z randomizacją i podwójnie ślepą próbą, oceniające skuteczność psychoterapii połączonej z użyciem LSD, zostało przeprowadzone u 12 pacjentów z zaburzeniami lękowymi związanymi z chorobami potencjalnie zagrażającymi życiu, takimi jak procesy nowotworowe. Pacjenci otrzymali LSD dwukrotnie, podczas dwóch sesji oddzielonych okresem 2–3 tygodni. Po sesjach psychoterapii wspomaganych LSD wykazano u nich, w porównaniu z osobami otrzymującymi placebo, znaczące zmniejszenie objawów lękowych i depresyjnych związanych z chorobą. W HADS (Hospital Anxiety and Depression Scale) cecha lęku w grupie eksperymentalnej obniżyła się o 3,6 punktu, w grupie placebo – o 0,6. Poprawa utrzymywała się przez 12 miesięcy. Nie zaobserwowano działań niepożądanych trwających dłużej niż dzień po leczeniu9.
Kolejnym przykładem zastosowania LSD jest jego użycie w terapii uzależnienia od alkoholu. W metaanalizie składającej się z 6 badań, przeprowadzonej przez Krebsa i wsp., w której łącznie wzięło udział 536 osób, badanej grupie podano jednorazowo LSD w dawce 200–800 μg, grupie kontrolnej – niższe dawki LSD, d-amfetaminę, placebo lub efedrynę. Po 2 i 6 miesiącach obserwacji wykazano redukcję nadużywania alkoholu u osób z badanej grupy. NNT (number needed to treat) dla LSD wyniosła 6, gdy dla naltreksonu – 910.
LSD znalazło także zastosowanie w neurologii. W badaniu przeprowadzonym przez Schindlera i wsp. dowiedziono, że użycie LSD zmniejszyło klasterowy ból głowy i powodowało remisję bardziej efektywnie niż konwencjonalne leki. Stwierdzono również, że skuteczność wykazują nawet małe dawki tej substancji11 – w celu leczenia bólu wykorzystuje się bromową pochodną LSD, która nie działa halucynogennie12.
Efekty niepożądane związane z użyciem LSD możemy podzielić na te wynikające ze stymulacji współczulnej oraz spowodowane przez pobudzenie przywspółczulnej części autonomicznego układu nerwowego. Do pierwszych zaliczamy podwyższenie skurczowego i rozkurczowego ciśnienia krwi oraz wzrost tętna13, a stymulacja przywspółczulna objawia się obfitym poceniem się, ślinieniem, nudnościami i wymiotami14.
MDMA (3,4-metylenodioksymetamfetamina)
MDMA, związek znany jako „ecstasy” lub „Molly”, działa poprzez stymulację uwalniania serotoniny, noradrenaliny, zwiększa również poziom kortyzolu, prolaktyny i oksytocyny w osoczu15. Pomimo podobieństwa w budowie MDMA wykazuje efekty, których nie można porównać ani z działaniem klasycznych halucynogenów, jak LSD czy psylocybina, ani tzw. stymulantów, takich jak amfetamina16. W badaniu przeprowadzonym w 2014 roku Hysek i wsp. udowodnili, że MDMA zwiększa empatię emocjonalną (należy do grupy empatogenów) i promuje zachowania prospołeczne. Umożliwia również rozpoznawanie emocji u innych ludzi. Przy użyciu FERT (Facial Expression Recognition Test) wykazano zmniejszoną zdolność do identyfikacji emocji – lęku, gniewu, oburzenia czy zaskoczenia, niezmieniona natomiast została zdolność do rozpoznawania pozytywnych emocji, takich jak radość. Dlatego też psychiatrzy i psychoterapeuci zapoczątkowali badania nad zastosowaniem MDMA w terapii zaburzeń psychicznych jako środka zwiększającego potrzebę wchodzenia w interakcje społeczne15.
Działanie MDMA na receptor α2 przyczynia się do paradoksalnego efektu relaksacji i uspokojenia17, korzystnie korygując nadmierną czujność związaną z przebytym urazem w przebiegu PTSD (posttraumatic stress disorder). Substancja ta ułatwia uwalnianie oksytocyny, co może zwiększać poziom empatii i potrzebę bliskości18. Dodatkowo działanie na receptory 5-HT2A wzmacnia pobudliwość emocjonalną i wpływa na pozytywny nastrój19, a zwiększony poziom serotoniny działa na receptor 5-HT2A w mechanizmie ułatwiającym zmianę sposobu myślenia o wydarzeniach przeżytych w przeszłości20. Odkrycia te sprawiły, że zaczęto zastanawiać się nad wykorzystaniem MDMA w psychoterapii. Mithoefer i wsp. badali użyteczność MDMA w leczeniu PTSD w grupie 20 chorych z przewlekłą, oporną na psychoterapię i farmakoterapię postacią PTSD. Na pierwszym etapie z podwójnie ślepą próbą 8 pacjentom zostało podane placebo, a 12 – MDMA. Po 2-miesięcznym okresie obserwacji uczestnikom otrzymującym placebo zaproponowano udział w drugim etapie, tj. w badaniu otwartym z użyciem MDMA. W porównaniu z tą samą psychoterapią z placebo terapia z MDMA spowodowała istotne statystycznie zmniejszenie objawów mierzonych za pomocą CAPS (Clinical-Administered PTSD Scale) oraz IES-R – Skali Wpływu Zdarzeń (Impact of Event Scale Revised)1 – zarówno 4 dni po pierwszej, 4 dni po drugiej, jak i 2 miesiące po drugiej sesji terapeutycznej. Sugeruje to potencjalną korzyść z psychoterapii połączonej z użyciem MDMA w leczeniu tego zaburzenia21.
Oehen i wsp. ocenili wpływ MDMA na leczenie przewlekłej, lekoopornej postaci PTSD. W badaniu z randomizacją i podwójnie ślepą próbą wzięło udział 12 uczestników, którzy uprzednio przeszli co najmniej 6-miesięczną psychoterapię i 3-miesięczną terapię lekami z grupy SSRI, a ich choroba w chwili rozpoczęcia eksperymentu trwała średnio 12 lat. Uczestnicy odbyli 3 eksperymentalne sesje psychoterapeutyczne połączone z użyciem MDMA oraz 12 sesji bez użycia substancji. Punktacja w CAPS spadła o 23,5 proc. w grupie eksperymentalnej. Punktacja w PDS (Posttraumatic Diagnosis Scale) również uległa obniżeniu22. Obecnie prowadzone jest badanie nad użyciem MDMA w terapii uzależnienia od alkoholu (BIMA, the Bristol Imperial MDMA in Alcoholism Study). Hipotezą badawczą jest fakt, że część pacjentów spożywających alkohol robi to, by zagłuszyć traumatyczne wspomnienia. Hipotetyczna korzyść z psychoterapii wspomaganej MDMA w postaci przezwyciężenia traum mogłaby prowadzić do ograniczenia spożywania alkoholu23.
Danforth i wsp. zbadali wpływ MDMA na objawy fobii społecznej u dorosłych pacjentów z autyzmem. W badaniu wzięło udział 12 osób, 8 z nich otrzymało MDMA w dawce 75–125 mg, 4 – placebo. Dwie podwójnie ślepe, eksperymentalne sesje psychoterapeutyczne zostały przeprowadzone w odstępie 1 miesiąca i były poprzedzone 3 sesjami bez użycia substancji. Po pierwszej sesji i po 7 miesiącach uzyskane wyniki w Skali Lęku Społecznego (LSAS, Lebowitz Social Anxiety Scale) potwierdziły korzyść terapii z MDMA. Klinicznie istotne zmniejszenie objawów fobii społecznej osiągnięto u 6 na 8 osób z grupy MDMA (75 proc.) i u 2 na 4 (50 proc.) w grupie placebo24.
Do działań niepożądanych mogących wystąpić po zażyciu MDMA należą: wzrost ciśnienia tętniczego, przyspieszenie tętna, wzrost temperatury ciała, szczękościsk, bruksizm, zmniejszony apetyt, zaburzenia koncentracji i równowagi25.
Amfetamina
W przeszłości amfetamina była uważana w świecie medycyny za panaceum na liczne dolegliwości. Została odkryta podczas poszukiwania tańszego, łatwiejszego do syntezy zamiennika efedryny i wprowadzona na rynek w 1935 roku jako lek na narkolepsję, łagodną depresję, parkinsonizm i wiele innych zaburzeń. W latach 30. XX w. zauważono korzyści ze stosowania amfetaminy u dzieci z ciężkimi zaburzeniami zachowania, prawdopodobnie dziś diagnozowanych jako ADHD (attention deficit hyperactivity disorder). Strukturalne podobieństwo amfetaminy do katecholaminowych neurotransmiterów – noradrenaliny i dopaminy – sprawia, że ma ona właściwości kompetycyjnego substratu transporterów wychwytu zwrotnego monoamin: transportera noradrenaliny (NET), transportera dopaminy (DAT) i transportera serotoniny (SERT)26, 27. Jej zastosowanie w medycynie związane jest głównie z ADHD – chorobą, która mimo stosunkowo częstego występowania, bywa rzadko diagnozowana, szczególnie u dorosłych28. W najnowszych badaniach nad częstością chorób psychicznych uznano, że w Europie na ADHD choruje ok. 3 mln osób29.
W 2018 roku Castells i wsp. przeprowadzili metaanalizę obejmującą 19 badań oceniających skuteczność trzech rodzajów amfetamin (lisdeksamfetamina w dawkach od 10,2 mg/d do 21,8 mg/d, deksamfetamina w dawkach od 30 mg/d do 70 mg/d i zmieszane sole amfetamin w dawkach od 12,5 mg/d do 80 mg/d) w leczeniu ADHD. Badania były kontrolowane placebo, a trzy z nich obejmowały lek porównawczy: guanfacynę, modafinil lub paroksetynę. Jedynie deksamfetamina nie zmniejszyła nasilenia objawów ADHD w ocenie klinicystów, natomiast wszystkie rodzaje amfetaminy działały skutecznie według subiektywnej oceny pacjentów. Użycie amfetamin było związane z większym ryzykiem wcześniejszego zakończenia leczenia z powodu działań niepożądanych. Wielkość dawek amfetaminy nie wpływała na różnice w skuteczności. Nie stwierdzono też różnic w skuteczności pomiędzy amfetaminą a guanfacyną, modafinilem czy paroksetyną30. Z metaanalizy przeprowadzonej w 2010 roku przez Faraone i wsp. wynika, że amfetamina ma większą skuteczność w leczeniu ADHD niż metylofenidat31.
Narkolepsja jest zaburzeniem snu charakteryzującym się nadmierną sennością w ciągu dnia, napadami snu i epizodami nagłej utraty napięcia mięśniowego. Amfetamina została wprowadzona do jej leczenia w 1935 roku i w dalszym ciągu jest wykorzystywana32. Mitler i wsp. przeprowadzili badanie nad użytecznością metamfetaminy w leczeniu narkolepsji. W porównaniu z amfetaminą ma silniejsze działanie centralne niż obwodowe z uwagi na większą lipofilność. Badana grupa obejmowała 8 pacjentów z narkolepsją, a grupa kontrolna – 8 osób dopasowanych do tych z badanej grupy pod względem płci, wieku, edukacji i historii pracy. Podczas badania, które trwało 28 dni, metamfetamina była podawana w pojedynczej, porannej dawce 0,20 lub 40–60 mg w grupie eksperymentalnej i 0,5 lub 10 mg w grupie kontrolnej. Metamfetamina zmniejszyła senność i deficyty wydajności u wszystkich osób w badanej grupie. Kwestionariusze skutków ubocznych ujawniły działania niepożądane u 5 z 8 osób w badanej grupie i 4 z 8 w kontrolnej33.
DMT (dimetylotryptamina)
Jedną z bardziej tajemniczych substancji psychodelicznych jest DMT (N, N-dimethyltryptamine) – serotoninergiczny halucynogen występujący w roślinach pochodzących z Ameryki Południowej, m.in. w Prestonia amazonica (Apocynaceae), oraz w niewielkich ilościach w mózgu, krwi i moczu ssaków34, 35. Odkrycie enzymu odpowiedzialnego za syntezę DMT z tryptaminy – INMT (N-metylotransferaza indoletyloaminowa), znajdującego się m.in. w płucach, sercu, żołądku czy trzustce, może sugerować, że DMT odgrywa rolę biologiczną albo że podczas ewolucji pełniła funkcję, która nie występuje u żyjących dziś osobników36. DMT, oprócz powinowactwa do receptorów serotoninowych 5-HT1A, 5-HT1B, 5-HT1D, 5-HT2A, 5-HT2B, 5-HT2C, 5-HT5A, 5-HT6 i 5-HT7, działa agonistycznie na receptor σ1R (sigma-1) oraz endogenny receptor dla śladów wybranych amin (TAAR, trace amine-associated receptor)37–39. Efekty, jakie wywołuje, to silna euforia, utrata poczucia czasu, przestrzeni i rożnie opisywane doświadczenia mistyczne. Niektórzy użytkownicy zgłaszali uczucie lęku, drżenia ciała czy też ucisk w klatce piersiowej40.
Historia doświadczeń z DMT sięga kilkuset lat i jest związana z praktykami religijnymi i rytuałami. Najpopularniejszy z nich to rytuał picia warzonej mikstury ayahuasca41. Ayahuasca jest najczęściej sporządzana z pnącza Banisteriopsis caapi (zawierającego alkaloidy β-karboliny będące inhibitorami MAO) oraz liści Psychotria viridis (zawierających DMT)42. Bez inhibitora MAO organizm szybko metabolizuje DMT i efekt psychoaktywny nie występuje43. Wyniki badania nad ayahuasca, znanego jako Hoasca project, wskazują, że kontrolowane używanie jest bezpieczne pod względem medycznym44, 45. Badania nad zastosowaniem w leczeniu DMT sięgają lat 70., kiedy to dowiedziono, że substancja ta może być wykorzystana w psychoterapii zespołu zależności alkoholowej46 i terapii lęku u chorych z nowotworem w stadium terminalnym47.
Fabregas i wsp. badali wpływ używania ayahuasca na uzależnienie od alkoholu. Porównano użytkowników stosujących ayahuascę z dżungli (n = 56) z tymi z obszarów wiejskich (n = 56), następnie porównano miejskich użytkowników tej substancji (n = 71) z osobami z grupy kontrolnej także z terenów miejskich (n = 59). Głównym kryterium włączenia do grupy użytkowników stosujących ayahuascę była historia używania substancji przez minimum 15 lat, co najmniej 2 razy w tygodniu. Badacze do oceny użyli skali ASI (Addiction Severity Index). Jak wykazały badania, obie podgrupy używające ayahuascę uzyskały niższe wyniki w skali ASI dotyczącej używania alkoholu. Badanych oceniano także w podskalach odnoszących się do chorób współistniejących, zatrudnienia, problemu nadużywania narkotyków, problemów z prawem oraz zaburzeń psychicznych. Wykazano, że rytualne używanie ayahuaski nie wiąże się z występowaniem problemów psychospołecznych, które powodują inne substancje odurzające48.
Zainteresowanie ayahuascą w leczeniu depresji wynika z jej wpływu na transmisję serotoninergiczną. Odkryto, że długotrwałe stosowanie mieszanki DMT i alkaloidów β-karboliny jest skorelowane ze zwiększoną gęstością transporterów serotoniny w płytkach krwi, których deficyt wiąże się m.in. z zaburzeniami depresyjnymi, agresją i nadużywaniem substancji psychoaktywnych49, 50. W badaniu przeprowadzonym przez Santos i wsp. na grupie 9 osób wykazano, że picie mikstury ayahuasca powodowało zmniejszenie uczucia bezsensowności i objawów panicznego lęku badanych za pomocą BHS (Beck Hopelessness Scale) oraz ASI-R (Anxiety Sensitivity Index-Revised). Nie zauważono wpływu naparu na objawy lęku mierzone w skali STAI (State-Trait Anxiety Inventory)51.
Ketamina
Ketamina jest anestetykiem odkrytym poł wieku temu. Mimo że najczęściej kojarzona jest z anestezjologią ze względu na swój wielokierunkowy mechanizm działania, wzbudza coraz większe zainteresowanie wśród psychiatrów. Najnowsza literatura donosi o jej skuteczności w leczeniu m.in. PTSD52, depresji lekoopornej53, 54, myśli samobójczych55–57, leczeniu uzależnienia od alkoholu58 oraz uzależnienia od kokainy59 i opioidów60. Ponadto ketamina może być obiecującym lekiem służącym do wzmocnienia działania selektywnych inhibitorów zwrotnego wychwytu serotoniny oraz inhibitorów zwrotnego wychwytu serotoniny i noradrenaliny w terapii lekoopornych zaburzeń depresyjnych61. W 2019 roku esketamina została zarejestrowana jako lek w Stanach Zjednoczonych. Jest stosowana w leczeniu depresji lekoopornej i dostępna w formie sprayu donosowego62.
Najdokładniej zbadanym działaniem farmakologicznym ketaminy jest jej selektywny antagonizm względem receptora N-metylo-D-asparaginowego (NMDA). Aktywacja receptora NMDA w mózgu skutkuje nasileniem objawów depresyjnych oraz lękowych i może stanowić czynnik ryzyka rozwoju zespołu stresu pourazowego. Antagonistyczne działanie ketaminy wobec tego receptora wydaje się obiecującą metodą leczenia PTSD. Wielu badaczy upatrywało podstaw antydepresyjnego działania anestetyku w tym właśnie mechanizmie, co doprowadziło do wnikliwych badań dotyczących anatagonistów receptorów NMDA, niebędących ketaminą. Wśród nich znalazły się m.in. dizocylpina (MK-801), Ro25-6981, memantyna, lanicemina (AZD6765) i traksoprodil (CP-101 606). Badania z użyciem dizocylpiny przeprowadzone na modelu zwierzęcym wykazały, że substancja, mimo powinowactwa z tym samym receptorem co ketamina, nie wywoływała długotrwałego efektu antydepresyjnego. Lanicemina, Ro25-6981, memantyna i traksoprodil również wywoływały słabszy i krócej trwający efekt przeciwdepresyjny niż ketamina, co w świetle aktualnych badań i dostępnej literatury czyni ją jedynym antagonistą receptorów NMDA możliwym do zastosowania w leczeniu zaburzeń depresyjnych.
W badaniach sekcyjnych pacjentów cierpiących na depresję wykazano zmniejszoną ekspresję mRNA podjednostek GluA1 i GluA3 receptora AMPA (kwas α-amino-3-hydroksy-5-metylo -4-isoksazolepropionowy) w korze perirynalnej, obszarze C1 hipokampa oraz zakręcie zębatym. Poszukiwanie podobnych zjawisk w modelu zwierzęcym doprowadziło do odkrycia, że również w tej grupie pod wpływem chronicznego stresu dochodzi do zmniejszenia ekspresji podjednostek receptora AMPA w wyżej wymienionych strukturach mózgu63. Jak wynika z badań przeprowadzonych na szczurach, ketamina powoduje gwałtowny i krótkotrwały wyrzut glutaminianu, a także zwiększa jego produkcję w środkowej części kory przedczołowej. Skutkuje to aktywacją receptorów AMPA i sugeruje ich udział w natychmiastowym działaniu przeciwdepresyjnym ketaminy. Ponadto badania przedkliniczne wskazują na udział wysokich stężeń glutaminianu w stymulacji neuroplastyczności.
Zaobserwowana w badaniach neuroobrazowych atrofia neuronów oraz zmniejszona objętość hipokampa i kory przedczołowej, występująca u pacjentów cierpiących na depresję oraz w modelu zwierzęcym, sugerują udział tych zjawisk w patogenezie zaburzeń depresyjnych. Opublikowane w 2019 roku badanie z zastosowaniem PET oraz radioligandu SV2A udokumentowało zmniejszoną gęstość synaps w grzbietowo-bocznej korze przedczołowej, przednim zakręcie obręczy i hipokampie wśród pacjentów, u których zdiagnozowano zaburzenia depresyjne lub PTSD. Badania sekcyjne, przeprowadzone u pacjentów, którzy popełnili samobójstwo, oraz cierpiących na depresję za życia wykazały obniżony poziom BDNF (brain-derived neurotrophic factor) i jego receptora kinazy tyrozynowej w korze przedczołowej oraz hipokampie. Indukowany przez ketaminę wyrzut glutaminianu, stymulując postsynaptyczne receptory AMPA, powoduje depolaryzację i aktywację kanałów wapniowych typu L, co prowadzi do uwolnienia BDNF i tym samym – wywołania natychmiastowego efektu antydepresyjnego. Co więcej, nie występuje on w modelu zwierzęcym, jeśli u badanych gryzoni wyciszono gen BDNF bądź dokonano mutacji w jego obrębie (BDNF Val66Met). Ketamina promuje ekspresję BDNF w hipokampie, ale także BDNF-TrkB-zależne różnicowanie neuronów w zakręcie zębatym, co prawdopodobnie odpowiada za długotrwały efekt antydepresyjny tego leku.
Innym czynnikiem biorącym udział w patogenezie zaburzeń depresyjnych jest VEGF (vascular endothelial growth factor). Wśród pacjentów z depresją oraz na modelu zwierzęcym wykazano dysregulację poziomów VEGF i innych neuro transmiterów w hipokampie. W grupie pacjentów otrzymujących przeciwciała anty-VEGF w terapii starczego zwyrodnienia plamki żółtej stwierdzono podwyższone ryzyko wystąpienia zaburzeń depresyjnych i lękowych. Istnieją również badania potwierdzające obniżony poziom VEGF w płynie mózgowo-rdzeniowym pacjentów, którzy próbowali popełnić samobójstwo, oraz cierpiących na depresję lekooporną. Ketamina indukuje ekspresję VEGF w hipokampie. Wiadomo, że neurony piramidalne kory przedczołowej są zarówno źródłem, jak i punktem uchwytu dla VEGF. Przewodnictwo neuronalne odbywające się za pośrednictwem receptora kinazy tyrozynowej VEGF-Flk-1 odgrywa kluczową rolę w antydepresyjnym działaniu ketaminy62.
W badaniu klinicznym z randomizacją, przeprowadzonym przed Feder i wsp., pacjenci cierpiący na PTSD otrzymali pojedynczy wlew ketaminy (0,5 mg/kg m.c.) lub midazolamu (0,045 mg/kg m.c.). Po 24 godzinach od podania odnotowano znaczną redukcję symptomów towarzyszących PTSD mierzoną za pomocą Skali Wpływu Zdarzeń (IES-R) Weissa i Marmara, wśród pacjentów, którzy otrzymali wlew anestetyku. Wśród 7 uczestników, którym podano ketaminę, zmniejszenie nasilenia symptomów utrzymywało się do 2 tygodni. Tak długotrwały efekt zaobserwowano jedynie u 1 pacjenta leczonego midazolamem. Dodatkowo po podaniu anestetyku nastąpiła redukcja objawów depresyjnych towarzyszących PTSD64.
Murrough i wsp. badali natomiast zastosowanie ketaminy u pacjentów cierpiących na depresję lekooporną – 72 uczestników podzielono na dwie grupy, którym podano odpowiednio: chlorowodorek ketaminy lub midazolam. Efekty mierzono za pomocą skali MADRS (the Montgomery-Asberg Depression Rating Scale). W grupie pacjentów otrzymujących anestetyk zaobserwowano większą redukcję objawów depresyjnych (wynik MADRS niższy o 7,95 punktu). Ponadto u 64 proc. uczestników leczonych ketaminą stwierdzono zmniejszenie liczby punktów uzyskanych w ww. skali o ponad 50 proc. w stosunku do 28 proc. w grupie z midazolamem53. W kolejnym badaniu nad zastosowaniem leku w depresji lekoopornej w badanej grupie zażywającej anestetyk zaobserwowano podobną redukcję nasilenia objawów depresyjnych54.
Badano także wykorzystanie ketaminy w leczeniu uzależnień od substancji psychoaktywnych. Wykazano, że podanie ketaminy skutkuje zmniejszeniem odczuwania przyjemności z picia i ograniczeniem potrzeby sięgania po alkohol58. Zbadano skuteczność ketaminy w leczeniu uzależnienia od kokainy w grupie 55 pacjentów – 48,2 proc. uczestników, którym podano ketaminę, utrzymało abstynencję przez 2 tygodnie od dnia badania, natomiast w grupie otrzymującej midazolam odsetek ten wynosił 10,7 proc.. Anestetyk, w porównaniu z midazolamem, obniżył ryzyko powrotu do nałogu o 53 proc. i zredukował odczuwanie głodu narkotykowego o 58,1 proc.59.
Krupitsky i wsp. badali wpływ ketaminy na utrzymanie abstynencji wśród 70 pacjentów uzależnionych od heroiny po leczeniu odwykowym. Uczestnicy zostali podzieleni na dwie grupy ze względu na dawkę leku: 0,2 mg/kg m.c. oraz 2 mg/kg m.c. W ciągu 2 lat od przeprowadzenia doświadczenia wśród pacjentów, którzy otrzymali większą dawkę anestetyku, zanotowano wyższy współczynnik abstynencji, zmniejszenie odczuwania głodu narkotykowego i znaczną poprawę stanu emocjonalnego w stosunku do osób z grupy kontrolnej60.
W 2019 roku opublikowano wyniki badania obejmującego 197 pacjentów chorujących na depresję lekooporną, podzielonych na dwie grupy. Jednej podawano esketaminę w formie sprayu donosowego (56 mg lub 84 mg x 2/tydzień) i lek antydepresyjny, a drugiej grupie – spray z placebo i lek antydepresyjny. Stosowano escitalopram, sertralinę, duloksetynę i wenlafaksynę. Stwierdzono większą redukcję objawów depresyjnych w grupie z esketaminą. Ponadto wśród tych ostatnich zaobserwowano szybsze ustąpienie symptomów niż w grupie z placebo. Przyjmowanie antydepresantu z esketaminą wywoływało częściej objawy niepożądane, takie jak nudności, zaburzenia dysocjacyjne, zawroty głowy i zaburzenia smaku, niż leczenie jedynie lekiem przeciwdepresyjnym. Było to przyczyną rezygnacji z dalszego uczestnictwa w badaniu 7 proc. uczestników z grupy otrzymującej anestetyk w porównaniu z 0,9 proc. w grupie z placebo61.
Ustalono, że działania niepożądane występujące po podaniu ketaminy są zależne od dawki. Największe ich nasilenie występuje w drugiej godzinie od podania. Objawy ustępują w ciągu 4–24 godzin. Należą do nich objawy dysocjacyjne, psychotyczne, a także przejściowy wzrost ciśnienia skurczowego, rozkurczowego i tętna65. Najnowsze badania przeprowadzone na modelu zwierzęcym sugerują, że (R)-ketamina i jej metabolit (2R,6R)-HNK wywołują mniej działań niepożądanych w porównaniu z (S)-ketaminą i ketaminą racemiczną63.
Konopie indyjskie
Marihuana, w większości krajów nielegalna, jest najczęściej zażywanym narkotykiem na świecie. Kwiaty konopi siewnej zawierają ponad 421 różnorodnych substancji chemicznych, w tym ponad 60 rodzajów kannabinoidów. Największe zainteresowanie badaczy budzą delta-9-tetrahydrokannabinol (THC) i kannabidiol (CBD), które mają odmienne właściwości. THC jest głównym psychoaktywnym kannabinoidem obecnym w konopiach indyjskich, który zmienia nastrój, percepcję, apetyt oraz odczuwanie bólu i napięcia66. CBD wykazuje działanie antypsychotyczne, przeciwlękowe, przeciwwymiotne, przeciwzapalne, neuroprotekcyjne i przeciwnowotworowe66, 67, jednocześnie nie wykazując powinowactwa do receptorów kannabinoidowych. Udowodnienie istnienia receptorów kannabinoidowych w mózgu w modelu zwierzęcym przez Devane’a w 1988 roku zapoczątkowało szereg badań, które doprowadziły do identyfikacji receptora CB2 w śledzionie68, sugerując, że kannabinoidy odgrywają rolę w funkcjonowaniu organizmu. Badania dotyczące receptorów kannabinoidowych CB1 i CB2, enzymów oraz endogennych ligandów (endokannabinoidów, anandamidu i 2-arachidonyloglicerolu) umożliwiły odkrycie układu endokannabinoidowego (eCB). Uczestniczy on zarówno w fizjologicznych, jak i patologicznych procesach zachodzących w ludzkim organizmie. Homeostaza pomiędzy składowymi układu endokannabinoidowego odgrywa kluczową rolę w rozwoju ośrodkowego układu nerwowego i neuroplastyczności. Oddziałuje na ośrodek nagrody w mózgu i mechanizm powstawania uzależnień. Ponadto eCB uczestniczy w regulacji apetytu, odczuwaniu bólu, procesach poznawczych i kontroli pamięci. Jest jednym z kluczowych modulatorów nie tylko autonomicznego układu nerwowego, lecz także układów: immunologicznego, endokrynologicznego, rozrodczego i pokarmowego66.
W ostatnich latach powstało wiele publikacji dotyczących skuteczność medycznej marihuany w leczeniu zaburzeń psychicznych. Wśród nich znalazły się m.in. zespół Tourette’a69, 70, jadłowstręt psychiczny71, demencja72–74, PTSD75, zespół zależności od opioidów76–78 i kannabinoidów79, 80, trichotillomania81, fobia społeczna82, psychoza/schizofrenia83– 85 i ADHD86. Leki stosowane w badaniach klinicznych podzielono na cztery grupy ze względu na mechanizm działania – agoniści receptora CB1: dronabinol, nabilon, nabiksimol, THC; antagoniści receptora CB1 lub jego odwrotni agoniści: rimonabant, drinabant; modulator kannabinoidów: kannabidiol oraz pozostałe kannabinoidy66.
Muller-Vahl i wsp. zbadali efekt zastosowania kannabinoidów w leczeniu zespołu Tourette’a. Redukcję objawów zaobserwowano u 10 na 12 pacjentów w grupie z THC w porównaniu z 3 na 12 pacjentów w grupie kontrolnej69. W kolejnym badaniu pacjentom podawano THC, zaczynając od dawki 2,5 mg do 10 mg. W grupie przyjmującej THC stwierdzono istotną statystycznie redukcję symptomów70.
W innym badaniu zastosowano dronabinol (2,5 mg x 2/d przez 4 tygodnie) oraz placebo wśród pacjentek cierpiących na anoreksję co najmniej od 5 lat. Zaobserwowano wzrost masy ciała w obu grupach, z przewagą tej otrzymującej kannabinoid (1 kg : 0,34 kg)71.
Dronabinol ma wpływ na zaburzenia poznawcze i apetyt wśród pacjentów z chorobą Alzheimera. W grupie otrzymującej kannabinoidy stwierdzono większy przyrost masy ciała i spłycenie afektu w porównaniu z grupą placebo72. Badania van Elsena wykazały, że THC nie redukuje objawów neuropsychiatrycznych ani zaburzeń zachowania wśród pacjentów z demencją73, 74.
Po zastosowaniu kannabinoidów w leczeniu PTSD nastąpiła redukcja występowania koszmarów nocnych oceniana za pomocą CAPS (Clinician- -Administered PTSD Scale) w grupie otrzymującej nabilon. Ponadto u 50 proc. pacjentów w tej grupie zanotowano poprawę stanu ogólnego w porównaniu z 11 proc. osób w grupie placebo75.
Według badania przeprowadzonego wśród pacjentów uzależnionych od opioidów dronabinol w dawce 30 mg/d redukował nasilenie objawów odstawiennych w porównaniu z pacjentami z grupy placebo. Uczestnicy, którzy palili marihuanę w trakcie eksperymentu, charakteryzowali się mniejszym nasileniem objawów lękowych i rzadziej cierpieli na bezsenność76. W innym badaniu pacjenci w trakcie leczenia odwykowego otrzymali dronabinol w dawce 40 mg, co wywołało u nich tachykardię i objawy lękowe77. Podobny efekt zaobserwowano w innym badaniu, stwierdzono jednak przy tym niewielką redukcję objawów odstawiennych78.
Levin i wsp. badali wpływ dronabinolu na leczenie uzależnienia od kannabinoidów. Nie uzyskano żadnych efektów leczenia, które pomogłyby uczestnikom osiągnąć abstynencję79. Badanie z użyciem Sativexu (mieszanka THC/CBD) wykazało, że jego stosowanie redukuje objawy odstawienne, jednak nie wpływa na odczuwanie głodu narkotykowego ani długość trwania abstynencji80.
Przeprowadzono również badanie kliniczne, w którym oceniano efekt leczenia dronabinolem (od 2,5 mg do 15 mg) pacjentek z trichotillomanią. Niemal 65 proc. uczestniczek odpowiedziało na leczenie, tj. uzyskało ponad 35-procentową redukcję wyniku w MGH-HPS (Massachusetts General Hospital Hair Pulling Scale)81.
Pacjenci cierpiący na fobię społeczną otrzymali pojedynczą dawkę CBD (600 mg) lub placebo, po czym zostali poddani testowi polegającemu na symulacji wystąpienia publicznego. W grupie, której podano kannabidiol, zaobserwowano efekt przeciwlękowy, zmniejszenie dyskomfortu i redukcję upośledzenia funkcji poznawczych82.
W badaniu McGuire i wsp. pacjenci chorujący na schizofrenię otrzymywali kannabidiol (1000 mg/d) lub placebo. Po 6 tygodniach leczenia w grupie z CBD odnotowano znaczną redukcję objawów schizofrenii, poprawę stanu ogólnego oraz funkcji poznawczych w porównaniu z grupą kontrolną84. Natomiast Boggs i wsp. nie stwierdzili poprawy w grupie pacjentów cierpiących na schizofrenię otrzymujących CBD (600 mg/d)85.
Używanie kannabinoidów, co należy podkreślić, może indukować epizody psychotyczne. W badaniu przeprowadzonym w 2019 roku na grupie ponad 2000 pacjentów oceniano zależność pomiędzy ilością i zawartością THC w palonej marihuanie a częstością występowania psychoz. Wykazano znaczny wzrost ryzyka wystąpienia epizodu psychotycznego wśród uczestników badania, którzy używali konopi indyjskich o zawartości THC powyżej 10 proc. i deklarowali codzienne przyjmowanie narkotyku, w porównaniu z osobami z grupy kontrolnej, które nigdy nie paliły marihuany87.
Nie stwierdzono natomiast statystycznie istotnej różnicy między nabiksimolem a placebo w skuteczności leczenia ADHD w takich aspektach, jak procesy poznawcze, poziom aktywności, labilność emocjonalna i impulsywność86.
Najczęstsze niepożądane działania medycznej marihuany to: zmęczenie, zawroty głowy, uczucie suchości w jamie ustnej oraz takie efekty psychologiczne, jak rozluźnienie, euforia, dysforia, nieprzyjemne odczucia, wzmożenie odczuwania bodźców dotykowych, zmiana percepcji czasu, lęk i panika, zaburzenia pamięci i dezorientacja. Ponadto może wystąpić tachykardia, hipotensja ortostatyczna, spadek napięcia mięśniowego i wzrost apetytu88.
Psylocybina (4-fosforyloksy-N,Ndimetylotryptamina)
Psylocybina to organiczny związek chemiczny z grupy tryptamin, alkaloid występujący naturalnie w grzybach z rodzaju Psilocybe. Po spożyciu pod wpływem kwaśnego środowiska panującego w żołądku jest defosforylowany do aktywnego metabolitu – psylocyny (4-hydroksy-N,N-dimetylotryptamina). Budową przypomina serotoninę oraz 5-hydroksytryptaminę. Psylocybina jako klasyczny psychodelik działa agonistycznie w stosunku do receptorów serotoninowych 5-HT1A, 5-HT2A89 i 5-HT2C90. Badania kliniczne z użyciem psylocybiny poddały ocenie jej skuteczność w leczeniu m.in. lęku i depresji wśród pacjentów onkologicznych91–93, zaburzeń obsesyjno-kompulsyjnych94, depresji lekoopornej95, 96 oraz uzależnień od alkoholu97 i nikotyny98.
Zaburzenia depresyjne i lękowe występują często wśród pacjentów onkologicznych. Skutkuje to zmniejszeniem adherencji terapeutycznej, pogorszeniem prognozy99 i wydłużeniem czasu pobytu w szpitalu100 w tej grupie chorych. W badaniu klinicznym obejmującym 51 pacjentów z nowotworem w stadium terminalnym i towarzyszącymi zaburzeniami depresyjnymi bądź lękowymi chorym podawano psylocybinę w dawkach: małej (1–3 mg/70 kg) lub dużej (22–30 mg/70 kg) w 2 sesjach. Po pierwszej sesji zaobserwowano remisję lub redukcję objawów depresyjnych o 50 proc. u 92 proc. pacjentów, którym podano wysoką dawkę leku, w porównaniu z 32 proc. w grupie placebo. Wyniki mierzono z użyciem skali nasilenia depresji GRID-HAMD-17 (GRID, Hamilton Depression Rating Scale). Nasilenie objawów lękowych badano, wykorzystując Skalę Lęku Hamiltona. W tym aspekcie zanotowano redukcję symptomów po pierwszym podaniu psychodeliku o 76 proc. w grupie otrzymującej wysoką dawkę i 24 proc. w grupie kontrolnej. Ponadto u większości pacjentów efekt przeciwdepresyjny i przeciwlękowy utrzymywał się po 6 miesiącach od zakończenia badania, niezależnie od otrzymanej dawki91. Grob i wsp. oceniali efekty stosowania psylocybiny także wśród pacjentów onkologicznych. Uczestnicy eksperymentu otrzymali psylocybinę lub niacynę jako placebo. Pomiędzy grupami nie zaobserwowano istotnych statystycznie różnic w redukcji nasilenia objawów depresyjnych i lękowych92. W innym badaniu 29 uczestnikom podano psylocybinę lub niacynę. Dodatkowo wszyscy pacjenci uczestniczyli w psychoterapii przez czas trwania badania. W grupie z psylocybiną u 80 proc. uczestników stwierdzono redukcję symptomów depresyjnych w stosunku do 14 proc. w grupie placebo. Zanotowano zmniejszenie nasilenia objawów lękowych o 58 proc. wśród pacjentów, którzy otrzymali psychodelik, a o 14 proc. w grupie kontrolnej. W badaniu kontrolnym przeprowadzonym po 6,5 miesiąca od zakończenia eksperymentu uczestnicy, którzy otrzymywali substancję aktywną, utrzymywali odpowiedź przeciwdepresyjną i przeciwlękową na poziomie 60–80 proc. w stosunku do pomiarów wyjściowych93.
Zbadano także zastosowanie psylocybiny w leczeniu zaburzeń obsesyjno-kompulsyjnych. Pacjenci otrzymali lek kolejno w dawce 100 μg/kg (mała), 200 μg/kg (średnia) i 300 μg/kg (duża). Wśród wszystkich uczestników badania stwierdzono redukcję nasilenia objawów obsesyjno-kompulsyjnych o 23–100 proc. w ciągu doby po podaniu psylocybiny94.
Ponadto badano skuteczność leczenia depresji lekoopornej psylocybiną. Po dwukrotnym przyjęciu psylocybiny 67 proc. pacjentów osiągnęło remisję, natomiast 58 proc. z nich spełniało jej kryteria 3 miesiące od zakończenia badania. Dodatkowo zaobserwowano redukcję nasilenia objawów lękowych i anhedonii95. W badaniu kontrolnym, przeprowadzonym 6 miesięcy po zakończeniu eksperymentu, większość pacjentów pozostawała w stanie remisji96.
Bogenschutz i wsp. przeprowadzili pierwsze badanie kliniczne oceniające skuteczność psylocybiny w leczeniu uzależnienia od alkoholu. Uczestnicy otrzymali psychodelik w dwóch sesjach nadzorowanych przez zespół lekarzy w 4-tygodniowym odstępie. Dodatkowo przez cały czas trwania eksperymentu uczęszczali na terapię wzmagającą motywację. Odsetek dni, w których pacjenci utrzymywali abstynencję, znacznie wzrósł już po pierwszej sesji w stosunku do ich liczby w pierwszych 4 tygodniach badania (tj. przed podaniem substancji). W badaniu kontrolnym przeprowadzonym 36 tygodni po leczeniu ilość alkoholu spożywanego przez uczestników uległa znacznemu zmniejszeniu97.
Pierwsze doświadczenie oceniające przydatność psylocybiny w leczeniu uzależnienia od nikotyny trwało 15 tygodni. W tym czasie uczestnicy otrzymali 3 dawki psylocybiny w piątym (20 mg/70 kg), siódmym (30 mg/70 kg) i trzynastym (30 mg/70 kg) tygodniu trwania eksperymentu. Dodatkowo pacjenci uczestniczyli w terapii poznawczo-behawioralnej 4 razy w tygodniu. W badaniu kontrolnym przeprowadzonym 6 miesięcy po zakończeniu leczenia 80 proc. pacjentów utrzymywało abstynencję nikotynową zbadaną za pomocą wydychanego tlenku węgla i poziomu kotyniny w moczu98.
Działania niepożądane psylocybiny obejmują nudności, wymioty, uczucie dyskomfortu fizycznego, lęk i dezorientację. Powoduje ona wzrost ciśnienia tętniczego i przyspieszenie tętna. W małych dawkach jest zazwyczaj dobrze tolerowana przez pacjentów i nie wywołuje poważnych działań niepożądanych wymagających interwencji lekarskiej91, 93. Podawanie wyższych dawek może wiązać się ze zwiększonym ryzykiem wystąpienia epizodów psychotycznych101.
Wnioski
Zastosowanie substancji psychoaktywnych w leczeniu zaburzeń psychicznych w Polsce jest tematem kontrowersyjnym, budzi jednak coraz większe zainteresowanie badaczy, lekarzy i pacjentów. Zwiększająca się liczba badań i publikacji potwierdzających skuteczność narkotyków w redukcji objawów depresyjno-lękowych wśród pacjentów opornych na standardowe leczenie może skutkować w przyszłości ich potencjalnym zastosowaniem w psychiatrii. Wieloletnie zażywanie leków antydepresyjnych i przeciwpsychotycznych wiąże się z występowaniem wielu działań niepożądanych, takich jak nadmierna sedacja, zaburzenia pamięci, dysfunkcje seksualne, objawy pozapiramidowe czy też zaburzenia metaboliczne w obrębie gospodarki węglowodanowej i lipidowej. Substancje psychoaktywne podawane pacjentom pod kontrolą lekarzy i w indywidualnie dobranej dawce nie wykazują podobnych właściwości, co może znacznie zwiększyć komfort życia chorych. Kolejną zaletą jest natychmiastowy efekt terapeutyczny wywoływany m.in. przez ketaminę czy LSD, w przeciwieństwie do działania klasycznych leków antydepresyjnych i przeciwpsychotycznych, które rozwija się zazwyczaj po wielu tygodniach stosowania, co może negatyw nie wpływać na przymierze terapeutyczne i prowadzić do rezygnacji z terapii. Ponadto wiele publikacji sugeruje skuteczność tego kontrowersyjnego leczenia w przypadku wielu innych schorzeń, takich jak PTSD, uzależnienia od substancji psychoaktywnych, ADHD czy zespół Tourette’a.
Należy jednak podkreślić, że większość badań, do których odwołano się w tej pracy, została przeprowadzona na niewielkich grupach pacjentów, ponadto omawiane tu substancje nie są tak dobrze zbadane jak leki stosowane standardowo, a ich dawki należy traktować jako eksperymentalne. Niewielka liczba publikacji i mała dostępność tego rodzaju leczenia w wielu krajach ogranicza analizę tego zagadnienia, które wymaga dalszej eksploracji. Z opisanych w pracy substancji psychoaktywnych największe znaczenie jako nowa forma terapii ma ketamina. Badania kliniczne z jej wykorzystaniem dostarczyły wystarczających dowodów naukowych na jej skuteczność w leczeniu zaburzeń depresyjnych, co doprowadziło do produkcji leków na jej bazie. Być może inne substancje psychoaktywne w przyszłości podążą jej drogą.
Piśmiennictwo:
1. Krajowe Biuro do spraw Przeciwdziałania Narkomanii. Narkotyki. www.kbpn.gov.pl/ portal?id=112184 (Accessed: 04.10.2020).
2. Tupper KW, Wood E, Yensen R, Johnson MW. Psychedelic medicine: a re-emerging therapeutic paradigm. CMAJ 2015; 187(14): 1054-9.
3. Mueller F, Lenz C, Dolder PC, Harder S, Schmid Y, Lang UE, et al. Acute effects of LSD on amygdala activity during processing of fearful stimuli in healthy subjects. Transl Psychiatry 2017; 7(4): e1084.
4. Nutt D. Psychedelic drugs – a new era in psychiatry? Dialogues Clin Neurosci 2019; 21(2): 139-47.
5. Rickli A, Moning OD, Hoener MC, Liechti ME. Receptor interaction profiles of novel psychoactive tryptamines compared with classic hallucinogens. Eur Neuropsychopharmacol 2016; 26(8): 1327-37.
6. Nichols DE. Psychedelics. Pharmacol Rev 2016; 68(2): 264-355.
7. Pahnke WN, Richards WA. Implications of LSD and experimental mysticism. J Relig Health 1966; 5(3): 175-208.
8. Gable RS. Toward a comparative overview of dependence potential and acute toxicity of psychoactive substances used nonmedically. Am J Drug Alcohol Abuse 1993; 19(3): 263-81.
9. Gasser P, Holstein D, Michel Y, Doblin R, Yazar-Klosinski B, Passie T, et al. Safety and efficacy of lysergic acid diethylamide-assisted psychotherapy for anxiety associated with life-threatening diseases. J Nerv Ment Dis 2014; 202(7): 513-20.
10. Krebs TS, Johansen PØ. Lysergic acid diethylamide (LSD) for alcoholism: meta-analysis of randomized controlled trials. J Psychopharmacol 2012; 26(7): 994-1002.
11. Schindler EA, Gottschalk CH, Weil MJ, Shapiro RE, Wright DA, Sewell RA. Indoleamine Hallucinogens in Cluster Headache: Results of the Clusterbusters Medication Use Survey. J Psychoactive Drugs 2015; 47(5): 372-81.
12. McGeeney BE. Cannabinoids and Hallucinogens for Headache. Headache: The Journal of Head and Face Pain 2013; 53: 447-58.
13. Dolder PC, Schmid Y, Müller F, Borgwardt S, Liechti ME. LSD Acutely Impairs Fear Recognition and Enhances Emotional Empathy and Sociality. Neuropsychopharmacology 2016; 41(11): 2638-46.
14. Passie T, Halpern JH, Stichtenoth DO, Emrich HM, Hintzen A. The pharmacology of lysergic acid diethylamide: a review. CNS Neurosci Ther 2008; 14(4): 295-314.
15. Hysek CM, Schmid Y, Simmler LD, Domes G, Heinrichs M, Eisenegger C, et al. MDMA enhances emotional empathy and prosocial behavior. Soc Cogn Affect Neurosci 2014; 9(11): 1645-52.
16. Dunlap LE, Andrews AM, Olson DE. Dark Classics in Chemical Neuroscience: 3,4-Methylenedioxymethamphetamine. ACS Chem Neurosci 2018; 9(10): 2408-27.
17. Giovannitti JA Jr, Thoms SM, Crawford JJ. Alpha-2 adrenergic receptor agonists: a review of current clinical applications. Anesth Prog 2015; 62(1): 31-9.
18.Thompson MR, Callaghan PD, Hunt GE, Cornish JL, McGregor IS. A role for oxytocin and 5-HT(1A) receptors in the prosocial effects of 3,4 methylenedioxymethamphetamine (“ecstasy”). Neuroscience 2007; 146(2): 509-14.
19. Liechti ME, Saur MR, Gamma A, Hell D, Vollenweider FX. Psychological and physiological effects of MDMA (“Ecstasy”) after pretreatment with the 5-HT(2) antagonist ketanserin in healthy humans. Neuropsychopharmacology 2000; 23(4): 396-404.
20. Nash JF, Roth BL, Brodkin JD, Nichols DE, Gudelsky GA. Effect of the R(-) and S(+) isomers of MDA and MDMA on phosphatidyl inositol turnover in cultured cells expressing 5-HT2A or 5-HT2C receptors. Neurosci Lett 1994; 177(1-2): 111-5.
21. Mithoefer MC, Wagner MT, Mithoefer AT, Jerome L, Doblin R. The safety and efficacy of ❴+/-❵3,4-methylenedioxymethamphetamine-assisted psychotherapy in subjects with chronic, treatment-resistant posttraumatic stress disorder: the first randomized controlled pilot study. J Psychopharmacol 2011; 25(4): 439-52.
22. Oehen P, Traber R, Widmer V, Schnyder U. A randomized, controlled pilot study of MDMA (± 3,4-Methylenedioxymethamphetamine)-assisted psychotherapy for treatment of resistant, chronic Post-Traumatic Stress Disorder (PTSD). J Psychopharmacol 2013; 27(1): 40-52.
23. Sessa B. Why MDMA therapy for alcohol use disorder? And why now? Neuropharmacology 2018; 142: 83-8.
24. Danforth AL, Grob CS, Struble C, Feduccia AA, Walker N, Jerome L, et al. Reduction in social anxiety after MDMA-assisted psychotherapy with autistic adults: a randomized, double-blind, placebo-controlled pilot study. Psychopharmacology (Berl) 2018; 235(11): 3137-48.
25. Vizeli P, Liechti ME. Safety pharmacology of acute MDMA administration in healthy subjects. J Psychopharmacol 2017; 31(5): 576-88.
26. Strohl MP. Bradley’s Benzedrine studies on children with behavioral disorders. Yale J Biol Med 2011; 84(1): 27-33.
27. Heal DJ, Smith SL, Gosden J, Nutt DJ. Amphetamine, past and present – a pharmacological and clinical perspective. J Psychopharmacol 2013; 27(6): 479-96.
28. Kooij SJ, Bejerot S, Blackwell A, Caci H, Casas-Brugué M, Carpentier PJ, et al. European consensus statement on diagnosis and treatment of adult ADHD: The European Network Adult ADHD. BMC Psychiatry 2010; 10: 67.
29. Wittchen HU, Jacobi F, Rehm J, Gustavsson A, Svensson M, Jönsson B, et al. The size and burden of mental disorders and other disorders of the brain in Europe 2010. Eur Neuropsychopharmacol 2011; 21(9): 655-79.
30. Castells X, Blanco-Silvente L, Cunill R. Amphetamines for attention deficit hyperactivity disorder (ADHD) in adults. Cochrane Database Syst Rev 2018; 8(8): CD007813.
31. Faraone SV, Buitelaar J. Comparing the efficacy of stimulants for ADHD in children and adolescents using meta-analysis. Eur Child Adolesc Psychiatry 2010; 19(4): 353-64.
32. Black SW, Yamanaka A, Kilduff TS. Challenges in the development of therapeutics for narcolepsy. Prog Neurobiol 2017; 152: 89-113.
33. Mitler MM, Hajdukovic R, Erman MK. Treatment of narcolepsy with methamphetamine. Sleep 1993; 16(4): 306-17.
34. National Library of Medicine – National Center of Biotechnology Information. https:// pubchem.ncbi.nlm.nih.gov/compound/N_N-Dimethyltryptamine (Accessed: 04.10.2020).
35. Franzen F, Gross H. Tryptamine, N,N-dimethyltryptamine, N,N-dimethyl-5-hydroxytryptamine and 5-methoxytryptamine in human blood and urine. Nature 1965; 206(988): 1052.
36. Thompson MA, Moon E, Kim UJ, Xu J, Siciliano MJ, Weinshilboum RM. Human indolethylamine N-methyltransferase: cDNA cloning and expression, gene cloning, and chromosomal localization. Genomics 1999; 61(3): 285-97.
37. Carbonaro TM, Gatch MB. Neuropharmacology of N,N-dimethyltryptamine. Brain Res Bull 2016; 126(Pt 1): 74-88.
38. Bunzow JR, Sonders MS, Arttamangkul S, Harrison LM, Zhang G, Quigley DI, et al. Amphetamine, 3,4-methylenedioxymethamphetamine, lysergic acid diethylamide, and metabolites of the catecholamine neurotransmitters are agonists of a rat trace amine receptor. Mol Pharmacol 2001; 60(6): 1181-8.
39. Fontanilla D, Johannessen M, Hajipour AR, Cozzi NV, Jackson MB, Ruoho AE. The hallucinogen N,N-dimethyltryptamine (DMT) is an endogenous sigma-1 receptor regulator. Science 2009; 323(5916): 934-7.
40. Davis AK, Barsuglia JP, Lancelotta R, Grant RM, Renn E. The epidemiology of 5-methoxy- N, N-dimethyltryptamine (5-MeO-DMT) use: Benefits, consequences, patterns of use, subjective effects, and reasons for consumption. J Psychopharmacol 2018; 32(7): 779-92.
41. Drug Enforcement Administration; Drug&Chemical Evaluation Section, N,n-dimethyltryptamine (DMT), 2019. www.deadiversion.usdoj.gov/drug_chem_info/dmt.pdf#search= ayahuasca (Accessed: 04.10.2020).
42. Hamill J, Hallak J, Dursun SM, Baker G. Ayahuasca. Psychological and Physiologic Effects, Pharmacology and Potential Uses in Addiction and Mental Illness. Curr Neuropharmacol 2019; 17(2): 108-28.
43. Riba J, Valle M, Urbano G, Yritia M, Morte A, Barbanoj MJ. Human pharmacology of ayahuasca: subjective and cardiovascular effects, monoamine metabolite excretion, and pharmacokinetics. J Pharmacol Exp Ther 2003; 306(1): 73-83.
44. Callaway JC, Raymon LP, Hearn WL, McKenna DJ, Grob CS, Brito GS, et al. Quantitation of N,N-dimethyltryptamine and harmala alkaloids in human plasma after oral dosing with ayahuasca. J Anal Toxicol 1996; 20(6): 492-7.
45. Callaway JC, McKenna DJ, Grob CS, Brito GS, Raymon LP, Poland RE, et al. Pharmacokinetics of Hoasca alkaloids in healthy humans. J Ethnopharmacol 1999; 65(3): 243-56.
46. Grof S, Soskin RA, Richards WA, Kurland AA. DPT as an adjunct in psychotherapy of alcoholics. Int Pharmacopsychiatry 1973; 8(1): 104-15.
47. Richards WA. Mystical and archetypal experiences of terminal patients in DPT-assisted psychotherapy. J Relig Health 1978; 17(2): 117-26.
48. Fábregas JM, González D, Fondevila S, Cutchet M, Fernández X, Barbos PC, et al. Assessment of addiction severity among ritual users of ayahuasca. Drug Alcohol Depend 2010; 111(3): 257-61.
49. Callaway JC, Airaksinen MM, McKenna DJ, Brito GS, Grob CS. Platelet serotonin uptake sites increased in drinkers of ayahuasca. Psychopharmacology (Berl) 1994; 116(3): 385-7.
50. Hallikainen T, Saito T, Lachman HM, Volavka J, Pohjalainen T, Ryynänen OP, et al. Association between low activity serotonin transporter promoter genotype and early onset alcoholism with habitual impulsive violent behavior. Mol Psychiatry 1999; 4(4): 385-8.
51. Santos RG, Landeira-Fernandez J, Strassman RJ, Motta V, Cruz AP. Effects of ayahuasca on psychometric measures of anxiety, panic-like and hopelessness in Santo Daime members. J Ethnopharmacol 2007; 112(3): 507-13.
52. Liriano F, Hatten C, Schwartz TL. Ketamine as treatment for post-traumatic stress disorder: a review. Drugs In Context 2019; 8: 212305.
53. Murrough JW, Iosifescu DV, Chang LC, Al Jurdi RK, Green CE, Perez AM, et al. Antidepressant efficacy of ketamine in treatment-resistant major depression: a two-site randomized controlled trial. Am J Psychiatry 2013; 170(10): 1134-42.
54. Singh JB, Fedgchin M, Daly EJ, De Boer P, Cooper K, Lim P, et al. A Double-Blind, Randomized, Placebo-Controlled, Dose-Frequency Study of Intravenous Ketamine in Patients With Treatment-Resistant Depression. Am J Psychiatry 2016; 173(8): 816-26.
55. Murrough JW, Soleimani L, DeWilde KE, Collins KA, Lapidus KA, Iacoviello BM, et al. Ketamine for rapid reduction of suicidal ideation: a randomized controlled trial. Psychol Med 2015; 45(16): 3571-80.
56. Price RB, Nock MK, Charney DS, Mathew SJ. Effects of intravenous ketamine on explicit and implicit measures of suicidality in treatment-resistant depression. Biol Psychiatry 2009; 66(5): 522-6.
57. Price RB, Iosifescu DV, Murrough JW, Chang LC, Al Jurdi RK, Iqbal SZ, et al. Effects of ketamine on explicit and implicit suicidal cognition: a randomized controlled trial in treatment-resistant depression. Depress Anxiety 2014; 31(4): 335-43.
58. Das RK, Gale G, Walsh K, Hennessy VE, Iskandar G, Mordecai LA, et al. Ketamine can reduce harmful drinking by pharmacologically rewriting drinking memories. Nat Commun 2019; 10: 5187.
59. Dakwar E, Nunes EV, Hart CL, Foltin RW, Mathew SJ, Carpenter KM, et al. A Single Ketamine Infusion Combined With Mindfulness-Based Behavioral Modification to Treat Cocaine Dependence: A Randomized Clinical Trial. Am J Psychiatry 2019; 176(11): 923-30.
60. Krupitsky E, Burakov A, Romanova T, Dunaevsky I, Strassman R, Grinenko A. Ketamine Psychotherapy for Heroin Addiction: Immediate Effects and Two-Year Follow-Up. J Subst Abuse Treat 2002; 23(4): 273-83.
61. Popova V, Daly EJ, Trivedi M, Cooper K, Lane R, Lim P, et al. Efficacy and Safety of Flexibly Dosed Esketamine Nasal Spray Combined With a Newly Initiated Oral Antidepressant in Treatment-Resistant Depression: A Randomized Double-Blind Active- Controlled Study. Am J Psychiatry 2019; 176(6): 428-38.
62. Deyama S, Duman RS. Neurotrophic mechanisms underlying the rapid and sustained antidepressant actions of ketamine. Pharmacol Biochem Behav 2020; 188: 172837. DOI: 10.1016/j.pbb.2019.172837.
63. Aleksandrova LR, Phillips AG, Wang YT. Antidepressant effects of ketamine and the roles of AMPA glutamate receptors and other mechanisms beyond NMDA receptor antagonism. J Psychiatry Neurosci 2017; 42(4): 222-9.
64. Feder A, Parides MK, Murrough JW, Perez AM, Morgan JE, Saxena S, et al. Efficacy of intravenous ketamine for treatment of chronic posttraumatic stress disorder. JAMA Psychiatry 2014; 71(6): 681-8.
65. Andrade C. Ketamine for Depression, 1: Clinical Summary of Issues Related to Efficacy, Adverse Effects, and Mechanism of Action. J Clin Psychiatry 2017; 78(4): e415-9.
66. Hoch E, Niemann D, von Keller R, Schneider M, Friemel CM, Preuss UW, et al. How effective and safe is medical cannabis as a treatment of mental disorders? A systematic review. Eur Arch Psychiatry Clin Neurosci 2019; 269(1): 87-105.
67. Huestis MA. Human cannabinoid pharmacokinetics. Chem Biodivers 2007; 4(8): 1770- 804.
68. Munro S, Thomas KL, Abu-Shaar M. Molecular characterization of a peripheral receptor for cannabinoids. Nature 1993; 365(6441): 61-5.
69. Müller-Vahl KR, Schneider U, Koblenz A, Jöbges M, Kolbe H, Daldrup T, et al. Treatment of Tourette’s syndrome with Delta 9-tetrahydrocannabinol (THC): a randomized crossover trial. Pharmacopsychiatry 2002; 35(2): 57-61. DOI: 10.1055/s-2002-25028.
70. Müller-Vahl KR, Schneider U, Prevedel H, Theloe K, Kolbe H, Daldrup T, et al. Delta 9-tetrahydrocannabinol (THC) is effective in the treatment of tics in Tourette syndrome: a 6-week randomized trial. J Clin Psychiatry 2003; 64(4): 459-65.
71. Andries A, Frystyk J, Flyvbjerg A, Støving RK. Dronabinol in severe, enduring anorexia nervosa: a randomized controlled trial. Int J Eat Disord 2014; 47(1): 18-23.
72. Volicer L, Stelly M, Morris J, McLaughlin J, Volicer BJ. Effects of dronabinol on anorexia and disturbed behavior in patients with Alzheimer’s disease. Int J Geriatr Psychiatry 1997; 12(9): 913-9.
73. Van der Elsen GA, Ahmed AI, Verkes RJ, Feuth T, van der Marck MA, Olde Rikkert MGM. Tetrahydrocannabinol in Behavioral Disturbances in Dementia: A Crossover Randomized Controlled Trial. Am J Geriatric Psychiatry 2015; 23: 1214-24.
74. Van den Elsen GA, Ahmed AI, Verkes RJ, Kramers C, Feuth T, Rosenberg PB, et al. Tetrahydrocannabinol for neuropsychiatric symptoms in dementia: A randomized controlled trial. Neurology 2015; 84(23): 2338-46.
75. Jetly R, Heber A, Fraser G, Boisvert D. The efficacy of nabilone, a synthetic cannabinoid, in the treatment of PTSD-associated nightmares: A preliminary randomized, double- -blind, placebo-controlled cross-over design study. Psychoneuroendocrinology 2015; 51: 585-8.
76. Bisaga A, Sullivan MA, Glass A, Mishlen K, Pavlicova M, Haney M, et al. The effects of dronabinol during detoxification and the initiation of treatment with extended release naltrexone. Drug Alcohol Depend 2015; 154: 38-45.
77. Jicha CJ, Lofwall MR, Nuzzo PA, Babalonis S, Elayi SC, Walsh SL. Safety of oral dronabinol during opioid withdrawal in humans. Drug Alcohol Depend 2015; 157: 179-83.
78. Lofwall MR, Babalonis S, Nuzzo PA, Elayi SC, Walsh SL. Opioid withdrawal suppression efficacy of oral dronabinol in opioid dependent humans. Drug Alcohol Depend 2016; 164: 143-50.
79. Levin FR, Mariani JJ, Brooks DJ, Pavlicova M, Cheng W, Nunes EV. Dronabinol for the treatment of cannabis dependence: a randomized, double-blind, placebo-controlled trial. Drug Alcohol Depend 2011; 116(1-3): 142-50.
80. Trigo JM, Lagzdins D, Rehm J, Selby P, Gamaleddin I, Fischer B, et al. Effects of fixed or self-titrated dosages of Sativex on cannabis withdrawal and cravings. Drug Alcohol Depend 2016; 161: 298-306.
81. Grant JE, Odlaug BL, Chamberlain SR, Kim SW. Dronabinol, a cannabinoid agonist, reduces hair pulling in trichotillomania: a pilot study. Psychopharmacology (Berl) 2011; 218(3): 493-502.
82. Bergamaschi MM, Queiroz RH, Chagas MH, de Oliveira DC, De Martinis BS, Kapczinski F, et al. Cannabidiol reduces the anxiety induced by simulated public speaking in treatment- naïve social phobia patients. Neuropsychopharmacology 2011; 36(6): 1219-26.
83. Leweke FM, Mueller JK, Lange B, Rohleder C. Therapeutic Potential of Cannabinoids in Psychosis. Biol Psychiatry 2016; 79(7): 604-12.
84. McGuire P, Robson P, Cubala WJ, Vasile D, Morrison PD, Barron R, et al. Cannabidiol (CBD) as an Adjunctive Therapy in Schizophrenia: A Multicenter Randomized Controlled Trial. Am J Psychiatry 2018; 175(3): 225-31.
85. Boggs DL, Surti T, Gupta A, Gupta S, Niciu M, Pittman B, et al. The effects of cannabidiol (CBD) on cognition and symptoms in outpatients with chronic schizophrenia a randomized placebo controlled trial. Psychopharmacology (Berl) 2018; 235(7): 1923-32.
86. Cooper RE, Williams E, Seegobin S, Tye C, Kuntsi J, Asherson P. Cannabinoids in attention- deficit/hyperactivity disorder: A randomised-controlled trial. Eur Neuropsychopharmacol 2017; 27(8): 795-808.
87. Di Forti M, Quattrone D, Freeman TP, Tripoli G, Gayer-Anderson C, Quigley H, et al.
The contribution of cannabis use to variation in the incidence of psychotic disorder
across Europe (EU-GEI): a multicentre case-control study. Lancet Psychiatry 2019; 6(5): 427-36.
88. Müller-Vahl KR. Treatment of Tourette syndrome with cannabinoids. Behav Neurol 2013; 27(1): 119-24.
89. Halberstadt AL. Recent advances in the neuropsychopharmacology of serotonergic hallucinogens. Behav Brain Res 2015; 277: 99-120.
90. Canal CE, Murnane KS. The serotonin 5-HT2C receptor and the non-addictive nature of classic hallucinogens. J Psychopharmacol 2017; 31(1): 127-43.
91. Griffiths RR, Johnson MW, Carducci MA, Umbricht A, Richards WA, Richards BD, et al. Psilocybin produces substantial and sustained decreases in depression and anxiety in patients with life-threatening cancer: A randomized double-blind trial. J Psychopharmacol 2016; 30(12): 1181-97.
92. Grob CS, Danforth AL, Chopra GS, Hagerty M, McKay CR, Halberstadt AL, et al. Pilot Study of Psilocybin Treatment for Anxiety in Patients With Advanced-Stage Cancer. Arch Gen Psychiatry 2011; 68(1): 71-8.
93. Ross S, Bossis A, Guss J, Agin-Liebes G, Malone T, Cohen B, et al. Rapid and sustained symptom reduction following psilocybin treatment for anxiety and depression in patients with life-threatening cancer: a randomized controlled trial. J Psychopharmacol 2016; 30(12): 1165-80.
94. Moreno FA, Wiegand CB, Taitano EK, Delgado PL. Safety, tolerability, and efficacy of psilocybin in 9 patients with obsessive-compulsive disorder. J Clin Psychiatry 2006; 67: 1735-40.
95. Carhart-Harris RL, Bolstridge M, Rucker J, Day CMJ, Erritzoe D, Mendel K, et al. Psilocybin with psychological support for treatment-resistant depression: an open-label feasibility study. Lancet Psychiatry 2016; 3: 619-27.
96. Carhart-Harris RL, Bolstridge M, Day CMJ, Rucker J, Watts R, Erritzoe DE, et al. Psilocybin with psychological support for treatment-resistant depression: six-month follow -up. Psychopharmacology (Berl) 2018; 235(2): 399-408.
97. Bogenschutz MP, Forcehimes AA, Pommy JA, Wilcox CE, Barbosa PC, Strassman RJ. Psilocybin-assisted treatment for alcohol dependence: a proof-of-concept study. J Psychopharmacol 2015; 29(3): 289-99.
98. Johnson MW, Garcia-Romeu A, Cosimano MP, Griffiths RR. Pilot study of the 5-HT2AR agonist psilocybin in the treatment of tobacco addiction. J Psychopharmacol 2014; 28(11): 983-92.
99. Arrieta Ó, Angulo LP, Núñez-Valencia C, Dorantes-Gallareta Y, Macedo EO, Martínez- -López D, et al. Association of Depression and Anxiety on Quality of Life, Treatment Adherence, and Prognosis in Patients with Advanced Non-small Cell Lung Cancer. Ann Surg Oncol 2013; 20(6): 1941-8.
100. Prieto JM, Blanch J, Atala J, Carreras E, Rovira M, Cirera E, et al. Psychiatric morbidity and impact on hospital length of stay among hematologic cancer patients receiving stemcell transplantation. J Clin Oncol 2002; 20(7): 1907-17.
101. Vollenweider FX, Vollenweider-Scherpenhuyzen MF, Bäbler A, Vogel H, Hell D. Psilocybin induces schizophrenia-like psychosis in humans via a serotonin-2 agonist action. Neuroreport 1998; 9(17): 3897-902.
Artykuł opublikowano w „Alkoholizmie i Narkomanii” 3/2021.

W ostatnim pięćdziesięcioleciu znaczenia nabrały badania nad wykorzystaniem substancji psychoaktywnych w leczeniu zaburzeń psychicznych. Liczne publikacje sugerują ich skuteczność w terapii wielu schorzeń, m.in. zaburzeń depresyjnych i lękowych, PTSD, uzależnienia od substancji psychoaktywnych, ADHD czy zespołu Tourette’a. Na szczególną uwagę zasługuje zastosowanie psychodelików, takich jak psylocybina i LSD, w terapii lęku i depresji związanych z chorobami terminalnymi. Nie są one bowiem obarczone działaniami niepożądanymi występującymi w przebiegu leczenia klasycznymi lekami antydepresyjnymi i przeciwpsychotycznymi, m.in. zespołu pozapiramidowego, dyskinezy, zaburzeń seksualnych, endokrynologicznych czy metabolicznych. Ich istotną zaletą jest natychmiastowy efekt terapeutyczny wywoływany np. przez esketaminę czy LSD. Podczas standardowego leczenia lekami przeciwdepresyjnymi oczekiwany efekt bywa zazwyczaj osiągany po wielu tygodniach stosowania, co może obniżać adherencję terapeutyczną i zniechęcać pacjentów do kontynuowania terapii. W artykule przedstawiono przegląd literatury dotyczącej leczenia chorób psychicznych z wykorzystaniem substancji psychoaktywnych. Omówiono takie aspekty, jak mechanizm działania, potencjalne zastosowanie i działania niepożądane substancji z grup klasycznych psychodelików, empatogenów, kannabinoli, stymulantów i dysocjantów. W przypadku niektórych omawianych substancji psychoaktywnych istnieją twarde dowody na ich skuteczność w terapii zaburzeń psychicznych. Ketamina jest substancją, której udowodniona naukowo efektywność w terapii zaburzeń depresyjnych zaowocowała wprowadzeniem jej na rynek jako nowej formy leczenia depresji.
Wprowadzenie
Ostatnio dużo uwagi poświęcono badaniom nad wykorzystywaniem substancji psychoaktywnych, zwanych potocznie narkotykami, w leczeniu zaburzeń psychicznych. W Polsce obowiązuje podział substancji psychoaktywnych na trzy grupy: do pierwszej należą alkohol, opiaty, leki uspokajające i nasenne, do drugiej – kannabinole i substancje halucynogenne (psychodeliki), do trzeciej – kokaina i inne stymulanty1. Do substancji psychodelicznych zaliczamy LSD (dietyloamid kwasu lizergowego), psylocybinę, DMT (dimetylotryptaminę) czy meskalinę, związane głownie z działaniem na receptor 5-HT2A, oraz empatogeny (MDMA, 3,4-metylenodioksymetamfetamina) oddziałujące na transmisję serotoninergiczną, dopaminergiczną i adrenergiczną2. Dotychczasowe prace wskazują na możliwą rolę substancji psychoaktywnych w zmianie transkrypcji neuronów i aktywowaniu innych szlaków komórkowych niż te aktywowane przez tradycyjne leki psychotropowe3. Substancje psychoaktywne, zanim stały się zakazane, były szeroko stosowane w psychiatrii, ich szkodliwość przyczyniła się jednak do zaniechania badań i terapii klinicznych. Co ciekawe, w ostatnich latach pojawiło się wiele badań oceniających wyżej wymienione substancje w leczeniu rożnych zaburzeń psychicznych, takich jak uzależnienia, zaburzenia depresyjne, lękowe i inne4 (tabela I). Prezentowana praca powstała na podstawie przeglądu wybranych artykułów z bazy bibliograficzno-abstraktowej PubMed. Wyszukując prace, autorzy używali takich terminów, jak „substancje psychoaktywne”, „leczenie”, „psychiatria”, „depresja”, „zaburzenia lękowe”, „PTSD”, „ADHD”, „choroby przewlekłe”.

LSD (dietyloamid kwasu lizergowego)
LSD należy do grupy klasycznych psychodelików. Silnie wiąże się z receptorami serotoninergicznymi 5-HT1A, 5-HT2A, 5-HT2C, dopaminergicznymi D2 i adrenergicznymi α2, natomiast słabiej z receptorami dopaminergicznymi D1, D3 i adrenergicznymi α15. Głównym mechanizmem działania LSD jest aktywacja transmisji glutaminergicznej kory czołowej, wtórna do stymulacji receptorów 5-HT2A6, a efekty psychotropowe, które wywołuje, są opisywane jako „doświadczenia mistyczne”7. Stosowanie LSD prowadzi do tolerancji o charakterze psychicznym8. Badanie z randomizacją i podwójnie ślepą próbą, oceniające skuteczność psychoterapii połączonej z użyciem LSD, zostało przeprowadzone u 12 pacjentów z zaburzeniami lękowymi związanymi z chorobami potencjalnie zagrażającymi życiu, takimi jak procesy nowotworowe. Pacjenci otrzymali LSD dwukrotnie, podczas dwóch sesji oddzielonych okresem 2–3 tygodni. Po sesjach psychoterapii wspomaganych LSD wykazano u nich, w porównaniu z osobami otrzymującymi placebo, znaczące zmniejszenie objawów lękowych i depresyjnych związanych z chorobą. W HADS (Hospital Anxiety and Depression Scale) cecha lęku w grupie eksperymentalnej obniżyła się o 3,6 punktu, w grupie placebo – o 0,6. Poprawa utrzymywała się przez 12 miesięcy. Nie zaobserwowano działań niepożądanych trwających dłużej niż dzień po leczeniu9.
Kolejnym przykładem zastosowania LSD jest jego użycie w terapii uzależnienia od alkoholu. W metaanalizie składającej się z 6 badań, przeprowadzonej przez Krebsa i wsp., w której łącznie wzięło udział 536 osób, badanej grupie podano jednorazowo LSD w dawce 200–800 μg, grupie kontrolnej – niższe dawki LSD, d-amfetaminę, placebo lub efedrynę. Po 2 i 6 miesiącach obserwacji wykazano redukcję nadużywania alkoholu u osób z badanej grupy. NNT (number needed to treat) dla LSD wyniosła 6, gdy dla naltreksonu – 910.
LSD znalazło także zastosowanie w neurologii. W badaniu przeprowadzonym przez Schindlera i wsp. dowiedziono, że użycie LSD zmniejszyło klasterowy ból głowy i powodowało remisję bardziej efektywnie niż konwencjonalne leki. Stwierdzono również, że skuteczność wykazują nawet małe dawki tej substancji11 – w celu leczenia bólu wykorzystuje się bromową pochodną LSD, która nie działa halucynogennie12.
Efekty niepożądane związane z użyciem LSD możemy podzielić na te wynikające ze stymulacji współczulnej oraz spowodowane przez pobudzenie przywspółczulnej części autonomicznego układu nerwowego. Do pierwszych zaliczamy podwyższenie skurczowego i rozkurczowego ciśnienia krwi oraz wzrost tętna13, a stymulacja przywspółczulna objawia się obfitym poceniem się, ślinieniem, nudnościami i wymiotami14.
MDMA (3,4-metylenodioksymetamfetamina)
MDMA, związek znany jako „ecstasy” lub „Molly”, działa poprzez stymulację uwalniania serotoniny, noradrenaliny, zwiększa również poziom kortyzolu, prolaktyny i oksytocyny w osoczu15. Pomimo podobieństwa w budowie MDMA wykazuje efekty, których nie można porównać ani z działaniem klasycznych halucynogenów, jak LSD czy psylocybina, ani tzw. stymulantów, takich jak amfetamina16. W badaniu przeprowadzonym w 2014 roku Hysek i wsp. udowodnili, że MDMA zwiększa empatię emocjonalną (należy do grupy empatogenów) i promuje zachowania prospołeczne. Umożliwia również rozpoznawanie emocji u innych ludzi. Przy użyciu FERT (Facial Expression Recognition Test) wykazano zmniejszoną zdolność do identyfikacji emocji – lęku, gniewu, oburzenia czy zaskoczenia, niezmieniona natomiast została zdolność do rozpoznawania pozytywnych emocji, takich jak radość. Dlatego też psychiatrzy i psychoterapeuci zapoczątkowali badania nad zastosowaniem MDMA w terapii zaburzeń psychicznych jako środka zwiększającego potrzebę wchodzenia w interakcje społeczne15.
Działanie MDMA na receptor α2 przyczynia się do paradoksalnego efektu relaksacji i uspokojenia17, korzystnie korygując nadmierną czujność związaną z przebytym urazem w przebiegu PTSD (posttraumatic stress disorder). Substancja ta ułatwia uwalnianie oksytocyny, co może zwiększać poziom empatii i potrzebę bliskości18. Dodatkowo działanie na receptory 5-HT2A wzmacnia pobudliwość emocjonalną i wpływa na pozytywny nastrój19, a zwiększony poziom serotoniny działa na receptor 5-HT2A w mechanizmie ułatwiającym zmianę sposobu myślenia o wydarzeniach przeżytych w przeszłości20. Odkrycia te sprawiły, że zaczęto zastanawiać się nad wykorzystaniem MDMA w psychoterapii. Mithoefer i wsp. badali użyteczność MDMA w leczeniu PTSD w grupie 20 chorych z przewlekłą, oporną na psychoterapię i farmakoterapię postacią PTSD. Na pierwszym etapie z podwójnie ślepą próbą 8 pacjentom zostało podane placebo, a 12 – MDMA. Po 2-miesięcznym okresie obserwacji uczestnikom otrzymującym placebo zaproponowano udział w drugim etapie, tj. w badaniu otwartym z użyciem MDMA. W porównaniu z tą samą psychoterapią z placebo terapia z MDMA spowodowała istotne statystycznie zmniejszenie objawów mierzonych za pomocą CAPS (Clinical-Administered PTSD Scale) oraz IES-R – Skali Wpływu Zdarzeń (Impact of Event Scale Revised)1 – zarówno 4 dni po pierwszej, 4 dni po drugiej, jak i 2 miesiące po drugiej sesji terapeutycznej. Sugeruje to potencjalną korzyść z psychoterapii połączonej z użyciem MDMA w leczeniu tego zaburzenia21.
Oehen i wsp. ocenili wpływ MDMA na leczenie przewlekłej, lekoopornej postaci PTSD. W badaniu z randomizacją i podwójnie ślepą próbą wzięło udział 12 uczestników, którzy uprzednio przeszli co najmniej 6-miesięczną psychoterapię i 3-miesięczną terapię lekami z grupy SSRI, a ich choroba w chwili rozpoczęcia eksperymentu trwała średnio 12 lat. Uczestnicy odbyli 3 eksperymentalne sesje psychoterapeutyczne połączone z użyciem MDMA oraz 12 sesji bez użycia substancji. Punktacja w CAPS spadła o 23,5 proc. w grupie eksperymentalnej. Punktacja w PDS (Posttraumatic Diagnosis Scale) również uległa obniżeniu22. Obecnie prowadzone jest badanie nad użyciem MDMA w terapii uzależnienia od alkoholu (BIMA, the Bristol Imperial MDMA in Alcoholism Study). Hipotezą badawczą jest fakt, że część pacjentów spożywających alkohol robi to, by zagłuszyć traumatyczne wspomnienia. Hipotetyczna korzyść z psychoterapii wspomaganej MDMA w postaci przezwyciężenia traum mogłaby prowadzić do ograniczenia spożywania alkoholu23.
Danforth i wsp. zbadali wpływ MDMA na objawy fobii społecznej u dorosłych pacjentów z autyzmem. W badaniu wzięło udział 12 osób, 8 z nich otrzymało MDMA w dawce 75–125 mg, 4 – placebo. Dwie podwójnie ślepe, eksperymentalne sesje psychoterapeutyczne zostały przeprowadzone w odstępie 1 miesiąca i były poprzedzone 3 sesjami bez użycia substancji. Po pierwszej sesji i po 7 miesiącach uzyskane wyniki w Skali Lęku Społecznego (LSAS, Lebowitz Social Anxiety Scale) potwierdziły korzyść terapii z MDMA. Klinicznie istotne zmniejszenie objawów fobii społecznej osiągnięto u 6 na 8 osób z grupy MDMA (75 proc.) i u 2 na 4 (50 proc.) w grupie placebo24.
Do działań niepożądanych mogących wystąpić po zażyciu MDMA należą: wzrost ciśnienia tętniczego, przyspieszenie tętna, wzrost temperatury ciała, szczękościsk, bruksizm, zmniejszony apetyt, zaburzenia koncentracji i równowagi25.
Amfetamina
W przeszłości amfetamina była uważana w świecie medycyny za panaceum na liczne dolegliwości. Została odkryta podczas poszukiwania tańszego, łatwiejszego do syntezy zamiennika efedryny i wprowadzona na rynek w 1935 roku jako lek na narkolepsję, łagodną depresję, parkinsonizm i wiele innych zaburzeń. W latach 30. XX w. zauważono korzyści ze stosowania amfetaminy u dzieci z ciężkimi zaburzeniami zachowania, prawdopodobnie dziś diagnozowanych jako ADHD (attention deficit hyperactivity disorder). Strukturalne podobieństwo amfetaminy do katecholaminowych neurotransmiterów – noradrenaliny i dopaminy – sprawia, że ma ona właściwości kompetycyjnego substratu transporterów wychwytu zwrotnego monoamin: transportera noradrenaliny (NET), transportera dopaminy (DAT) i transportera serotoniny (SERT)26, 27. Jej zastosowanie w medycynie związane jest głównie z ADHD – chorobą, która mimo stosunkowo częstego występowania, bywa rzadko diagnozowana, szczególnie u dorosłych28. W najnowszych badaniach nad częstością chorób psychicznych uznano, że w Europie na ADHD choruje ok. 3 mln osób29.
W 2018 roku Castells i wsp. przeprowadzili metaanalizę obejmującą 19 badań oceniających skuteczność trzech rodzajów amfetamin (lisdeksamfetamina w dawkach od 10,2 mg/d do 21,8 mg/d, deksamfetamina w dawkach od 30 mg/d do 70 mg/d i zmieszane sole amfetamin w dawkach od 12,5 mg/d do 80 mg/d) w leczeniu ADHD. Badania były kontrolowane placebo, a trzy z nich obejmowały lek porównawczy: guanfacynę, modafinil lub paroksetynę. Jedynie deksamfetamina nie zmniejszyła nasilenia objawów ADHD w ocenie klinicystów, natomiast wszystkie rodzaje amfetaminy działały skutecznie według subiektywnej oceny pacjentów. Użycie amfetamin było związane z większym ryzykiem wcześniejszego zakończenia leczenia z powodu działań niepożądanych. Wielkość dawek amfetaminy nie wpływała na różnice w skuteczności. Nie stwierdzono też różnic w skuteczności pomiędzy amfetaminą a guanfacyną, modafinilem czy paroksetyną30. Z metaanalizy przeprowadzonej w 2010 roku przez Faraone i wsp. wynika, że amfetamina ma większą skuteczność w leczeniu ADHD niż metylofenidat31.
Narkolepsja jest zaburzeniem snu charakteryzującym się nadmierną sennością w ciągu dnia, napadami snu i epizodami nagłej utraty napięcia mięśniowego. Amfetamina została wprowadzona do jej leczenia w 1935 roku i w dalszym ciągu jest wykorzystywana32. Mitler i wsp. przeprowadzili badanie nad użytecznością metamfetaminy w leczeniu narkolepsji. W porównaniu z amfetaminą ma silniejsze działanie centralne niż obwodowe z uwagi na większą lipofilność. Badana grupa obejmowała 8 pacjentów z narkolepsją, a grupa kontrolna – 8 osób dopasowanych do tych z badanej grupy pod względem płci, wieku, edukacji i historii pracy. Podczas badania, które trwało 28 dni, metamfetamina była podawana w pojedynczej, porannej dawce 0,20 lub 40–60 mg w grupie eksperymentalnej i 0,5 lub 10 mg w grupie kontrolnej. Metamfetamina zmniejszyła senność i deficyty wydajności u wszystkich osób w badanej grupie. Kwestionariusze skutków ubocznych ujawniły działania niepożądane u 5 z 8 osób w badanej grupie i 4 z 8 w kontrolnej33.
DMT (dimetylotryptamina)
Jedną z bardziej tajemniczych substancji psychodelicznych jest DMT (N, N-dimethyltryptamine) – serotoninergiczny halucynogen występujący w roślinach pochodzących z Ameryki Południowej, m.in. w Prestonia amazonica (Apocynaceae), oraz w niewielkich ilościach w mózgu, krwi i moczu ssaków34, 35. Odkrycie enzymu odpowiedzialnego za syntezę DMT z tryptaminy – INMT (N-metylotransferaza indoletyloaminowa), znajdującego się m.in. w płucach, sercu, żołądku czy trzustce, może sugerować, że DMT odgrywa rolę biologiczną albo że podczas ewolucji pełniła funkcję, która nie występuje u żyjących dziś osobników36. DMT, oprócz powinowactwa do receptorów serotoninowych 5-HT1A, 5-HT1B, 5-HT1D, 5-HT2A, 5-HT2B, 5-HT2C, 5-HT5A, 5-HT6 i 5-HT7, działa agonistycznie na receptor σ1R (sigma-1) oraz endogenny receptor dla śladów wybranych amin (TAAR, trace amine-associated receptor)37–39. Efekty, jakie wywołuje, to silna euforia, utrata poczucia czasu, przestrzeni i rożnie opisywane doświadczenia mistyczne. Niektórzy użytkownicy zgłaszali uczucie lęku, drżenia ciała czy też ucisk w klatce piersiowej40.
Historia doświadczeń z DMT sięga kilkuset lat i jest związana z praktykami religijnymi i rytuałami. Najpopularniejszy z nich to rytuał picia warzonej mikstury ayahuasca41. Ayahuasca jest najczęściej sporządzana z pnącza Banisteriopsis caapi (zawierającego alkaloidy β-karboliny będące inhibitorami MAO) oraz liści Psychotria viridis (zawierających DMT)42. Bez inhibitora MAO organizm szybko metabolizuje DMT i efekt psychoaktywny nie występuje43. Wyniki badania nad ayahuasca, znanego jako Hoasca project, wskazują, że kontrolowane używanie jest bezpieczne pod względem medycznym44, 45. Badania nad zastosowaniem w leczeniu DMT sięgają lat 70., kiedy to dowiedziono, że substancja ta może być wykorzystana w psychoterapii zespołu zależności alkoholowej46 i terapii lęku u chorych z nowotworem w stadium terminalnym47.
Fabregas i wsp. badali wpływ używania ayahuasca na uzależnienie od alkoholu. Porównano użytkowników stosujących ayahuascę z dżungli (n = 56) z tymi z obszarów wiejskich (n = 56), następnie porównano miejskich użytkowników tej substancji (n = 71) z osobami z grupy kontrolnej także z terenów miejskich (n = 59). Głównym kryterium włączenia do grupy użytkowników stosujących ayahuascę była historia używania substancji przez minimum 15 lat, co najmniej 2 razy w tygodniu. Badacze do oceny użyli skali ASI (Addiction Severity Index). Jak wykazały badania, obie podgrupy używające ayahuascę uzyskały niższe wyniki w skali ASI dotyczącej używania alkoholu. Badanych oceniano także w podskalach odnoszących się do chorób współistniejących, zatrudnienia, problemu nadużywania narkotyków, problemów z prawem oraz zaburzeń psychicznych. Wykazano, że rytualne używanie ayahuaski nie wiąże się z występowaniem problemów psychospołecznych, które powodują inne substancje odurzające48.
Zainteresowanie ayahuascą w leczeniu depresji wynika z jej wpływu na transmisję serotoninergiczną. Odkryto, że długotrwałe stosowanie mieszanki DMT i alkaloidów β-karboliny jest skorelowane ze zwiększoną gęstością transporterów serotoniny w płytkach krwi, których deficyt wiąże się m.in. z zaburzeniami depresyjnymi, agresją i nadużywaniem substancji psychoaktywnych49, 50. W badaniu przeprowadzonym przez Santos i wsp. na grupie 9 osób wykazano, że picie mikstury ayahuasca powodowało zmniejszenie uczucia bezsensowności i objawów panicznego lęku badanych za pomocą BHS (Beck Hopelessness Scale) oraz ASI-R (Anxiety Sensitivity Index-Revised). Nie zauważono wpływu naparu na objawy lęku mierzone w skali STAI (State-Trait Anxiety Inventory)51.
Ketamina
Ketamina jest anestetykiem odkrytym poł wieku temu. Mimo że najczęściej kojarzona jest z anestezjologią ze względu na swój wielokierunkowy mechanizm działania, wzbudza coraz większe zainteresowanie wśród psychiatrów. Najnowsza literatura donosi o jej skuteczności w leczeniu m.in. PTSD52, depresji lekoopornej53, 54, myśli samobójczych55–57, leczeniu uzależnienia od alkoholu58 oraz uzależnienia od kokainy59 i opioidów60. Ponadto ketamina może być obiecującym lekiem służącym do wzmocnienia działania selektywnych inhibitorów zwrotnego wychwytu serotoniny oraz inhibitorów zwrotnego wychwytu serotoniny i noradrenaliny w terapii lekoopornych zaburzeń depresyjnych61. W 2019 roku esketamina została zarejestrowana jako lek w Stanach Zjednoczonych. Jest stosowana w leczeniu depresji lekoopornej i dostępna w formie sprayu donosowego62.
Najdokładniej zbadanym działaniem farmakologicznym ketaminy jest jej selektywny antagonizm względem receptora N-metylo-D-asparaginowego (NMDA). Aktywacja receptora NMDA w mózgu skutkuje nasileniem objawów depresyjnych oraz lękowych i może stanowić czynnik ryzyka rozwoju zespołu stresu pourazowego. Antagonistyczne działanie ketaminy wobec tego receptora wydaje się obiecującą metodą leczenia PTSD. Wielu badaczy upatrywało podstaw antydepresyjnego działania anestetyku w tym właśnie mechanizmie, co doprowadziło do wnikliwych badań dotyczących anatagonistów receptorów NMDA, niebędących ketaminą. Wśród nich znalazły się m.in. dizocylpina (MK-801), Ro25-6981, memantyna, lanicemina (AZD6765) i traksoprodil (CP-101 606). Badania z użyciem dizocylpiny przeprowadzone na modelu zwierzęcym wykazały, że substancja, mimo powinowactwa z tym samym receptorem co ketamina, nie wywoływała długotrwałego efektu antydepresyjnego. Lanicemina, Ro25-6981, memantyna i traksoprodil również wywoływały słabszy i krócej trwający efekt przeciwdepresyjny niż ketamina, co w świetle aktualnych badań i dostępnej literatury czyni ją jedynym antagonistą receptorów NMDA możliwym do zastosowania w leczeniu zaburzeń depresyjnych.
W badaniach sekcyjnych pacjentów cierpiących na depresję wykazano zmniejszoną ekspresję mRNA podjednostek GluA1 i GluA3 receptora AMPA (kwas α-amino-3-hydroksy-5-metylo -4-isoksazolepropionowy) w korze perirynalnej, obszarze C1 hipokampa oraz zakręcie zębatym. Poszukiwanie podobnych zjawisk w modelu zwierzęcym doprowadziło do odkrycia, że również w tej grupie pod wpływem chronicznego stresu dochodzi do zmniejszenia ekspresji podjednostek receptora AMPA w wyżej wymienionych strukturach mózgu63. Jak wynika z badań przeprowadzonych na szczurach, ketamina powoduje gwałtowny i krótkotrwały wyrzut glutaminianu, a także zwiększa jego produkcję w środkowej części kory przedczołowej. Skutkuje to aktywacją receptorów AMPA i sugeruje ich udział w natychmiastowym działaniu przeciwdepresyjnym ketaminy. Ponadto badania przedkliniczne wskazują na udział wysokich stężeń glutaminianu w stymulacji neuroplastyczności.
Zaobserwowana w badaniach neuroobrazowych atrofia neuronów oraz zmniejszona objętość hipokampa i kory przedczołowej, występująca u pacjentów cierpiących na depresję oraz w modelu zwierzęcym, sugerują udział tych zjawisk w patogenezie zaburzeń depresyjnych. Opublikowane w 2019 roku badanie z zastosowaniem PET oraz radioligandu SV2A udokumentowało zmniejszoną gęstość synaps w grzbietowo-bocznej korze przedczołowej, przednim zakręcie obręczy i hipokampie wśród pacjentów, u których zdiagnozowano zaburzenia depresyjne lub PTSD. Badania sekcyjne, przeprowadzone u pacjentów, którzy popełnili samobójstwo, oraz cierpiących na depresję za życia wykazały obniżony poziom BDNF (brain-derived neurotrophic factor) i jego receptora kinazy tyrozynowej w korze przedczołowej oraz hipokampie. Indukowany przez ketaminę wyrzut glutaminianu, stymulując postsynaptyczne receptory AMPA, powoduje depolaryzację i aktywację kanałów wapniowych typu L, co prowadzi do uwolnienia BDNF i tym samym – wywołania natychmiastowego efektu antydepresyjnego. Co więcej, nie występuje on w modelu zwierzęcym, jeśli u badanych gryzoni wyciszono gen BDNF bądź dokonano mutacji w jego obrębie (BDNF Val66Met). Ketamina promuje ekspresję BDNF w hipokampie, ale także BDNF-TrkB-zależne różnicowanie neuronów w zakręcie zębatym, co prawdopodobnie odpowiada za długotrwały efekt antydepresyjny tego leku.
Innym czynnikiem biorącym udział w patogenezie zaburzeń depresyjnych jest VEGF (vascular endothelial growth factor). Wśród pacjentów z depresją oraz na modelu zwierzęcym wykazano dysregulację poziomów VEGF i innych neuro transmiterów w hipokampie. W grupie pacjentów otrzymujących przeciwciała anty-VEGF w terapii starczego zwyrodnienia plamki żółtej stwierdzono podwyższone ryzyko wystąpienia zaburzeń depresyjnych i lękowych. Istnieją również badania potwierdzające obniżony poziom VEGF w płynie mózgowo-rdzeniowym pacjentów, którzy próbowali popełnić samobójstwo, oraz cierpiących na depresję lekooporną. Ketamina indukuje ekspresję VEGF w hipokampie. Wiadomo, że neurony piramidalne kory przedczołowej są zarówno źródłem, jak i punktem uchwytu dla VEGF. Przewodnictwo neuronalne odbywające się za pośrednictwem receptora kinazy tyrozynowej VEGF-Flk-1 odgrywa kluczową rolę w antydepresyjnym działaniu ketaminy62.
W badaniu klinicznym z randomizacją, przeprowadzonym przed Feder i wsp., pacjenci cierpiący na PTSD otrzymali pojedynczy wlew ketaminy (0,5 mg/kg m.c.) lub midazolamu (0,045 mg/kg m.c.). Po 24 godzinach od podania odnotowano znaczną redukcję symptomów towarzyszących PTSD mierzoną za pomocą Skali Wpływu Zdarzeń (IES-R) Weissa i Marmara, wśród pacjentów, którzy otrzymali wlew anestetyku. Wśród 7 uczestników, którym podano ketaminę, zmniejszenie nasilenia symptomów utrzymywało się do 2 tygodni. Tak długotrwały efekt zaobserwowano jedynie u 1 pacjenta leczonego midazolamem. Dodatkowo po podaniu anestetyku nastąpiła redukcja objawów depresyjnych towarzyszących PTSD64.
Murrough i wsp. badali natomiast zastosowanie ketaminy u pacjentów cierpiących na depresję lekooporną – 72 uczestników podzielono na dwie grupy, którym podano odpowiednio: chlorowodorek ketaminy lub midazolam. Efekty mierzono za pomocą skali MADRS (the Montgomery-Asberg Depression Rating Scale). W grupie pacjentów otrzymujących anestetyk zaobserwowano większą redukcję objawów depresyjnych (wynik MADRS niższy o 7,95 punktu). Ponadto u 64 proc. uczestników leczonych ketaminą stwierdzono zmniejszenie liczby punktów uzyskanych w ww. skali o ponad 50 proc. w stosunku do 28 proc. w grupie z midazolamem53. W kolejnym badaniu nad zastosowaniem leku w depresji lekoopornej w badanej grupie zażywającej anestetyk zaobserwowano podobną redukcję nasilenia objawów depresyjnych54.
Badano także wykorzystanie ketaminy w leczeniu uzależnień od substancji psychoaktywnych. Wykazano, że podanie ketaminy skutkuje zmniejszeniem odczuwania przyjemności z picia i ograniczeniem potrzeby sięgania po alkohol58. Zbadano skuteczność ketaminy w leczeniu uzależnienia od kokainy w grupie 55 pacjentów – 48,2 proc. uczestników, którym podano ketaminę, utrzymało abstynencję przez 2 tygodnie od dnia badania, natomiast w grupie otrzymującej midazolam odsetek ten wynosił 10,7 proc.. Anestetyk, w porównaniu z midazolamem, obniżył ryzyko powrotu do nałogu o 53 proc. i zredukował odczuwanie głodu narkotykowego o 58,1 proc.59.
Krupitsky i wsp. badali wpływ ketaminy na utrzymanie abstynencji wśród 70 pacjentów uzależnionych od heroiny po leczeniu odwykowym. Uczestnicy zostali podzieleni na dwie grupy ze względu na dawkę leku: 0,2 mg/kg m.c. oraz 2 mg/kg m.c. W ciągu 2 lat od przeprowadzenia doświadczenia wśród pacjentów, którzy otrzymali większą dawkę anestetyku, zanotowano wyższy współczynnik abstynencji, zmniejszenie odczuwania głodu narkotykowego i znaczną poprawę stanu emocjonalnego w stosunku do osób z grupy kontrolnej60.
W 2019 roku opublikowano wyniki badania obejmującego 197 pacjentów chorujących na depresję lekooporną, podzielonych na dwie grupy. Jednej podawano esketaminę w formie sprayu donosowego (56 mg lub 84 mg x 2/tydzień) i lek antydepresyjny, a drugiej grupie – spray z placebo i lek antydepresyjny. Stosowano escitalopram, sertralinę, duloksetynę i wenlafaksynę. Stwierdzono większą redukcję objawów depresyjnych w grupie z esketaminą. Ponadto wśród tych ostatnich zaobserwowano szybsze ustąpienie symptomów niż w grupie z placebo. Przyjmowanie antydepresantu z esketaminą wywoływało częściej objawy niepożądane, takie jak nudności, zaburzenia dysocjacyjne, zawroty głowy i zaburzenia smaku, niż leczenie jedynie lekiem przeciwdepresyjnym. Było to przyczyną rezygnacji z dalszego uczestnictwa w badaniu 7 proc. uczestników z grupy otrzymującej anestetyk w porównaniu z 0,9 proc. w grupie z placebo61.
Ustalono, że działania niepożądane występujące po podaniu ketaminy są zależne od dawki. Największe ich nasilenie występuje w drugiej godzinie od podania. Objawy ustępują w ciągu 4–24 godzin. Należą do nich objawy dysocjacyjne, psychotyczne, a także przejściowy wzrost ciśnienia skurczowego, rozkurczowego i tętna65. Najnowsze badania przeprowadzone na modelu zwierzęcym sugerują, że (R)-ketamina i jej metabolit (2R,6R)-HNK wywołują mniej działań niepożądanych w porównaniu z (S)-ketaminą i ketaminą racemiczną63.
Konopie indyjskie
Marihuana, w większości krajów nielegalna, jest najczęściej zażywanym narkotykiem na świecie. Kwiaty konopi siewnej zawierają ponad 421 różnorodnych substancji chemicznych, w tym ponad 60 rodzajów kannabinoidów. Największe zainteresowanie badaczy budzą delta-9-tetrahydrokannabinol (THC) i kannabidiol (CBD), które mają odmienne właściwości. THC jest głównym psychoaktywnym kannabinoidem obecnym w konopiach indyjskich, który zmienia nastrój, percepcję, apetyt oraz odczuwanie bólu i napięcia66. CBD wykazuje działanie antypsychotyczne, przeciwlękowe, przeciwwymiotne, przeciwzapalne, neuroprotekcyjne i przeciwnowotworowe66, 67, jednocześnie nie wykazując powinowactwa do receptorów kannabinoidowych. Udowodnienie istnienia receptorów kannabinoidowych w mózgu w modelu zwierzęcym przez Devane’a w 1988 roku zapoczątkowało szereg badań, które doprowadziły do identyfikacji receptora CB2 w śledzionie68, sugerując, że kannabinoidy odgrywają rolę w funkcjonowaniu organizmu. Badania dotyczące receptorów kannabinoidowych CB1 i CB2, enzymów oraz endogennych ligandów (endokannabinoidów, anandamidu i 2-arachidonyloglicerolu) umożliwiły odkrycie układu endokannabinoidowego (eCB). Uczestniczy on zarówno w fizjologicznych, jak i patologicznych procesach zachodzących w ludzkim organizmie. Homeostaza pomiędzy składowymi układu endokannabinoidowego odgrywa kluczową rolę w rozwoju ośrodkowego układu nerwowego i neuroplastyczności. Oddziałuje na ośrodek nagrody w mózgu i mechanizm powstawania uzależnień. Ponadto eCB uczestniczy w regulacji apetytu, odczuwaniu bólu, procesach poznawczych i kontroli pamięci. Jest jednym z kluczowych modulatorów nie tylko autonomicznego układu nerwowego, lecz także układów: immunologicznego, endokrynologicznego, rozrodczego i pokarmowego66.
W ostatnich latach powstało wiele publikacji dotyczących skuteczność medycznej marihuany w leczeniu zaburzeń psychicznych. Wśród nich znalazły się m.in. zespół Tourette’a69, 70, jadłowstręt psychiczny71, demencja72–74, PTSD75, zespół zależności od opioidów76–78 i kannabinoidów79, 80, trichotillomania81, fobia społeczna82, psychoza/schizofrenia83– 85 i ADHD86. Leki stosowane w badaniach klinicznych podzielono na cztery grupy ze względu na mechanizm działania – agoniści receptora CB1: dronabinol, nabilon, nabiksimol, THC; antagoniści receptora CB1 lub jego odwrotni agoniści: rimonabant, drinabant; modulator kannabinoidów: kannabidiol oraz pozostałe kannabinoidy66.
Muller-Vahl i wsp. zbadali efekt zastosowania kannabinoidów w leczeniu zespołu Tourette’a. Redukcję objawów zaobserwowano u 10 na 12 pacjentów w grupie z THC w porównaniu z 3 na 12 pacjentów w grupie kontrolnej69. W kolejnym badaniu pacjentom podawano THC, zaczynając od dawki 2,5 mg do 10 mg. W grupie przyjmującej THC stwierdzono istotną statystycznie redukcję symptomów70.
W innym badaniu zastosowano dronabinol (2,5 mg x 2/d przez 4 tygodnie) oraz placebo wśród pacjentek cierpiących na anoreksję co najmniej od 5 lat. Zaobserwowano wzrost masy ciała w obu grupach, z przewagą tej otrzymującej kannabinoid (1 kg : 0,34 kg)71.
Dronabinol ma wpływ na zaburzenia poznawcze i apetyt wśród pacjentów z chorobą Alzheimera. W grupie otrzymującej kannabinoidy stwierdzono większy przyrost masy ciała i spłycenie afektu w porównaniu z grupą placebo72. Badania van Elsena wykazały, że THC nie redukuje objawów neuropsychiatrycznych ani zaburzeń zachowania wśród pacjentów z demencją73, 74.
Po zastosowaniu kannabinoidów w leczeniu PTSD nastąpiła redukcja występowania koszmarów nocnych oceniana za pomocą CAPS (Clinician- -Administered PTSD Scale) w grupie otrzymującej nabilon. Ponadto u 50 proc. pacjentów w tej grupie zanotowano poprawę stanu ogólnego w porównaniu z 11 proc. osób w grupie placebo75.
Według badania przeprowadzonego wśród pacjentów uzależnionych od opioidów dronabinol w dawce 30 mg/d redukował nasilenie objawów odstawiennych w porównaniu z pacjentami z grupy placebo. Uczestnicy, którzy palili marihuanę w trakcie eksperymentu, charakteryzowali się mniejszym nasileniem objawów lękowych i rzadziej cierpieli na bezsenność76. W innym badaniu pacjenci w trakcie leczenia odwykowego otrzymali dronabinol w dawce 40 mg, co wywołało u nich tachykardię i objawy lękowe77. Podobny efekt zaobserwowano w innym badaniu, stwierdzono jednak przy tym niewielką redukcję objawów odstawiennych78.
Levin i wsp. badali wpływ dronabinolu na leczenie uzależnienia od kannabinoidów. Nie uzyskano żadnych efektów leczenia, które pomogłyby uczestnikom osiągnąć abstynencję79. Badanie z użyciem Sativexu (mieszanka THC/CBD) wykazało, że jego stosowanie redukuje objawy odstawienne, jednak nie wpływa na odczuwanie głodu narkotykowego ani długość trwania abstynencji80.
Przeprowadzono również badanie kliniczne, w którym oceniano efekt leczenia dronabinolem (od 2,5 mg do 15 mg) pacjentek z trichotillomanią. Niemal 65 proc. uczestniczek odpowiedziało na leczenie, tj. uzyskało ponad 35-procentową redukcję wyniku w MGH-HPS (Massachusetts General Hospital Hair Pulling Scale)81.
Pacjenci cierpiący na fobię społeczną otrzymali pojedynczą dawkę CBD (600 mg) lub placebo, po czym zostali poddani testowi polegającemu na symulacji wystąpienia publicznego. W grupie, której podano kannabidiol, zaobserwowano efekt przeciwlękowy, zmniejszenie dyskomfortu i redukcję upośledzenia funkcji poznawczych82.
W badaniu McGuire i wsp. pacjenci chorujący na schizofrenię otrzymywali kannabidiol (1000 mg/d) lub placebo. Po 6 tygodniach leczenia w grupie z CBD odnotowano znaczną redukcję objawów schizofrenii, poprawę stanu ogólnego oraz funkcji poznawczych w porównaniu z grupą kontrolną84. Natomiast Boggs i wsp. nie stwierdzili poprawy w grupie pacjentów cierpiących na schizofrenię otrzymujących CBD (600 mg/d)85.
Używanie kannabinoidów, co należy podkreślić, może indukować epizody psychotyczne. W badaniu przeprowadzonym w 2019 roku na grupie ponad 2000 pacjentów oceniano zależność pomiędzy ilością i zawartością THC w palonej marihuanie a częstością występowania psychoz. Wykazano znaczny wzrost ryzyka wystąpienia epizodu psychotycznego wśród uczestników badania, którzy używali konopi indyjskich o zawartości THC powyżej 10 proc. i deklarowali codzienne przyjmowanie narkotyku, w porównaniu z osobami z grupy kontrolnej, które nigdy nie paliły marihuany87.
Nie stwierdzono natomiast statystycznie istotnej różnicy między nabiksimolem a placebo w skuteczności leczenia ADHD w takich aspektach, jak procesy poznawcze, poziom aktywności, labilność emocjonalna i impulsywność86.
Najczęstsze niepożądane działania medycznej marihuany to: zmęczenie, zawroty głowy, uczucie suchości w jamie ustnej oraz takie efekty psychologiczne, jak rozluźnienie, euforia, dysforia, nieprzyjemne odczucia, wzmożenie odczuwania bodźców dotykowych, zmiana percepcji czasu, lęk i panika, zaburzenia pamięci i dezorientacja. Ponadto może wystąpić tachykardia, hipotensja ortostatyczna, spadek napięcia mięśniowego i wzrost apetytu88.
Psylocybina (4-fosforyloksy-N,Ndimetylotryptamina)
Psylocybina to organiczny związek chemiczny z grupy tryptamin, alkaloid występujący naturalnie w grzybach z rodzaju Psilocybe. Po spożyciu pod wpływem kwaśnego środowiska panującego w żołądku jest defosforylowany do aktywnego metabolitu – psylocyny (4-hydroksy-N,N-dimetylotryptamina). Budową przypomina serotoninę oraz 5-hydroksytryptaminę. Psylocybina jako klasyczny psychodelik działa agonistycznie w stosunku do receptorów serotoninowych 5-HT1A, 5-HT2A89 i 5-HT2C90. Badania kliniczne z użyciem psylocybiny poddały ocenie jej skuteczność w leczeniu m.in. lęku i depresji wśród pacjentów onkologicznych91–93, zaburzeń obsesyjno-kompulsyjnych94, depresji lekoopornej95, 96 oraz uzależnień od alkoholu97 i nikotyny98.
Zaburzenia depresyjne i lękowe występują często wśród pacjentów onkologicznych. Skutkuje to zmniejszeniem adherencji terapeutycznej, pogorszeniem prognozy99 i wydłużeniem czasu pobytu w szpitalu100 w tej grupie chorych. W badaniu klinicznym obejmującym 51 pacjentów z nowotworem w stadium terminalnym i towarzyszącymi zaburzeniami depresyjnymi bądź lękowymi chorym podawano psylocybinę w dawkach: małej (1–3 mg/70 kg) lub dużej (22–30 mg/70 kg) w 2 sesjach. Po pierwszej sesji zaobserwowano remisję lub redukcję objawów depresyjnych o 50 proc. u 92 proc. pacjentów, którym podano wysoką dawkę leku, w porównaniu z 32 proc. w grupie placebo. Wyniki mierzono z użyciem skali nasilenia depresji GRID-HAMD-17 (GRID, Hamilton Depression Rating Scale). Nasilenie objawów lękowych badano, wykorzystując Skalę Lęku Hamiltona. W tym aspekcie zanotowano redukcję symptomów po pierwszym podaniu psychodeliku o 76 proc. w grupie otrzymującej wysoką dawkę i 24 proc. w grupie kontrolnej. Ponadto u większości pacjentów efekt przeciwdepresyjny i przeciwlękowy utrzymywał się po 6 miesiącach od zakończenia badania, niezależnie od otrzymanej dawki91. Grob i wsp. oceniali efekty stosowania psylocybiny także wśród pacjentów onkologicznych. Uczestnicy eksperymentu otrzymali psylocybinę lub niacynę jako placebo. Pomiędzy grupami nie zaobserwowano istotnych statystycznie różnic w redukcji nasilenia objawów depresyjnych i lękowych92. W innym badaniu 29 uczestnikom podano psylocybinę lub niacynę. Dodatkowo wszyscy pacjenci uczestniczyli w psychoterapii przez czas trwania badania. W grupie z psylocybiną u 80 proc. uczestników stwierdzono redukcję symptomów depresyjnych w stosunku do 14 proc. w grupie placebo. Zanotowano zmniejszenie nasilenia objawów lękowych o 58 proc. wśród pacjentów, którzy otrzymali psychodelik, a o 14 proc. w grupie kontrolnej. W badaniu kontrolnym przeprowadzonym po 6,5 miesiąca od zakończenia eksperymentu uczestnicy, którzy otrzymywali substancję aktywną, utrzymywali odpowiedź przeciwdepresyjną i przeciwlękową na poziomie 60–80 proc. w stosunku do pomiarów wyjściowych93.
Zbadano także zastosowanie psylocybiny w leczeniu zaburzeń obsesyjno-kompulsyjnych. Pacjenci otrzymali lek kolejno w dawce 100 μg/kg (mała), 200 μg/kg (średnia) i 300 μg/kg (duża). Wśród wszystkich uczestników badania stwierdzono redukcję nasilenia objawów obsesyjno-kompulsyjnych o 23–100 proc. w ciągu doby po podaniu psylocybiny94.
Ponadto badano skuteczność leczenia depresji lekoopornej psylocybiną. Po dwukrotnym przyjęciu psylocybiny 67 proc. pacjentów osiągnęło remisję, natomiast 58 proc. z nich spełniało jej kryteria 3 miesiące od zakończenia badania. Dodatkowo zaobserwowano redukcję nasilenia objawów lękowych i anhedonii95. W badaniu kontrolnym, przeprowadzonym 6 miesięcy po zakończeniu eksperymentu, większość pacjentów pozostawała w stanie remisji96.
Bogenschutz i wsp. przeprowadzili pierwsze badanie kliniczne oceniające skuteczność psylocybiny w leczeniu uzależnienia od alkoholu. Uczestnicy otrzymali psychodelik w dwóch sesjach nadzorowanych przez zespół lekarzy w 4-tygodniowym odstępie. Dodatkowo przez cały czas trwania eksperymentu uczęszczali na terapię wzmagającą motywację. Odsetek dni, w których pacjenci utrzymywali abstynencję, znacznie wzrósł już po pierwszej sesji w stosunku do ich liczby w pierwszych 4 tygodniach badania (tj. przed podaniem substancji). W badaniu kontrolnym przeprowadzonym 36 tygodni po leczeniu ilość alkoholu spożywanego przez uczestników uległa znacznemu zmniejszeniu97.
Pierwsze doświadczenie oceniające przydatność psylocybiny w leczeniu uzależnienia od nikotyny trwało 15 tygodni. W tym czasie uczestnicy otrzymali 3 dawki psylocybiny w piątym (20 mg/70 kg), siódmym (30 mg/70 kg) i trzynastym (30 mg/70 kg) tygodniu trwania eksperymentu. Dodatkowo pacjenci uczestniczyli w terapii poznawczo-behawioralnej 4 razy w tygodniu. W badaniu kontrolnym przeprowadzonym 6 miesięcy po zakończeniu leczenia 80 proc. pacjentów utrzymywało abstynencję nikotynową zbadaną za pomocą wydychanego tlenku węgla i poziomu kotyniny w moczu98.
Działania niepożądane psylocybiny obejmują nudności, wymioty, uczucie dyskomfortu fizycznego, lęk i dezorientację. Powoduje ona wzrost ciśnienia tętniczego i przyspieszenie tętna. W małych dawkach jest zazwyczaj dobrze tolerowana przez pacjentów i nie wywołuje poważnych działań niepożądanych wymagających interwencji lekarskiej91, 93. Podawanie wyższych dawek może wiązać się ze zwiększonym ryzykiem wystąpienia epizodów psychotycznych101.
Wnioski
Zastosowanie substancji psychoaktywnych w leczeniu zaburzeń psychicznych w Polsce jest tematem kontrowersyjnym, budzi jednak coraz większe zainteresowanie badaczy, lekarzy i pacjentów. Zwiększająca się liczba badań i publikacji potwierdzających skuteczność narkotyków w redukcji objawów depresyjno-lękowych wśród pacjentów opornych na standardowe leczenie może skutkować w przyszłości ich potencjalnym zastosowaniem w psychiatrii. Wieloletnie zażywanie leków antydepresyjnych i przeciwpsychotycznych wiąże się z występowaniem wielu działań niepożądanych, takich jak nadmierna sedacja, zaburzenia pamięci, dysfunkcje seksualne, objawy pozapiramidowe czy też zaburzenia metaboliczne w obrębie gospodarki węglowodanowej i lipidowej. Substancje psychoaktywne podawane pacjentom pod kontrolą lekarzy i w indywidualnie dobranej dawce nie wykazują podobnych właściwości, co może znacznie zwiększyć komfort życia chorych. Kolejną zaletą jest natychmiastowy efekt terapeutyczny wywoływany m.in. przez ketaminę czy LSD, w przeciwieństwie do działania klasycznych leków antydepresyjnych i przeciwpsychotycznych, które rozwija się zazwyczaj po wielu tygodniach stosowania, co może negatyw nie wpływać na przymierze terapeutyczne i prowadzić do rezygnacji z terapii. Ponadto wiele publikacji sugeruje skuteczność tego kontrowersyjnego leczenia w przypadku wielu innych schorzeń, takich jak PTSD, uzależnienia od substancji psychoaktywnych, ADHD czy zespół Tourette’a.
Należy jednak podkreślić, że większość badań, do których odwołano się w tej pracy, została przeprowadzona na niewielkich grupach pacjentów, ponadto omawiane tu substancje nie są tak dobrze zbadane jak leki stosowane standardowo, a ich dawki należy traktować jako eksperymentalne. Niewielka liczba publikacji i mała dostępność tego rodzaju leczenia w wielu krajach ogranicza analizę tego zagadnienia, które wymaga dalszej eksploracji. Z opisanych w pracy substancji psychoaktywnych największe znaczenie jako nowa forma terapii ma ketamina. Badania kliniczne z jej wykorzystaniem dostarczyły wystarczających dowodów naukowych na jej skuteczność w leczeniu zaburzeń depresyjnych, co doprowadziło do produkcji leków na jej bazie. Być może inne substancje psychoaktywne w przyszłości podążą jej drogą.
Piśmiennictwo:
1. Krajowe Biuro do spraw Przeciwdziałania Narkomanii. Narkotyki. www.kbpn.gov.pl/ portal?id=112184 (Accessed: 04.10.2020).
2. Tupper KW, Wood E, Yensen R, Johnson MW. Psychedelic medicine: a re-emerging therapeutic paradigm. CMAJ 2015; 187(14): 1054-9.
3. Mueller F, Lenz C, Dolder PC, Harder S, Schmid Y, Lang UE, et al. Acute effects of LSD on amygdala activity during processing of fearful stimuli in healthy subjects. Transl Psychiatry 2017; 7(4): e1084.
4. Nutt D. Psychedelic drugs – a new era in psychiatry? Dialogues Clin Neurosci 2019; 21(2): 139-47.
5. Rickli A, Moning OD, Hoener MC, Liechti ME. Receptor interaction profiles of novel psychoactive tryptamines compared with classic hallucinogens. Eur Neuropsychopharmacol 2016; 26(8): 1327-37.
6. Nichols DE. Psychedelics. Pharmacol Rev 2016; 68(2): 264-355.
7. Pahnke WN, Richards WA. Implications of LSD and experimental mysticism. J Relig Health 1966; 5(3): 175-208.
8. Gable RS. Toward a comparative overview of dependence potential and acute toxicity of psychoactive substances used nonmedically. Am J Drug Alcohol Abuse 1993; 19(3): 263-81.
9. Gasser P, Holstein D, Michel Y, Doblin R, Yazar-Klosinski B, Passie T, et al. Safety and efficacy of lysergic acid diethylamide-assisted psychotherapy for anxiety associated with life-threatening diseases. J Nerv Ment Dis 2014; 202(7): 513-20.
10. Krebs TS, Johansen PØ. Lysergic acid diethylamide (LSD) for alcoholism: meta-analysis of randomized controlled trials. J Psychopharmacol 2012; 26(7): 994-1002.
11. Schindler EA, Gottschalk CH, Weil MJ, Shapiro RE, Wright DA, Sewell RA. Indoleamine Hallucinogens in Cluster Headache: Results of the Clusterbusters Medication Use Survey. J Psychoactive Drugs 2015; 47(5): 372-81.
12. McGeeney BE. Cannabinoids and Hallucinogens for Headache. Headache: The Journal of Head and Face Pain 2013; 53: 447-58.
13. Dolder PC, Schmid Y, Müller F, Borgwardt S, Liechti ME. LSD Acutely Impairs Fear Recognition and Enhances Emotional Empathy and Sociality. Neuropsychopharmacology 2016; 41(11): 2638-46.
14. Passie T, Halpern JH, Stichtenoth DO, Emrich HM, Hintzen A. The pharmacology of lysergic acid diethylamide: a review. CNS Neurosci Ther 2008; 14(4): 295-314.
15. Hysek CM, Schmid Y, Simmler LD, Domes G, Heinrichs M, Eisenegger C, et al. MDMA enhances emotional empathy and prosocial behavior. Soc Cogn Affect Neurosci 2014; 9(11): 1645-52.
16. Dunlap LE, Andrews AM, Olson DE. Dark Classics in Chemical Neuroscience: 3,4-Methylenedioxymethamphetamine. ACS Chem Neurosci 2018; 9(10): 2408-27.
17. Giovannitti JA Jr, Thoms SM, Crawford JJ. Alpha-2 adrenergic receptor agonists: a review of current clinical applications. Anesth Prog 2015; 62(1): 31-9.
18.Thompson MR, Callaghan PD, Hunt GE, Cornish JL, McGregor IS. A role for oxytocin and 5-HT(1A) receptors in the prosocial effects of 3,4 methylenedioxymethamphetamine (“ecstasy”). Neuroscience 2007; 146(2): 509-14.
19. Liechti ME, Saur MR, Gamma A, Hell D, Vollenweider FX. Psychological and physiological effects of MDMA (“Ecstasy”) after pretreatment with the 5-HT(2) antagonist ketanserin in healthy humans. Neuropsychopharmacology 2000; 23(4): 396-404.
20. Nash JF, Roth BL, Brodkin JD, Nichols DE, Gudelsky GA. Effect of the R(-) and S(+) isomers of MDA and MDMA on phosphatidyl inositol turnover in cultured cells expressing 5-HT2A or 5-HT2C receptors. Neurosci Lett 1994; 177(1-2): 111-5.
21. Mithoefer MC, Wagner MT, Mithoefer AT, Jerome L, Doblin R. The safety and efficacy of ❴+/-❵3,4-methylenedioxymethamphetamine-assisted psychotherapy in subjects with chronic, treatment-resistant posttraumatic stress disorder: the first randomized controlled pilot study. J Psychopharmacol 2011; 25(4): 439-52.
22. Oehen P, Traber R, Widmer V, Schnyder U. A randomized, controlled pilot study of MDMA (± 3,4-Methylenedioxymethamphetamine)-assisted psychotherapy for treatment of resistant, chronic Post-Traumatic Stress Disorder (PTSD). J Psychopharmacol 2013; 27(1): 40-52.
23. Sessa B. Why MDMA therapy for alcohol use disorder? And why now? Neuropharmacology 2018; 142: 83-8.
24. Danforth AL, Grob CS, Struble C, Feduccia AA, Walker N, Jerome L, et al. Reduction in social anxiety after MDMA-assisted psychotherapy with autistic adults: a randomized, double-blind, placebo-controlled pilot study. Psychopharmacology (Berl) 2018; 235(11): 3137-48.
25. Vizeli P, Liechti ME. Safety pharmacology of acute MDMA administration in healthy subjects. J Psychopharmacol 2017; 31(5): 576-88.
26. Strohl MP. Bradley’s Benzedrine studies on children with behavioral disorders. Yale J Biol Med 2011; 84(1): 27-33.
27. Heal DJ, Smith SL, Gosden J, Nutt DJ. Amphetamine, past and present – a pharmacological and clinical perspective. J Psychopharmacol 2013; 27(6): 479-96.
28. Kooij SJ, Bejerot S, Blackwell A, Caci H, Casas-Brugué M, Carpentier PJ, et al. European consensus statement on diagnosis and treatment of adult ADHD: The European Network Adult ADHD. BMC Psychiatry 2010; 10: 67.
29. Wittchen HU, Jacobi F, Rehm J, Gustavsson A, Svensson M, Jönsson B, et al. The size and burden of mental disorders and other disorders of the brain in Europe 2010. Eur Neuropsychopharmacol 2011; 21(9): 655-79.
30. Castells X, Blanco-Silvente L, Cunill R. Amphetamines for attention deficit hyperactivity disorder (ADHD) in adults. Cochrane Database Syst Rev 2018; 8(8): CD007813.
31. Faraone SV, Buitelaar J. Comparing the efficacy of stimulants for ADHD in children and adolescents using meta-analysis. Eur Child Adolesc Psychiatry 2010; 19(4): 353-64.
32. Black SW, Yamanaka A, Kilduff TS. Challenges in the development of therapeutics for narcolepsy. Prog Neurobiol 2017; 152: 89-113.
33. Mitler MM, Hajdukovic R, Erman MK. Treatment of narcolepsy with methamphetamine. Sleep 1993; 16(4): 306-17.
34. National Library of Medicine – National Center of Biotechnology Information. https:// pubchem.ncbi.nlm.nih.gov/compound/N_N-Dimethyltryptamine (Accessed: 04.10.2020).
35. Franzen F, Gross H. Tryptamine, N,N-dimethyltryptamine, N,N-dimethyl-5-hydroxytryptamine and 5-methoxytryptamine in human blood and urine. Nature 1965; 206(988): 1052.
36. Thompson MA, Moon E, Kim UJ, Xu J, Siciliano MJ, Weinshilboum RM. Human indolethylamine N-methyltransferase: cDNA cloning and expression, gene cloning, and chromosomal localization. Genomics 1999; 61(3): 285-97.
37. Carbonaro TM, Gatch MB. Neuropharmacology of N,N-dimethyltryptamine. Brain Res Bull 2016; 126(Pt 1): 74-88.
38. Bunzow JR, Sonders MS, Arttamangkul S, Harrison LM, Zhang G, Quigley DI, et al. Amphetamine, 3,4-methylenedioxymethamphetamine, lysergic acid diethylamide, and metabolites of the catecholamine neurotransmitters are agonists of a rat trace amine receptor. Mol Pharmacol 2001; 60(6): 1181-8.
39. Fontanilla D, Johannessen M, Hajipour AR, Cozzi NV, Jackson MB, Ruoho AE. The hallucinogen N,N-dimethyltryptamine (DMT) is an endogenous sigma-1 receptor regulator. Science 2009; 323(5916): 934-7.
40. Davis AK, Barsuglia JP, Lancelotta R, Grant RM, Renn E. The epidemiology of 5-methoxy- N, N-dimethyltryptamine (5-MeO-DMT) use: Benefits, consequences, patterns of use, subjective effects, and reasons for consumption. J Psychopharmacol 2018; 32(7): 779-92.
41. Drug Enforcement Administration; Drug&Chemical Evaluation Section, N,n-dimethyltryptamine (DMT), 2019. www.deadiversion.usdoj.gov/drug_chem_info/dmt.pdf#search= ayahuasca (Accessed: 04.10.2020).
42. Hamill J, Hallak J, Dursun SM, Baker G. Ayahuasca. Psychological and Physiologic Effects, Pharmacology and Potential Uses in Addiction and Mental Illness. Curr Neuropharmacol 2019; 17(2): 108-28.
43. Riba J, Valle M, Urbano G, Yritia M, Morte A, Barbanoj MJ. Human pharmacology of ayahuasca: subjective and cardiovascular effects, monoamine metabolite excretion, and pharmacokinetics. J Pharmacol Exp Ther 2003; 306(1): 73-83.
44. Callaway JC, Raymon LP, Hearn WL, McKenna DJ, Grob CS, Brito GS, et al. Quantitation of N,N-dimethyltryptamine and harmala alkaloids in human plasma after oral dosing with ayahuasca. J Anal Toxicol 1996; 20(6): 492-7.
45. Callaway JC, McKenna DJ, Grob CS, Brito GS, Raymon LP, Poland RE, et al. Pharmacokinetics of Hoasca alkaloids in healthy humans. J Ethnopharmacol 1999; 65(3): 243-56.
46. Grof S, Soskin RA, Richards WA, Kurland AA. DPT as an adjunct in psychotherapy of alcoholics. Int Pharmacopsychiatry 1973; 8(1): 104-15.
47. Richards WA. Mystical and archetypal experiences of terminal patients in DPT-assisted psychotherapy. J Relig Health 1978; 17(2): 117-26.
48. Fábregas JM, González D, Fondevila S, Cutchet M, Fernández X, Barbos PC, et al. Assessment of addiction severity among ritual users of ayahuasca. Drug Alcohol Depend 2010; 111(3): 257-61.
49. Callaway JC, Airaksinen MM, McKenna DJ, Brito GS, Grob CS. Platelet serotonin uptake sites increased in drinkers of ayahuasca. Psychopharmacology (Berl) 1994; 116(3): 385-7.
50. Hallikainen T, Saito T, Lachman HM, Volavka J, Pohjalainen T, Ryynänen OP, et al. Association between low activity serotonin transporter promoter genotype and early onset alcoholism with habitual impulsive violent behavior. Mol Psychiatry 1999; 4(4): 385-8.
51. Santos RG, Landeira-Fernandez J, Strassman RJ, Motta V, Cruz AP. Effects of ayahuasca on psychometric measures of anxiety, panic-like and hopelessness in Santo Daime members. J Ethnopharmacol 2007; 112(3): 507-13.
52. Liriano F, Hatten C, Schwartz TL. Ketamine as treatment for post-traumatic stress disorder: a review. Drugs In Context 2019; 8: 212305.
53. Murrough JW, Iosifescu DV, Chang LC, Al Jurdi RK, Green CE, Perez AM, et al. Antidepressant efficacy of ketamine in treatment-resistant major depression: a two-site randomized controlled trial. Am J Psychiatry 2013; 170(10): 1134-42.
54. Singh JB, Fedgchin M, Daly EJ, De Boer P, Cooper K, Lim P, et al. A Double-Blind, Randomized, Placebo-Controlled, Dose-Frequency Study of Intravenous Ketamine in Patients With Treatment-Resistant Depression. Am J Psychiatry 2016; 173(8): 816-26.
55. Murrough JW, Soleimani L, DeWilde KE, Collins KA, Lapidus KA, Iacoviello BM, et al. Ketamine for rapid reduction of suicidal ideation: a randomized controlled trial. Psychol Med 2015; 45(16): 3571-80.
56. Price RB, Nock MK, Charney DS, Mathew SJ. Effects of intravenous ketamine on explicit and implicit measures of suicidality in treatment-resistant depression. Biol Psychiatry 2009; 66(5): 522-6.
57. Price RB, Iosifescu DV, Murrough JW, Chang LC, Al Jurdi RK, Iqbal SZ, et al. Effects of ketamine on explicit and implicit suicidal cognition: a randomized controlled trial in treatment-resistant depression. Depress Anxiety 2014; 31(4): 335-43.
58. Das RK, Gale G, Walsh K, Hennessy VE, Iskandar G, Mordecai LA, et al. Ketamine can reduce harmful drinking by pharmacologically rewriting drinking memories. Nat Commun 2019; 10: 5187.
59. Dakwar E, Nunes EV, Hart CL, Foltin RW, Mathew SJ, Carpenter KM, et al. A Single Ketamine Infusion Combined With Mindfulness-Based Behavioral Modification to Treat Cocaine Dependence: A Randomized Clinical Trial. Am J Psychiatry 2019; 176(11): 923-30.
60. Krupitsky E, Burakov A, Romanova T, Dunaevsky I, Strassman R, Grinenko A. Ketamine Psychotherapy for Heroin Addiction: Immediate Effects and Two-Year Follow-Up. J Subst Abuse Treat 2002; 23(4): 273-83.
61. Popova V, Daly EJ, Trivedi M, Cooper K, Lane R, Lim P, et al. Efficacy and Safety of Flexibly Dosed Esketamine Nasal Spray Combined With a Newly Initiated Oral Antidepressant in Treatment-Resistant Depression: A Randomized Double-Blind Active- Controlled Study. Am J Psychiatry 2019; 176(6): 428-38.
62. Deyama S, Duman RS. Neurotrophic mechanisms underlying the rapid and sustained antidepressant actions of ketamine. Pharmacol Biochem Behav 2020; 188: 172837. DOI: 10.1016/j.pbb.2019.172837.
63. Aleksandrova LR, Phillips AG, Wang YT. Antidepressant effects of ketamine and the roles of AMPA glutamate receptors and other mechanisms beyond NMDA receptor antagonism. J Psychiatry Neurosci 2017; 42(4): 222-9.
64. Feder A, Parides MK, Murrough JW, Perez AM, Morgan JE, Saxena S, et al. Efficacy of intravenous ketamine for treatment of chronic posttraumatic stress disorder. JAMA Psychiatry 2014; 71(6): 681-8.
65. Andrade C. Ketamine for Depression, 1: Clinical Summary of Issues Related to Efficacy, Adverse Effects, and Mechanism of Action. J Clin Psychiatry 2017; 78(4): e415-9.
66. Hoch E, Niemann D, von Keller R, Schneider M, Friemel CM, Preuss UW, et al. How effective and safe is medical cannabis as a treatment of mental disorders? A systematic review. Eur Arch Psychiatry Clin Neurosci 2019; 269(1): 87-105.
67. Huestis MA. Human cannabinoid pharmacokinetics. Chem Biodivers 2007; 4(8): 1770- 804.
68. Munro S, Thomas KL, Abu-Shaar M. Molecular characterization of a peripheral receptor for cannabinoids. Nature 1993; 365(6441): 61-5.
69. Müller-Vahl KR, Schneider U, Koblenz A, Jöbges M, Kolbe H, Daldrup T, et al. Treatment of Tourette’s syndrome with Delta 9-tetrahydrocannabinol (THC): a randomized crossover trial. Pharmacopsychiatry 2002; 35(2): 57-61. DOI: 10.1055/s-2002-25028.
70. Müller-Vahl KR, Schneider U, Prevedel H, Theloe K, Kolbe H, Daldrup T, et al. Delta 9-tetrahydrocannabinol (THC) is effective in the treatment of tics in Tourette syndrome: a 6-week randomized trial. J Clin Psychiatry 2003; 64(4): 459-65.
71. Andries A, Frystyk J, Flyvbjerg A, Støving RK. Dronabinol in severe, enduring anorexia nervosa: a randomized controlled trial. Int J Eat Disord 2014; 47(1): 18-23.
72. Volicer L, Stelly M, Morris J, McLaughlin J, Volicer BJ. Effects of dronabinol on anorexia and disturbed behavior in patients with Alzheimer’s disease. Int J Geriatr Psychiatry 1997; 12(9): 913-9.
73. Van der Elsen GA, Ahmed AI, Verkes RJ, Feuth T, van der Marck MA, Olde Rikkert MGM. Tetrahydrocannabinol in Behavioral Disturbances in Dementia: A Crossover Randomized Controlled Trial. Am J Geriatric Psychiatry 2015; 23: 1214-24.
74. Van den Elsen GA, Ahmed AI, Verkes RJ, Kramers C, Feuth T, Rosenberg PB, et al. Tetrahydrocannabinol for neuropsychiatric symptoms in dementia: A randomized controlled trial. Neurology 2015; 84(23): 2338-46.
75. Jetly R, Heber A, Fraser G, Boisvert D. The efficacy of nabilone, a synthetic cannabinoid, in the treatment of PTSD-associated nightmares: A preliminary randomized, double- -blind, placebo-controlled cross-over design study. Psychoneuroendocrinology 2015; 51: 585-8.
76. Bisaga A, Sullivan MA, Glass A, Mishlen K, Pavlicova M, Haney M, et al. The effects of dronabinol during detoxification and the initiation of treatment with extended release naltrexone. Drug Alcohol Depend 2015; 154: 38-45.
77. Jicha CJ, Lofwall MR, Nuzzo PA, Babalonis S, Elayi SC, Walsh SL. Safety of oral dronabinol during opioid withdrawal in humans. Drug Alcohol Depend 2015; 157: 179-83.
78. Lofwall MR, Babalonis S, Nuzzo PA, Elayi SC, Walsh SL. Opioid withdrawal suppression efficacy of oral dronabinol in opioid dependent humans. Drug Alcohol Depend 2016; 164: 143-50.
79. Levin FR, Mariani JJ, Brooks DJ, Pavlicova M, Cheng W, Nunes EV. Dronabinol for the treatment of cannabis dependence: a randomized, double-blind, placebo-controlled trial. Drug Alcohol Depend 2011; 116(1-3): 142-50.
80. Trigo JM, Lagzdins D, Rehm J, Selby P, Gamaleddin I, Fischer B, et al. Effects of fixed or self-titrated dosages of Sativex on cannabis withdrawal and cravings. Drug Alcohol Depend 2016; 161: 298-306.
81. Grant JE, Odlaug BL, Chamberlain SR, Kim SW. Dronabinol, a cannabinoid agonist, reduces hair pulling in trichotillomania: a pilot study. Psychopharmacology (Berl) 2011; 218(3): 493-502.
82. Bergamaschi MM, Queiroz RH, Chagas MH, de Oliveira DC, De Martinis BS, Kapczinski F, et al. Cannabidiol reduces the anxiety induced by simulated public speaking in treatment- naïve social phobia patients. Neuropsychopharmacology 2011; 36(6): 1219-26.
83. Leweke FM, Mueller JK, Lange B, Rohleder C. Therapeutic Potential of Cannabinoids in Psychosis. Biol Psychiatry 2016; 79(7): 604-12.
84. McGuire P, Robson P, Cubala WJ, Vasile D, Morrison PD, Barron R, et al. Cannabidiol (CBD) as an Adjunctive Therapy in Schizophrenia: A Multicenter Randomized Controlled Trial. Am J Psychiatry 2018; 175(3): 225-31.
85. Boggs DL, Surti T, Gupta A, Gupta S, Niciu M, Pittman B, et al. The effects of cannabidiol (CBD) on cognition and symptoms in outpatients with chronic schizophrenia a randomized placebo controlled trial. Psychopharmacology (Berl) 2018; 235(7): 1923-32.
86. Cooper RE, Williams E, Seegobin S, Tye C, Kuntsi J, Asherson P. Cannabinoids in attention- deficit/hyperactivity disorder: A randomised-controlled trial. Eur Neuropsychopharmacol 2017; 27(8): 795-808.
87. Di Forti M, Quattrone D, Freeman TP, Tripoli G, Gayer-Anderson C, Quigley H, et al.
The contribution of cannabis use to variation in the incidence of psychotic disorder
across Europe (EU-GEI): a multicentre case-control study. Lancet Psychiatry 2019; 6(5): 427-36.
88. Müller-Vahl KR. Treatment of Tourette syndrome with cannabinoids. Behav Neurol 2013; 27(1): 119-24.
89. Halberstadt AL. Recent advances in the neuropsychopharmacology of serotonergic hallucinogens. Behav Brain Res 2015; 277: 99-120.
90. Canal CE, Murnane KS. The serotonin 5-HT2C receptor and the non-addictive nature of classic hallucinogens. J Psychopharmacol 2017; 31(1): 127-43.
91. Griffiths RR, Johnson MW, Carducci MA, Umbricht A, Richards WA, Richards BD, et al. Psilocybin produces substantial and sustained decreases in depression and anxiety in patients with life-threatening cancer: A randomized double-blind trial. J Psychopharmacol 2016; 30(12): 1181-97.
92. Grob CS, Danforth AL, Chopra GS, Hagerty M, McKay CR, Halberstadt AL, et al. Pilot Study of Psilocybin Treatment for Anxiety in Patients With Advanced-Stage Cancer. Arch Gen Psychiatry 2011; 68(1): 71-8.
93. Ross S, Bossis A, Guss J, Agin-Liebes G, Malone T, Cohen B, et al. Rapid and sustained symptom reduction following psilocybin treatment for anxiety and depression in patients with life-threatening cancer: a randomized controlled trial. J Psychopharmacol 2016; 30(12): 1165-80.
94. Moreno FA, Wiegand CB, Taitano EK, Delgado PL. Safety, tolerability, and efficacy of psilocybin in 9 patients with obsessive-compulsive disorder. J Clin Psychiatry 2006; 67: 1735-40.
95. Carhart-Harris RL, Bolstridge M, Rucker J, Day CMJ, Erritzoe D, Mendel K, et al. Psilocybin with psychological support for treatment-resistant depression: an open-label feasibility study. Lancet Psychiatry 2016; 3: 619-27.
96. Carhart-Harris RL, Bolstridge M, Day CMJ, Rucker J, Watts R, Erritzoe DE, et al. Psilocybin with psychological support for treatment-resistant depression: six-month follow -up. Psychopharmacology (Berl) 2018; 235(2): 399-408.
97. Bogenschutz MP, Forcehimes AA, Pommy JA, Wilcox CE, Barbosa PC, Strassman RJ. Psilocybin-assisted treatment for alcohol dependence: a proof-of-concept study. J Psychopharmacol 2015; 29(3): 289-99.
98. Johnson MW, Garcia-Romeu A, Cosimano MP, Griffiths RR. Pilot study of the 5-HT2AR agonist psilocybin in the treatment of tobacco addiction. J Psychopharmacol 2014; 28(11): 983-92.
99. Arrieta Ó, Angulo LP, Núñez-Valencia C, Dorantes-Gallareta Y, Macedo EO, Martínez- -López D, et al. Association of Depression and Anxiety on Quality of Life, Treatment Adherence, and Prognosis in Patients with Advanced Non-small Cell Lung Cancer. Ann Surg Oncol 2013; 20(6): 1941-8.
100. Prieto JM, Blanch J, Atala J, Carreras E, Rovira M, Cirera E, et al. Psychiatric morbidity and impact on hospital length of stay among hematologic cancer patients receiving stemcell transplantation. J Clin Oncol 2002; 20(7): 1907-17.
101. Vollenweider FX, Vollenweider-Scherpenhuyzen MF, Bäbler A, Vogel H, Hell D. Psilocybin induces schizophrenia-like psychosis in humans via a serotonin-2 agonist action. Neuroreport 1998; 9(17): 3897-902.
Artykuł opublikowano w „Alkoholizmie i Narkomanii” 3/2021.

Źródło:
Alkoholizm i Narkomania/Katarzyna Karaś, Katarzyna Groblińska, Krzysztof Szczygieł i Jerzy Samochowiec
Alkoholizm i Narkomania/Katarzyna Karaś, Katarzyna Groblińska, Krzysztof Szczygieł i Jerzy Samochowiec



















