Zespół nakładania polekowego uszkodzenia wątroby i niealkoholowej stłuszczeniowej choroby wątroby

Zidentyfikowano ok. 1000 różnych leków i innych substancji o potencjalnym działaniu hepatotoksycznym. Leki potencjalnie uszkadzające wątrobę działają poprzez tzw. bezpośredni efekt hepatotoksyczny, który zależy od przyjętej dawki leku, jest możliwy do przewidzenia, charakteryzuje się krótkim okresem latencji, wynoszącym zwykle 1–8 tygodni, i który można zaobserwować u wielu pacjentów.
Autorka: Halina Cichoż-Lach Klinika Gastroenterologii z Pracownią Endoskopową, Uniwersytet Medyczny w Lublinie
Zespół nakładania polekowego uszkodzenia wątroby (drug induced liver injury – DILI) i niealkoholowej stłuszczeniowej choroby wątroby (non-alcoholic fatty liver disease – NAFLD) to istotny, a jednocześnie trudny problem z punktu widzenia klinicznego. Stanowi on ogromne wyzwanie dla lekarza praktyka.
Niealkoholowa stłuszczeniowa choroba wątroby zazwyczaj wiąże się z obecnością zespołu metabolicznego, a podstawą diagnostyki jest stwierdzenie obecności stłuszczenia wątroby na podstawie badań obrazowych, zwykle badania ultrasonograficznego (USG) jamy brzusznej. Konieczne jest wykluczenie tzw. wtórnego stłuszczenia wątroby. Aktywności aminotransferaz (ALT, AST) mogą utrzymywać się na podwyższonym poziomie, chociaż w ok. 60% przypadków mogą pozostawać w granicach normy, nawet u pacjentów z niealkoholowym stłuszczeniowym zapaleniem wątroby (non-alcoholic steatohepatitis – NASH). Przyjmuje się, że aktywność ALT nie jest biomarkerem NAFLD ani NASH i nie ma znaczenia diagnostycznego w NASH i we włóknieniu wątroby. Co warte podkreślenia, prawidłowe aktywności ALT nie wykluczają NAFLD i nie mogą być podstawą jej rozpoznania [1, 2].
Niemniej w praktyce lekarzy POZ rekomenduje się, aby osoby z cechami zespołu metabolicznego i podwyższonymi aktywnościami aminotransferaz były badane pod kątem NAFLD. Pacjenci z NAFLD powinni być poddawani badaniom w kierunku chorób układu krążenia, są one bowiem najczęstszą przyczyną zgonów w tej grupie. Włączenie odpowiedniej terapii pozwala zmniejszyć dynamikę progresji zarówno NAFLD, jak i chorób układu krążenia, co redukuje ryzyko rozwoju poważnych powikłań. Wciąż nie ma jednego leku, który definitywnie zmieniłby przebieg NAFLD i odwrócił zmiany histologiczne, które pojawiają się w zaawansowanych postaciach choroby.
Podstawą leczenia jest modyfikacja stylu życia zmierzająca do trwałej redukcji masy ciała oraz leczenie elementów zespołu metabolicznego: otyłości, hiperlipidemii, cukrzycy i nadciśnienia tętniczego. Pacjenci z prostym stłuszczeniem bez cech NASH i włóknienia mają dobre rokowanie, jeśli stosują się do tych zaleceń. Pacjenci z zaawansowanym włóknieniem (F ≥ 2 wg METAVIR) potwierdzonym histologicznie oraz chorzy z wysokim ryzykiem progresji wymagają farmakoterapii [3]. W leczeniu stosuje się działającą antyoksydacyjnie witaminę E w dawce 800 mg/dobę, zalecaną u pacjentów z NASH potwierdzonym histologicznie bez współistnienia cukrzycy. Pewnym ograniczeniem jej stosowania jest zwiększone ryzyko rozwoju raka prostaty u mężczyzn po 50. roku życia i udaru krwotocznego. Kolejnym lekiem rekomendowanym w leczeniu NASH potwierdzonego w biopsji wątroby jest pioglitazon. Jego działaniem ubocznym jest przyrost masy ciała, zwiększone ryzyko złamań osteoporotycznych u kobiet, zwiększone ryzyko rozwoju raka pęcherza moczowego oraz niewydolności serca, co może ograniczać jego stosowanie.
Bezpieczną formą farmakoterapii jest stosowanie kwasu ursodezoksycholowego (UDCA) w dawce 10–15 mg/kg m.c./dobę. Wykazuje on działanie antyoksydacyjne, cytoprotekcyjne, antyapoptotyczne, przeciwzapalne, choleretyczne, poprawia czynność wydzielniczą hepatocytów i zmniejsza insulinooporność. Powoduje on zmniejszenie aktywności aminotransferaz oraz stłuszczenia wątrobowego [4, 5]. Niezależnie od tych zaleceń wciąż trwają badania nad nowymi sposobami leczenia NASH.
Polekowe uszkodzenie wątroby definiowane jest jako uszkodzenie wątroby spowodowane lekami, suplementami diety, produktami ziołowymi stosowanymi w normalnych, zalecanych dawkach, przy wykluczeniu innych przyczyn uszkodzenia wątroby. W zespole nakładania DILI/NAFLD obserwuje się cechy wskazujące na istnienie tych dwóch patologii w obrazie klinicznym, biochemicznym i histologicznym.
Częstość występowania DILI jest trudna do określenia, ale wydaje się, że jest ona statystycznie niedoszacowana. Wynika to z faktu, że nie wszystkie kraje prowadzą rejestry DILI. Przyjmuje się, że waha się ona w granicach 1–20/100 000 mieszkańców w krajach rozwiniętych, wykazując duże zróżnicowanie geograficzne [6]. Polekowe uszkodzenia wątroby stanowią 5% przypadków ostrego zapalenia wątroby i 30–70% przypadków ostrej niewydolności wątroby.
Bardzo wiele leków może mieć działanie hepatotoksyczne. Najczęściej są to antybiotyki, które odpowiadają za 46% przypadków DILI w USA, suplementy diety, NLPZ, tuberkulostatyki, cytostatyki, leki sercowo-krążeniowe, preparaty stosowane w zaburzeniach metabolicznych, w schorzeniach neurologicznych, leki o działaniu hormonalnym, leki stosowane w terapii biologicznej. Dotychczas zidentyfikowano ok. 1000 różnych leków i innych substancji (w tym suplementów diety) o potencjalnym działaniu hepatotoksycznym [7, 8].
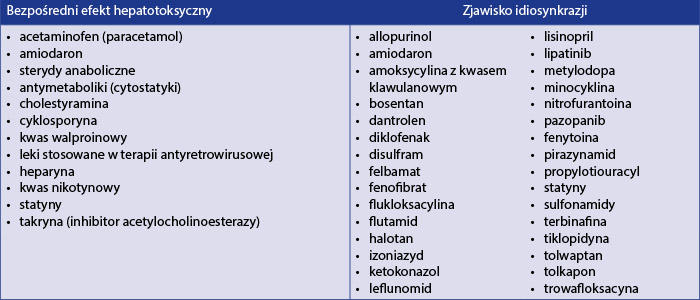
Leki potencjalnie uszkadzające wątrobę działają poprzez tzw. bezpośredni efekt hepatotoksyczny, który zależy od przyjętej dawki leku, jest możliwy do przewidzenia, charakteryzuje się krótkim okresem latencji (czas od przyjęcia leku do wystąpienia objawów uszkodzenia wątroby), wynoszącym zwykle 1–8 tygodni, i który można zaobserwować u wielu pacjentów. W ten sposób działa paracetamol, będący najczęstszą przyczyną ostrej niewydolności wątroby. Drugi mechanizm działania to zjawisko idiosynkrazji – nie do końca wyjaśniona, rzadko występująca nadwrażliwość na hepatotoksyczny efekt danego leku. W tym przypadku okres latencji może się wahać w szerokich granicach – od 1 tygodnia do nawet 12 miesięcy, obraz kliniczny jest różnorodny, efekt nie zależy od dawki leku i jest trudny do przewidzenia, działanie hepatotoksyczne występuje jako reakcja immunologiczna bądź metaboliczna [9]. W tabeli 1 przedstawiono leki, które najczęściej powodują DILI, z określeniem ich mechanizmu działania.

W praktyce klinicznej bardzo istotna jest znajomość czynników sprzyjających DILI, co zwiększa czujność lekarza i ułatwia rozpoznanie tej patologii. Do czynników zależnych od pacjenta należą: wiek (im starszy pacjent, tym większe ryzyko hepatotoksyczności, co jest związane z niższą aktywnością metabolizmu wątrobowego), płeć (częściej chorują kobiety), ciąża, pochodzenie etniczne, czynniki genetyczne, obecność chorób współistniejących, zwłaszcza przewlekłych chorób wątroby, zespół metaboliczny [10–12]. Czynniki ryzyka zależne od leków to: dawka (pojedyncza, dobowa, w przypadku niektórych leków dawka kumulacyjna), budowa chemiczna, profil farmakokinetyczny (lipofilność) i metabolizm wątrobowy, wpływ na czynność mitochondriów oraz na transport wątrobowo-żółciowy, jednoczesne stosowanie innych leków i ryzyko interakcji (szczególnie w przypadku leków metabolizowanych przy udziale izoenzymów cytochromu P-450) [13, 14].
Diagnostyka DILI opiera się na stwierdzeniu uszkodzenia wątroby i udowodnieniu związku między tym uszkodzeniem a stosowaniem leku. Sprowadza się to zawsze do żmudnej analizy chronologii zjawisk laboratoryjnych i klinicznych, oceny reakcji wątroby na odstawienie leku oraz na wykluczeniu chorób wątroby o innej etiologii. W praktyce niekiedy napotyka się różne trudności. Często związek między przyjmowaniem leku a wystąpieniem objawów hepatotoksycznych nie jest oczywisty – pacjenci stosują jednocześnie kilka leków, u chorego współistnieją inne choroby wątroby, a ponadto brakuje specyficznych parametrów laboratoryjnych, typowych markerów klinicznych i histopatologicznych dla DILI czy zespołu nakładania DILI/NAFLD.
Objawy kliniczne DILI, niezależnie od typu reakcji na leki, są bardzo zróżnicowane. Często pacjenci skarżą się na uczucie rozbicia, zmęczenie, ból w nadbrzuszu, występują objawy nadwrażliwości: gorączka, wysypka, zapalenie śluzówek, eozynofilia, objawy zapalenia naczyń, powiększenie węzłów chłonnych, żółtaczka. W 10% przypadków może pojawić się ostra niewydolność wątroby z koagulopatią i ciężką encefalopatią (najczęściej jest ona wywołana paracetamolem), zdecydowanie rzadziej przewlekłe uszkodzenie wątroby.
Niejednokrotnie jedyną manifestacją mogą być nieprawidłowe aktywności aminotransferaz, fosfatazy alkalicznej (ALP) czy podwyższone stężenie bilirubiny całkowitej bez jakichkolwiek objawów klinicznych.
Rozpoznanie DILI wymaga zebrania dokładnego wywiadu dotyczącego zażywanych leków, włącznie z preparatami ziołowymi i suplementami diety. Zaleca się, aby w diagnostyce DILI uwzględniać wszystkie leki zażywane w okresie 3–6 miesięcy przed rozpoznaniem choroby [15]. Wyróżnia się następujące postacie DILI:
• miąższowe, gdy aktywność ALT jest równa lub przekracza 5-krotnie górną granicę normy (ALT ≥ 5 GGN) lub gdy stosunek aktywności ALT do ALP wynosi 5 lub więcej, przy czym aktywność enzymów wyraża się jako wielokrotność GGN,
• cholestatyczne, gdy aktywność ALP jest równa lub przekracza 2-krotnie GGN lub gdy stosunek aktywności ALT do ALP wynosi 2 lub mniej,
• mieszane, gdy stosunek aktywności ALT do ALP waha się między 2 a 5 [16].
Jest to możliwe w praktyce lekarza POZ, ponieważ opiera się on na podstawowych, powszechnie oznaczanych parametrach biochemicznych. Zdecydowanie rzadziej występuje DILI manifestujące się stłuszczeniem wątroby lub zmianami żylno-okluzyjnymi [17]. W tabeli 2 zestawiono różne typy DILI i leki, które je powodują.
W postępowaniu diagnostycznym w kierunku DILI rekomenduje się także test CIOMS/RUCAM (Council for International Organizations of Medical Sciences/Roussel Uclaf Causality Assessment Method). Jest on jednocześnie próbą ujednolicenia kryteriów diagnostycznych DILI. Bierze pod uwagę 7 parametrów:
• okres latencji,
• przebieg po odstawieniu potencjalnie hepatotoksycznego leku (dechallenge test, który obejmuje obserwację wyników badań laboratoryjnych w dwóch przedziałach czasowych: przed i po odstawieniu leku),
• obecność czynników ryzyka,
• przyjmowanie innych leków,
• wykluczenie innej etiologii uszkodzenia wątroby,
• dane dotyczące potencjalnej hepatotoksyczności stosowanego leku (z listy Micromedex lub LivTox – dostępne na platformach internetowych),
• reakcję ustroju na ponowne wprowadzenie leku (test powtórnej ekspozycji – rechallenge test, wykorzystywany coraz rzadziej, przeciwwskazany w uszkodzeniu wątroby przebiegającym z martwicą hepatocytów).
Każdemu z tych parametrów przypisuje się pewną liczbę punktów, a celem wskaźnika jest określenie prawdopodobieństwa wystąpienia DILI. Zgromadzenie 8 lub więcej punktów sugeruje rozpoznanie DILI z wysokim prawdopodobieństwem, natomiast uzyskanie 2 lub mniej punktów czyni rozpoznanie nieprawdopodobnym [18]. Należy pamiętać, że w praktyce klinicznej laboratoryjne wskaźniki uszkodzenia miąższowego wątroby wykazują szybszy spadek niż wskaźniki cholestazy.
Szczególnie trudne diagnostycznie są przypadki nakładania się NAFLD i DILI, zwłaszcza manifestującego się stłuszczeniem wątroby, jak w przypadku tamoksifenu lub amiodaronu. Wymagają one skrupulatnej analizy stosowanych leków i postępowania diagnostycznego potwierdzającego obecność NAFLD.
W leczeniu zespołu nakładania NAFLD/DILI podstawą jest terapia NAFLD, a zwłaszcza NASH, oraz natychmiastowe odstawienie leku podejrzanego o działanie hepatotoksyczne. Nie ma leczenia przyczynowego komponentu DILI. Jedynie w zatruciu paracetamolem stosuje się N-acetylocysteinę, a w zatruciu kwasem walproinowym lewokarnitynę. W cholestatycznych postaciach DILI stosuje się UDCA w dawce 15 mg/kg m.c./dobę, chociaż nie ma wielu badań w tym zakresie. W wybranych przypadkach rozważa się steroidoterapię [19–21]. W ostrej niewydolności wątroby jedynym sposobem postępowania jest przeszczep narządu.
W praktyce lekarza POZ bardzo istotna jest profilaktyka DILI. Polega ona na skrupulatnym rozważeniu wskazań i przeciwwskazań do zastosowania leku, zwłaszcza przy współistnieniu innej patologii wątroby, unikaniu w miarę możliwości polipragmazji, zwłaszcza u chorych w starszym wieku. U każdego pacjenta leczonego preparatem o znanym potencjalnym działaniu hepatotoksycznym (co można sprawdzić na platformach Micromedex lub LivTox) należy okresowo wykonywać badania parametrów wątrobowych.
Piśmiennictwo
1. Verma S, Jensen D, Hart J, Mohanty SR. Predictive value of ALT levels for non-alcoholic steatohepatitis (NASH) and advanced fibrosis in non-alcoholic fatty liver disease (NAFLD). Liver Int 2013; 33: 1398-1405.
2. Fracanzani AL, Valenti L, Bugianesi E i wsp. Risk of severe liver disease in nonalcoholic fatty liver disease with normal aminotransferase levels: a role for insulin resistance and diabetes. Hepatology 2008; 48: 792-798.
3. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver diseases European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD) and European Association for the Study of Obesity (EASO). J Hepatol 2016; 64: 1388-1402.
4. Lindor KD, Kowdley KV, Heathcote EJ i wsp. Ursodeoxycholic acid for treatment of nonalcoholic steatohepatitis: results of a randomized trial. Hepatology 2004; 39: 770-778.
5. Xiang Z, Chen YP, Ma KF i wsp. The role of ursodeoxycholic acid in non-alcoholic steatohepatitis: a systematic review. BMC Gastroenterol 2013; 13: 140.
6. Yu YC, Mao YM, Chen CW i wsp.; Drug-induced Liver Injury (DILI) Study Group; Chinese Society of Hepatology (CSH); Chinese Medical Association (CMA). CSH guidelines for the diagnosis and treatment of drug-induced liver injury. Hepatol Int 2017; 11: 221-241.
7. Licata A, Minissale MG, Calvaruso V, Craxì A. A focus on epidemiology of drug-induced liver injury: analysis of a prospective cohort. Eur Rew Med Pharmacol Sci 2017; 21 (1 Suppl): 112-121.
8. Hartleb M, Gutkowski K. Polekowe uszkodzenia wątroby. Wielka Interna – Gastroenterologia. Część I. Medical Tribune Polska 2010.
9. Tesche R, Schulze J, Eickhoff A, Danan G. Drug induced liver injury: can biomarkers assist RUCAM in causality assessment? Int J Mol Sci 2017; 18: pii: E803.
10. Amacher DE. Female gender as a susceptibility factor for drug-induced liver injury. Hum Exp Toxicol 2014; 33: 928-939.
11. Chalasani N, Reddy KRK, Fontana RJ i wsp. Idiosyncratic drug induced liver injury in African-Americans is associated with greater morbidity and mortality compared to caucasians: a randomized controlled trial. Am J Gastroenterol 2017; 112: 1382-1388.
12. Merrell MD, Cherrington NJ. Drug metabolism alterations in nonalcoholic fatty liver disease. Drug Metab Rev 2011; 43: 317-334.
13. Pauli-Magnus C, Stieger B, Meier Y i wsp. Enterohepatic transport of bile salts and genetics of cholestasis. J Hepatol 2005; 43: 342-357.
14. EASL Clinical Practice Guidelines. Drug-induced liver injury. J Hepatool 2019 [w druku].
15. Habior A, Hartleb M, Milkiewicz P i wsp. Rekomendacje Sekcji Hepatologicznej Polskiego Towarzystwa Gastroenterologii dotyczące cholestatycznych chorób wątroby – adaptacja wytycznych europejskich Hepatology Group of Polish. Gastroenterol Klin 2013; 5: 5-39.
16. Aithal GP, Watkins PB, Andrade RJ i wsp. Case definition and phenotype standardization in drug-induced liver injury. Clin Pharmacol Ther 2011; 89: 806-815.
17. Giordano C, Rivas J, Zervos K. An uptade on treatment of drug-induced liver injury. J Clin Translat Hepatology 2014; 2: 74-79.
18. Kullak-Ublick GA, Andrade RJ, Merz M i wsp. Drug-induced liver injury: recent advances in diagnosis and risk assessment. Gut 2017; 6: 1154-1164.
19. Katsinelos P, Vasiliadis T, Xiarchos P i wsp. Ursodeoxycholic acid (UDCA) for the treatment of amoxycillin-clavulanate potassium (Augmentin)-induced intra-hepatic cholestasis: report of two cases. Eur J Gastroenterol Hepatol 2000; 12: 365-368.
20. Smith LA, Ignacio JRA, Winesett MP i wsp. Vanishing bile duct syndrome: amoxicillin-clavulanic acid associated intra-hepatic cholestasis responsive to ursodeoxycholic acid. J Pediatr Gastroenterol Nutr 2005; 41: 469-473.
21. Wree A, Dechêne A, Herzer K i wsp. Steroid and ursodesoxycholic acid combination therapy in severe druginduced liver injury. Digestion 2011; 84: 54-59.
22. Giannattasio A, D’ambrosi M, Volpicelli M, Iorio R. Steroid therapy for a case of severe drug-induced cholestasis. Ann Pharmacother 2006; 40: 1196-1199.
Zespół nakładania polekowego uszkodzenia wątroby (drug induced liver injury – DILI) i niealkoholowej stłuszczeniowej choroby wątroby (non-alcoholic fatty liver disease – NAFLD) to istotny, a jednocześnie trudny problem z punktu widzenia klinicznego. Stanowi on ogromne wyzwanie dla lekarza praktyka.
Niealkoholowa stłuszczeniowa choroba wątroby zazwyczaj wiąże się z obecnością zespołu metabolicznego, a podstawą diagnostyki jest stwierdzenie obecności stłuszczenia wątroby na podstawie badań obrazowych, zwykle badania ultrasonograficznego (USG) jamy brzusznej. Konieczne jest wykluczenie tzw. wtórnego stłuszczenia wątroby. Aktywności aminotransferaz (ALT, AST) mogą utrzymywać się na podwyższonym poziomie, chociaż w ok. 60% przypadków mogą pozostawać w granicach normy, nawet u pacjentów z niealkoholowym stłuszczeniowym zapaleniem wątroby (non-alcoholic steatohepatitis – NASH). Przyjmuje się, że aktywność ALT nie jest biomarkerem NAFLD ani NASH i nie ma znaczenia diagnostycznego w NASH i we włóknieniu wątroby. Co warte podkreślenia, prawidłowe aktywności ALT nie wykluczają NAFLD i nie mogą być podstawą jej rozpoznania [1, 2].
Niemniej w praktyce lekarzy POZ rekomenduje się, aby osoby z cechami zespołu metabolicznego i podwyższonymi aktywnościami aminotransferaz były badane pod kątem NAFLD. Pacjenci z NAFLD powinni być poddawani badaniom w kierunku chorób układu krążenia, są one bowiem najczęstszą przyczyną zgonów w tej grupie. Włączenie odpowiedniej terapii pozwala zmniejszyć dynamikę progresji zarówno NAFLD, jak i chorób układu krążenia, co redukuje ryzyko rozwoju poważnych powikłań. Wciąż nie ma jednego leku, który definitywnie zmieniłby przebieg NAFLD i odwrócił zmiany histologiczne, które pojawiają się w zaawansowanych postaciach choroby.
Podstawą leczenia jest modyfikacja stylu życia zmierzająca do trwałej redukcji masy ciała oraz leczenie elementów zespołu metabolicznego: otyłości, hiperlipidemii, cukrzycy i nadciśnienia tętniczego. Pacjenci z prostym stłuszczeniem bez cech NASH i włóknienia mają dobre rokowanie, jeśli stosują się do tych zaleceń. Pacjenci z zaawansowanym włóknieniem (F ≥ 2 wg METAVIR) potwierdzonym histologicznie oraz chorzy z wysokim ryzykiem progresji wymagają farmakoterapii [3]. W leczeniu stosuje się działającą antyoksydacyjnie witaminę E w dawce 800 mg/dobę, zalecaną u pacjentów z NASH potwierdzonym histologicznie bez współistnienia cukrzycy. Pewnym ograniczeniem jej stosowania jest zwiększone ryzyko rozwoju raka prostaty u mężczyzn po 50. roku życia i udaru krwotocznego. Kolejnym lekiem rekomendowanym w leczeniu NASH potwierdzonego w biopsji wątroby jest pioglitazon. Jego działaniem ubocznym jest przyrost masy ciała, zwiększone ryzyko złamań osteoporotycznych u kobiet, zwiększone ryzyko rozwoju raka pęcherza moczowego oraz niewydolności serca, co może ograniczać jego stosowanie.
Bezpieczną formą farmakoterapii jest stosowanie kwasu ursodezoksycholowego (UDCA) w dawce 10–15 mg/kg m.c./dobę. Wykazuje on działanie antyoksydacyjne, cytoprotekcyjne, antyapoptotyczne, przeciwzapalne, choleretyczne, poprawia czynność wydzielniczą hepatocytów i zmniejsza insulinooporność. Powoduje on zmniejszenie aktywności aminotransferaz oraz stłuszczenia wątrobowego [4, 5]. Niezależnie od tych zaleceń wciąż trwają badania nad nowymi sposobami leczenia NASH.
Polekowe uszkodzenie wątroby definiowane jest jako uszkodzenie wątroby spowodowane lekami, suplementami diety, produktami ziołowymi stosowanymi w normalnych, zalecanych dawkach, przy wykluczeniu innych przyczyn uszkodzenia wątroby. W zespole nakładania DILI/NAFLD obserwuje się cechy wskazujące na istnienie tych dwóch patologii w obrazie klinicznym, biochemicznym i histologicznym.
Częstość występowania DILI jest trudna do określenia, ale wydaje się, że jest ona statystycznie niedoszacowana. Wynika to z faktu, że nie wszystkie kraje prowadzą rejestry DILI. Przyjmuje się, że waha się ona w granicach 1–20/100 000 mieszkańców w krajach rozwiniętych, wykazując duże zróżnicowanie geograficzne [6]. Polekowe uszkodzenia wątroby stanowią 5% przypadków ostrego zapalenia wątroby i 30–70% przypadków ostrej niewydolności wątroby.
Bardzo wiele leków może mieć działanie hepatotoksyczne. Najczęściej są to antybiotyki, które odpowiadają za 46% przypadków DILI w USA, suplementy diety, NLPZ, tuberkulostatyki, cytostatyki, leki sercowo-krążeniowe, preparaty stosowane w zaburzeniach metabolicznych, w schorzeniach neurologicznych, leki o działaniu hormonalnym, leki stosowane w terapii biologicznej. Dotychczas zidentyfikowano ok. 1000 różnych leków i innych substancji (w tym suplementów diety) o potencjalnym działaniu hepatotoksycznym [7, 8].
Leki potencjalnie uszkadzające wątrobę działają poprzez tzw. bezpośredni efekt hepatotoksyczny, który zależy od przyjętej dawki leku, jest możliwy do przewidzenia, charakteryzuje się krótkim okresem latencji (czas od przyjęcia leku do wystąpienia objawów uszkodzenia wątroby), wynoszącym zwykle 1–8 tygodni, i który można zaobserwować u wielu pacjentów. W ten sposób działa paracetamol, będący najczęstszą przyczyną ostrej niewydolności wątroby. Drugi mechanizm działania to zjawisko idiosynkrazji – nie do końca wyjaśniona, rzadko występująca nadwrażliwość na hepatotoksyczny efekt danego leku. W tym przypadku okres latencji może się wahać w szerokich granicach – od 1 tygodnia do nawet 12 miesięcy, obraz kliniczny jest różnorodny, efekt nie zależy od dawki leku i jest trudny do przewidzenia, działanie hepatotoksyczne występuje jako reakcja immunologiczna bądź metaboliczna [9]. W tabeli 1 przedstawiono leki, które najczęściej powodują DILI, z określeniem ich mechanizmu działania.

W praktyce klinicznej bardzo istotna jest znajomość czynników sprzyjających DILI, co zwiększa czujność lekarza i ułatwia rozpoznanie tej patologii. Do czynników zależnych od pacjenta należą: wiek (im starszy pacjent, tym większe ryzyko hepatotoksyczności, co jest związane z niższą aktywnością metabolizmu wątrobowego), płeć (częściej chorują kobiety), ciąża, pochodzenie etniczne, czynniki genetyczne, obecność chorób współistniejących, zwłaszcza przewlekłych chorób wątroby, zespół metaboliczny [10–12]. Czynniki ryzyka zależne od leków to: dawka (pojedyncza, dobowa, w przypadku niektórych leków dawka kumulacyjna), budowa chemiczna, profil farmakokinetyczny (lipofilność) i metabolizm wątrobowy, wpływ na czynność mitochondriów oraz na transport wątrobowo-żółciowy, jednoczesne stosowanie innych leków i ryzyko interakcji (szczególnie w przypadku leków metabolizowanych przy udziale izoenzymów cytochromu P-450) [13, 14].
Diagnostyka DILI opiera się na stwierdzeniu uszkodzenia wątroby i udowodnieniu związku między tym uszkodzeniem a stosowaniem leku. Sprowadza się to zawsze do żmudnej analizy chronologii zjawisk laboratoryjnych i klinicznych, oceny reakcji wątroby na odstawienie leku oraz na wykluczeniu chorób wątroby o innej etiologii. W praktyce niekiedy napotyka się różne trudności. Często związek między przyjmowaniem leku a wystąpieniem objawów hepatotoksycznych nie jest oczywisty – pacjenci stosują jednocześnie kilka leków, u chorego współistnieją inne choroby wątroby, a ponadto brakuje specyficznych parametrów laboratoryjnych, typowych markerów klinicznych i histopatologicznych dla DILI czy zespołu nakładania DILI/NAFLD.
Objawy kliniczne DILI, niezależnie od typu reakcji na leki, są bardzo zróżnicowane. Często pacjenci skarżą się na uczucie rozbicia, zmęczenie, ból w nadbrzuszu, występują objawy nadwrażliwości: gorączka, wysypka, zapalenie śluzówek, eozynofilia, objawy zapalenia naczyń, powiększenie węzłów chłonnych, żółtaczka. W 10% przypadków może pojawić się ostra niewydolność wątroby z koagulopatią i ciężką encefalopatią (najczęściej jest ona wywołana paracetamolem), zdecydowanie rzadziej przewlekłe uszkodzenie wątroby.
Niejednokrotnie jedyną manifestacją mogą być nieprawidłowe aktywności aminotransferaz, fosfatazy alkalicznej (ALP) czy podwyższone stężenie bilirubiny całkowitej bez jakichkolwiek objawów klinicznych.
Rozpoznanie DILI wymaga zebrania dokładnego wywiadu dotyczącego zażywanych leków, włącznie z preparatami ziołowymi i suplementami diety. Zaleca się, aby w diagnostyce DILI uwzględniać wszystkie leki zażywane w okresie 3–6 miesięcy przed rozpoznaniem choroby [15]. Wyróżnia się następujące postacie DILI:
• miąższowe, gdy aktywność ALT jest równa lub przekracza 5-krotnie górną granicę normy (ALT ≥ 5 GGN) lub gdy stosunek aktywności ALT do ALP wynosi 5 lub więcej, przy czym aktywność enzymów wyraża się jako wielokrotność GGN,
• cholestatyczne, gdy aktywność ALP jest równa lub przekracza 2-krotnie GGN lub gdy stosunek aktywności ALT do ALP wynosi 2 lub mniej,
• mieszane, gdy stosunek aktywności ALT do ALP waha się między 2 a 5 [16].
Jest to możliwe w praktyce lekarza POZ, ponieważ opiera się on na podstawowych, powszechnie oznaczanych parametrach biochemicznych. Zdecydowanie rzadziej występuje DILI manifestujące się stłuszczeniem wątroby lub zmianami żylno-okluzyjnymi [17]. W tabeli 2 zestawiono różne typy DILI i leki, które je powodują.

W postępowaniu diagnostycznym w kierunku DILI rekomenduje się także test CIOMS/RUCAM (Council for International Organizations of Medical Sciences/Roussel Uclaf Causality Assessment Method). Jest on jednocześnie próbą ujednolicenia kryteriów diagnostycznych DILI. Bierze pod uwagę 7 parametrów:
• okres latencji,
• przebieg po odstawieniu potencjalnie hepatotoksycznego leku (dechallenge test, który obejmuje obserwację wyników badań laboratoryjnych w dwóch przedziałach czasowych: przed i po odstawieniu leku),
• obecność czynników ryzyka,
• przyjmowanie innych leków,
• wykluczenie innej etiologii uszkodzenia wątroby,
• dane dotyczące potencjalnej hepatotoksyczności stosowanego leku (z listy Micromedex lub LivTox – dostępne na platformach internetowych),
• reakcję ustroju na ponowne wprowadzenie leku (test powtórnej ekspozycji – rechallenge test, wykorzystywany coraz rzadziej, przeciwwskazany w uszkodzeniu wątroby przebiegającym z martwicą hepatocytów).
Każdemu z tych parametrów przypisuje się pewną liczbę punktów, a celem wskaźnika jest określenie prawdopodobieństwa wystąpienia DILI. Zgromadzenie 8 lub więcej punktów sugeruje rozpoznanie DILI z wysokim prawdopodobieństwem, natomiast uzyskanie 2 lub mniej punktów czyni rozpoznanie nieprawdopodobnym [18]. Należy pamiętać, że w praktyce klinicznej laboratoryjne wskaźniki uszkodzenia miąższowego wątroby wykazują szybszy spadek niż wskaźniki cholestazy.
Szczególnie trudne diagnostycznie są przypadki nakładania się NAFLD i DILI, zwłaszcza manifestującego się stłuszczeniem wątroby, jak w przypadku tamoksifenu lub amiodaronu. Wymagają one skrupulatnej analizy stosowanych leków i postępowania diagnostycznego potwierdzającego obecność NAFLD.
W leczeniu zespołu nakładania NAFLD/DILI podstawą jest terapia NAFLD, a zwłaszcza NASH, oraz natychmiastowe odstawienie leku podejrzanego o działanie hepatotoksyczne. Nie ma leczenia przyczynowego komponentu DILI. Jedynie w zatruciu paracetamolem stosuje się N-acetylocysteinę, a w zatruciu kwasem walproinowym lewokarnitynę. W cholestatycznych postaciach DILI stosuje się UDCA w dawce 15 mg/kg m.c./dobę, chociaż nie ma wielu badań w tym zakresie. W wybranych przypadkach rozważa się steroidoterapię [19–21]. W ostrej niewydolności wątroby jedynym sposobem postępowania jest przeszczep narządu.
W praktyce lekarza POZ bardzo istotna jest profilaktyka DILI. Polega ona na skrupulatnym rozważeniu wskazań i przeciwwskazań do zastosowania leku, zwłaszcza przy współistnieniu innej patologii wątroby, unikaniu w miarę możliwości polipragmazji, zwłaszcza u chorych w starszym wieku. U każdego pacjenta leczonego preparatem o znanym potencjalnym działaniu hepatotoksycznym (co można sprawdzić na platformach Micromedex lub LivTox) należy okresowo wykonywać badania parametrów wątrobowych.
Piśmiennictwo
1. Verma S, Jensen D, Hart J, Mohanty SR. Predictive value of ALT levels for non-alcoholic steatohepatitis (NASH) and advanced fibrosis in non-alcoholic fatty liver disease (NAFLD). Liver Int 2013; 33: 1398-1405.
2. Fracanzani AL, Valenti L, Bugianesi E i wsp. Risk of severe liver disease in nonalcoholic fatty liver disease with normal aminotransferase levels: a role for insulin resistance and diabetes. Hepatology 2008; 48: 792-798.
3. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver diseases European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD) and European Association for the Study of Obesity (EASO). J Hepatol 2016; 64: 1388-1402.
4. Lindor KD, Kowdley KV, Heathcote EJ i wsp. Ursodeoxycholic acid for treatment of nonalcoholic steatohepatitis: results of a randomized trial. Hepatology 2004; 39: 770-778.
5. Xiang Z, Chen YP, Ma KF i wsp. The role of ursodeoxycholic acid in non-alcoholic steatohepatitis: a systematic review. BMC Gastroenterol 2013; 13: 140.
6. Yu YC, Mao YM, Chen CW i wsp.; Drug-induced Liver Injury (DILI) Study Group; Chinese Society of Hepatology (CSH); Chinese Medical Association (CMA). CSH guidelines for the diagnosis and treatment of drug-induced liver injury. Hepatol Int 2017; 11: 221-241.
7. Licata A, Minissale MG, Calvaruso V, Craxì A. A focus on epidemiology of drug-induced liver injury: analysis of a prospective cohort. Eur Rew Med Pharmacol Sci 2017; 21 (1 Suppl): 112-121.
8. Hartleb M, Gutkowski K. Polekowe uszkodzenia wątroby. Wielka Interna – Gastroenterologia. Część I. Medical Tribune Polska 2010.
9. Tesche R, Schulze J, Eickhoff A, Danan G. Drug induced liver injury: can biomarkers assist RUCAM in causality assessment? Int J Mol Sci 2017; 18: pii: E803.
10. Amacher DE. Female gender as a susceptibility factor for drug-induced liver injury. Hum Exp Toxicol 2014; 33: 928-939.
11. Chalasani N, Reddy KRK, Fontana RJ i wsp. Idiosyncratic drug induced liver injury in African-Americans is associated with greater morbidity and mortality compared to caucasians: a randomized controlled trial. Am J Gastroenterol 2017; 112: 1382-1388.
12. Merrell MD, Cherrington NJ. Drug metabolism alterations in nonalcoholic fatty liver disease. Drug Metab Rev 2011; 43: 317-334.
13. Pauli-Magnus C, Stieger B, Meier Y i wsp. Enterohepatic transport of bile salts and genetics of cholestasis. J Hepatol 2005; 43: 342-357.
14. EASL Clinical Practice Guidelines. Drug-induced liver injury. J Hepatool 2019 [w druku].
15. Habior A, Hartleb M, Milkiewicz P i wsp. Rekomendacje Sekcji Hepatologicznej Polskiego Towarzystwa Gastroenterologii dotyczące cholestatycznych chorób wątroby – adaptacja wytycznych europejskich Hepatology Group of Polish. Gastroenterol Klin 2013; 5: 5-39.
16. Aithal GP, Watkins PB, Andrade RJ i wsp. Case definition and phenotype standardization in drug-induced liver injury. Clin Pharmacol Ther 2011; 89: 806-815.
17. Giordano C, Rivas J, Zervos K. An uptade on treatment of drug-induced liver injury. J Clin Translat Hepatology 2014; 2: 74-79.
18. Kullak-Ublick GA, Andrade RJ, Merz M i wsp. Drug-induced liver injury: recent advances in diagnosis and risk assessment. Gut 2017; 6: 1154-1164.
19. Katsinelos P, Vasiliadis T, Xiarchos P i wsp. Ursodeoxycholic acid (UDCA) for the treatment of amoxycillin-clavulanate potassium (Augmentin)-induced intra-hepatic cholestasis: report of two cases. Eur J Gastroenterol Hepatol 2000; 12: 365-368.
20. Smith LA, Ignacio JRA, Winesett MP i wsp. Vanishing bile duct syndrome: amoxicillin-clavulanic acid associated intra-hepatic cholestasis responsive to ursodeoxycholic acid. J Pediatr Gastroenterol Nutr 2005; 41: 469-473.
21. Wree A, Dechêne A, Herzer K i wsp. Steroid and ursodesoxycholic acid combination therapy in severe druginduced liver injury. Digestion 2011; 84: 54-59.
22. Giannattasio A, D’ambrosi M, Volpicelli M, Iorio R. Steroid therapy for a case of severe drug-induced cholestasis. Ann Pharmacother 2006; 40: 1196-1199.
Źródło:
Lekarz POZ 1/2020
Lekarz POZ 1/2020