Współistnienie łuszczycowego zapalenia stawów i choroby Leśniowskiego-Crohna
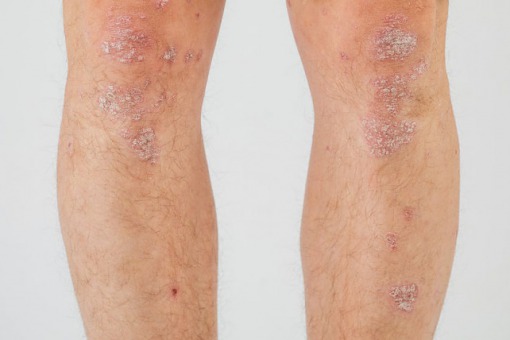
U 20-letniego mężczyzny z łuszczycowym zapaleniem stawów okresowo występowały biegunki i bóle brzucha, doszło do utraty masy ciała. W trakcie hospitalizacji rozpoznano chorobę Leśniowskiego-Chrona. Autorzy pracy opisują trudności diagnostyczne i terapeutyczne w przypadku współistnienia tych dwóch jednostek chorobowych.
Autorzy: Ewa Krecipro-Nizińska, Anna Durazińska, Piotr Wiland
Nieswoiste zapalenia jelit (NZJ) należą do grupy chorób autoimmunologicznych. Zaliczamy do nich chorobę Leśniowskiego-Crohna, wrzodziejące zapalenie jelita grubego (łac. colitis ulcerosa – CU) i mikroskopowe zapalenie jelit. Często zdarza się, że schorzeniom tym towarzyszą objawy pozastawowe: zapalenie stawów, osteopenia i osteoporoza, stłuszczenie wątroby, pierwotne stwardniające zapalenie dróg żółciowych, rak dróg żółciowych, rumień guzowaty, zgorzelinowe zapalenie skóry, zapalenie spojówek, zapalenie tęczówki.
Dolegliwości bólowe stawów mogą dotyczyć 5–30% populacji w zależności od typu zapalenia jelit [1, 2]. Objawy stawowe mogą wiązać się z zaostrzeniem choroby jelit, mogą dotyczyć kilku stawów lub być wielostawowe. Uważa się, że rozpoznanie choroby zapalnej stawów może wyprzedzać często o wiele lat rozpoznanie zapalnej choroby jelit. W przypadku zajęcia osiowego pacjenci często zgłaszają typowe objawy zapalnego bólu krzyża przed 40. rokiem życia – podstępny początek, dolegliwości zwłaszcza w nocy i ustępujący ból po ćwiczeniach. Zwykle obserwuje się dobrą odpowiedź na podanie niesteroidowych leków przeciwzapalnych (NLPZ). Nie zaobserwowano związku z zaostrzeniem zapalenia jelit [1].
Diagnostyka choroby zapalnej stawów i choroby zapalnej jelit przysparza wielu trudności. W licznych pracach podkreśla się, że zapalenie stawów dotyczy pacjentów z cechami zajęcia jelita grubego oraz objawami pozastawowymi, jak rumień guzowaty czy piodermia zgorzelinowa (łac. pyoderma gangrenosum). Proces zapalny może dotyczyć kręgosłupa (z zajęciem i bez zajęcia stawów krzyżowo-biodrowych) oraz stawów obwodowych. Ze względu na liczbę zajętych stawów dzielimy go na dwa podtypy:
– I – wyróżniamy w przypadku zajęcia do sześciu stawów, często łącznie z zaostrzeniem zapalnej choroby jelit, może się samoograniczać,
– II – choroba wielostawowa, zwłaszcza z zajęciem stawów śródręczno-paliczkowych (MCP), a także dużych stawów obwodowych, zazwyczaj nie ma powiązania z zaostrzeniem choroby podstawowej [2].
Zgodnie z aktualnym stanem wiedzy zapalenia stawów w przebiegu NZJ zalicza się obecnie do grupy spondyloartropatii. Ponieważ choroba jelit jest chorobą autoimmunologiczną, może się zdarzyć, że zapalenie stawów ma inne podłoże, np. reumatoidalne zapalenie stawów.
W niniejszej pracy chcemy przedstawić przypadek obecnie 20-letniego mężczyzny z rozpoznanym w 16. roku życia łuszczycowym zapaleniem stawów. Pacjent został przyjęty do kliniki w trybie ostrodyżurowym z powodu niedokrwistości oraz wysiękowego zapalenia stawów kolanowych i skokowych.
W wywiadzie: łuszczyca skóry od 14. roku życia. W rodzinie na łuszczycę chorowała matka pacjenta. W 15. roku życia przebył uraz kolana lewego (skręcenie z naderwaniem więzadeł krzyżowych) – leczony zachowawczo, od tego czasu utrzymuje się wysięk w kolanie. W 16. roku życia na oddziale reumatologii rozpoznano łuszczycowe zapalenie stawów (ŁZS) i wprowadzono do leczenia metotreksat w dawkach wzrastających do 25 mg/tydzień podawanych doustnie i podskórnie, które pacjent aplikował do chwili przyjęcia do szpitala. Interwencyjnie w czasie zaostrzeń stawowych podawano glukokortykosteroidy.
Od 2015 r. pacjent skarżył się na okresowe bóle brzucha i biegunki (2–3 luźne stolce/dobę, bez składników patologicznych), co chory wiązał z zażywaniem metotreksatu. Schudł około 14 kg w ciągu ostatnich kilku miesięcy przed hospitalizacją, zgłaszał pogorszenie apetytu.
Podczas przyjęcia: stan ogólny średni, bladość powłok, BMI 17,5, bóle i obrzęki stawów kolanowych i skokowych. Z badań laboratoryjnych: niedokrwistość mikrocytowa (Hb 7,1 g/dl, MCV 68), nadpłytkowość PLT 780 tys./ul, wysokie parametry zapalenia OB 104 mm/h, CRP 135,6 mg/dl, hipoalbuminemia 2,8 g/dl, niedobór witaminy D 16,8 ng/ml, niskie stężenie żelaza w surowicy, ferrytyna i UIBC w normie, nieobecne przeciwciała przeciwko gliadynie IgA i IgG oraz transglutaminazie tkankowej IgA.
W trakcie hospitalizacji przeprowadzono diagnostykę endoskopową przewodu pokarmowego. W gastroskopii stwierdzono jedynie zapalenie dwunastnicy niewielkiego stopnia. W kolonoskopii uwidoczniono zmiany sugerujące chorobę Leśniowskiego-Crohna z lokalizacją w jelicie krętym i wszystkich odcinkach jelita grubego (drobne nadżerki pokryte włóknikiem, pseudopolipy zapalne). By zlokalizować zmiany, wykonano enterografię TK – w jelicie grubym od esicy do kątnicy uwidoczniono pogrubienie ściany jelita i hiperwaskularyzację krezki oraz odczynowe węzły chłonne. Obraz wskazywał na długoodcinkowe zmiany zapalne jelita grubego. Końcowa część jelita krętego (łac. ileum terminale) była zapadnięta, z prawdopodobnym niewielkim, krótkoodcinkowym pogrubieniem ściany. Nie wykazano (przy nieoptymalnym wypełnieniu jelita) pogrubienia ściany, zwężeń ani poszerzeń jelita cienkiego.
Po dożylnym podaniu kontrastu jodowego Optiray 350 wystąpiła reakcja alergiczna – obrzęk twarzy, bez obrzęku krtani i języka. Objawy ustąpiły po hydrokortyzonie.
W densytometrii kręgosłupa L1-L4 stwierdzono znaczny ubytek gęstości kości Z-score total 3,2 (32%).
Objawy zapalenia stawów zmniejszyły się po dołączeniu do terapii metypredu 16 mg na dobę i sulfasalazyny w dawce początkowej 1,0 g na dobę. Niedokrwistość wymagała przetoczenia 2 jednostek koncentratu krwinek czerwonych, podania dożylnie preparatu żelaza z późniejszą suplementacją doustną. Stosowano leczenie żywieniowe (modulen, fresubin protein), w leczeniu zapalenia jelit Pentasę 3 g/dobę. Rozpoczęto suplementację witaminy D. Złagodzono objawy jelitowe.
Dyskusja
W terapii bardzo ważne jest holistyczne podejście do pacjenta oraz starannie zebrany wywiad. U opisywanego chorego w 16. roku życia rozpoznano ŁZS. Był leczony metotreksatem w postaci doustnej i podskórnej. Zgłaszał jednak towarzyszące chorobie bóle brzucha i biegunki. W badaniach dodatkowych wykryto niedokrwistość, którą wiązano z zapaleniem stawów, nie zlecono więc diagnostyki gastroenterologicznej [2].
Głównym problemem w przypadku naszego pacjenta jest postępowanie terapeutyczne. Zazwyczaj leczenie choroby podstawowej pomaga w kontroli zapalenia stawów i odwrotnie [3].
W ramach programu lekowego do leczenia choroby Leśniowskiego-Crohna można włączyć infliksimab, adalimumab, wedolizumab (VDZ) lub ustekinumab. Czas leczenia jest ograniczony – podobnie jak w programach lekowych reumatologicznych. W przypadku leczenia infliksimabem terapia indukcyjna trwa 6 tygodni. Leczenie podtrzymujące infliksimabem powinno trwać aż do momentu stwierdzenia braku odpowiedzi na leczenie, jednakże nie dłużej niż 24 miesiące od momentu podania pierwszej dawki w terapii indukcyjnej. Adalimumab można podawać do 12 miesięcy, czas terapii indukcyjnej wynosi 12 tygodni. Podobnie w przypadku ustekinumabu – czas leczenia to 12 miesięcy, czas terapii indukcyjnej 8 tygodni. W tym miejscu należy wspomnieć o nowym leku, który znalazł się w programach lekowych – VDZ. Jest to humanizowane monoklonalne przeciwciało IgG1 przeciwko integrynie α4β7, które wybiórczo blokuje jej interakcję z MAdCAM-1 (ang. mucosal vascular addressin cell adhesion molecule 1). Ponieważ VDZ wiąże tylko cały dimer α4β7, działanie jego jest ograniczone do przewodu pokarmowego i nie wpływa na migrację limfocytów w innych narządach, w tym w ośrodkowym układzie nerwowym. Wynika to ze specyficznego rozmieszczenia MAdCAM-1, którego ekspresję stwierdza się jedynie w nabłonku naczyń jelita cienkiego i okrężnicy [4]. Według programu terapeutycznego terapia indukcyjna to 14 tygodni, a leczenie podtrzymujące VDZ powinno trwać aż do momentu stwierdzenia braku odpowiedzi na leczenie, jednakże nie dłużej niż 24 miesiące od momentu podania pierwszej dawki w terapii indukcyjnej [5].
W ramach programu leczenia ŁZS można wziąć pod uwagę zastosowanie adalimumabu, certolizumabu pegol, etanerceptu, golimumabu, infliksymabu czy sekukinumabu. Do programu kwalifikuje się pacjentów z ustalonym rozpoznaniem ŁZS na podstawie kryteriów CASPAR, z aktywną i ciężką postacią choroby oraz z niezadowalającą odpowiedzią na stosowane dotychczas leki (zgodnie z rekomendacjami EULAR/GRAPPA/ASAS). W ramach programów lekowych możliwe jest zastosowanie maksymalnie czterech leków biologicznych, w tym nie więcej niż dwóch inhibitorów TNF-α w przypadku ich nieskuteczności oraz nie więcej niż trzech inhibitorów TNF-α, jeśli przyczyną odstawienia przynajmniej jednego z nich była nietolerancja lub działania niepożądane. Czas podawania leku w ramach programu lekowego przy pierwszym podawaniu leku biologicznego nie może być dłuższy niż 18 miesięcy. Pacjent, który został wyłączony z programu lekowego zgodnie z zapisami programu z powodu uzyskania niskiej aktywności choroby i u którego w trakcie badania kontrolnego stwierdzono nawrót aktywnej choroby zgodny z kryteriami włączenia do programu, jest włączany do leczenia w ramach programu bez powtórnej kwalifikacji [5].
U opisywanego pacjenta z objawami z pogranicza chorób zapalnych jelit i choroby reumatycznej należałoby rozważyć włączenie do leczenia inhibitorów TNF-α – adalimumabu czy infliksimabu – lub inhibitora interleukiny 12/23 – ustekinumabu (w pełni ludzkie przeciwciało monoklonalne IgG1κ przeciwko interleukinie 12/23, lek dostępny w programie lekowym łuszczycy). Wedolizumab działa tylko w przewodzie pokarmowym. W świetle najnowszych danych może zmniejszać szanse na wystąpienie zaostrzenia dolegliwości stawowych [6]. Z kolei etanercept nie wykazuje działania w zapaleniach jelit, może powodować zaostrzenie zapalnej choroby jelit.
Każdy pacjent powinien być diagnozowany indywidualnie, pod kątem zgłaszanych dolegliwości i wyboru najlepszej opcji terapeutycznej. Pamiętajmy o dokładnym zbieraniu wywiadu i ścisłej współpracy z innymi specjalistami.
Piśmiennictwo
1. Wiland P. Zapalenia stawów w przebiegu nieswoistych zapaleń jelit. W: Gajewski P, Szczeklik A (red.). Interna Szczeklika, Medycyna Praktyczna, Kraków 2019.
2. Inman RD. Clinical manifestationd and diagnosis of arthritis associated with inflammatory bowel disease and other gastrointestinal diseases. UpToDate 2017.
3. Inman RD. Treatment of arthritis associated with inflammatory bowel disease. UpToDate 2017.
4. Radwan P, Skrzydło-Radomańska B. Vedolizumab – nowy sposób biologicznego leczenia nieswoistych zapaleń jelit. Gastroenterol Prakt 2015; 1: 43-49.
5. https://www.gov.pl/web/zdrowie/choroby-nieonkologiczne.
6. Feagan BG, Sandborn WJ, Colombel J-F i wsp. Incidence of arthritis/arthralgia in inflammatory bowel disease with long-term vedolizumab treatment: post hoc analyses of the GEMINI trials. J Crohns Colitis 2019; 13: 50-57.
1. Wiland P. Zapalenia stawów w przebiegu nieswoistych zapaleń jelit. W: Gajewski P, Szczeklik A (red.). Interna Szczeklika, Medycyna Praktyczna, Kraków 2019.
2. Inman RD. Clinical manifestationd and diagnosis of arthritis associated with inflammatory bowel disease and other gastrointestinal diseases. UpToDate 2017.
3. Inman RD. Treatment of arthritis associated with inflammatory bowel disease. UpToDate 2017.
4. Radwan P, Skrzydło-Radomańska B. Vedolizumab – nowy sposób biologicznego leczenia nieswoistych zapaleń jelit. Gastroenterol Prakt 2015; 1: 43-49.
5. https://www.gov.pl/web/zdrowie/choroby-nieonkologiczne.
6. Feagan BG, Sandborn WJ, Colombel J-F i wsp. Incidence of arthritis/arthralgia in inflammatory bowel disease with long-term vedolizumab treatment: post hoc analyses of the GEMINI trials. J Crohns Colitis 2019; 13: 50-57.
Pełna treść artykułu: Ewa Krecipro-Nizińska, Anna Durazińska, Piotr Wiland. Współistnienie łuszczycowego zapalenia stawów oraz choroby Leśniowskiego-Crohna. Wskazana konsultacja gastroenterologa i możliwości terapeutyczne – opis przypadku. Reumatologia News 2020; 5(1): 58-60.
Nieswoiste zapalenia jelit (NZJ) należą do grupy chorób autoimmunologicznych. Zaliczamy do nich chorobę Leśniowskiego-Crohna, wrzodziejące zapalenie jelita grubego (łac. colitis ulcerosa – CU) i mikroskopowe zapalenie jelit. Często zdarza się, że schorzeniom tym towarzyszą objawy pozastawowe: zapalenie stawów, osteopenia i osteoporoza, stłuszczenie wątroby, pierwotne stwardniające zapalenie dróg żółciowych, rak dróg żółciowych, rumień guzowaty, zgorzelinowe zapalenie skóry, zapalenie spojówek, zapalenie tęczówki.
Dolegliwości bólowe stawów mogą dotyczyć 5–30% populacji w zależności od typu zapalenia jelit [1, 2]. Objawy stawowe mogą wiązać się z zaostrzeniem choroby jelit, mogą dotyczyć kilku stawów lub być wielostawowe. Uważa się, że rozpoznanie choroby zapalnej stawów może wyprzedzać często o wiele lat rozpoznanie zapalnej choroby jelit. W przypadku zajęcia osiowego pacjenci często zgłaszają typowe objawy zapalnego bólu krzyża przed 40. rokiem życia – podstępny początek, dolegliwości zwłaszcza w nocy i ustępujący ból po ćwiczeniach. Zwykle obserwuje się dobrą odpowiedź na podanie niesteroidowych leków przeciwzapalnych (NLPZ). Nie zaobserwowano związku z zaostrzeniem zapalenia jelit [1].
Diagnostyka choroby zapalnej stawów i choroby zapalnej jelit przysparza wielu trudności. W licznych pracach podkreśla się, że zapalenie stawów dotyczy pacjentów z cechami zajęcia jelita grubego oraz objawami pozastawowymi, jak rumień guzowaty czy piodermia zgorzelinowa (łac. pyoderma gangrenosum). Proces zapalny może dotyczyć kręgosłupa (z zajęciem i bez zajęcia stawów krzyżowo-biodrowych) oraz stawów obwodowych. Ze względu na liczbę zajętych stawów dzielimy go na dwa podtypy:
– I – wyróżniamy w przypadku zajęcia do sześciu stawów, często łącznie z zaostrzeniem zapalnej choroby jelit, może się samoograniczać,
– II – choroba wielostawowa, zwłaszcza z zajęciem stawów śródręczno-paliczkowych (MCP), a także dużych stawów obwodowych, zazwyczaj nie ma powiązania z zaostrzeniem choroby podstawowej [2].
Zgodnie z aktualnym stanem wiedzy zapalenia stawów w przebiegu NZJ zalicza się obecnie do grupy spondyloartropatii. Ponieważ choroba jelit jest chorobą autoimmunologiczną, może się zdarzyć, że zapalenie stawów ma inne podłoże, np. reumatoidalne zapalenie stawów.
W niniejszej pracy chcemy przedstawić przypadek obecnie 20-letniego mężczyzny z rozpoznanym w 16. roku życia łuszczycowym zapaleniem stawów. Pacjent został przyjęty do kliniki w trybie ostrodyżurowym z powodu niedokrwistości oraz wysiękowego zapalenia stawów kolanowych i skokowych.
W wywiadzie: łuszczyca skóry od 14. roku życia. W rodzinie na łuszczycę chorowała matka pacjenta. W 15. roku życia przebył uraz kolana lewego (skręcenie z naderwaniem więzadeł krzyżowych) – leczony zachowawczo, od tego czasu utrzymuje się wysięk w kolanie. W 16. roku życia na oddziale reumatologii rozpoznano łuszczycowe zapalenie stawów (ŁZS) i wprowadzono do leczenia metotreksat w dawkach wzrastających do 25 mg/tydzień podawanych doustnie i podskórnie, które pacjent aplikował do chwili przyjęcia do szpitala. Interwencyjnie w czasie zaostrzeń stawowych podawano glukokortykosteroidy.
Od 2015 r. pacjent skarżył się na okresowe bóle brzucha i biegunki (2–3 luźne stolce/dobę, bez składników patologicznych), co chory wiązał z zażywaniem metotreksatu. Schudł około 14 kg w ciągu ostatnich kilku miesięcy przed hospitalizacją, zgłaszał pogorszenie apetytu.
Podczas przyjęcia: stan ogólny średni, bladość powłok, BMI 17,5, bóle i obrzęki stawów kolanowych i skokowych. Z badań laboratoryjnych: niedokrwistość mikrocytowa (Hb 7,1 g/dl, MCV 68), nadpłytkowość PLT 780 tys./ul, wysokie parametry zapalenia OB 104 mm/h, CRP 135,6 mg/dl, hipoalbuminemia 2,8 g/dl, niedobór witaminy D 16,8 ng/ml, niskie stężenie żelaza w surowicy, ferrytyna i UIBC w normie, nieobecne przeciwciała przeciwko gliadynie IgA i IgG oraz transglutaminazie tkankowej IgA.
W trakcie hospitalizacji przeprowadzono diagnostykę endoskopową przewodu pokarmowego. W gastroskopii stwierdzono jedynie zapalenie dwunastnicy niewielkiego stopnia. W kolonoskopii uwidoczniono zmiany sugerujące chorobę Leśniowskiego-Crohna z lokalizacją w jelicie krętym i wszystkich odcinkach jelita grubego (drobne nadżerki pokryte włóknikiem, pseudopolipy zapalne). By zlokalizować zmiany, wykonano enterografię TK – w jelicie grubym od esicy do kątnicy uwidoczniono pogrubienie ściany jelita i hiperwaskularyzację krezki oraz odczynowe węzły chłonne. Obraz wskazywał na długoodcinkowe zmiany zapalne jelita grubego. Końcowa część jelita krętego (łac. ileum terminale) była zapadnięta, z prawdopodobnym niewielkim, krótkoodcinkowym pogrubieniem ściany. Nie wykazano (przy nieoptymalnym wypełnieniu jelita) pogrubienia ściany, zwężeń ani poszerzeń jelita cienkiego.
Po dożylnym podaniu kontrastu jodowego Optiray 350 wystąpiła reakcja alergiczna – obrzęk twarzy, bez obrzęku krtani i języka. Objawy ustąpiły po hydrokortyzonie.
W densytometrii kręgosłupa L1-L4 stwierdzono znaczny ubytek gęstości kości Z-score total 3,2 (32%).
Objawy zapalenia stawów zmniejszyły się po dołączeniu do terapii metypredu 16 mg na dobę i sulfasalazyny w dawce początkowej 1,0 g na dobę. Niedokrwistość wymagała przetoczenia 2 jednostek koncentratu krwinek czerwonych, podania dożylnie preparatu żelaza z późniejszą suplementacją doustną. Stosowano leczenie żywieniowe (modulen, fresubin protein), w leczeniu zapalenia jelit Pentasę 3 g/dobę. Rozpoczęto suplementację witaminy D. Złagodzono objawy jelitowe.
Dyskusja
W terapii bardzo ważne jest holistyczne podejście do pacjenta oraz starannie zebrany wywiad. U opisywanego chorego w 16. roku życia rozpoznano ŁZS. Był leczony metotreksatem w postaci doustnej i podskórnej. Zgłaszał jednak towarzyszące chorobie bóle brzucha i biegunki. W badaniach dodatkowych wykryto niedokrwistość, którą wiązano z zapaleniem stawów, nie zlecono więc diagnostyki gastroenterologicznej [2].
Głównym problemem w przypadku naszego pacjenta jest postępowanie terapeutyczne. Zazwyczaj leczenie choroby podstawowej pomaga w kontroli zapalenia stawów i odwrotnie [3].
W ramach programu lekowego do leczenia choroby Leśniowskiego-Crohna można włączyć infliksimab, adalimumab, wedolizumab (VDZ) lub ustekinumab. Czas leczenia jest ograniczony – podobnie jak w programach lekowych reumatologicznych. W przypadku leczenia infliksimabem terapia indukcyjna trwa 6 tygodni. Leczenie podtrzymujące infliksimabem powinno trwać aż do momentu stwierdzenia braku odpowiedzi na leczenie, jednakże nie dłużej niż 24 miesiące od momentu podania pierwszej dawki w terapii indukcyjnej. Adalimumab można podawać do 12 miesięcy, czas terapii indukcyjnej wynosi 12 tygodni. Podobnie w przypadku ustekinumabu – czas leczenia to 12 miesięcy, czas terapii indukcyjnej 8 tygodni. W tym miejscu należy wspomnieć o nowym leku, który znalazł się w programach lekowych – VDZ. Jest to humanizowane monoklonalne przeciwciało IgG1 przeciwko integrynie α4β7, które wybiórczo blokuje jej interakcję z MAdCAM-1 (ang. mucosal vascular addressin cell adhesion molecule 1). Ponieważ VDZ wiąże tylko cały dimer α4β7, działanie jego jest ograniczone do przewodu pokarmowego i nie wpływa na migrację limfocytów w innych narządach, w tym w ośrodkowym układzie nerwowym. Wynika to ze specyficznego rozmieszczenia MAdCAM-1, którego ekspresję stwierdza się jedynie w nabłonku naczyń jelita cienkiego i okrężnicy [4]. Według programu terapeutycznego terapia indukcyjna to 14 tygodni, a leczenie podtrzymujące VDZ powinno trwać aż do momentu stwierdzenia braku odpowiedzi na leczenie, jednakże nie dłużej niż 24 miesiące od momentu podania pierwszej dawki w terapii indukcyjnej [5].
W ramach programu leczenia ŁZS można wziąć pod uwagę zastosowanie adalimumabu, certolizumabu pegol, etanerceptu, golimumabu, infliksymabu czy sekukinumabu. Do programu kwalifikuje się pacjentów z ustalonym rozpoznaniem ŁZS na podstawie kryteriów CASPAR, z aktywną i ciężką postacią choroby oraz z niezadowalającą odpowiedzią na stosowane dotychczas leki (zgodnie z rekomendacjami EULAR/GRAPPA/ASAS). W ramach programów lekowych możliwe jest zastosowanie maksymalnie czterech leków biologicznych, w tym nie więcej niż dwóch inhibitorów TNF-α w przypadku ich nieskuteczności oraz nie więcej niż trzech inhibitorów TNF-α, jeśli przyczyną odstawienia przynajmniej jednego z nich była nietolerancja lub działania niepożądane. Czas podawania leku w ramach programu lekowego przy pierwszym podawaniu leku biologicznego nie może być dłuższy niż 18 miesięcy. Pacjent, który został wyłączony z programu lekowego zgodnie z zapisami programu z powodu uzyskania niskiej aktywności choroby i u którego w trakcie badania kontrolnego stwierdzono nawrót aktywnej choroby zgodny z kryteriami włączenia do programu, jest włączany do leczenia w ramach programu bez powtórnej kwalifikacji [5].
U opisywanego pacjenta z objawami z pogranicza chorób zapalnych jelit i choroby reumatycznej należałoby rozważyć włączenie do leczenia inhibitorów TNF-α – adalimumabu czy infliksimabu – lub inhibitora interleukiny 12/23 – ustekinumabu (w pełni ludzkie przeciwciało monoklonalne IgG1κ przeciwko interleukinie 12/23, lek dostępny w programie lekowym łuszczycy). Wedolizumab działa tylko w przewodzie pokarmowym. W świetle najnowszych danych może zmniejszać szanse na wystąpienie zaostrzenia dolegliwości stawowych [6]. Z kolei etanercept nie wykazuje działania w zapaleniach jelit, może powodować zaostrzenie zapalnej choroby jelit.
Każdy pacjent powinien być diagnozowany indywidualnie, pod kątem zgłaszanych dolegliwości i wyboru najlepszej opcji terapeutycznej. Pamiętajmy o dokładnym zbieraniu wywiadu i ścisłej współpracy z innymi specjalistami.
Piśmiennictwo
1. Wiland P. Zapalenia stawów w przebiegu nieswoistych zapaleń jelit. W: Gajewski P, Szczeklik A (red.). Interna Szczeklika, Medycyna Praktyczna, Kraków 2019.
2. Inman RD. Clinical manifestationd and diagnosis of arthritis associated with inflammatory bowel disease and other gastrointestinal diseases. UpToDate 2017.
3. Inman RD. Treatment of arthritis associated with inflammatory bowel disease. UpToDate 2017.
4. Radwan P, Skrzydło-Radomańska B. Vedolizumab – nowy sposób biologicznego leczenia nieswoistych zapaleń jelit. Gastroenterol Prakt 2015; 1: 43-49.
5. https://www.gov.pl/web/zdrowie/choroby-nieonkologiczne.
6. Feagan BG, Sandborn WJ, Colombel J-F i wsp. Incidence of arthritis/arthralgia in inflammatory bowel disease with long-term vedolizumab treatment: post hoc analyses of the GEMINI trials. J Crohns Colitis 2019; 13: 50-57.
1. Wiland P. Zapalenia stawów w przebiegu nieswoistych zapaleń jelit. W: Gajewski P, Szczeklik A (red.). Interna Szczeklika, Medycyna Praktyczna, Kraków 2019.
2. Inman RD. Clinical manifestationd and diagnosis of arthritis associated with inflammatory bowel disease and other gastrointestinal diseases. UpToDate 2017.
3. Inman RD. Treatment of arthritis associated with inflammatory bowel disease. UpToDate 2017.
4. Radwan P, Skrzydło-Radomańska B. Vedolizumab – nowy sposób biologicznego leczenia nieswoistych zapaleń jelit. Gastroenterol Prakt 2015; 1: 43-49.
5. https://www.gov.pl/web/zdrowie/choroby-nieonkologiczne.
6. Feagan BG, Sandborn WJ, Colombel J-F i wsp. Incidence of arthritis/arthralgia in inflammatory bowel disease with long-term vedolizumab treatment: post hoc analyses of the GEMINI trials. J Crohns Colitis 2019; 13: 50-57.
Pełna treść artykułu: Ewa Krecipro-Nizińska, Anna Durazińska, Piotr Wiland. Współistnienie łuszczycowego zapalenia stawów oraz choroby Leśniowskiego-Crohna. Wskazana konsultacja gastroenterologa i możliwości terapeutyczne – opis przypadku. Reumatologia News 2020; 5(1): 58-60.



