Elektrowstrząsy u chorej na schizofrenię lekooporną
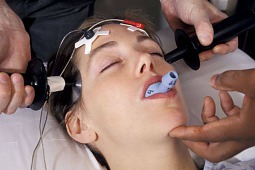
Mimo postępów w leczeniu schizofrenii, u około 30 proc. chorych obserwuje się lekooporność. W takich przypadkach stosowane są różnorodne formy augmentacji leczenia, jednak za złoty standard uznaje się włączenie klozapiny. W odniesieniu do chorych, u których klozapina nie przyniosła oczekiwanych efektów terapeutycznych, proponuje się jednoczesne wykonanie serii zabiegów elektrowstrząsowych. - Ostatnio szczególną uwagę zwraca się na możliwość zastosowania klozapiny z elektrowstrząsami podtrzymującymi - podkreślają eksperci z Kliniki Psychiatrii Dorosłych Uniwersytetu Medyczny im. Karola Marcinkowskiego w Poznaniu.
Artykuł Przemysława Zakowicza, Pawła Wójciaka, Sebastiana Dziudy i Filipa Rybakowskiego z Kliniki Psychiatrii Dorosłych Uniwersytetu Medyczny im. Karola Marcinkowskiego w Poznaniu:
- Schizofrenia jest przewlekłą chorobą neurorozwojową występującą u około 1 proc. populacji, prowadzącą do znaczących zaburzeń w funkcjonowaniu społecznym i zawodowym [1].
W patogenezie schizofrenii uczestniczą zaburzenia neuroprzekaźnictwa, głównie dopaminergicznego, a sama choroba manifestuje się różnymi objawami klinicznymi, precyzyjnie zdefiniowanymi po raz pierwszy przez Kurta Schneidera [2]. Kryteria diagnostyczne choroby wymagają stwierdzenia obecności omamów słuchowych o charakterze głosów komentujących lub dyskutujących oraz urojeń (dziwacznych, wpływu, nasyłania lub rozgłaśniania myśli) [3].
Leczenie schizofrenii opiera się głównie na stosowaniu leków przeciwpsychotycznych (klasycznych i atypowych), które przy właściwej współpracy terapeutycznej pozwalają na remisję objawów oraz utrzymanie dobrego funkcjonowania społecznego. Nie mniej istotnym problemem, występującym u około 30 proc. chorych, jest lekooporność [4, 5].
Sama definicja lekooporności w schizofrenii (treatment resistant schizophrenia – TRS) jest przedmiotem kontrowersji. Najbardziej rozpowszechniona mówi o braku remisji, nawrotach objawów lub objawach nietolerancji przy stosowaniu dwóch różnych leków przeciwpsychotycznych lub klozapiny w odpowiednich dawkach, przez wystarczająco długi czas (według części autorów minimum 2 lata) [6, 7]. Inne powszechnie akceptowane kryteria TRS zakładają czas trwania choroby powyżej 5 lat z utrzymywaniem się objawów psychotycznych, których nasilenie nie ulega zmniejszeniu mimo regularnego, minimum 2-letniego stosowania adekwatnych dawek dwóch różnych leków przeciwpsychotycznych, ze szczególnym uwzględnieniem braku odpowiedzi na klozapinę [8, 9].
Złotym standardem w terapii TRS jest stosowanie klozapiny, która w porównaniu z innymi lekami wykazuje największy potencjał przeciwpsychotyczny [10]. Jej skuteczność jest jednak ograniczona do 60–70 proc. chorych z rozpoznaniem TRS [11], długotrwałe stosowanie leku w dużych dawkach wiąże się z ryzykiem wystąpienia działań niepożądanych, z najgroźniejszymi, obejmującymi zaburzenia rytmu serca oraz neutropenię lub agranulocytozę [1, 12]. W celu redukcji powyższego ryzyka sugeruje się monitorowanie stężenia leku w surowicy krwi pozwalające na zminimalizowanie ryzyka powikłań przy zakresie terapeutycznym 200–400 ng/ml [11]. W związku z ograniczoną skutecznością klozapiny proponowane są różne terapie augmentacyjne, zakładające dodanie do klozapiny leków przeciwpsychotycznych (risperidon, aripiprazol, amisulpryd, sertindol, ziprazydon), leków przeciwdepresyjnych, wielonienasyconych kwasów tłuszczowych omega-3 lub lamotryginy [13].
Poprawę wyników leczenia może przynieść również zastosowanie dodatkowej terapii elektrowstrząsami (electroconvulsive therapy – ECT). Zastosowanie obu metod leczenia jednocześnie (elektrowstrząsy + klozapina) w świetle ostat nich doniesień naukowych staje się coraz bardziej uzasadnione w odniesieniu do lekoopornych postaci schizofrenii [4, 6, 10, 12, 31–33]. Szczególną uwagę zwraca się na możliwość stosowania klozapiny z elektrowstrząsami podtrzymującymi (maintenance electroconvulsive therapy – M-ECT) [14].
W niniejszej pracy przedstawiono przypadek pacjentki ze schizofrenią paranoidalną z opornymi na leczenie imperatywnymi omamami słuchowymi, u której zastosowano z powodzeniem wyżej wymienioną terapię.
Opis przypadku
Pacjentka, 35-letnia, praworęczna, stanu wolnego, urodzona jako trzecie dziecko w rodzinie nieobciążonej pod względem nałogów oraz chorób psychicznych, z wyjątkiem kuzynki ze strony ojca chorującej na schizofrenię. Wywiad okołoporodowy nie wskazywał na ryzyko uszkodzenia ośrodkowego układu nerwowego, rozwój fizyczny i psychiczny w dzieciństwie przebiegał prawidłowo. Pacjentka ukończyła liceum ogólnokształcące, w tym trzecią klasę z nauczaniem indywidualnym. Przystąpiła do egzaminu dojrzałości, który z powodu zaostrzenia choroby miał wynik negatywny. Chora negowała stosowanie używek i alkoholu, nie była karana. Osobowość przedchorobowa nie wskazywała na cechy zaburzeń, kontakt z rówieśnikami przed epizodem psychotycznym określała jako dobry i nieodbiegający od normy, usposobienie żywe, energiczne oraz optymistyczne nastawienie do życia.
Pierwszy epizod zaburzeń psychicznych w 16. roku życia (1999), rozpoznano zaburzenia depresyjne okresu adolescencji. Pacjentkę hospitalizowano wówczas w klinice psychiatrii dzieci i młodzieży z powodu obniżonego nastroju, urojeń autowanitatywnych oraz prób samobójczych. Po zastosowanym leczeniu fluwoksaminą uzyskano znaczącą poprawę funkcjonowania. Po raz drugi hospitalizowana w wieku 17 lat z powodu nasilonych omamów słuchowych o charakterze głosów imperatywnych, namawiających pacjentkę do samookaleczania się i popełnienia samobójstwa, z towarzyszącymi urojeniami ksobnymi i odnoszącymi prowadzącymi do ograniczenia zainteresowań oraz wycofania się z aktywności społecznej. Ustalono wówczas rozpoznanie schizofrenii paranoidalnej. Zastosowane leczenie przeciwpsychotyczne doprowadziło do względnej remisji objawowej oraz poprawy funkcjonowania. W latach 2000–2005 pacjentka była hospitalizowana jeszcze 11-krotnie w podobnym obrazie psychopatologicznym. Uzyskiwana była tylko częściowa poprawa, mimo intensywnej farmakoterapii, w której stosowano m.in. kwetiapinę do 800 mg, flupentiksol do 18 mg, olanzapinę do 60 mg, amisulpryd do 400 mg, sulpiryd do 300 mg, risperidon do 6 mg, dekanonian haloperydolu w dawce 150 mg co 2 tygodnie. W 2001 roku po raz pierwszy zastosowano klozapinę do dawki 900 mg/dobę. Wymienione leki stosowane były również w politerapii. Poza lekami przeciwpsychotycznymi stosowano także leki przeciwdepresyjne z grupy selektywnych inhibitorów zwrotnego wychwytu serotoniny (selective serotonin reuptake inhibitor – SSRI) oraz trójpierścieniowe, a także sole litu.
W 2004 roku po raz pierwszy zastosowano terapię ECT. Wykonano wówczas 16 zabiegów elektrowstrząsowych z dobrym efektem klinicznym (ustąpienie doznań psychotycznych), po których rozpoczęto zabiegi podtrzymujące co 3 tygodnie. Od grudnia 2005 do października 2006 roku wykonano łącznie 9 zabiegów przypominających, w tym czasie wystąpiły dwa zaostrzenia choroby wymagające wykonania kolejnej serii 10 zabiegów elektrowstrząsowych. W efekcie, w roku 2006 istotnemu zmniejszeniu uległa liczba dni hospitalizacji pacjentki, w porównaniu z latami, podczas których nie stosowano sejsmoterapii (tab. 1). W październiku 2006 roku odstąpiono od zabiegów ze względu na wystąpienie napadów padaczkowych (udział zastosowanych leków w wywołaniu wyżej wspomnianego ataku nie jest wykluczony). Konieczne było zastosowanie kwasu walproinowego.
W latach 2006–2011 pacjentka była hospitalizowana 11 razy. Stosowano m.in. następujące schematy leczenia (dawki dobowe): klozapina 400 mg, kwetiapina IR 800 mg, citalopram 20 mg; ziprazydon 160 mg, klozapina 200 mg, perfenazyna 100 mg co 2 tygodnie; ziprazydon 160 mg, klozapina 300 mg, chlorpromazyna 300 mg; klozapina 400 mg, risperidon LAI 50 mg co 2 tygodnie; klozapina 400 mg, sertindol 12 mg, risperidon LAI 50 mg co 2 tygodnie. Mimo stosowanych leków, uzyskiwano tylko krótkie okresy remisji oraz słabe funkcjonowanie społeczne pacjentki, w konsekwencji dochodziło do przewlekłych hospitalizacji do 180 dni w roku (tab. 1).
111
W styczniu 2012 roku po raz kolejny zastosowano sejsmoterapię – wykonano 10 zabiegów, i włączono klozapinę w dawce 200 mg/dobę. Ze względu na pogorszenie stanu psychicznego, w sierpniu 2012 i lipcu 2013 roku konieczne było ponowne wykonanie serii zabiegów. Nie obserwowano napadów padaczkowych, mimo że nie stosowano już leków przeciwpadaczkowych. Od sierpnia 2013 roku rozpoczęto zabiegi przypominające z częstością początkowo co 2, następnie co 3 i 4 tygodnie aż do stycznia 2014 roku. Wówczas nastąpiło zaostrzenie. Po serii zabiegów elektrowstrząsowych uzyskano poprawę. Odstąpiono od kontynuacji zabiegów podtrzymujących, a do farmakoterapii (klozapina 500 mg, haloperidol 13 mg, escitalopram 10 mg) dołączono 200 mg lamotryginy. Po 6-miesięcznym okresie remisji nastąpił nawrót objawów psychotycznych. Wykonano kolejną serię zabiegów, po czym w grudniu 2014 roku włączono ponownie podtrzymujące zabiegi elektrowstrząsowe. Zabiegi wykonywane były z częstością co 2–4 tygodnie. Podczas wydłużania odstępów między kolejnymi elektrowstrząsami podtrzymującymi do 4 tygodni obserwowano nawroty objawów psychotycznych opornych na korekty farmakoterapii. Poprawę uzyskiwano, skracając odstępy między zabiegami do 3 tygodni. Od czasu zastosowania regularnych zabiegów podtrzymujących obserwowano redukcję łącznej liczby dni hospitalizacji pacjentki w ujęciach rocznych, w szczególności tych wynikających z zaostrzeń choroby (tab. 1). Stan psychiczny chorej umożliwił monoterapię klozapiną w dawce 600 mg, co pozwoliło ograniczyć działania niepożądane, które występowały u pacjentki w związku ze stosowaną wcześniej politerapią (m.in. mlekotok, senność, parkinsonizm polekowy).
Obecnie chora dobrze toleruje stosowane leczenie, nie zgłasza istotnych skarg na pogorszenie pamięci. Pacjentka podczas każdej procedury była monitorowana w zapisie elektroencefalograficznym (EEG), nie stwierdzono, żeby napady wywołane zabiegiem elektrowstrząsowym przekraczały 60 s. Ponadto od 2012 roku nie przyjmuje leków przeciwpadaczkowych i nie zaobserwowano do dzisiaj nowych napadów epileptycznych.
Zmniejszyło się, w subiektywnej ocenie pacjentki, nasilenie głosów imperatywnych oraz myśli i zamiarów samobójczych. Uzyskana poprawa pozwala pacjentce na samodzielne wykonywanie podstawowych czynności życiowych, korzystanie z rehabilitacji w warunkach środowiskowego domu samopomocy, dobry kontakt z rodziną, a także realizację zainteresowań (pacjentka z sukcesami uczestniczy w organizowanych lokalnie konkursach muzycznych).
W badaniach psychometrycznych Positive and Negative Syndrome Scale (PANSS) 56 pkt. W badaniu funkcji poznawczych widoczne umiarkowane deficyty w postaci spowolnienia procesu uczenia się, obniżenia pamięci wzrokowej, operacyjnej i fluencji słownej niewpływające znacząco na poziom codziennego funkcjonowania. Mini-Mental State Examination (MMSE) 28 pkt, test rysowania zegara (Clock Drawing Test – CDT) bezbłędny.
Pacjentka od początku choroby do marca 2018 roku została poddana łącznie ponad 150 zabiegom elektrowstrząsowym (w tym M-ECT). Obecnie zabiegi wykonywane są co 3 tygodnie, w znieczuleniu ogólnym (propofol, sukcynylocholina), przy użyciu aparatu Thymatron ECT System IV (dostarczona energia: 432,4 mC, częstotliwość 60 Hz, czas trwania bodźca 7,9 s). Stosowana jest też farmakoterapia klozapiną w dawce 600 mg/dobę.
Komentarz
Opisany przypadek 35-letniej chorej ze schizofrenią paranoidalną spełnia kryteria diagnostyczne rozpoznania lekooporności, niezależnie od rodzaju zastosowanej definicji tego zespołu. Najprostsze definiują TRS jako brak odpowiedzi na optymalne leczenie [15] oraz nieosiągnięcie przedchorobowego poziomu funkcjonowania [16]. U pacjentki nie uzyskano znaczącej poprawy stanu psychicznego po zastosowaniu leczenia skojarzonego dwoma różnymi lekami przeciwpsychotycznymi [17]; brak reakcji na klozapinę, zgodnie z kryteriami zaproponowanymi przez Mouaffaka [18], pozwala na rozpoznanie schizofrenii opornej na leczenie klozapiną (clozapineresistant schizophrenia – CRS), określanej także mianem schizofrenii skrajnie lekoopornej (ultra-resistant schizophrenia – URS). Dla tej postaci choroby jedną z proponowanych strategii terapeutycznych jest zastosowanie ECT. Zgodnie z wytycznymi American Psychiatric Association wskazania do takich zabiegów w schizofrenii obejmują katatonię, pozytywną wcześniejszą historię leczenia zabiegowego oraz niepełną odpowiedź na leczenie farmakologiczne [19], a także stany przebiegające z agresją, autoagresją lub zachowaniami samobójczymi [20]. Dyskusyjną kwestię stanowi dobór schematu leczenia. Standardem jest leczenie podstawowe (acute course of ECT), obejmujące zwykle 12 do 20 zabiegów przez okres 3 do 4 tygodni, jednakże według danych z literatury po 4 miesiącach od ukończenia zabiegów u 45,4 proc. chorych dochodzi do nawrotu objawów, a znacząca poprawa utrzymuje się jedynie u 22,5 proc. [21]. W celu zapobieżenia nawrotom objawów proponuje się stosowanie zabiegów uzupełniających (continuation ECT – C-ECT) w okresie 6 miesięcy od zakończenia leczenia podstawowego lub zabiegów podtrzymujących (M-ECT) powyżej 6 miesięcy [20, 23]. Szczególną skutecznością, według niektórych autorów, cechuje się zastosowanie łączne klozapiny oraz M-ECT, zwłaszcza u chorych z zachowaniami autoagresywnymi zagrażającymi życiu i z przewagą objawów pozytywnych [21, 23, 24].
W schemacie tym kontrowersję budzi czas i częstość stosowania zabiegów podtrzymujących oraz możliwość występowania działań niepożądanych. Proponuje się podejście indywidualne, z zabiegami co tydzień, 2 tygodnie lub raz w miesiącu [25], stosowanymi zazwyczaj przez 6–12 miesięcy [26]; opisano również leczenie trwające 13,5 miesiąca [27], 19 miesięcy [28], a nawet 12 lat [29]. Mimo początkowych obaw co do możliwych działań niepożądanych, dane z literatury potwierdzają wysoki poziom bezpieczeństwa i małe ryzyko wystąpienia lub kumulacji zaburzeń procesów poznawczych podczas stosowania M-ECT [25, 30].
W opisanym przypadku chora spełniała kryteria zastosowania ECT w przebiegu schizofrenii (przewlekłość przebiegu, oporność na leczenie przeciwpsychotyczne, uporczywość zaburzeń spostrzegania z zachowaniami zagrażającymi życiu). Zastosowany schemat terapeutyczny, polegający na połączeniu terapii klozapiną w dawce 600 mg/ dobę z M-ECT stosowanymi co 3 tygodnie przez okres powyżej roku, przyniósł znaczącą poprawę stanu klinicznego z redukcją zaburzeń spostrzegania i wyeliminowaniem zachowań autoagresywnych i suicydalnych; uzyskane wyniki znajdują potwierdzenie w danych z literatury [4, 6, 21]. U chorej nie obserwowano zaburzeń funkcji poznawczych przy zastosowaniu do oceny, zgodnie z sugestią licznych autorów, MMSE [31, 34]. Chora pozostaje nadal w leczeniu, jej obecny stan psychiczny pozwala na funkcjonowanie w środowisku rodzinnym i aktywne uczestniczenie w rehabilitacji w ramach środowiskowego domu samopomocy.
Stosowanie łączonej terapii klozapiną z M-ECT w schizofrenii lekoopornej wydaje się obiecującą perspektywą leczniczą. Z uwagi jednak na nieliczne doniesienia metoda ta wymaga dalszej intensywnej oceny i monitorowania, w szczególności w zakresie stworzenia precyzyjnych schematów terapeutycznych oraz długoterminowej oceny bezpieczeństwa.
Piśmiennictwo:
1. Gelder M, Mayou R, Geddes J. Schizophrenia and Related Disorders. In: Psychiatry, Third Edition. New York:
Oxford University Press Inc.; 2005, p. 119-135.
2. Schneider K. Clinical Psychopathology. New York: Grune & Stratton; 1959.
3. American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition. Arlington; 2013.
4. Yoshino Y, Ozaki Y, Kawasoe K, Niiya T, Sonobe N, et al. Combined clozapine and electroconvulsive therapy in
Japanese schizophrenia patient: a case report. Clin Psychopharmacol Neurosci 2014; 12: 160-162.
5. Saha S, Chant D, Welham J, McGrath J. A systematic review of the prevalence of schizophrenia. PLoS Med 2005;
2: e141.
6. Moeller S, Kalkwarf N, Luecke C, Oritz D, Jahn S, et al. Achieving stable remission with maintenance electroconvulsive therapy in a patient with treatment-resistant schizophrenia. Medicine 2017; 96: 48.
7. Zheng W, Xiang YT, Yang HX, Xiang YQ, de Leon J. Clozapine augmentation with antiepileptic drugs for
treatment-resistant schizophrenia: a meta-analysis of randomized controlled trials. J Clin Psychiatry 2017; 78:
e498-e505.
8. Molins C, Roldan A, Corripio I, Isohanni M, Miettunen J, et al. Response to antipsychotic drugs in treatmentresistant schizophrenia: conclusions based on systematic review. Schizophr Res 2016; 178: 64-67.
9. Suzuki T, Remington G, Mulsant BH, Rajji TK, Uchida H, et al. Treatment-resistant schizophrenia and response
to antipsychotics: a review. Schizophr Res 2011; 133: 54-62.
10. Grover S, Hazari N, Kate N. Combined use of clozapine and ECT: a review. Acta Neuropsychiatrica 2015; 27: 131-142.
11. Meltzer HY. Treatment of neuroleptic-nonresponsive schizophrenic patient. Schizophr Bull 1992; 18: 515-542.
12. Grover S, Subho C, Hazari N, Avasthi A. Effectiveness of electroconvulsive therapy in patients with treatment
resistant schizophrenia: a retrospective study. Psychiatry Res 2017; 249: 349-353.
14. Vayisoğlu S, Yağcioğlu AE. Augmentation strategies in patients with schizophrenia who show partial response
to clozapine treatment. Turk Psikiyatri Derg 2014; 25: 201-211.
15. Ward HB, Szabo ST, Rakesh G. Maintenance ECT in achizophrenia: a systematic review. Psychiatry Res 2018;
264: 131-142.
16. Taylor DM, Duncan-McConnell D. Refractory schizophrenia and atypical antipsychotics. J Psychopharmacol
2000; 14: 409-418.
17. Meltzer HY. Defining treatment refractoriness in schizophrenia. Schizophr Bull 1990; 16: 563-565.
18. Suzuki T, Remington G, Mulsant BH, Uchida H, Rajji TK, et al. Defining treatment-resistant schizophrenia and
response to antipsychotics: a review and recommendation. Psychiatry Res 2012; 197: 1-6.
19. Mouaffak F, Tranulis C, Gourevitch R, Poirier MF, Douki S, et al. Augmentation strategies of clozapine with
antipsychotics in the treatment of ultraresistant schizophrenia. Clin Neuropharmacol 2006; 29: 28-33.
20. APA 2001. The practice of electroconvulsive therapy: recommendations for treatment, training and privileging:
a Task Force Report of the American Psychiatric Association. Washington D.C.: American Psychiatric Association; 2001.
21. Tharyan P, Adams CE. Electroconvulsive therapy for schizophrenia. Cochrane Database Syst Rev 2005; 18:
CD000076.
22. Havaki-Kontaxaki BJ, Ferentinos PP, Kontaxakis VP, Paplos KG, Soldatos CR. Concurrent administration
of clozapine and electroconvulsive therapy in clozapine-resistant schizophrenia. Clin Neuropharmacol 2006;
29: 52-56.
23. Sackeim HA, Haskett RF, Mulsant BH, Thase ME, Mann JJ, et al. Continuation pharmacotherapy in the prevention of relapse following electroconvulsive therapy: a randomized controlled trial. JAMA 2001; 285: 1299-1307.
24. Weiner RD, Reti IM. Key updates in the clinical application of electroconvulsive therapy. Int Rev Psychiatry
2017; 29: 54-62.
25. Braga R, Petrides G, Schooler N, Bailine S, Kane J, Mendelowitz A. Continuation electroconvulsive therapy for
clozapine-resistant schizophrenia. Biological Psychiatry 2017; 81 Suppl: S309.
26. Iancu I, Nimrod P, Orit SL, Pinhas D. Patients with schizophrenia or schizoaffective disorder who receive multiple
electroconvulsive therapy sessions: characteristics, indications, and results. Neuropsychiatr Dis Treat 2015; 11: 853-862.
27. Shelef A, Mazeh D, Berger U, Baruch Y, Barak Y. Acute electroconvulsive therapy followed by maintenance electroconvulsive therapy decreases hospital re-admission rates of older patients with severe mental illness. J ECT
2015; 31: 125-128.
28. Rami L, Barnardo M, Valdes M, Boget T, Portella MJ, et al. Absence of additional cognitive impairment in schizophrenia patients during maintenance electroconvulsive therapy. Schizophr Bull 2004; 30: 185-189.
29. Huuhka K, Viikki M, Tammentie T, Tuohimaa K, Bjorqvist M, et al. One-year follow-up after discontinuing
maintenance electroconvulsive therapy. J ECT 2012; 28: 225-228.
30. Kristensen D, Bauer J, Hageman I, Jorgensen MB. Electroconvulsive therapy for treating schizophrenia: a chart
review of patients from two catchment areas. Eur Arch Psychiatry Clin Neurosci 2011; 261: 425-432.
31. Müller HHO, Reike M, Grosse-Holze S, Röther M, Lücke C, Philipsen A, et al. Electroconvulsive therapy hasn’t
negative effects on short-term memory function, as assessed using a bedside hand-held device. Ment Illn 2017;
9: 7093.
32. Petrides G, Malur C, Braga RJ, Bailine SH, Schooler NR, et al. Electroconvulsive therapy augmentation in clozapine-resistant schizophrenia: a prospective, randomized study. Am J Psychiatry 2014; 26: 13060787.
33. Lally J, Tully J, Robertson D, Stubbs B, Gaughran F, et al. Augmentation of clozapine with electroconvulsive
therapy in treatment resistant schizophrenia: A systematic review and meta-analysis. Schizophrenia Research
2016; 171: 215-224.
34. Howes DO, McCutcheon R, Agid O, de Bartolomeis A, van Beveren NJ, et al. Treatment-Resistant Schizophrenia: Treatment Response and Resistance in Psychosis (TRRIP) Working Group Consensus Guidelines on Diagnosis and Terminology. Am J Psychiatry 2017; 174: 3.
35. Masoudzadeh A, Khalilian AR. Comparative Study of Clozapine, Electroshock and the Combination of ECT
with Clozapine in Treatment-Resistant Schizophrenic Patients. Pakistan Journal of Biological Sciences 2007; 10:
4287-4290.
O najważniejszych kwestiach związanych z polską psychiatrią będzie mowa podczas konferencji "Psychiatria w pytaniach i odpowiedziach". Więcej o wydarzeniu na stronie: www.termedia.pl/Psychiatria-w-pytaniach-i-odpowiedziach.
Przeczytaj także: "Prof. Agata Szulc: Brakuje empatii", "Najbardziej wpływowy polski psychiatra to...", "Prof. Rybakowski zapowiada powstanie centrum zdrowia psychicznego w Poznaniu".
Zachęcamy do polubienia profilu "Menedżera Zdrowia" na Facebooku: www.facebook.com/MenedzerZdrowia i obserwowania kont na Twitterze i LinkedInie: www.twitter.com/MenedzerZdrowia i www.linkedin.com/MenedzerZdrowia.
- Schizofrenia jest przewlekłą chorobą neurorozwojową występującą u około 1 proc. populacji, prowadzącą do znaczących zaburzeń w funkcjonowaniu społecznym i zawodowym [1].
W patogenezie schizofrenii uczestniczą zaburzenia neuroprzekaźnictwa, głównie dopaminergicznego, a sama choroba manifestuje się różnymi objawami klinicznymi, precyzyjnie zdefiniowanymi po raz pierwszy przez Kurta Schneidera [2]. Kryteria diagnostyczne choroby wymagają stwierdzenia obecności omamów słuchowych o charakterze głosów komentujących lub dyskutujących oraz urojeń (dziwacznych, wpływu, nasyłania lub rozgłaśniania myśli) [3].
Leczenie schizofrenii opiera się głównie na stosowaniu leków przeciwpsychotycznych (klasycznych i atypowych), które przy właściwej współpracy terapeutycznej pozwalają na remisję objawów oraz utrzymanie dobrego funkcjonowania społecznego. Nie mniej istotnym problemem, występującym u około 30 proc. chorych, jest lekooporność [4, 5].
Sama definicja lekooporności w schizofrenii (treatment resistant schizophrenia – TRS) jest przedmiotem kontrowersji. Najbardziej rozpowszechniona mówi o braku remisji, nawrotach objawów lub objawach nietolerancji przy stosowaniu dwóch różnych leków przeciwpsychotycznych lub klozapiny w odpowiednich dawkach, przez wystarczająco długi czas (według części autorów minimum 2 lata) [6, 7]. Inne powszechnie akceptowane kryteria TRS zakładają czas trwania choroby powyżej 5 lat z utrzymywaniem się objawów psychotycznych, których nasilenie nie ulega zmniejszeniu mimo regularnego, minimum 2-letniego stosowania adekwatnych dawek dwóch różnych leków przeciwpsychotycznych, ze szczególnym uwzględnieniem braku odpowiedzi na klozapinę [8, 9].
Złotym standardem w terapii TRS jest stosowanie klozapiny, która w porównaniu z innymi lekami wykazuje największy potencjał przeciwpsychotyczny [10]. Jej skuteczność jest jednak ograniczona do 60–70 proc. chorych z rozpoznaniem TRS [11], długotrwałe stosowanie leku w dużych dawkach wiąże się z ryzykiem wystąpienia działań niepożądanych, z najgroźniejszymi, obejmującymi zaburzenia rytmu serca oraz neutropenię lub agranulocytozę [1, 12]. W celu redukcji powyższego ryzyka sugeruje się monitorowanie stężenia leku w surowicy krwi pozwalające na zminimalizowanie ryzyka powikłań przy zakresie terapeutycznym 200–400 ng/ml [11]. W związku z ograniczoną skutecznością klozapiny proponowane są różne terapie augmentacyjne, zakładające dodanie do klozapiny leków przeciwpsychotycznych (risperidon, aripiprazol, amisulpryd, sertindol, ziprazydon), leków przeciwdepresyjnych, wielonienasyconych kwasów tłuszczowych omega-3 lub lamotryginy [13].
Poprawę wyników leczenia może przynieść również zastosowanie dodatkowej terapii elektrowstrząsami (electroconvulsive therapy – ECT). Zastosowanie obu metod leczenia jednocześnie (elektrowstrząsy + klozapina) w świetle ostat nich doniesień naukowych staje się coraz bardziej uzasadnione w odniesieniu do lekoopornych postaci schizofrenii [4, 6, 10, 12, 31–33]. Szczególną uwagę zwraca się na możliwość stosowania klozapiny z elektrowstrząsami podtrzymującymi (maintenance electroconvulsive therapy – M-ECT) [14].
W niniejszej pracy przedstawiono przypadek pacjentki ze schizofrenią paranoidalną z opornymi na leczenie imperatywnymi omamami słuchowymi, u której zastosowano z powodzeniem wyżej wymienioną terapię.
Opis przypadku
Pacjentka, 35-letnia, praworęczna, stanu wolnego, urodzona jako trzecie dziecko w rodzinie nieobciążonej pod względem nałogów oraz chorób psychicznych, z wyjątkiem kuzynki ze strony ojca chorującej na schizofrenię. Wywiad okołoporodowy nie wskazywał na ryzyko uszkodzenia ośrodkowego układu nerwowego, rozwój fizyczny i psychiczny w dzieciństwie przebiegał prawidłowo. Pacjentka ukończyła liceum ogólnokształcące, w tym trzecią klasę z nauczaniem indywidualnym. Przystąpiła do egzaminu dojrzałości, który z powodu zaostrzenia choroby miał wynik negatywny. Chora negowała stosowanie używek i alkoholu, nie była karana. Osobowość przedchorobowa nie wskazywała na cechy zaburzeń, kontakt z rówieśnikami przed epizodem psychotycznym określała jako dobry i nieodbiegający od normy, usposobienie żywe, energiczne oraz optymistyczne nastawienie do życia.
Pierwszy epizod zaburzeń psychicznych w 16. roku życia (1999), rozpoznano zaburzenia depresyjne okresu adolescencji. Pacjentkę hospitalizowano wówczas w klinice psychiatrii dzieci i młodzieży z powodu obniżonego nastroju, urojeń autowanitatywnych oraz prób samobójczych. Po zastosowanym leczeniu fluwoksaminą uzyskano znaczącą poprawę funkcjonowania. Po raz drugi hospitalizowana w wieku 17 lat z powodu nasilonych omamów słuchowych o charakterze głosów imperatywnych, namawiających pacjentkę do samookaleczania się i popełnienia samobójstwa, z towarzyszącymi urojeniami ksobnymi i odnoszącymi prowadzącymi do ograniczenia zainteresowań oraz wycofania się z aktywności społecznej. Ustalono wówczas rozpoznanie schizofrenii paranoidalnej. Zastosowane leczenie przeciwpsychotyczne doprowadziło do względnej remisji objawowej oraz poprawy funkcjonowania. W latach 2000–2005 pacjentka była hospitalizowana jeszcze 11-krotnie w podobnym obrazie psychopatologicznym. Uzyskiwana była tylko częściowa poprawa, mimo intensywnej farmakoterapii, w której stosowano m.in. kwetiapinę do 800 mg, flupentiksol do 18 mg, olanzapinę do 60 mg, amisulpryd do 400 mg, sulpiryd do 300 mg, risperidon do 6 mg, dekanonian haloperydolu w dawce 150 mg co 2 tygodnie. W 2001 roku po raz pierwszy zastosowano klozapinę do dawki 900 mg/dobę. Wymienione leki stosowane były również w politerapii. Poza lekami przeciwpsychotycznymi stosowano także leki przeciwdepresyjne z grupy selektywnych inhibitorów zwrotnego wychwytu serotoniny (selective serotonin reuptake inhibitor – SSRI) oraz trójpierścieniowe, a także sole litu.
W 2004 roku po raz pierwszy zastosowano terapię ECT. Wykonano wówczas 16 zabiegów elektrowstrząsowych z dobrym efektem klinicznym (ustąpienie doznań psychotycznych), po których rozpoczęto zabiegi podtrzymujące co 3 tygodnie. Od grudnia 2005 do października 2006 roku wykonano łącznie 9 zabiegów przypominających, w tym czasie wystąpiły dwa zaostrzenia choroby wymagające wykonania kolejnej serii 10 zabiegów elektrowstrząsowych. W efekcie, w roku 2006 istotnemu zmniejszeniu uległa liczba dni hospitalizacji pacjentki, w porównaniu z latami, podczas których nie stosowano sejsmoterapii (tab. 1). W październiku 2006 roku odstąpiono od zabiegów ze względu na wystąpienie napadów padaczkowych (udział zastosowanych leków w wywołaniu wyżej wspomnianego ataku nie jest wykluczony). Konieczne było zastosowanie kwasu walproinowego.
W latach 2006–2011 pacjentka była hospitalizowana 11 razy. Stosowano m.in. następujące schematy leczenia (dawki dobowe): klozapina 400 mg, kwetiapina IR 800 mg, citalopram 20 mg; ziprazydon 160 mg, klozapina 200 mg, perfenazyna 100 mg co 2 tygodnie; ziprazydon 160 mg, klozapina 300 mg, chlorpromazyna 300 mg; klozapina 400 mg, risperidon LAI 50 mg co 2 tygodnie; klozapina 400 mg, sertindol 12 mg, risperidon LAI 50 mg co 2 tygodnie. Mimo stosowanych leków, uzyskiwano tylko krótkie okresy remisji oraz słabe funkcjonowanie społeczne pacjentki, w konsekwencji dochodziło do przewlekłych hospitalizacji do 180 dni w roku (tab. 1).
111
W styczniu 2012 roku po raz kolejny zastosowano sejsmoterapię – wykonano 10 zabiegów, i włączono klozapinę w dawce 200 mg/dobę. Ze względu na pogorszenie stanu psychicznego, w sierpniu 2012 i lipcu 2013 roku konieczne było ponowne wykonanie serii zabiegów. Nie obserwowano napadów padaczkowych, mimo że nie stosowano już leków przeciwpadaczkowych. Od sierpnia 2013 roku rozpoczęto zabiegi przypominające z częstością początkowo co 2, następnie co 3 i 4 tygodnie aż do stycznia 2014 roku. Wówczas nastąpiło zaostrzenie. Po serii zabiegów elektrowstrząsowych uzyskano poprawę. Odstąpiono od kontynuacji zabiegów podtrzymujących, a do farmakoterapii (klozapina 500 mg, haloperidol 13 mg, escitalopram 10 mg) dołączono 200 mg lamotryginy. Po 6-miesięcznym okresie remisji nastąpił nawrót objawów psychotycznych. Wykonano kolejną serię zabiegów, po czym w grudniu 2014 roku włączono ponownie podtrzymujące zabiegi elektrowstrząsowe. Zabiegi wykonywane były z częstością co 2–4 tygodnie. Podczas wydłużania odstępów między kolejnymi elektrowstrząsami podtrzymującymi do 4 tygodni obserwowano nawroty objawów psychotycznych opornych na korekty farmakoterapii. Poprawę uzyskiwano, skracając odstępy między zabiegami do 3 tygodni. Od czasu zastosowania regularnych zabiegów podtrzymujących obserwowano redukcję łącznej liczby dni hospitalizacji pacjentki w ujęciach rocznych, w szczególności tych wynikających z zaostrzeń choroby (tab. 1). Stan psychiczny chorej umożliwił monoterapię klozapiną w dawce 600 mg, co pozwoliło ograniczyć działania niepożądane, które występowały u pacjentki w związku ze stosowaną wcześniej politerapią (m.in. mlekotok, senność, parkinsonizm polekowy).
Obecnie chora dobrze toleruje stosowane leczenie, nie zgłasza istotnych skarg na pogorszenie pamięci. Pacjentka podczas każdej procedury była monitorowana w zapisie elektroencefalograficznym (EEG), nie stwierdzono, żeby napady wywołane zabiegiem elektrowstrząsowym przekraczały 60 s. Ponadto od 2012 roku nie przyjmuje leków przeciwpadaczkowych i nie zaobserwowano do dzisiaj nowych napadów epileptycznych.
Zmniejszyło się, w subiektywnej ocenie pacjentki, nasilenie głosów imperatywnych oraz myśli i zamiarów samobójczych. Uzyskana poprawa pozwala pacjentce na samodzielne wykonywanie podstawowych czynności życiowych, korzystanie z rehabilitacji w warunkach środowiskowego domu samopomocy, dobry kontakt z rodziną, a także realizację zainteresowań (pacjentka z sukcesami uczestniczy w organizowanych lokalnie konkursach muzycznych).
W badaniach psychometrycznych Positive and Negative Syndrome Scale (PANSS) 56 pkt. W badaniu funkcji poznawczych widoczne umiarkowane deficyty w postaci spowolnienia procesu uczenia się, obniżenia pamięci wzrokowej, operacyjnej i fluencji słownej niewpływające znacząco na poziom codziennego funkcjonowania. Mini-Mental State Examination (MMSE) 28 pkt, test rysowania zegara (Clock Drawing Test – CDT) bezbłędny.
Pacjentka od początku choroby do marca 2018 roku została poddana łącznie ponad 150 zabiegom elektrowstrząsowym (w tym M-ECT). Obecnie zabiegi wykonywane są co 3 tygodnie, w znieczuleniu ogólnym (propofol, sukcynylocholina), przy użyciu aparatu Thymatron ECT System IV (dostarczona energia: 432,4 mC, częstotliwość 60 Hz, czas trwania bodźca 7,9 s). Stosowana jest też farmakoterapia klozapiną w dawce 600 mg/dobę.
Komentarz
Opisany przypadek 35-letniej chorej ze schizofrenią paranoidalną spełnia kryteria diagnostyczne rozpoznania lekooporności, niezależnie od rodzaju zastosowanej definicji tego zespołu. Najprostsze definiują TRS jako brak odpowiedzi na optymalne leczenie [15] oraz nieosiągnięcie przedchorobowego poziomu funkcjonowania [16]. U pacjentki nie uzyskano znaczącej poprawy stanu psychicznego po zastosowaniu leczenia skojarzonego dwoma różnymi lekami przeciwpsychotycznymi [17]; brak reakcji na klozapinę, zgodnie z kryteriami zaproponowanymi przez Mouaffaka [18], pozwala na rozpoznanie schizofrenii opornej na leczenie klozapiną (clozapineresistant schizophrenia – CRS), określanej także mianem schizofrenii skrajnie lekoopornej (ultra-resistant schizophrenia – URS). Dla tej postaci choroby jedną z proponowanych strategii terapeutycznych jest zastosowanie ECT. Zgodnie z wytycznymi American Psychiatric Association wskazania do takich zabiegów w schizofrenii obejmują katatonię, pozytywną wcześniejszą historię leczenia zabiegowego oraz niepełną odpowiedź na leczenie farmakologiczne [19], a także stany przebiegające z agresją, autoagresją lub zachowaniami samobójczymi [20]. Dyskusyjną kwestię stanowi dobór schematu leczenia. Standardem jest leczenie podstawowe (acute course of ECT), obejmujące zwykle 12 do 20 zabiegów przez okres 3 do 4 tygodni, jednakże według danych z literatury po 4 miesiącach od ukończenia zabiegów u 45,4 proc. chorych dochodzi do nawrotu objawów, a znacząca poprawa utrzymuje się jedynie u 22,5 proc. [21]. W celu zapobieżenia nawrotom objawów proponuje się stosowanie zabiegów uzupełniających (continuation ECT – C-ECT) w okresie 6 miesięcy od zakończenia leczenia podstawowego lub zabiegów podtrzymujących (M-ECT) powyżej 6 miesięcy [20, 23]. Szczególną skutecznością, według niektórych autorów, cechuje się zastosowanie łączne klozapiny oraz M-ECT, zwłaszcza u chorych z zachowaniami autoagresywnymi zagrażającymi życiu i z przewagą objawów pozytywnych [21, 23, 24].
W schemacie tym kontrowersję budzi czas i częstość stosowania zabiegów podtrzymujących oraz możliwość występowania działań niepożądanych. Proponuje się podejście indywidualne, z zabiegami co tydzień, 2 tygodnie lub raz w miesiącu [25], stosowanymi zazwyczaj przez 6–12 miesięcy [26]; opisano również leczenie trwające 13,5 miesiąca [27], 19 miesięcy [28], a nawet 12 lat [29]. Mimo początkowych obaw co do możliwych działań niepożądanych, dane z literatury potwierdzają wysoki poziom bezpieczeństwa i małe ryzyko wystąpienia lub kumulacji zaburzeń procesów poznawczych podczas stosowania M-ECT [25, 30].
W opisanym przypadku chora spełniała kryteria zastosowania ECT w przebiegu schizofrenii (przewlekłość przebiegu, oporność na leczenie przeciwpsychotyczne, uporczywość zaburzeń spostrzegania z zachowaniami zagrażającymi życiu). Zastosowany schemat terapeutyczny, polegający na połączeniu terapii klozapiną w dawce 600 mg/ dobę z M-ECT stosowanymi co 3 tygodnie przez okres powyżej roku, przyniósł znaczącą poprawę stanu klinicznego z redukcją zaburzeń spostrzegania i wyeliminowaniem zachowań autoagresywnych i suicydalnych; uzyskane wyniki znajdują potwierdzenie w danych z literatury [4, 6, 21]. U chorej nie obserwowano zaburzeń funkcji poznawczych przy zastosowaniu do oceny, zgodnie z sugestią licznych autorów, MMSE [31, 34]. Chora pozostaje nadal w leczeniu, jej obecny stan psychiczny pozwala na funkcjonowanie w środowisku rodzinnym i aktywne uczestniczenie w rehabilitacji w ramach środowiskowego domu samopomocy.
Stosowanie łączonej terapii klozapiną z M-ECT w schizofrenii lekoopornej wydaje się obiecującą perspektywą leczniczą. Z uwagi jednak na nieliczne doniesienia metoda ta wymaga dalszej intensywnej oceny i monitorowania, w szczególności w zakresie stworzenia precyzyjnych schematów terapeutycznych oraz długoterminowej oceny bezpieczeństwa.
Piśmiennictwo:
1. Gelder M, Mayou R, Geddes J. Schizophrenia and Related Disorders. In: Psychiatry, Third Edition. New York:
Oxford University Press Inc.; 2005, p. 119-135.
2. Schneider K. Clinical Psychopathology. New York: Grune & Stratton; 1959.
3. American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition. Arlington; 2013.
4. Yoshino Y, Ozaki Y, Kawasoe K, Niiya T, Sonobe N, et al. Combined clozapine and electroconvulsive therapy in
Japanese schizophrenia patient: a case report. Clin Psychopharmacol Neurosci 2014; 12: 160-162.
5. Saha S, Chant D, Welham J, McGrath J. A systematic review of the prevalence of schizophrenia. PLoS Med 2005;
2: e141.
6. Moeller S, Kalkwarf N, Luecke C, Oritz D, Jahn S, et al. Achieving stable remission with maintenance electroconvulsive therapy in a patient with treatment-resistant schizophrenia. Medicine 2017; 96: 48.
7. Zheng W, Xiang YT, Yang HX, Xiang YQ, de Leon J. Clozapine augmentation with antiepileptic drugs for
treatment-resistant schizophrenia: a meta-analysis of randomized controlled trials. J Clin Psychiatry 2017; 78:
e498-e505.
8. Molins C, Roldan A, Corripio I, Isohanni M, Miettunen J, et al. Response to antipsychotic drugs in treatmentresistant schizophrenia: conclusions based on systematic review. Schizophr Res 2016; 178: 64-67.
9. Suzuki T, Remington G, Mulsant BH, Rajji TK, Uchida H, et al. Treatment-resistant schizophrenia and response
to antipsychotics: a review. Schizophr Res 2011; 133: 54-62.
10. Grover S, Hazari N, Kate N. Combined use of clozapine and ECT: a review. Acta Neuropsychiatrica 2015; 27: 131-142.
11. Meltzer HY. Treatment of neuroleptic-nonresponsive schizophrenic patient. Schizophr Bull 1992; 18: 515-542.
12. Grover S, Subho C, Hazari N, Avasthi A. Effectiveness of electroconvulsive therapy in patients with treatment
resistant schizophrenia: a retrospective study. Psychiatry Res 2017; 249: 349-353.
14. Vayisoğlu S, Yağcioğlu AE. Augmentation strategies in patients with schizophrenia who show partial response
to clozapine treatment. Turk Psikiyatri Derg 2014; 25: 201-211.
15. Ward HB, Szabo ST, Rakesh G. Maintenance ECT in achizophrenia: a systematic review. Psychiatry Res 2018;
264: 131-142.
16. Taylor DM, Duncan-McConnell D. Refractory schizophrenia and atypical antipsychotics. J Psychopharmacol
2000; 14: 409-418.
17. Meltzer HY. Defining treatment refractoriness in schizophrenia. Schizophr Bull 1990; 16: 563-565.
18. Suzuki T, Remington G, Mulsant BH, Uchida H, Rajji TK, et al. Defining treatment-resistant schizophrenia and
response to antipsychotics: a review and recommendation. Psychiatry Res 2012; 197: 1-6.
19. Mouaffak F, Tranulis C, Gourevitch R, Poirier MF, Douki S, et al. Augmentation strategies of clozapine with
antipsychotics in the treatment of ultraresistant schizophrenia. Clin Neuropharmacol 2006; 29: 28-33.
20. APA 2001. The practice of electroconvulsive therapy: recommendations for treatment, training and privileging:
a Task Force Report of the American Psychiatric Association. Washington D.C.: American Psychiatric Association; 2001.
21. Tharyan P, Adams CE. Electroconvulsive therapy for schizophrenia. Cochrane Database Syst Rev 2005; 18:
CD000076.
22. Havaki-Kontaxaki BJ, Ferentinos PP, Kontaxakis VP, Paplos KG, Soldatos CR. Concurrent administration
of clozapine and electroconvulsive therapy in clozapine-resistant schizophrenia. Clin Neuropharmacol 2006;
29: 52-56.
23. Sackeim HA, Haskett RF, Mulsant BH, Thase ME, Mann JJ, et al. Continuation pharmacotherapy in the prevention of relapse following electroconvulsive therapy: a randomized controlled trial. JAMA 2001; 285: 1299-1307.
24. Weiner RD, Reti IM. Key updates in the clinical application of electroconvulsive therapy. Int Rev Psychiatry
2017; 29: 54-62.
25. Braga R, Petrides G, Schooler N, Bailine S, Kane J, Mendelowitz A. Continuation electroconvulsive therapy for
clozapine-resistant schizophrenia. Biological Psychiatry 2017; 81 Suppl: S309.
26. Iancu I, Nimrod P, Orit SL, Pinhas D. Patients with schizophrenia or schizoaffective disorder who receive multiple
electroconvulsive therapy sessions: characteristics, indications, and results. Neuropsychiatr Dis Treat 2015; 11: 853-862.
27. Shelef A, Mazeh D, Berger U, Baruch Y, Barak Y. Acute electroconvulsive therapy followed by maintenance electroconvulsive therapy decreases hospital re-admission rates of older patients with severe mental illness. J ECT
2015; 31: 125-128.
28. Rami L, Barnardo M, Valdes M, Boget T, Portella MJ, et al. Absence of additional cognitive impairment in schizophrenia patients during maintenance electroconvulsive therapy. Schizophr Bull 2004; 30: 185-189.
29. Huuhka K, Viikki M, Tammentie T, Tuohimaa K, Bjorqvist M, et al. One-year follow-up after discontinuing
maintenance electroconvulsive therapy. J ECT 2012; 28: 225-228.
30. Kristensen D, Bauer J, Hageman I, Jorgensen MB. Electroconvulsive therapy for treating schizophrenia: a chart
review of patients from two catchment areas. Eur Arch Psychiatry Clin Neurosci 2011; 261: 425-432.
31. Müller HHO, Reike M, Grosse-Holze S, Röther M, Lücke C, Philipsen A, et al. Electroconvulsive therapy hasn’t
negative effects on short-term memory function, as assessed using a bedside hand-held device. Ment Illn 2017;
9: 7093.
32. Petrides G, Malur C, Braga RJ, Bailine SH, Schooler NR, et al. Electroconvulsive therapy augmentation in clozapine-resistant schizophrenia: a prospective, randomized study. Am J Psychiatry 2014; 26: 13060787.
33. Lally J, Tully J, Robertson D, Stubbs B, Gaughran F, et al. Augmentation of clozapine with electroconvulsive
therapy in treatment resistant schizophrenia: A systematic review and meta-analysis. Schizophrenia Research
2016; 171: 215-224.
34. Howes DO, McCutcheon R, Agid O, de Bartolomeis A, van Beveren NJ, et al. Treatment-Resistant Schizophrenia: Treatment Response and Resistance in Psychosis (TRRIP) Working Group Consensus Guidelines on Diagnosis and Terminology. Am J Psychiatry 2017; 174: 3.
35. Masoudzadeh A, Khalilian AR. Comparative Study of Clozapine, Electroshock and the Combination of ECT
with Clozapine in Treatment-Resistant Schizophrenic Patients. Pakistan Journal of Biological Sciences 2007; 10:
4287-4290.
O najważniejszych kwestiach związanych z polską psychiatrią będzie mowa podczas konferencji "Psychiatria w pytaniach i odpowiedziach". Więcej o wydarzeniu na stronie: www.termedia.pl/Psychiatria-w-pytaniach-i-odpowiedziach.
Przeczytaj także: "Prof. Agata Szulc: Brakuje empatii", "Najbardziej wpływowy polski psychiatra to...", "Prof. Rybakowski zapowiada powstanie centrum zdrowia psychicznego w Poznaniu".
Zachęcamy do polubienia profilu "Menedżera Zdrowia" na Facebooku: www.facebook.com/MenedzerZdrowia i obserwowania kont na Twitterze i LinkedInie: www.twitter.com/MenedzerZdrowia i www.linkedin.com/MenedzerZdrowia.
Źródło:
Postępy Psychiatrii i Neurologii/Przemysław Zakowicz, Paweł Wójciak, Sebastian Dziuda, Filip Rybakowski
Postępy Psychiatrii i Neurologii/Przemysław Zakowicz, Paweł Wójciak, Sebastian Dziuda, Filip Rybakowski



















