Antagoniści wapnia w leczeniu nadciśnienia tętniczego – jak zmniejszyć ryzyko działań niepożądanych?
Ponieważ patogeneza tego działania niepożądanego nie jest związana z nadmiarem sodu lub wody w organizmie, zastosowanie leku moczopędnego nie zmniejsza obrzęku.
Nadciśnienie tętnicze (NT) to często spotykane schorzenie w codziennej praktyce lekarskiej i jeden z najważniejszych modyfikowalnych czynników ryzyka chorób układu krążenia, a według Światowej Organizacji Zdrowia (World Health Organization – WHO) pierwsza przyczyna przedwczesnych zgonów na świecie. We wszystkich grupach wiekowych, etnicznych, u obu płci wysokość ciśnienia tętniczego wykazuje liniowy związek ze śmiertelnością oraz zapadalnością na choroby układu krążenia (zawał serca, udar, choroba tętnic obwodowych) i niewydolność nerek [1, 2].
Świat cierpi obecnie z powodu pandemii koronawirusa SARS-CoV-2, który wywołuje chorobę zwaną COVID-19. Badaczom udało się ustalić, dla jakich osób SARS-CoV-2 jest szczególnie niebezpieczny. W grupie ryzyka znajdują się przede wszystkim osoby starsze i z obniżoną odpornością, ale na ciężki przebieg COVID-19 są narażeni także pacjenci z cukrzycą, schorzeniami układu oddechowego i chorobami układu krążenia, w tym z NT. Dlatego tak istotna jest skuteczna i bezpieczna terapia hipotensyjna [3, 4]. Podstawowym celem leczenia pacjenta z NT jest zmniejszenie śmiertelności oraz globalnego ryzyka powikłań sercowo-naczyniowych i nerkowych. Skuteczna farmakoterapia hipotensyjna zmniejsza względne ryzyko zgonu (10–15%) i powikłań w układzie sercowo-naczyniowym (20%), zwłaszcza udaru (35%) i niewydolności serca (40%), a także opóźnia progresję choroby nerek. U większości pacjentów z NT obok zmian stylu życia w celu osiągnięcia docelowego ciśnienia tętniczego konieczne jest zastosowanie leczenia farmakologicznego. Aktualne wytyczne Polskiego Towarzystwa Nadciśnienia Tętniczego (PTNT) z 2019 r. w niepowikłanym NT, a także w większości przypadków NT powikłanego lub z chorobami towarzyszącymi (z wyjątkiem kobiet w ciąży) w pierwszym i drugim rzucie rekomendują terapię hipotensyjną z zastosowaniem preparatów z pięciu podstawowych grup leków hipotensyjnych, tzw. leków pierwszego rzutu, w przypadku których udowodniono korzystny wpływ na redukcję śmiertelności sercowo-naczyniowej i/lub ryzyka incydentów sercowo-naczyniowych [1, 2, 7].
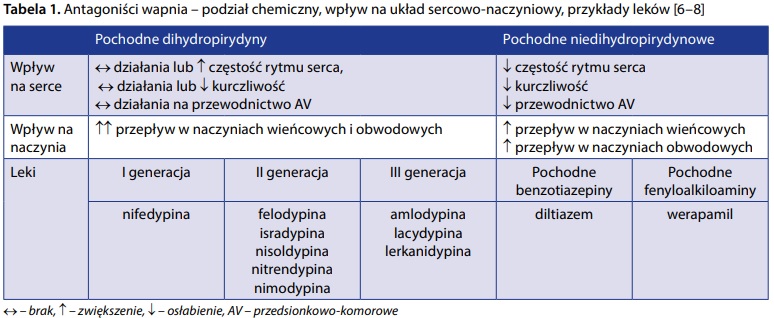
Jedną z nich są antagoniści wapnia – blokery kanału wapniowego (calcium channel blockers – CCB), heterogenna grupa leków, do której należą: pochodne dihydropirydyny, pochodne fenyloalkiloaminy oraz pochodne benzotiazepiny. Wpływ CCB na serce i naczynia zależy od ich budowy chemicznej. Pochodne dihydropirydyny wykazują wybitne powinowactwo do naczyń krwionośnych, pochodne fenyloalkiloaminy wpływają głównie na serce, słabiej na naczynia krwionośne, natomiast działanie pochodnych benzotiazepiny zajmuje miejsce pośrednie. Ten zróżnicowany wpływ na układ sercowo-naczyniowy determinuje wskazania rejestracyjne poszczególnych substancji i odmienne spektrum działań niepożądanych (tab. 1) [6–8].
Podstawowy mechanizm działania tej grupy leków polega na hamowaniu (poprzez wpływ na kanały wapniowe typu L) napływu jonów wapnia do komórek. Wapń wewnątrzkomórkowy umożliwia skurcz mięśni gładkich i jest konieczny do prawidłowej czynności węzła zatokowego i prawidłowego przewodnictwa bodźców w mięśniu sercowym, ponadto napływ wapnia jest niezbędny do sekrecji insuliny przez komórki trzustki. Niższe wewnątrzkomórkowe stężenie jonów wapnia powoduje rozszerzenie naczyń krwionośnych, zmniejszenie obwodowego oporu naczyniowego, a w konsekwencji obniżenie ciśnienia tętniczego. Właściwości farmakodynamiczne tych leków są wykorzystywane poza terapią hipotensyjną w leczeniu wielu chorób układu sercowo-naczyniowego: zaburzeń rytmu serca, choroby niedokrwiennej serca, zespołu Raynauda, zaburzeń krążenia mózgowego i obwodowego, a także w porodzie przedwczesnym [6–10].
Blokery kanału wapniowego III generacji różnią się istotnie od krótko działających pochodnych dihydropirydyny, które gwałtownie obniżając ciśnienie tętnicze, powodują pobudzenie baroreceptorów i odruchowy wzrost napięcia układu współczulnego, co prowadzi do częstoskurczu, nadmiernej kurczliwości mięśnia sercowego, wzrostu długu tlenowego i aktywacji układu renina–angiotensyna–aldosteron. Wśród leków III generacji lerkanidypina działa słabiej inotropowo ujemnie niż inne pochodne dihydropirydyny. Stosowana w dawkach terapeutycznych nie powoduje odruchowej tachykardii ani innych objawów pobudzenia współczulnego u pacjentów z NT. Brak wpływu na czynność serca wiąże się między innymi z brakiem wzrostu stężenia noradrenaliny w trakcie terapii, nawet przy stosowaniu dużych dawek [11, 12]. Leki z grupy dihydropirydynowych antagonistów wapnia wykazują różny wpływ na naczynia kłębuszka nerkowego, dlatego nie wszystkie działają nefroprotekcyjnie. W przeciwieństwie do inhibitorów konwertazy angiotensyny (angiotensin-converting-enzyme inhibitors – ACEI), rozkurczając naczynia doprowadzające krew do kłębuszka nerkowego, mogą zwiększać ciśnienie śródkłębuszkowe oraz białkomocz. Nasilenie białkomoczu podczas stosowania amlodypiny zaobserwowano w badaniu AASK (The African American Study of Kidney Disease and Hypertension) [13]. Równoczesne stosowanie felodypiny i ramiprylu (ACEI) nie zwiększało nefroprotekcyjnego działania inhibitora konwertazy angiotensyny [14].
W porównaniu z tradycyjnymi lekami z grupy CCB unikatowy wpływ na tętniczki kłębuszka nerkowego wykazuje lerkanidypina. Lek ten nie tylko rozszerza tętniczki doprowadzające (podobnie jak np. amlodypina), w których dominują kanały wapniowe typu L, ale również tętniczki odprowadzające, z przewagą kanałów wapniowych typu T, obniżając ciśnienie w kłębuszku nerkowym. Efekt ten prawdopodobnie powoduje zmniejszenie lub ustąpienie białkomoczu i zahamowanie progresji niewydolności nerek. Lerkanidypina w porównaniu z pochodnymi dihydropirydyny (lacydypina, amlodypina) wykazuje najwyższą selektywność w stosunku do kanałów wapniowych typu T (współczynnik selektywności CaT/CaL > 1) [15, 16].
Nefroprotekcyjne działanie lerkanidypiny zostało potwierdzone w badaniach zaplanowanych i przeprowadzonych zgodnie z zasadami evidence-based medicine (tab. 2). Della i wsp. zaobserwowali, że stosowanie lerkanidypiny (10–20 mg/dobę) nie tylko stanowi skuteczną terapię hipotensyjną, lecz także nie pogarsza albuminurii u pacjentów z NT i cukrzycą typu 2 ze współistniejącą mikroalbuminurią [17]. Badanie ZAFRA wykazało silne działanie hipotensyjne lerkanidypiny u pacjentów z przewlekłą chorobą nerek, dobry profil tolerancji oraz poprawę czynności nerek mierzoną klirensem kreatyniny [18]. Badanie Roblesa i wsp. potwierdziło, że leczenie lerkanidypiną daje szansę na poprawę rokowania chorych z cechami uszkodzenia nerek. Odnotowana redukcja białkomoczu była proporcjonalnie większa, niż wynikałoby to z obniżenia ciśnienia tętniczego, a także bardziej zależna od dawki w porównaniu z poprzednimi doniesieniami [19]. Wyniki kolejnego badania Roblesa i wsp. po raz kolejny potwierdziły wyjątkowe nefroprotekcyjne właściwości lerkanidypiny [20], dzięki którym jej stosowanie poprawia rokowanie w bardzo zagrożonej powikłaniami sercowo-naczyniowymi populacji chorych z NT i subklinicznymi powikłaniami narządowymi, takimi jak albuminuria, czy z przewlekłą chorobą nerek. Według rekomendacji PTNT z 2019 r. lerkanidypina jest preferowanym antagonistą wapnia u chorych z NT i albuminurią [2].

Ważną zaletą antagonistów wapnia jest neutralność metaboliczna, która pozwala kojarzyć je z lekami blokującymi układ renina–angiotensyna–aldosteron u chorych ze współistniejącymi zaburzeniami gospodarki lipidowej i/lub węglowodanowej. Skuteczność i bezpieczeństwo długo działających pochodnych dihydropirydyny uzasadnia ich stosowanie u pacjentów w podeszłym wieku, w tym u chorych z izolowanym NT skurczowym, a także z NT oraz towarzyszącą przewlekłą obturacyjną chorobą płuc i astmą oskrzelową [2, 6]. Stosowanie tej grupy leków może jednak spowodować wystąpienie działań niepożądanych, co ogranicza ich wykorzystanie w farmakoterapii hipotensyjnej. Preparaty krótko działające charakteryzują się licznymi i groźnymi działaniami niepożądanymi w zakresie układu sercowo-naczyniowego (np. stosowanie nifedypiny zwiększa częstość zawałów serca) [21]. Preparaty długo działające uważa się za względnie bezpieczne, a ich efekty niepożądane zwykle ograniczają się do obrzęków, bólów głowy czy zaparć [6]. Inotropowo ujemne działanie pochodnych niedihydropirydynowych (werapamil, diltiazem) może być szkodliwe u pacjentów z niewydolnością serca lub obniżoną frakcją wyrzutową lewej komory [6].
Obrzęki (łac. oedema) powstają w wyniku gromadzenia płynu w przestrzeni pozakomórkowej i pozanaczyniowej tkanek i narządów. Objętość płynu pomiędzy przestrzenią śródmiąższową a wewnątrznaczyniową jest zależna od ciśnienia hydrostatycznego i onkotycznego. Zaburzenia skutkujące zwiększeniem ciśnienia hydrostatycznego w naczyniach włosowatych, obniżeniem ciśnienia onkotycznego osocza (hipoalbuminemia), zwiększeniem objętości osocza, zwiększeniem przepuszczalności naczyń włosowatych czy niedrożnością układu chłonnego będą prowadziły do gromadzenia się płynu i obrzęków [22]. Ze względu na umiejscowienie obrzęki można podzielić na miejscowe oraz uogólnione [23]. Dihydropirydynowe blokery kanałów wapniowych stanowią drugą co do częstości występowania (po hydralazynie i minoksydylu) przyczynę polekowych obrzęków u pacjentów przyjmujących leki hipotensyjne [24]. W tabeli 3 zestawiono aktualne badania kliniczne, w których analizowano obrzęki jako działanie niepożądane antagonistów kanałów wapniowych [25–32]. Stwierdzono, że jest ono zależne od dawki, a częstość jego występowania waha się od 5% do nawet 70% u pacjentów leczonych wysokimi dawkami. Obrzęki mogą się pojawić nawet do 6 miesięcy od rozpoczęcia leczenia [25]. Wielokrotnie wykazano, że ryzyko wystąpienia obrzęków obwodowych można zmniejszyć, stosując lipofilne blokery kanałów wapniowych [25, 29–32]. Już w 2002 r. Leonetti i wsp. zaobserwowali dwukrotnie niższą częstość występowania obrzęków u pacjentów leczonych lerkanidypiną w porównaniu z amlodypiną [29]. Skutkowało to między innymi znacznie rzadszym odstawianiem leku. Podobne wyniki uzyskano w grupie kobiet w wieku pomenopauzalnym z NT – stosowanie lerkanidypiny wiązało się z trzykrotnie zmniejszoną częstością występowania obrzęków [30].

Z kolei w badaniu na grupie 22 nieleczonych wcześniej mężczyzn z NT wykazano, że stosowanie lerkanidypiny powoduje znacznie mniejszy przyrost masy nogi w porównaniu z amlodypiną [31]. Metaanaliza z 2009 r. podsumowująca 8 randomizowanych badań klinicznych nad dihydropirydynowymi blokerami kanałów wapniowych potwierdza mniejszą częstość występowania obrzęków u pacjentów leczonych lerkanidypiną w porównaniu z lekami I generacji oraz mniejsze ryzyko odstawienia leku z uwagi na to działanie niepożądane [32]. Zgodnie z wynikami metaanalizy Makaniego i wsp. obejmującej 106 badań klinicznych na łącznej liczbie 99 769 pacjentów, stosowanie lipofilnych antagonistów kanału wapniowego zmniejsza ryzyko wystąpienia obrzęków o 57% [27]. Niedawno opublikowane badania wykazały, że wpływ na ryzyko wystąpienia obrzęków w trakcie leczenia dihydropirydynowymi blokerami kanałów wapniowych mogą mieć również czynniki genetyczne. Amlodypina jest metabolizowana przy udziale enzymów cytochromu P450, z których najistotniejszą rolę w tym przypadku odgrywają CYP3A4 i CYP3A5. Badacze wykazali, że nosiciele allela kodującego niefunkcjonalny enzym CYP3A5 byli bardziej narażeni na wystąpienie obrzęków podczas leczenia amlodypiną [33]. Warto zaznaczyć, że ryzyko wystąpienia obrzęków w trakcie leczenia amlodypiną jest znacznie mniejsze, jeżeli nie jest ona stosowana w monoterapii, lecz w połączeniu z lekami z grupy ACEI lub sartanów [24].
Pomimo kilku dekad stosowania antagonistów wapnia mechanizm powstawania obrzęków nadal nie jest do końca poznany. Sugeruje się, że polega przede wszystkim na przesunięciu płynu z przestrzeni naczyniowej do tkanki śródmiąższowej. Wazodylatacja naczyń przedwłośniczkowych powoduje odruchowy skurcz naczyń zawłośniczkowch, co prowadzi do wzrostu ciśnienia hydrostatycznego w naczyniach włosowatych i zwiększenia ich przepuszczalności, czego skutkiem jest ucieczka płynu poza naczynie [26, 34]. Ponieważ dihydropirydynowe blokery kanałów wapniowych wywierają znacznie silniejszy wpływ wazodylatacyjny na tętniczki niż pochodne fenyloalkiloaminy (werapamil) czy benzotiazepiny (diltiazem), ryzyko obrzęku jest w ich przypadku znacznie większe w porównaniu z pozostałymi grupami CCB [26]. W razie wystąpienia obrzęków podczas terapii antagonistami wapnia w zależności od sytuacji klinicznej można rozważyć następujące postępowanie: odstawienie leku, redukcję jego dawki, zamianę antagonisty wapnia starszej generacji (np. amlodypina, felodypina, nitrendypina) na lek lipofilny (lacydypina, lerkanidypina) lub włączenie leku hamującego układ renina–angiotensyna–aldosteron (ACEI lub bloker receptora angiotensynowego) [27]. Ponieważ patogeneza tego działania niepożądanego nie jest związana z nadmiarem sodu lub wody w organizmie, zastosowanie leku moczopędnego nie zmniejsza obrzęku [32].
Wyniki dużych badań klinicznych z pochodnymi dihydropirydynowymi wykazujące ich korzystny wpływ na redukcję ryzyka sercowo-naczyniowego potwierdzają rekomendacje tej grupy leków w terapii NT. Poza skutecznością hipotensyjną wskazuje się na ich neutralność metaboliczną oraz dogodne dla pacjenta dawkowanie – raz na dobę. Jednym z działań niepożądanych pochodnych dihydropirydynowych są obrzęki obwodowe (przede wszystkim obrzęki podudzi), które są efektem ich głównego mechanizmu działania – wazodylatacji tętniczek obwodowych. Szczególnie teraz, w dobie pandemii, kiedy preferowane są teleporady i lekarz rzadziej widzi pacjenta, istotne jest rozpoznanie tego objawu jako działania niepożądanego leku, a nie jako symptomu choroby, co może spowodować niewłaściwe postępowanie terapeutyczne, np. nieuzasadnione włączenie diuretyku czy stosowanie preparatów diosminy (reklamowanych jako substancje zmniejszające obrzęki). U pacjentów wymagających terapii pochodną dihydropirydynową alternatywą może być stosowanie lerkanidypiny – leku nowszego, lipofilnego, wykazującego działanie nefroprotekcyjne. Obecnie dużego znaczenia nabiera fakt, że lerkanidypina jest jednym z leków intensywnie badanych pod kątem redukowania aktywności katalitycznej głównej proteazy SARS-CoV-2 [35]. Właściwość ta może sprawić, że znajdzie ona zastosowanie w leczeniu chorych na COVID-19.
Piśmiennictwo
1. https://www.who.int/news-room/fact-sheets/detail/hypertension
2. Zasady postępowania w nadciśnieniu tętniczym Wytyczne PTNT 2019. https://nadcisnienietetnicze.pl/ptnt/wytyczne_ptnt.
3. Tadic M, Cuspidi C, Mancia G i wsp. COVID-19, hypertension and cardiovascular diseases: Should we change the therapy? Pharmacol Res 2020; 158:104906.
4. Schiffrin EL, Flack JM, Ito S i wsp. Hypertension and COVID-19. Am J Hypertens 2020; 33: 373-374.
5. Unger T, Borghi C, Charchar F i wsp. 2020 International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension 2020; 75: 1334-1357.
6. www.urpl.gov.pl
7. https://indeks.mp.pl/leki
8. www.drug.com
9. https://www.webmd.com/heart-disease/guide/heart-disease-calcium-channel-blocker-drugs.
10. McKeever RG, Hamilton RJ. Calcium channel blockers. 2020. W: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021. PMID: 29494080.
11. Grassi G, Seravalle G, Turri C i wsp. Short- versus long-term effects of different dihydropyridines on sympathetic andbaroreflex function in hypertension. Hypertension 2003; 41: 558-562.
12. Melnik MV, Afonicheva II, Beloborodova AV. [The role pleiotropic effects of calcium channel blocker lercanidipine in perioperative therapy of arterial hypertension]. Anesteziol Reanimatol 2016; 61: 395-398.
13. Wright JT, Bakris G, Greene T i wsp. Effect of blood pressure lowering and antihypertensive drug class on progression of hypertensive kidney disease. Results from the AASK trial. JAMA 2002; 288: 2421-2431.
14. Ruggenenti P, Perna A, Loriga G i wsp. Blood-pressure control for renoprotection in patients with non-diabetic chronic renal disease (REIN-2): multicentre, randomised controlled trial. Lancet 2005; 365: 939-946.
15. Burnier M. Renal protection with calcium antagonists: the role of lercanidipine. Curr Med Res Opin 2013; 29: 1727-1735.
16. Cerbai E, Mugelli A. Lercanidipine and T-type calcium current. Eur Rev Med Pharmacol Sci 2018; 22: 4025-4031.
17. Della Vestra M, Pozza G, Mosca A i wsp. Effect of lercanidipine compared with ramipril on albumin excretion rate in hypertensive type 2 diabetic patients with microalbuminuria: DIAL Study (diabete, ipertensione, albuminuria, lercanidipina). Diabetes Nutr Metab 2004; 17: 259-266.
18. Robles NR, Ocon J, Gomez CF i wsp. Lercanidipine in patients with chronic renal failure: the ZAFRA study. Ren Fail 2005; 27: 73-80.
19. Robles NR, Romero B, de Vinuesa EG i wsp. Treatment of proteinuria with lercanidipine associated with renin-angiotensin axis-blocking drugs. Ren Fail 2010; 32: 192-197.
20. Robles NR, Colvo C, Sobrio J i wsp. Lercanidipine valuable effect on urine protein losses: the RED LEVEL study. Curr Med Res Opin 2016; 32: 29-34.
21. Psaty BM, Heckbert SR, Koepsell TD i wsp. The risk of myocardial infarction associated with antihypertensive drugtherapies. JAMA 1995; 274: 620-625.
22. Trayes KP, Studdiford JS, Pickle S, Tully AS. Edema: diagnosis and management. Am Fam Physician 2013; 88: 102-110.
23. Szczeklik W, Kokot F, Strzeszyński Ł. Obrzęki. https://www.mp.pl/interna/chapter/B16.I.1.23. Dostęp: 12.04.2021.
24. de la Sierra A. Mitigation of calcium channel blocker-related oedema in hypertension by antagonists of the renin-angiotensin system. J Hum Hypertens 2009; 23: 503-511.
25. Galappatthy P, Waniganayake YC, Sabeer MI i wsp. Leg edema with (S)-amlodipine vs conventional amlodipine given in triple therapy for hypertension: a randomized double blind controlled clinical trial. BMC Cardiovasc Disord 2016; 16: 168.
26. Khadka S, Joshi R, Shrestha DB, i wsp. Amlodipine-induced pedal edema and its relation to other variables in patients at a Tertiary Level Hospital of Kathmandu, Nepal. J Pharm Technol 2019; 35: 51-55.
27. Makani H, Bangalore S, Romero J i wsp. Peripheral edema associated with calcium channel blockers: incidence and withdrawal rate – a meta-analysis of randomized trials. J Hypertens 2011; 29: 1270-1280.
28. Vukadinović D, Scholz SS, Messerli FH i wsp. Peripheral edema and headache associated with amlodipine treatment: a meta-analysis of randomized, placebo-controlled trials. J Hypertens 2019; 37: 2093-2103.
29. Leonetti G, Magnani B, Pessina AC i wsp.; COHORT Study Group. Tolerability of long-term treatment with lercanidipine versus amlodipine and lacidipine in elderly hypertensives. Am J Hypertens 2002; 15: 932-940.
30. Lund-Johansen P, Stranden E, Helberg S i wsp. Quantification of leg oedema in postmenopausal hypertensive patients treated with lercanidipine or amlodipine. J Hypertens 2003; 21: 1003-1010.
31. Pedrinelli R, Dell’Omo G, Mariani M. Calcium channel blockers, postural vasoconstriction and dependent oedema in essential hypertension. J Hum Hypertens 2001; 15: 455-461.
32. Makarounas-Kirchmann K, Glover-Koudounas S, Ferrari P. Results of a meta-analysis comparing the tolerability of lercanidipine and other dihydropyridine calcium channel blockers. Clin Ther 2009; 31: 1652-1663.
33. Liang H, Zhang X, Ma Z i wsp. Association of CYP3A5 gene polymorphisms and amlodipine-induced peripheral edema in Chinese Han patients with essential hypertension. Pharmgenomics Pers Med 2021; 14: 189-197.
34. Shetty KK, Shetty RK, Naveenchandra G. Calcium channel blockers induced pedal edema; mechanism and treatment options: review. Int J Sci App Res 2015; 2: 27-33.
35. Ghahremanpour MM, Tirado-Rives J, Deshmukh M i wsp. Identification of 14 known drugs as inhibitors of the main protease of SARS-CoV-2. bioRxiv 2020; doi: 10.1101/2020.08.28.271957.
Świat cierpi obecnie z powodu pandemii koronawirusa SARS-CoV-2, który wywołuje chorobę zwaną COVID-19. Badaczom udało się ustalić, dla jakich osób SARS-CoV-2 jest szczególnie niebezpieczny. W grupie ryzyka znajdują się przede wszystkim osoby starsze i z obniżoną odpornością, ale na ciężki przebieg COVID-19 są narażeni także pacjenci z cukrzycą, schorzeniami układu oddechowego i chorobami układu krążenia, w tym z NT. Dlatego tak istotna jest skuteczna i bezpieczna terapia hipotensyjna [3, 4]. Podstawowym celem leczenia pacjenta z NT jest zmniejszenie śmiertelności oraz globalnego ryzyka powikłań sercowo-naczyniowych i nerkowych. Skuteczna farmakoterapia hipotensyjna zmniejsza względne ryzyko zgonu (10–15%) i powikłań w układzie sercowo-naczyniowym (20%), zwłaszcza udaru (35%) i niewydolności serca (40%), a także opóźnia progresję choroby nerek. U większości pacjentów z NT obok zmian stylu życia w celu osiągnięcia docelowego ciśnienia tętniczego konieczne jest zastosowanie leczenia farmakologicznego. Aktualne wytyczne Polskiego Towarzystwa Nadciśnienia Tętniczego (PTNT) z 2019 r. w niepowikłanym NT, a także w większości przypadków NT powikłanego lub z chorobami towarzyszącymi (z wyjątkiem kobiet w ciąży) w pierwszym i drugim rzucie rekomendują terapię hipotensyjną z zastosowaniem preparatów z pięciu podstawowych grup leków hipotensyjnych, tzw. leków pierwszego rzutu, w przypadku których udowodniono korzystny wpływ na redukcję śmiertelności sercowo-naczyniowej i/lub ryzyka incydentów sercowo-naczyniowych [1, 2, 7].
Jedną z nich są antagoniści wapnia – blokery kanału wapniowego (calcium channel blockers – CCB), heterogenna grupa leków, do której należą: pochodne dihydropirydyny, pochodne fenyloalkiloaminy oraz pochodne benzotiazepiny. Wpływ CCB na serce i naczynia zależy od ich budowy chemicznej. Pochodne dihydropirydyny wykazują wybitne powinowactwo do naczyń krwionośnych, pochodne fenyloalkiloaminy wpływają głównie na serce, słabiej na naczynia krwionośne, natomiast działanie pochodnych benzotiazepiny zajmuje miejsce pośrednie. Ten zróżnicowany wpływ na układ sercowo-naczyniowy determinuje wskazania rejestracyjne poszczególnych substancji i odmienne spektrum działań niepożądanych (tab. 1) [6–8].

Podstawowy mechanizm działania tej grupy leków polega na hamowaniu (poprzez wpływ na kanały wapniowe typu L) napływu jonów wapnia do komórek. Wapń wewnątrzkomórkowy umożliwia skurcz mięśni gładkich i jest konieczny do prawidłowej czynności węzła zatokowego i prawidłowego przewodnictwa bodźców w mięśniu sercowym, ponadto napływ wapnia jest niezbędny do sekrecji insuliny przez komórki trzustki. Niższe wewnątrzkomórkowe stężenie jonów wapnia powoduje rozszerzenie naczyń krwionośnych, zmniejszenie obwodowego oporu naczyniowego, a w konsekwencji obniżenie ciśnienia tętniczego. Właściwości farmakodynamiczne tych leków są wykorzystywane poza terapią hipotensyjną w leczeniu wielu chorób układu sercowo-naczyniowego: zaburzeń rytmu serca, choroby niedokrwiennej serca, zespołu Raynauda, zaburzeń krążenia mózgowego i obwodowego, a także w porodzie przedwczesnym [6–10].
Blokery kanału wapniowego III generacji różnią się istotnie od krótko działających pochodnych dihydropirydyny, które gwałtownie obniżając ciśnienie tętnicze, powodują pobudzenie baroreceptorów i odruchowy wzrost napięcia układu współczulnego, co prowadzi do częstoskurczu, nadmiernej kurczliwości mięśnia sercowego, wzrostu długu tlenowego i aktywacji układu renina–angiotensyna–aldosteron. Wśród leków III generacji lerkanidypina działa słabiej inotropowo ujemnie niż inne pochodne dihydropirydyny. Stosowana w dawkach terapeutycznych nie powoduje odruchowej tachykardii ani innych objawów pobudzenia współczulnego u pacjentów z NT. Brak wpływu na czynność serca wiąże się między innymi z brakiem wzrostu stężenia noradrenaliny w trakcie terapii, nawet przy stosowaniu dużych dawek [11, 12]. Leki z grupy dihydropirydynowych antagonistów wapnia wykazują różny wpływ na naczynia kłębuszka nerkowego, dlatego nie wszystkie działają nefroprotekcyjnie. W przeciwieństwie do inhibitorów konwertazy angiotensyny (angiotensin-converting-enzyme inhibitors – ACEI), rozkurczając naczynia doprowadzające krew do kłębuszka nerkowego, mogą zwiększać ciśnienie śródkłębuszkowe oraz białkomocz. Nasilenie białkomoczu podczas stosowania amlodypiny zaobserwowano w badaniu AASK (The African American Study of Kidney Disease and Hypertension) [13]. Równoczesne stosowanie felodypiny i ramiprylu (ACEI) nie zwiększało nefroprotekcyjnego działania inhibitora konwertazy angiotensyny [14].
W porównaniu z tradycyjnymi lekami z grupy CCB unikatowy wpływ na tętniczki kłębuszka nerkowego wykazuje lerkanidypina. Lek ten nie tylko rozszerza tętniczki doprowadzające (podobnie jak np. amlodypina), w których dominują kanały wapniowe typu L, ale również tętniczki odprowadzające, z przewagą kanałów wapniowych typu T, obniżając ciśnienie w kłębuszku nerkowym. Efekt ten prawdopodobnie powoduje zmniejszenie lub ustąpienie białkomoczu i zahamowanie progresji niewydolności nerek. Lerkanidypina w porównaniu z pochodnymi dihydropirydyny (lacydypina, amlodypina) wykazuje najwyższą selektywność w stosunku do kanałów wapniowych typu T (współczynnik selektywności CaT/CaL > 1) [15, 16].
Nefroprotekcyjne działanie lerkanidypiny zostało potwierdzone w badaniach zaplanowanych i przeprowadzonych zgodnie z zasadami evidence-based medicine (tab. 2). Della i wsp. zaobserwowali, że stosowanie lerkanidypiny (10–20 mg/dobę) nie tylko stanowi skuteczną terapię hipotensyjną, lecz także nie pogarsza albuminurii u pacjentów z NT i cukrzycą typu 2 ze współistniejącą mikroalbuminurią [17]. Badanie ZAFRA wykazało silne działanie hipotensyjne lerkanidypiny u pacjentów z przewlekłą chorobą nerek, dobry profil tolerancji oraz poprawę czynności nerek mierzoną klirensem kreatyniny [18]. Badanie Roblesa i wsp. potwierdziło, że leczenie lerkanidypiną daje szansę na poprawę rokowania chorych z cechami uszkodzenia nerek. Odnotowana redukcja białkomoczu była proporcjonalnie większa, niż wynikałoby to z obniżenia ciśnienia tętniczego, a także bardziej zależna od dawki w porównaniu z poprzednimi doniesieniami [19]. Wyniki kolejnego badania Roblesa i wsp. po raz kolejny potwierdziły wyjątkowe nefroprotekcyjne właściwości lerkanidypiny [20], dzięki którym jej stosowanie poprawia rokowanie w bardzo zagrożonej powikłaniami sercowo-naczyniowymi populacji chorych z NT i subklinicznymi powikłaniami narządowymi, takimi jak albuminuria, czy z przewlekłą chorobą nerek. Według rekomendacji PTNT z 2019 r. lerkanidypina jest preferowanym antagonistą wapnia u chorych z NT i albuminurią [2].

Ważną zaletą antagonistów wapnia jest neutralność metaboliczna, która pozwala kojarzyć je z lekami blokującymi układ renina–angiotensyna–aldosteron u chorych ze współistniejącymi zaburzeniami gospodarki lipidowej i/lub węglowodanowej. Skuteczność i bezpieczeństwo długo działających pochodnych dihydropirydyny uzasadnia ich stosowanie u pacjentów w podeszłym wieku, w tym u chorych z izolowanym NT skurczowym, a także z NT oraz towarzyszącą przewlekłą obturacyjną chorobą płuc i astmą oskrzelową [2, 6]. Stosowanie tej grupy leków może jednak spowodować wystąpienie działań niepożądanych, co ogranicza ich wykorzystanie w farmakoterapii hipotensyjnej. Preparaty krótko działające charakteryzują się licznymi i groźnymi działaniami niepożądanymi w zakresie układu sercowo-naczyniowego (np. stosowanie nifedypiny zwiększa częstość zawałów serca) [21]. Preparaty długo działające uważa się za względnie bezpieczne, a ich efekty niepożądane zwykle ograniczają się do obrzęków, bólów głowy czy zaparć [6]. Inotropowo ujemne działanie pochodnych niedihydropirydynowych (werapamil, diltiazem) może być szkodliwe u pacjentów z niewydolnością serca lub obniżoną frakcją wyrzutową lewej komory [6].
Obrzęki (łac. oedema) powstają w wyniku gromadzenia płynu w przestrzeni pozakomórkowej i pozanaczyniowej tkanek i narządów. Objętość płynu pomiędzy przestrzenią śródmiąższową a wewnątrznaczyniową jest zależna od ciśnienia hydrostatycznego i onkotycznego. Zaburzenia skutkujące zwiększeniem ciśnienia hydrostatycznego w naczyniach włosowatych, obniżeniem ciśnienia onkotycznego osocza (hipoalbuminemia), zwiększeniem objętości osocza, zwiększeniem przepuszczalności naczyń włosowatych czy niedrożnością układu chłonnego będą prowadziły do gromadzenia się płynu i obrzęków [22]. Ze względu na umiejscowienie obrzęki można podzielić na miejscowe oraz uogólnione [23]. Dihydropirydynowe blokery kanałów wapniowych stanowią drugą co do częstości występowania (po hydralazynie i minoksydylu) przyczynę polekowych obrzęków u pacjentów przyjmujących leki hipotensyjne [24]. W tabeli 3 zestawiono aktualne badania kliniczne, w których analizowano obrzęki jako działanie niepożądane antagonistów kanałów wapniowych [25–32]. Stwierdzono, że jest ono zależne od dawki, a częstość jego występowania waha się od 5% do nawet 70% u pacjentów leczonych wysokimi dawkami. Obrzęki mogą się pojawić nawet do 6 miesięcy od rozpoczęcia leczenia [25]. Wielokrotnie wykazano, że ryzyko wystąpienia obrzęków obwodowych można zmniejszyć, stosując lipofilne blokery kanałów wapniowych [25, 29–32]. Już w 2002 r. Leonetti i wsp. zaobserwowali dwukrotnie niższą częstość występowania obrzęków u pacjentów leczonych lerkanidypiną w porównaniu z amlodypiną [29]. Skutkowało to między innymi znacznie rzadszym odstawianiem leku. Podobne wyniki uzyskano w grupie kobiet w wieku pomenopauzalnym z NT – stosowanie lerkanidypiny wiązało się z trzykrotnie zmniejszoną częstością występowania obrzęków [30].

Z kolei w badaniu na grupie 22 nieleczonych wcześniej mężczyzn z NT wykazano, że stosowanie lerkanidypiny powoduje znacznie mniejszy przyrost masy nogi w porównaniu z amlodypiną [31]. Metaanaliza z 2009 r. podsumowująca 8 randomizowanych badań klinicznych nad dihydropirydynowymi blokerami kanałów wapniowych potwierdza mniejszą częstość występowania obrzęków u pacjentów leczonych lerkanidypiną w porównaniu z lekami I generacji oraz mniejsze ryzyko odstawienia leku z uwagi na to działanie niepożądane [32]. Zgodnie z wynikami metaanalizy Makaniego i wsp. obejmującej 106 badań klinicznych na łącznej liczbie 99 769 pacjentów, stosowanie lipofilnych antagonistów kanału wapniowego zmniejsza ryzyko wystąpienia obrzęków o 57% [27]. Niedawno opublikowane badania wykazały, że wpływ na ryzyko wystąpienia obrzęków w trakcie leczenia dihydropirydynowymi blokerami kanałów wapniowych mogą mieć również czynniki genetyczne. Amlodypina jest metabolizowana przy udziale enzymów cytochromu P450, z których najistotniejszą rolę w tym przypadku odgrywają CYP3A4 i CYP3A5. Badacze wykazali, że nosiciele allela kodującego niefunkcjonalny enzym CYP3A5 byli bardziej narażeni na wystąpienie obrzęków podczas leczenia amlodypiną [33]. Warto zaznaczyć, że ryzyko wystąpienia obrzęków w trakcie leczenia amlodypiną jest znacznie mniejsze, jeżeli nie jest ona stosowana w monoterapii, lecz w połączeniu z lekami z grupy ACEI lub sartanów [24].
Pomimo kilku dekad stosowania antagonistów wapnia mechanizm powstawania obrzęków nadal nie jest do końca poznany. Sugeruje się, że polega przede wszystkim na przesunięciu płynu z przestrzeni naczyniowej do tkanki śródmiąższowej. Wazodylatacja naczyń przedwłośniczkowych powoduje odruchowy skurcz naczyń zawłośniczkowch, co prowadzi do wzrostu ciśnienia hydrostatycznego w naczyniach włosowatych i zwiększenia ich przepuszczalności, czego skutkiem jest ucieczka płynu poza naczynie [26, 34]. Ponieważ dihydropirydynowe blokery kanałów wapniowych wywierają znacznie silniejszy wpływ wazodylatacyjny na tętniczki niż pochodne fenyloalkiloaminy (werapamil) czy benzotiazepiny (diltiazem), ryzyko obrzęku jest w ich przypadku znacznie większe w porównaniu z pozostałymi grupami CCB [26]. W razie wystąpienia obrzęków podczas terapii antagonistami wapnia w zależności od sytuacji klinicznej można rozważyć następujące postępowanie: odstawienie leku, redukcję jego dawki, zamianę antagonisty wapnia starszej generacji (np. amlodypina, felodypina, nitrendypina) na lek lipofilny (lacydypina, lerkanidypina) lub włączenie leku hamującego układ renina–angiotensyna–aldosteron (ACEI lub bloker receptora angiotensynowego) [27]. Ponieważ patogeneza tego działania niepożądanego nie jest związana z nadmiarem sodu lub wody w organizmie, zastosowanie leku moczopędnego nie zmniejsza obrzęku [32].
Wyniki dużych badań klinicznych z pochodnymi dihydropirydynowymi wykazujące ich korzystny wpływ na redukcję ryzyka sercowo-naczyniowego potwierdzają rekomendacje tej grupy leków w terapii NT. Poza skutecznością hipotensyjną wskazuje się na ich neutralność metaboliczną oraz dogodne dla pacjenta dawkowanie – raz na dobę. Jednym z działań niepożądanych pochodnych dihydropirydynowych są obrzęki obwodowe (przede wszystkim obrzęki podudzi), które są efektem ich głównego mechanizmu działania – wazodylatacji tętniczek obwodowych. Szczególnie teraz, w dobie pandemii, kiedy preferowane są teleporady i lekarz rzadziej widzi pacjenta, istotne jest rozpoznanie tego objawu jako działania niepożądanego leku, a nie jako symptomu choroby, co może spowodować niewłaściwe postępowanie terapeutyczne, np. nieuzasadnione włączenie diuretyku czy stosowanie preparatów diosminy (reklamowanych jako substancje zmniejszające obrzęki). U pacjentów wymagających terapii pochodną dihydropirydynową alternatywą może być stosowanie lerkanidypiny – leku nowszego, lipofilnego, wykazującego działanie nefroprotekcyjne. Obecnie dużego znaczenia nabiera fakt, że lerkanidypina jest jednym z leków intensywnie badanych pod kątem redukowania aktywności katalitycznej głównej proteazy SARS-CoV-2 [35]. Właściwość ta może sprawić, że znajdzie ona zastosowanie w leczeniu chorych na COVID-19.
Piśmiennictwo
1. https://www.who.int/news-room/fact-sheets/detail/hypertension
2. Zasady postępowania w nadciśnieniu tętniczym Wytyczne PTNT 2019. https://nadcisnienietetnicze.pl/ptnt/wytyczne_ptnt.
3. Tadic M, Cuspidi C, Mancia G i wsp. COVID-19, hypertension and cardiovascular diseases: Should we change the therapy? Pharmacol Res 2020; 158:104906.
4. Schiffrin EL, Flack JM, Ito S i wsp. Hypertension and COVID-19. Am J Hypertens 2020; 33: 373-374.
5. Unger T, Borghi C, Charchar F i wsp. 2020 International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension 2020; 75: 1334-1357.
6. www.urpl.gov.pl
7. https://indeks.mp.pl/leki
8. www.drug.com
9. https://www.webmd.com/heart-disease/guide/heart-disease-calcium-channel-blocker-drugs.
10. McKeever RG, Hamilton RJ. Calcium channel blockers. 2020. W: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021. PMID: 29494080.
11. Grassi G, Seravalle G, Turri C i wsp. Short- versus long-term effects of different dihydropyridines on sympathetic andbaroreflex function in hypertension. Hypertension 2003; 41: 558-562.
12. Melnik MV, Afonicheva II, Beloborodova AV. [The role pleiotropic effects of calcium channel blocker lercanidipine in perioperative therapy of arterial hypertension]. Anesteziol Reanimatol 2016; 61: 395-398.
13. Wright JT, Bakris G, Greene T i wsp. Effect of blood pressure lowering and antihypertensive drug class on progression of hypertensive kidney disease. Results from the AASK trial. JAMA 2002; 288: 2421-2431.
14. Ruggenenti P, Perna A, Loriga G i wsp. Blood-pressure control for renoprotection in patients with non-diabetic chronic renal disease (REIN-2): multicentre, randomised controlled trial. Lancet 2005; 365: 939-946.
15. Burnier M. Renal protection with calcium antagonists: the role of lercanidipine. Curr Med Res Opin 2013; 29: 1727-1735.
16. Cerbai E, Mugelli A. Lercanidipine and T-type calcium current. Eur Rev Med Pharmacol Sci 2018; 22: 4025-4031.
17. Della Vestra M, Pozza G, Mosca A i wsp. Effect of lercanidipine compared with ramipril on albumin excretion rate in hypertensive type 2 diabetic patients with microalbuminuria: DIAL Study (diabete, ipertensione, albuminuria, lercanidipina). Diabetes Nutr Metab 2004; 17: 259-266.
18. Robles NR, Ocon J, Gomez CF i wsp. Lercanidipine in patients with chronic renal failure: the ZAFRA study. Ren Fail 2005; 27: 73-80.
19. Robles NR, Romero B, de Vinuesa EG i wsp. Treatment of proteinuria with lercanidipine associated with renin-angiotensin axis-blocking drugs. Ren Fail 2010; 32: 192-197.
20. Robles NR, Colvo C, Sobrio J i wsp. Lercanidipine valuable effect on urine protein losses: the RED LEVEL study. Curr Med Res Opin 2016; 32: 29-34.
21. Psaty BM, Heckbert SR, Koepsell TD i wsp. The risk of myocardial infarction associated with antihypertensive drugtherapies. JAMA 1995; 274: 620-625.
22. Trayes KP, Studdiford JS, Pickle S, Tully AS. Edema: diagnosis and management. Am Fam Physician 2013; 88: 102-110.
23. Szczeklik W, Kokot F, Strzeszyński Ł. Obrzęki. https://www.mp.pl/interna/chapter/B16.I.1.23. Dostęp: 12.04.2021.
24. de la Sierra A. Mitigation of calcium channel blocker-related oedema in hypertension by antagonists of the renin-angiotensin system. J Hum Hypertens 2009; 23: 503-511.
25. Galappatthy P, Waniganayake YC, Sabeer MI i wsp. Leg edema with (S)-amlodipine vs conventional amlodipine given in triple therapy for hypertension: a randomized double blind controlled clinical trial. BMC Cardiovasc Disord 2016; 16: 168.
26. Khadka S, Joshi R, Shrestha DB, i wsp. Amlodipine-induced pedal edema and its relation to other variables in patients at a Tertiary Level Hospital of Kathmandu, Nepal. J Pharm Technol 2019; 35: 51-55.
27. Makani H, Bangalore S, Romero J i wsp. Peripheral edema associated with calcium channel blockers: incidence and withdrawal rate – a meta-analysis of randomized trials. J Hypertens 2011; 29: 1270-1280.
28. Vukadinović D, Scholz SS, Messerli FH i wsp. Peripheral edema and headache associated with amlodipine treatment: a meta-analysis of randomized, placebo-controlled trials. J Hypertens 2019; 37: 2093-2103.
29. Leonetti G, Magnani B, Pessina AC i wsp.; COHORT Study Group. Tolerability of long-term treatment with lercanidipine versus amlodipine and lacidipine in elderly hypertensives. Am J Hypertens 2002; 15: 932-940.
30. Lund-Johansen P, Stranden E, Helberg S i wsp. Quantification of leg oedema in postmenopausal hypertensive patients treated with lercanidipine or amlodipine. J Hypertens 2003; 21: 1003-1010.
31. Pedrinelli R, Dell’Omo G, Mariani M. Calcium channel blockers, postural vasoconstriction and dependent oedema in essential hypertension. J Hum Hypertens 2001; 15: 455-461.
32. Makarounas-Kirchmann K, Glover-Koudounas S, Ferrari P. Results of a meta-analysis comparing the tolerability of lercanidipine and other dihydropyridine calcium channel blockers. Clin Ther 2009; 31: 1652-1663.
33. Liang H, Zhang X, Ma Z i wsp. Association of CYP3A5 gene polymorphisms and amlodipine-induced peripheral edema in Chinese Han patients with essential hypertension. Pharmgenomics Pers Med 2021; 14: 189-197.
34. Shetty KK, Shetty RK, Naveenchandra G. Calcium channel blockers induced pedal edema; mechanism and treatment options: review. Int J Sci App Res 2015; 2: 27-33.
35. Ghahremanpour MM, Tirado-Rives J, Deshmukh M i wsp. Identification of 14 known drugs as inhibitors of the main protease of SARS-CoV-2. bioRxiv 2020; doi: 10.1101/2020.08.28.271957.
Źródło:
Lekarz POZ 2021; 7 (2): 87-93 Autorzy: Katarzyna Korzeniowska,Artur Cieślewicz
Lekarz POZ 2021; 7 (2): 87-93 Autorzy: Katarzyna Korzeniowska,Artur Cieślewicz
