Azytromycyna – cechy, mechanizm i spektrum działania
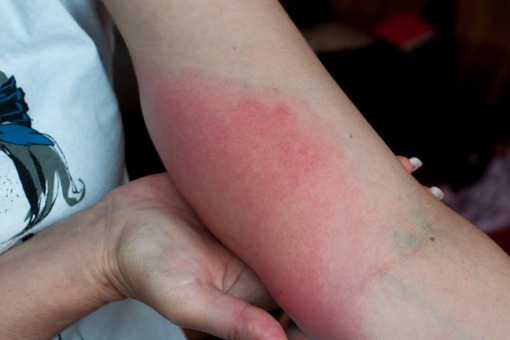
Borelioza jest najczęstszą chorobą odkleszczową w Polsce, a liczba rejestrowanych zachorowań systematycznie wzrasta. Według PTEiLChZ w leczeniu rumienia wędrującego należy zastosować jeden z następujących antybiotyków: doksycyklinę, amoksycylinę, aksetyl cefuroksymu lub azytromycynę. Autorzy artykułu przedstawiają przegląd wytycznych i opis przypadku pacjentki z rumieniem wędrującym skutecznie leczonej azytromycyną.
Autorzy: Marta Kucharska, Krzysztof Simon
Azytromycyna – krótka charakterystyka leku
Mechanizm działania, spektrum przeciwbakteryjne
Azytromycyna jest antybiotykiem azalidowym zaliczanym do makrolidów nowej generacji. W zależności od dawki działa bakteriostatycznie lub bakteriobójczo. Mechanizm jej działania polega na hamowaniu syntezy białka w komórce bakteryjnej, co następuje w wyniku odwracalnego przyłączenia do podjednostki 50S rybosomu. Związanie antybiotyku z rybosomem prowadzi do dysocjacji transportowego RNA (tRNA) i tym samym uniemożliwia wydłużanie łańcucha peptydowego, zaburza syntezę białka, a także hamuje wzrost bakterii.
Spektrum przeciwbakteryjne azytromycyny jest szerokie i obejmuje zarówno bakterie Gram-dodatnie, Gram-ujemne, jak i tak zwane bakterie atypowe. Azytromycyna wykazuje aktywność wobec m.in. bakterii atypowych, takich jak: Mycoplasma pneumoniae, Ureaplasma, Chlamydia, Legionella, ziarenkowców Gram-dodatnich: Streptococcus w tym S. pneumoniae, ziarenkowców Gram-ujemnych: Moraxella, Neisseria gonorrhoeae, pałeczek Gram-ujemnych: Heamophilus influenzae, Bordetella pertussis, krętków: Borrelia burgdorferi, Treponema, mikroaerofilnych bakterii spiralnych: Campylobacter, Helicobacter, maczugowców – Corynebacterium diphteriae, prątków nietypowych: Mycobacterium avium complex intercellulare. Antybiotyk ten wykazuje również umiarkowaną aktywność wobec: Staphylococcus, Listerii, beztlenowych ziarenkowców z rodzaju Peptostreptococcus, Gram-dodatnich laseczek z rodzaju Clostridium.
Farmakokinetyka azytromycyny
Azytromycyna charakteryzuje się unikalnymi właściwościami farmakokinetycznymi – jedną z wartych podkreślenia jest zdolność osiągania dużych stężeń w tkankach, co pozwala na skrócenie terapii do 3–5 dni.
Azytromycyna dobrze wchłania się po przyjęciu doustnym. Wykazano, że jej biodostępność wynosi około 37%, a jej największe stężenie w osoczu osiągane jest po 2–3 godzinach od przyjęcia leku. Jest szeroko rozprowadzana w organizmie i silnie wiązana w tkankach. Antybiotyk ten bardzo szybko przedostaje się z krwi do przedziałów wewnątrzkomórkowych, skąd jest powoli uwalniany. Stężenie azytromycyny w tkankach jest znacznie większe, nawet 50-krotnie, niż w osoczu. Wykazano również, że stężenie antybiotyku w neutrofilach, makrofagach płucnych, tkance migdałków podniebiennych oraz narządach miednicy i narządach płciowych utrzymuje się na podwyższonym poziomie przez dłuższy czas – średni okres biologicznego półtrwania w tkankach wynosi 2–4 dni (ryc. 1.). Właściwość ta pozwala leczyć choroby przenoszone drogą płciową jednorazową dawką azytromycyny, jak również skrócić terapię zakażeń skóry, tkanek miękkich i niektórych zakażeń układu oddechowego do 3–5 dni.
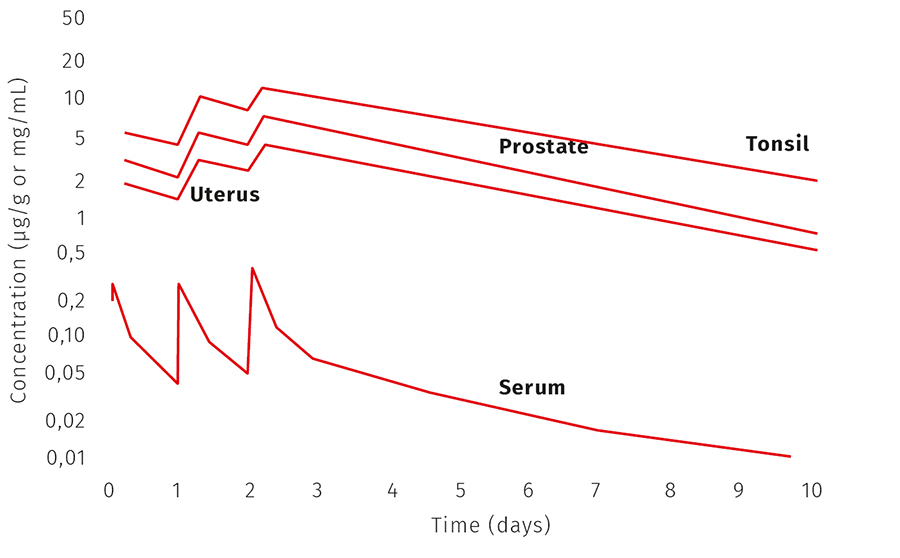
Ryc. 1. Farmakokinetyka azytromycyny w tkankach i surowicy. W badaniu zastosowano azytromycynę w dawce 500 mg podawanej raz dziennie przez 3 dni (reprodukcja na podstawie Foulds i wsp., nr piśm. 10)
W badaniach na zwierzętach wykazano również, że azytromycyna osiąga wysokie stężenie w fagocytach, szczególnie aktywnych, stąd stwierdzano jej wysokie stężenie w ogniskach zapalnych. Większą ekspozycję na lek w zainfekowanej tkance w modelach zwierzęcych ilustruje ryc. 2.
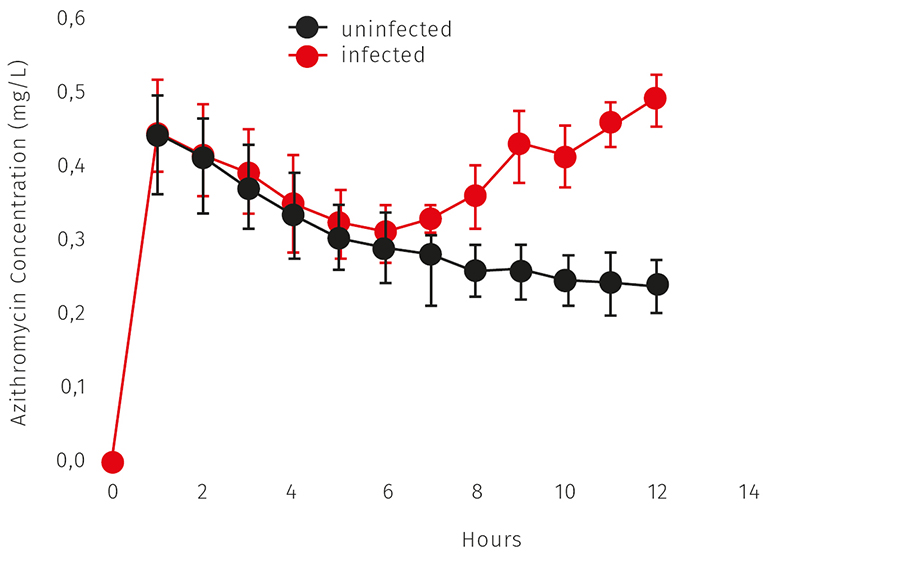
Ryc. 2. Stężenie azytromycyny w tkance niezakażonej i zakażonej (S. aureus) w funkcji czasu – model zwierzęcy powstały w oparciu o infekcję uda szczura (reprodukcja na podstawie Lucini i wsp., nr piśm. 7)
Azytromycyna dobrze przenika do: płynu otrzewnowego, wątroby, żółci, moczu, gruczołu krokowego, wydzieliny drzewa oskrzelowego, opłucnej, płynu stawowego. Choć przenika do ośrodkowego układu nerwowego, to nie osiąga w płynie mózgowo-rdzeniowym stężenia terapeutycznego.
Wiązanie azytromycyny z białkami surowicy jest zmienne, w zależności od stężenia w surowicy i wynosi od 12% przy stężeniu 0,5 µg/ml do 52% przy stężeniu 0,05 µg/ml. Z kolei okres półtrwania w fazie eliminacji z osocza jest ściśle związany z okresem półtrwania w tkankach, wynoszącym od 2 do 4 dni. Azytromycyna wydalana jest głównie z żółcią w postaci niezmienionej oraz w postaci metabolitów, ponadto z moczem w postaci niezmienionej.
W badaniach klinicznych i farmakokinetycznych wykazano, że azytromycyna nie wchodzi w istotne interakcje z takimi lekami, jak: karbamazepina, teofilina, atorwastatyna, midazolam, sildenafil, zydowudyna, cymetydyna, trimetoprim i sulfametoksazol, flukonazol, metyloprednizolon, cetyryzyna, efawirenz. Wykazano natomiast interakcje z lekami, takimi jak: digoksyna, kolchicyna, alkaloidy sporyszu, hydroksychlorochina, cyklosporyna. Choć wchłanianie azytromycyny nie zmienia się istotnie pod wpływem przyjmowanych równocześnie leków zmniejszających kwaśność soku żołądkowego, zaleca się stosowanie azytromycyny co najmniej jedną godzinę przed lub dwie godziny po zastosowaniu leków zobojętniających sok żołądkowy. U pacjentów stosujących doustne leki przeciwzakrzepowe z grupy pochodnych kumaryny należy zwrócić uwagę na właściwą częstość kontrolnych oznaczeń czasu protrombinowego podczas terapii azytromycyną ze względu na większą skłonność do krwawień. Należy również pamiętać, żeby zachować ostrożność podczas stosowania azytromycyny u pacjentów z wydłużonym odstępem QT oraz u przyjmujących produkty lecznicze, o których wiadomo, że wydłużają odstęp QT, ze względu na ryzyko wywołania zaburzeń rytmu serca, w tym torsade de pointes.
Wskazania do stosowania azytromycyny
Azytromycyna jest powszechnie stosowanym antybiotykiem, często jako alternatywa dla beta-laktamów (w przypadku alergii na beta-laktamy makrolidy uznawane są w wielu rekomendacjach za leki I rzutu) lub w skojarzeniu z beta-laktamami w leczeniu pozaszpitalnych zapaleń płuc. Biorąc pod uwagę szerokie spektrum przeciwbakteryjne i dystrybucję w tkankach, antybiotyk ten jest rekomendowany w leczeniu przede wszystkim zakażeń górnych i dolnych dróg oddechowych, w ostrym zapaleniu ucha środkowego, w zakażeniu skóry i tkanek miękkich o nasileniu niewielkim do umiarkowanego (np. w róży, liszajcu, ropnym zapaleniu skóry, rumieniu wędrującym, trądziku pospolitym) oraz w chorobach przenoszonych drogą płciową, np. w niepowikłanych zakażeniach wywołanych przez Chlamydia trachomatis. Miejscowo lek ten jest stosowany w zapaleniu spojówek. Wskazania do jego stosowania przedstawiono w tabeli 1.

Tab. 1. Wskazania do zastosowania azytromycyny (zgodnie z ChPL (nr piśm. 12)
W większości wskazań klinicznych dla pacjentów dorosłych i dzieci o masie > 45 kg całkowita dawka azytromycyny wynosi 1500 mg i może zostać podana w schemacie 3- lub 5-dniowym (patrz: tabela poniżej).
U dzieci i młodzieży o masie ciała < 45 kg dawką zazwyczaj zalecaną jest 10 mg/kg na dobę, podawane w pojedynczej dawce raz na dobę przez 3 kolejne dni (dawka maksymalna wynosi 30 mg/kg). Alternatywnie tę samą dawkę całkowitą można podać przez 5 kolejnych dni: 10 mg/kg m.c. pierwszego dnia, a następnie 5 mg/kg m.c. na dobę przez pozostałe cztery dni. Maksymalna dawka całkowita u dzieci wynosi 1500 mg.
Przykłady dawkowania leku w wybranych jednostkach chorobowych przedstawiono w tabeli 2.

Tab. 2. Dawkowanie azytromycyny w wybranych sytuacjach klinicznych dla pacjentów dorosłych i dzieci > 45 kg mc.
Do najczęstszych działań niepożądanych azytromycyny po podaniu doustnych należą: zaburzenia żołądkowo-jelitowe (np. nudności, biegunka, ból brzucha), reakcje nadwrażliwości (np. osutka, reakcja nadwrażliwości na światło), zawroty i bóle głowy, rzadko cholestatyczne zapalenie wątroby.
Azytromycyna a leczenie rumienia wędrującego
Choroba z Lyme – krótkie przedstawienie problemu
Borelioza (choroba z Lyme) jest chorobą wielonarządową coraz powszechniej występującą na świecie. Obserwuje się ją w Europie, Ameryce Północnej i Azji, a badania pokazują, że jej zasięg rośnie, co ma między innymi związek ze zmianami klimatu, w tym z globalnym ociepleniem. Czynnikiem etiologicznym są krętki z grupy Borrelia burgdorferi sensu lato (w Polsce są to gatunki B. burgdorferi, B. garinii i B. afzelii, rzadziej B. spielmanii). Wektorem choroby są kleszcze – w Polsce należące do rodzaju Ixodes (zwykle I. ricinus – kleszcz pospolity, rzadziej I. persulcatus – kleszcz tajgowy).
Pierwszą i często jedyną manifestacją choroby z Lyme jest rumień wędrujący (łac. erythema migrans – EM). Jest to zmiana skórna pojawiająca się we wczesnym stadium choroby, zwykle w 3.–5. dniu, w miejscu pokłucia przez kleszcza, o wielkości większej niż 5 cm z przejaśnieniem w miejscu ukłucia i z tendencją do rozprzestrzeniania się. Jest to objaw patognomoniczny choroby z Lyme – to znaczy na tyle charakterystyczny, że jego wystąpienie upoważnia do postawienia diagnozy i wdrożenia leczenia. Rumieniowi mogą towarzyszyć objawy ogólne, takie jak: gorączka, złe samopoczucie, zmęczenie, ból głowy, bóle stawów i mięśni. Leczenie pacjenta na tym etapie choroby jest istotne, by nie dopuścić do rozwoju dużo poważniejszych powikłań. W wyniku rozsiewu krętków w organizmie może, choć nie musi, dojść do zajęcia odległych układów/narządów, a powikłania związane z boreliozą mogą osiągnąć nasilenie od łagodnych po ciężkie, choć zasadniczo nie prowadzą do zgonu. Dotyczą one zwykle skóry, stawów, serca, układu nerwowego i występują średnio u kilku/kilkunastu procent pacjentów (zapalenie stawów w Europie obserwowano u 3–7% pacjentów, podczas gdy w Stanach Zjednoczonych do 30%).
Szacuje się, że w Polsce około 10–12% zdrowej populacji ma dodatnie wyniki badań serologicznych w kierunku zakażenia B. burdorferi sensu lato, choć biorąc pod uwagę fakt, że wyniki te zostały opublikowane kilkanaście lat temu, a od lat obserwuje się rosnącą zapadalność na boreliozę, wskaźniki te mogą być wyższe. Z drugiej strony należy podkreślić, że obecność przeciwciał nie jest tożsama z diagnozą choroby, która powinna opierać się zarówno na wynikach badań, jak i obecności charakterystycznych objawów (z wyjątkiem rumienia wędrującego, gdzie nie ma konieczności wykonywania badań serologicznych, co nierzadko opóźnia wdrożenie właściwego leczenia). Wdrażanie antybiotykoterapii „na wyniki” i przy braku typowych objawów choroby jest wbrew rekomendacjom i może okazać się szkodliwe dla pacjenta. Leczenie nigdy nie wyeliminuje przeciwciał przeciwko krętkom Borrelia – są one naturalną, prawidłową odpowiedzią humoralną na większość patogenów. Niestety nieprawidłowe interpretowanie wyników badań serologicznych, jak również pewna „moda” na boreliozę i wielość nieprawidłowych informacji krążących w internecie i mediach przyczyniają się do nadużywania antybiotyków i poszukiwania przez pacjentów innych, nierekomendowanych i nierzadko szkodliwych terapii.
Rosnąca zapadalność na boreliozę powoduje zwiększenie liczby zgłoszeń pacjentów zarówno z objawami choroby, jak i z samymi dodatnimi wynikami badań serologicznych do lekarzy różnych specjalności, szczególnie: rodzinnych, internistów, pediatrów, dermatologów. Stąd tak ważne jest przekazywanie aktualnej wiedzy medycznej dotyczącej standardów postępowania i leczenia oraz edukowanie pacjentów, zarówno z zakresu chorób odkleszczowych, jak i zagrożeń wynikających z nieprawidłowego, długotrwałego leczenia.
Epidemiologia
Zapadalność na boreliozę na terenach endemicznych jest wysoka i – jak pokazują badania – w ostatnich latach nadal rośnie. Według CDC (Centers for Disease Control and Prevention, Ośrodki Kontroli i Prewencji Chorób) liczba przypadków tej choroby wzrosła z 10 000 w 1991 r. do > 25 000 w roku 2014. Jest to obecnie najczęściej występująca choroba przenoszona przez wektory w Ameryce Północnej, gdzie stanowi istotny problem szczególnie w północno-wschodnich stanach USA. Również w Europie borelioza jest najczęstszą chorobą odkleszczową. Rejestrowanych jest coraz więcej przypadków boreliozy, głównie w jej centralnej i północnej części (ryc. 3.). Wśród krajów szczególnie narażonych na jej występowanie wymienia się m.in.: Niemcy, Austrię, Szwecję, Finlandię, Polskę, Bułgarię, Węgry, Czechy, Estonię, Litwę, Słowenię. Według danych opublikowanych przez WHO (World Health Organization, Światowa Organizacja Zdrowia) i ECDC cztery ostatnie wymienione państwa to kraje o najwyższej prewalencji. W jednym z badań wykazano, że około 27% populacji żyjącej w zachodniej Szwecji ma stwierdzane przeciwciała przeciwko Borrelia burgdorferii w klasie IgG.
Ryc. 3. Liczba przypadków choroby z Lyme w Europie zgłoszonych do WHO. (https://www.euro.who.int/__data/assets/pdf_file/0008/246167/Fact-sheet-Lymeborreliosis- Eng.pdf)
Borelioza jest najczęstszą chorobą odkleszczową w Polsce, a liczba rejestrowanych zachorowań systematycznie wzrasta. Według danych Państwowego Zakładu Higieny (PZH) w 2012 r. zarejestrowano 8794 zachorowań, rok później już 12 763, najwięcej w województwach podlaskim i warmińsko-mazurskim. W latach 2016 i 2017, wg danych opublikowanych na stronie PZH jeszcze sprzed pandemii SARS-CoV-2, wartości te wynosiły odpowiednio 21 201 i 21 514, z czego 10,8% i 12,6% pacjentów wymagało hospitalizacji (ryc. 4. i tab. 2.). Zmieniło się również geograficzne rozprzestrzenienie choroby. Choć najwyższa zapadalność nadal jest w województwie podlaskim, to w drugiej kolejności terenami, gdzie choroba powszechnie jest wykrywana, są województwa: małopolskie, lubelskie, warmińsko-mazurskie.
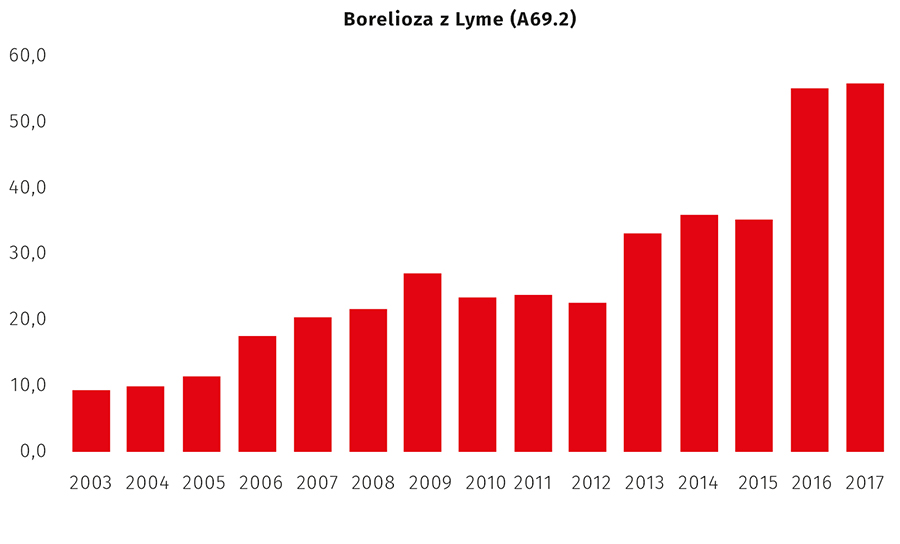
Ryc. 4. Zapadalność (na 100 tys.) na wybrane choroby zakaźne i zatrucia podlegające obowiązkowemu zgłoszeniu i objęte sprawozdaniami w latach 2003–2017 – borelioza z Lyme (A69.2) (Czarkowski M.P. i wsp., nr piśm. 2)
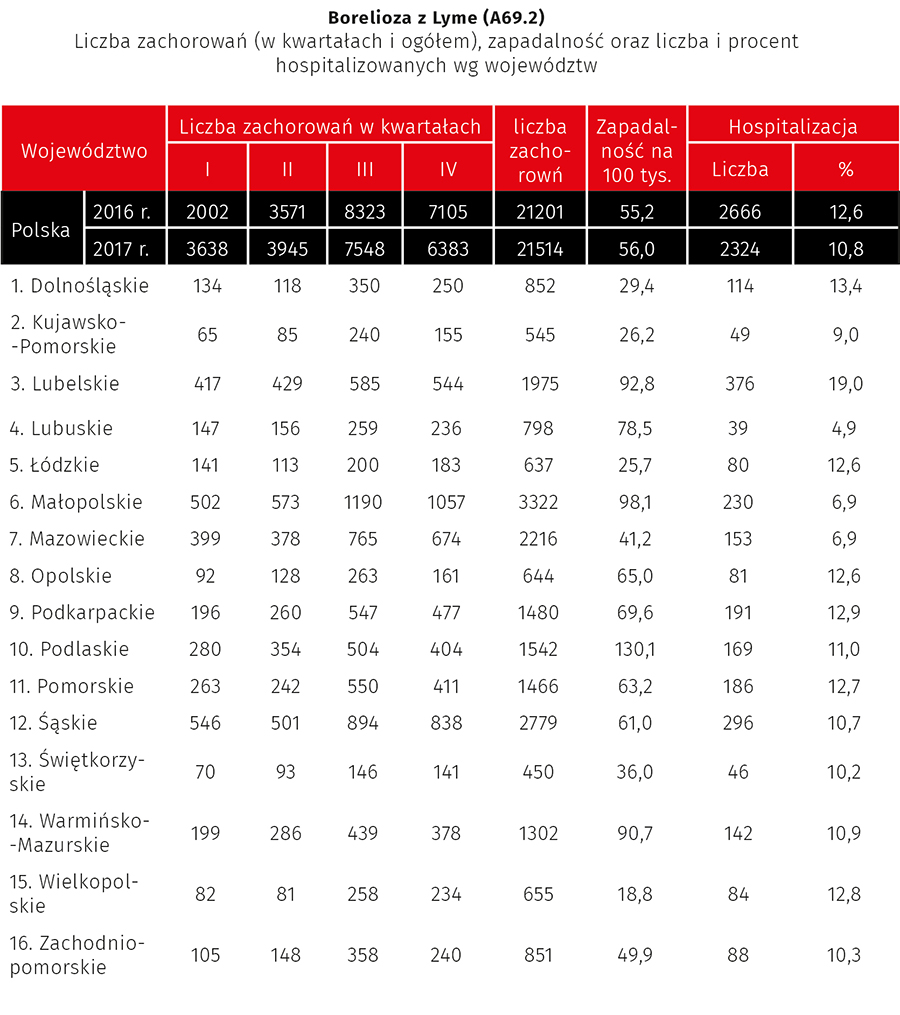
Tab. 3. Zapadalność na boreliozę w Polsce w latach 2016–2017 (Czarkowski M.P. i wsp., nr piśm. 2)
Rosnąca liczba przypadków zachorowań na chorobę z Lyme ma związek z ocieplaniem się klimatu, w wyniku czego zwiększa się liczba i zasięg występowania zakażonych kleszczy. W rozprzestrzenianiu się zakażonych kleszczy istotną rolę odgrywają zwierzęta, na których żerują kleszcze, są to m.in. zwierzęta jeleniowate czy migrujące ptaki. Innym czynnikiem wpływającym na wyniki raportów jest większa świadomość istnienia problemu w populacji oraz coraz powszechniejsze stosowanie diagnostyki w kierunku boreliozy, choć wyniki te nie zawsze są interpretowane prawidłowo (istnieje tendencja do nadrozpoznawalności choroby w oparciu tylko o wyniki badań serologicznych i bez typowych klinicznych objawów choroby). Niemniej liczba przypadków w Europie, zarówno boreliozy, jak i innych chorób odkleszczowych (takich jak wirus odkleszczowego zapalenia mózgu) systematycznie rośnie, podobnie rośnie sam zasięg choroby, która coraz częściej stwierdzana jest na obszarach, gdzie do tej pory nie była odnotowywana.
Najwyższa zapadalność na boreliozę przypada na okres wiosny i lata. Z badania przeprowadzonego w Stanach Zjednoczonych wynika, że najwięcej przypadków boreliozy z Lyme rejestrowanych jest od maja do października, z czego > 60% przypadków zgłasza się w czerwcu i lipcu. Ma to związek z aktywnością kleszczy, szczególnie ich wczesnych form rozwojowych, jakimi są nimfy. Są to niedojrzałe formy, ze względu na wielkość trudne do zauważenia, które aktywność rozpoczynają z początkiem wiosny. Dorosłe osobniki, większe i lepiej widoczne, rzadziej stanowią przyczynę zakażenia – ich aktywność wiąże się jednak z drugim wzrostem zachorowalności, który przypada na miesiące jesienne.
Etiologia i patofizjologia
Wektorem choroby jest kleszcz z rodzaju Ixodes. W Polsce za transmisję zakażenia odpowiada zwykle kleszcz pospolity – Ixodes ricinus, rzadziej kleszcz tajgowy – Ixodes persulcatus. W Ameryce Północnej chorobę przenoszą inne gatunki kleszczy – Ixodes scapularis oraz Ixodes pacificus. Kleszcze najliczniej występują na pograniczu poszczególnych biotopów – są powszechne w lasach mieszanych z przewagą gatunków liściastych (głównie na obrzeżach lasów, wzdłuż leśnych ścieżek, w miejscach, gdzie las liściasty styka się z iglastym), jak również na łąkach, w zaroślach, wysokich trawach. Natomiast, co warte podkreślenia, gdyż jest jednym z fałszywych mitów, nie „skaczą” z drzew.
Boreliozę wywołuje zakażenie krętkami Borrelia burgdorferi sensu lato, które dostają się do organizmu człowieka w wyniku ukłucia skóry przez zakażonego kleszcza, w tym jego postaci larwalnej i nimfy. Spośród kilkunastu genogatunków Borrelia udowodniono chorobotwórczość dla człowieka 9 z nich (B. burgdorferi sensu stricto, B. garinii, B. afzelii, B. bissetii, B. spielmanii, B. valaisiana, B. lusitaniae, B. bavariensis, B. kurtenbachii). Według badań w Polsce na większości obszarów dominuje B. afzelii.
Transmisja bakterii do organizmu człowieka nie następuje natychmiast po ukłuciu. Szacuje się, że po ukłuciu przez kleszcza klinicznie jawna choroba rozwija się u 0,3–1,4% pacjentów, natomiast prawdopodobieństwo wytworzenia przeciwciał przeciwko Borrelia burgdorferi wynosi 3–6%. Jest to ważne z kontekście interpretacji wyników badań, szczególnie pacjentów zaniepokojonych obecnością przeciwciał, którzy nie prezentują żadnych objawów choroby.
Po zakażeniu możliwy jest rozwój miejscowego stanu zapalnego (zwykle jest to rumień wędrujący) lub rozsiew bakterii do odległych miejsc. Krętki mogą ulec rozsiewowi przez naczynia krwionośne do różnych narządów/układów, takich jak: skóra, serce, układ nerwowy, stawy. Do rozsiewu może dojść po kilku tygodniach od inokulacji, ale może on również wystąpić u pacjentów z objawami trwającymi krócej niż tydzień. Dlatego tak istotne jest właściwe rozpoznanie choroby i jej leczenie – zmniejsza to ryzyko powikłań i wpływa na poprawę stanu pacjentów. Większość objawów boreliozy pojawia się w pierwszych 6 miesiącach od zakażenia. Oprócz rumienia wędrującego najczęstsze manifestacje choroby z Lyme to: porażenie nerwu twarzowego, aseptyczne zapalenie opon mózgowo-rdzeniowych, korzeniowe zespoły bólowe, nabyte bloki serca, przewlekłe zapalenie stawów.
Warto podkreślić, że poszczególne gatunki krętka wykazują odmienny organotropizm. Wykazano, że w Europie, gdzie dominują gatunki B. garinii i B. afzelii, znacząco częściej niż w Ameryce Północnej dochodzi do zajęcia układu nerwowego i skóry. Z kolei w USA częściej obserwuje się zakażenia gatunkami krętków związanych z rozwojem zapalenia stawów.
Obraz choroby – rumień wędrujący
Rumień wędrujący jest objawem wczesnego stadium boreliozy. Pojawia się u 60–80% pacjentów w okresie 5–30 dni od momentu zakażenia. Rozpoznaje się go na podstawie charakterystycznego obrazu klinicznego, choć w diagnostyce pomocny jest wywiad uwzględniający epidemiologię choroby. Warto jednak podkreślić, że duży odsetek pacjentów nie pamięta pokłucia przez kleszcza.
Sama obecność rumienia wędrującego, jako objawu patognomonicznego, wystarcza do rozpoznania boreliozy z Lyme i podjęcia decyzji o wdrożeniu antybiotykoterapii. Wykonywanie testów serologicznych na tym etapie jest zbędne, ponieważ u blisko połowy chorych nie wykrywa się przeciwciał w tym okresie. Zdecydowana większość pacjentów wytworzy je po około miesiącu od zachorowania, co nie powinno mieć wpływu ani na rozpoczęcie antybiotykoterapii, ani na ocenę skuteczności leczenia. I choć doświadczenie pokazuje, że ocena przeciwciał przy rumieniu jest powszechnie stosowaną praktyką, to przy obecności klasycznego rumienia nie ma uzasadnienia, by takie badanie wykonywać. Praktyka taka niejednokrotnie może okazać się dla pacjentka szkodliwa, choćby z powodu zaniechania wdrożenia antybiotykoterapii do czasu uzyskania dodatnich wyników badań. A warto podkreślić, że pomimo szybkiego rozprzestrzeniania się bakterii drogą krwi i do układu nerwowego właściwa antybiotykoterapia jest bardzo skuteczna, a także zapobiega wystąpieniu powikłań.
Typowy rumień wędrujący pojawia się zwykle w okolicy wcześniejszego ukłucia przez kleszcza. Stopniowo rozszerza się obwodowo, a średnica wynosi co najmniej 5 cm. U > 50% chorych rumień charakteryzuje się centralnym przejaśnieniem. U około połowy chorych rumieniowi towarzyszą niecharakterystyczne objawy, takie jak: zmęczenie (54%), bóle mięśni (44%), bóle stawów (44%), ból głowy (42%), gorączka lub dreszcze (39%). Pojawienie się rumienia o średnicy mniejszej niż 5 cm, szczególnie gdy pojawił się on w krótkim czasie od ukłucia, wymaga różnicowania z odczynem alergicznym. Poza tym diagnostyka różnicowa obejmuje: grzybice, zakażenia paciorkowcowe i gronkowcowe skóry, ziarniniaka obrączkowatego.
Leczenie rumienia wędrującego
Niezwłoczne leczenie rumienia wędrującego cechuje się bardzo dużą skutecznością, ocenianą tylko i wyłącznie na podstawie dynamiki obrazu klinicznego (ustąpienie objawów). W leczeniu stosuje się antybiotyki z trzech grup: beta-laktamów, tetracyklin lub makrolidów. Terapia trwa zwykle 10–14 dni i nie powinna trwać dłużej niż 28 dni. Poniżej przedstawiono rekomendacje polskie i międzynarodowe.
Niestety wielość nieprawdziwych informacji krążących w mediach i internecie powoduje, że pacjenci niejednokrotnie poszukują „alternatywnych” terapii. Warto zaznaczyć, że nie istnieją rzetelne dane naukowe potwierdzające celowość stosowania przedłużonej antybiotykoterapii czy antybiotykoterapii sekwencyjnej (popularnej formy leczenia wśród pacjentów), jaką zaleca towarzystwo ILADS (International Lyme and Associated Diseases Society). Nie jest ona także akceptowana przez WHO.
Podobnie nie udowodniono skuteczności następujących leków i sposobów leczenia: fluorochinolonów, wankomycyny, metronidazolu, tinidazolu, amantadyny, izoniazydu, trimetoprimu-sulfametoksazolu, flukonazolu, wielokrotnej i przedłużonej terapii tego samego epizodu choroby, antybiotykoterapii skojarzonej, przekraczania dawek antybiotyków, tzw. pulsacyjnego podawania antybiotyków, immunoglobulin, leczenia w komorze hiperbarycznej tlenowej, ozonoterapii, witamin i suplementów diety, preparatów magnezu i bizmutu.
Wytyczne PTEiLChZ
W Polsce rekomendacje leczenia boreliozy ustalane są przez Polskiego Towarzystwo Epidemiologów i Lekarzy Chorób Zakaźnych (PTEiLChZ). Ostatnie zalecenia zostały opublikowane w 2018 r. Według PTEiLChZ w leczeniu rumienia wędrującego należy zastosować jeden z czterech antybiotyków: doksycyklinę, amoksycylinę, aksetyl cefuroksymu lub azytromycynę. Leczenie innymi makrolidami, takimi jak klarytromycyna lub roksytromycyna, nie powinno być stosowane ze względu na niższą skuteczność w porównaniu z lekami wymienionymi wyżej. Warto zwrócić uwagę, że żadna z rekomendowanych terapii nie powinna być prowadzona dłużej niż 28 dni, a w przypadku azytromycyny nie dłużej niż 10 dni. U kobiet w ciąży i karmiących piersią przeciwwskazane jest stosowanie doksycykliny, podobnie lek ten nie powinien być stosowany u dzieci poniżej 8. r.ż. Rekomendacje PTEiLChZ przedstawiono w tab. 4.
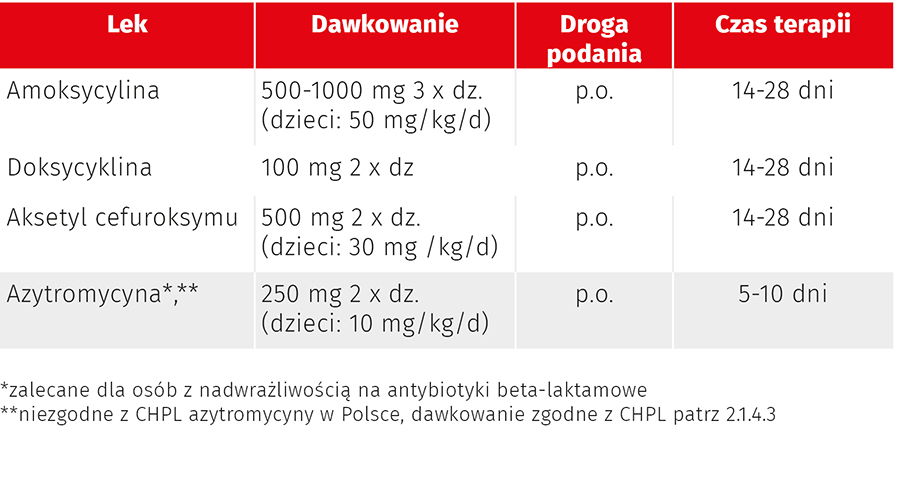
Tab. 4. Wskazania do zastosowania azytromycyny (zgodnie z ChPL, nr piśm. 12)
Inne wytyczne
Podobne zalecenia zawierają inne europejskie i światowe wytyczne. Według rekomendacji CDC (Center for Disease Control and Prevention) w leczeniu rumienia wędrującego należy zastosować doksycyklinę, amoksycylinę lub aksetyl cefuroksymu, a w przypadku nietolerancji wyżej wymienionych leków – azytromycynę. Antybiotyki te należy stosować, zarówno u dorosłych, jak i u dzieci, z uwzględnieniem ograniczeń wynikających z charakterystyki produktu leczniczego.
Warto podkreślić, że zarówno autorzy powyższych zaleceń, jak i innych towarzystw, w oparciu o wyniki badań, sugerują krótsze terapie EM – i tak w przypadku leczenia doksycykliną wystarczająca powinna być terapia 10–14-dniowa, w przypadku beta-laktamów – 14-dniowa, a w przypadku azytromycyny czas leczenia powinien wynosić średnio 7 dni (5–10) [niezgodne z CHPL azytromycyny w Polsce, dawkowanie zgodne z CHPL – patrz: Miejsce azytromycyny w leczeniu rumienia wędrującego]. W oparciu o wyniki badań przeprowadzonych zarówno w Ameryce Północnej, jak i w Europie wykazano, że dłuższe terapie nie przynoszą pacjentom dodatkowych korzyści, za to wiążą się z wyższym ryzykiem wystąpienia działań niepożądanych.
Pod koniec 2020 r. zostały opublikowane wspólne rekomendacje leczenia boreliozy amerykańskiego towarzystwa zakaźniczego, neurologicznego i reumatologicznego (Infectious Diseases Society of America (IDSA), American Academy of Neurology (AAN), American College of Rheumatology (ACR)). Według nich w celu leczenia rumienia wędrującego należy zastosować jeden z czterech antybiotyków: doksycyklinę, amoksycyklinę, aksetyl cefuroksymu lub azytromycynę. Azytromycyna powinna być stosowana jako antybiotyk II linii u pacjentów z przeciwwskazaniami do stosowania doksycykliny lub beta-laktamów. Podsumowanie zaleceń dotyczących leczenia EM przedstawiono w tab. 5.
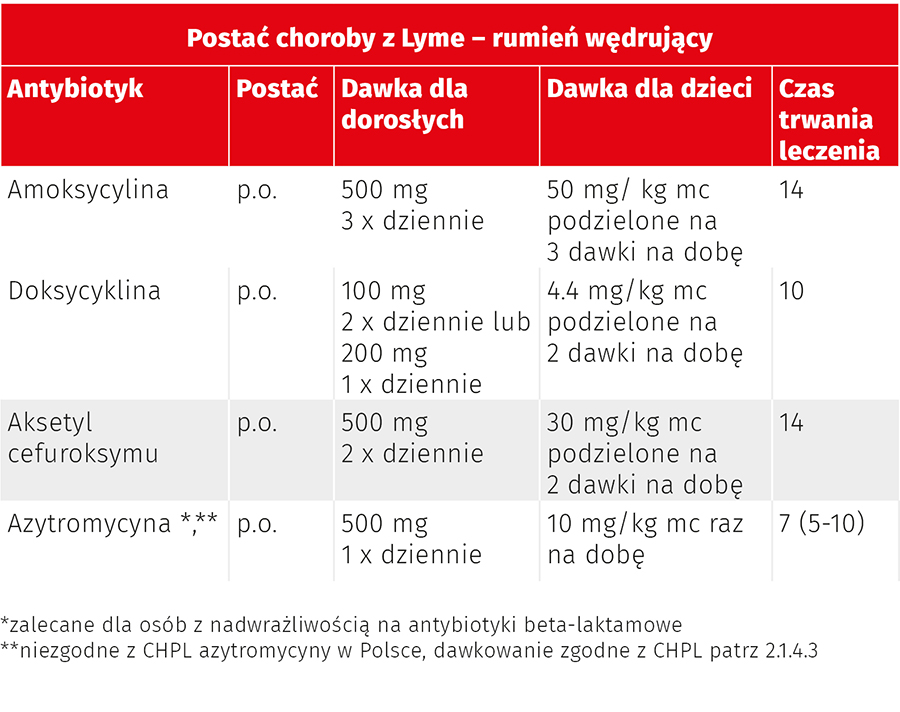
Tab. 5. Leczenie rumienia wędrującego (według Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA), American Academy of Neurology (AAN), American College of Rheumatology (ACR): 2020 Guidelines for the Prevention, Diagnosis and Treatment of Lyme Disease)
Miejsce azytromycyny w leczeniu rumienia wędrującego
Choć azytromycyna traktowana jest przez większość towarzystw jako antybiotyk II linii, warto podkreślić jej rolę w leczeniu szczególnych grup pacjentów, takich jak: dzieci, kobiety w ciążku, kobiety karmiące piersią, osoby z alergią/przeciwwskazaniami do stosowania doksycykliny lub beta-laktamów.
Według charakterystyki produktu leczniczego (ChPL) obowiązującej w Polsce w leczeniu rumienia wędrującego dawka całkowita azytromycyny powinna wynosić 3 g i należy ją podać w następującym schemacie: 1. dnia 1 g, a następnie 500 mg od 2. do 5. dnia, w pojedynczych dawkach dobowych (ryc. 5.). Powyższe dawkowanie dotyczy dorosłych i dzieci o masie ciała > 45 kg. U dzieci o masie ciała < 45 kg należy zastosować dawkowanie według poniższego schematu – 1. dnia 20 mg/kg m.c. 1 x dziennie, następnie od 2. do 5. dnia leczenia w dawce 10 mg/kg m.c. 1 x dziennie.
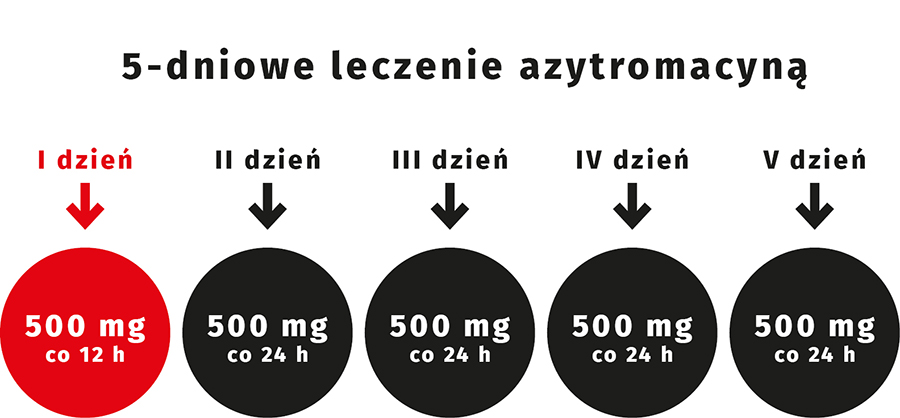
Ryc. 5. Dawkowanie azytromycyny w leczeniu rumienia wędrującego u pacjentów dorosłych i dzieci > 45 kg m.c.
Błędy w diagnostyce i leczeniu rumienia wędrującego
Do najczęstszych błędów popełnianych w diagnostyce i leczeniu należą:
• stosowanie wielotygodniowej, a nawet wielomiesięcznej antybiotykoterapii, stosowanie kilku antybiotyków jednocześnie lub w dawkach „pulsacyjnych”;
• stosowanie niewłaściwych antybiotyków, np. metronidazolu, tynidazolu, nieskutecznych wobec bakterii tlenowych, jakimi są Borrelia spp., czy leków pierwotniakobójczych, np. Malarone;
• opieranie się w ocenie skuteczności leczenia na wartościach stężeń przeciwciał zamiast na ocenie klinicznej (stopniowej poprawie); oczekiwanie, że po wdrożeniu antybiotykoterapii stężenie przeciwciał gwałtownie się obniży;
• ocena obecności/stężenia przeciwciał u pacjentów we wczesnym okresie zakażenia;
• monitorowanie miana przeciwciał po leczeniu lub w oderwaniu od obrazu klinicznego choroby (np. u pacjentów zdrowych).
Przypadek kliniczny
24-letnia pacjentka, bez istotnej przeszłości chorobowej, zgłosiła się w lipcu 2021 r. do izby przyjęć z powodu zaobserwowanego tydzień wcześniej rumienia na udzie. Zmiana nie swędziała ani nie bolała, za to powiększała się. Poza tym pacjentka zgłaszała pobolewanie mięśni. Miesiąc wcześniej była na wyjeździe w górach, ale pokłucia przez kleszcza nie pamiętała. Poza tym w wywiadzie: pacjentka zgłasza alergię na roztocza i złą tolerancję amoksycyliny, obecnie stara się o dziecko.
W badaniu fizykalnym lekarz stwierdził obecność rumienia na podudziu lewym o średnicy kilkunastu centymetrów. Zmiana nie bolała, była w poziomie skóry, miała nieregularny brzeg. Poza tym miała przejaśnienie z wyjątkiem ciemnoróżowego środka. Badający lekarz rozpoznał boreliozę i zaproponował leczenie.
Ze względu na nietolerancję beta-laktamów i prawdopodobną ciążę badający lekarz zalecił zastosowanie azytromycyny – pierwszego dnia 500 mg co 12 godzin, następnie 500 mg raz dziennie przez 4 kolejne dni. Pacjentka zastosowała zaordynowane leczenie. Po 3 dniach zmiana zaczęła ustępować.
Po dwóch tygodniach pacjentka zgłosiła się na kontrolę. Zmiana skórna ustąpiła, podobnie jak pozostałe objawy. Obecnie pacjentka czuje się dobrze, ale jest zaniepokojona dodatnim wynikiem p/Borrelia na obecność przeciwciał w klasie IgM i IgG, który poleciła jej wykonać koleżanka z pracy. Lekarz poinformował pacjentkę, że jest po skutecznym leczeniu boreliozy, nie prezentuje żadnych objawów, a dodatni wynik badania serologicznego jest tylko wyrazem „pamięci immunologicznej”, co nie jest tożsame z obecnością choroby. Poinformował również o braku wskazań do „kontroli serologicznej” przy braku typowych objawów.
Piśmiennictwo
1. Simon K, Kucharska M. Postępowanie terapeutyczne w rumieniu wędrującym w przebiegu boreliozy z Lyme. Wyd. Teva 2017; 1-23.
2. Czarkowski MP, Cielebąk E, Staszewska-Jakubik E, Barbara Kondej B. Choroby zakaźne i zatrucia w Polsce w 2017 roku. Warszawa 2018.
3. Pancewicz S, Moniszko-Malinowska A, Garlicki A i wsp. Diagnostyka i leczenie boreliozy z Lyme. Standardy Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych, 2018.
4. Karlsson J, Andréasson B, Kondori N i wsp. Comparative study of immune status to infectious agents in elderly patients with multiple myeloma, Waldenstrom’s macroglobulinemia, and monoclonal gammopathy of undetermined significance. Clin Vaccine Immunol 2011; 18: 969-77.
5. Stańczak J, Kubica-Biernat B, Racewicz M i wsp. Detection of three genospecies of Borrelia burgdorferi sensu lato in Ixodes ricinus ticks collected in different regions of Poland. Int J Med Microbiol 2000; 290: 559-566.
6. Lantos PM, Rumbaugh J, Bockenstedt L i wsp. Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA), American Academy of Neurology (AAN), and American College of Rheumatology (ACR): 2020 Guidelines for the Prevention, Diagnosis and Treatment of Lyme Disease. Clin Infect Dis 2021; 72: e1-e48.
7. Lucini V, Grosso S, Pannacci M, Scaglione F. Azithromycinkinetics in infected tissue evaluated by microdialysis, abstr A-335. Abstr. 46th Intersci. Conf Antimicrob Agents Chemother, San Francisco, CA, 2006.
8. Gonzalez D, Schmidt S, Derendorf H i wsp. Importance of Relating Efficacy Measures to Unbound Drug Concentrations for Anti-Infective Agents. Clin Microbiol Rev 2013; 26: 274-288.
9. Rothermel CD. Single-dose azithromycin for acute otitis media: a pharmacokinetic/ pharmacodynamic rationale. Curr Ther Res Clin Exp 2003; 64 (Suppl 1): 4-15.
10. Foulds G, Johnson RB. Selection of dose regimens of azithromycin. J Antimicrob Chemother 1993; 31 (Suppl E): 39–50.
11. Korzybski D, Nowiński A. Makrolidy – nie tylko działanie przeciwbakteryjne, 2013.
12. Azytromycyna – Charakterystyka produktu leczniczego.
13. Wormser GP, Dattwyler RJ, Shapiro ED i wsp. The clinical assessment, treatment, and prevention of lyme disease, human granulocytic anaplasmosis, and babesiosis: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2006; 43: 1089-1134.
14. https://www.euro.who.int/__data/assets/pdf_file/0008/246167/Fact-sheet-Lyme-borreliosis-Eng.pdf
Azytromycyna – krótka charakterystyka leku
Mechanizm działania, spektrum przeciwbakteryjne
Azytromycyna jest antybiotykiem azalidowym zaliczanym do makrolidów nowej generacji. W zależności od dawki działa bakteriostatycznie lub bakteriobójczo. Mechanizm jej działania polega na hamowaniu syntezy białka w komórce bakteryjnej, co następuje w wyniku odwracalnego przyłączenia do podjednostki 50S rybosomu. Związanie antybiotyku z rybosomem prowadzi do dysocjacji transportowego RNA (tRNA) i tym samym uniemożliwia wydłużanie łańcucha peptydowego, zaburza syntezę białka, a także hamuje wzrost bakterii.
Spektrum przeciwbakteryjne azytromycyny jest szerokie i obejmuje zarówno bakterie Gram-dodatnie, Gram-ujemne, jak i tak zwane bakterie atypowe. Azytromycyna wykazuje aktywność wobec m.in. bakterii atypowych, takich jak: Mycoplasma pneumoniae, Ureaplasma, Chlamydia, Legionella, ziarenkowców Gram-dodatnich: Streptococcus w tym S. pneumoniae, ziarenkowców Gram-ujemnych: Moraxella, Neisseria gonorrhoeae, pałeczek Gram-ujemnych: Heamophilus influenzae, Bordetella pertussis, krętków: Borrelia burgdorferi, Treponema, mikroaerofilnych bakterii spiralnych: Campylobacter, Helicobacter, maczugowców – Corynebacterium diphteriae, prątków nietypowych: Mycobacterium avium complex intercellulare. Antybiotyk ten wykazuje również umiarkowaną aktywność wobec: Staphylococcus, Listerii, beztlenowych ziarenkowców z rodzaju Peptostreptococcus, Gram-dodatnich laseczek z rodzaju Clostridium.
Farmakokinetyka azytromycyny
Azytromycyna charakteryzuje się unikalnymi właściwościami farmakokinetycznymi – jedną z wartych podkreślenia jest zdolność osiągania dużych stężeń w tkankach, co pozwala na skrócenie terapii do 3–5 dni.
Azytromycyna dobrze wchłania się po przyjęciu doustnym. Wykazano, że jej biodostępność wynosi około 37%, a jej największe stężenie w osoczu osiągane jest po 2–3 godzinach od przyjęcia leku. Jest szeroko rozprowadzana w organizmie i silnie wiązana w tkankach. Antybiotyk ten bardzo szybko przedostaje się z krwi do przedziałów wewnątrzkomórkowych, skąd jest powoli uwalniany. Stężenie azytromycyny w tkankach jest znacznie większe, nawet 50-krotnie, niż w osoczu. Wykazano również, że stężenie antybiotyku w neutrofilach, makrofagach płucnych, tkance migdałków podniebiennych oraz narządach miednicy i narządach płciowych utrzymuje się na podwyższonym poziomie przez dłuższy czas – średni okres biologicznego półtrwania w tkankach wynosi 2–4 dni (ryc. 1.). Właściwość ta pozwala leczyć choroby przenoszone drogą płciową jednorazową dawką azytromycyny, jak również skrócić terapię zakażeń skóry, tkanek miękkich i niektórych zakażeń układu oddechowego do 3–5 dni.

Ryc. 1. Farmakokinetyka azytromycyny w tkankach i surowicy. W badaniu zastosowano azytromycynę w dawce 500 mg podawanej raz dziennie przez 3 dni (reprodukcja na podstawie Foulds i wsp., nr piśm. 10)
W badaniach na zwierzętach wykazano również, że azytromycyna osiąga wysokie stężenie w fagocytach, szczególnie aktywnych, stąd stwierdzano jej wysokie stężenie w ogniskach zapalnych. Większą ekspozycję na lek w zainfekowanej tkance w modelach zwierzęcych ilustruje ryc. 2.

Ryc. 2. Stężenie azytromycyny w tkance niezakażonej i zakażonej (S. aureus) w funkcji czasu – model zwierzęcy powstały w oparciu o infekcję uda szczura (reprodukcja na podstawie Lucini i wsp., nr piśm. 7)
Azytromycyna dobrze przenika do: płynu otrzewnowego, wątroby, żółci, moczu, gruczołu krokowego, wydzieliny drzewa oskrzelowego, opłucnej, płynu stawowego. Choć przenika do ośrodkowego układu nerwowego, to nie osiąga w płynie mózgowo-rdzeniowym stężenia terapeutycznego.
Wiązanie azytromycyny z białkami surowicy jest zmienne, w zależności od stężenia w surowicy i wynosi od 12% przy stężeniu 0,5 µg/ml do 52% przy stężeniu 0,05 µg/ml. Z kolei okres półtrwania w fazie eliminacji z osocza jest ściśle związany z okresem półtrwania w tkankach, wynoszącym od 2 do 4 dni. Azytromycyna wydalana jest głównie z żółcią w postaci niezmienionej oraz w postaci metabolitów, ponadto z moczem w postaci niezmienionej.
W badaniach klinicznych i farmakokinetycznych wykazano, że azytromycyna nie wchodzi w istotne interakcje z takimi lekami, jak: karbamazepina, teofilina, atorwastatyna, midazolam, sildenafil, zydowudyna, cymetydyna, trimetoprim i sulfametoksazol, flukonazol, metyloprednizolon, cetyryzyna, efawirenz. Wykazano natomiast interakcje z lekami, takimi jak: digoksyna, kolchicyna, alkaloidy sporyszu, hydroksychlorochina, cyklosporyna. Choć wchłanianie azytromycyny nie zmienia się istotnie pod wpływem przyjmowanych równocześnie leków zmniejszających kwaśność soku żołądkowego, zaleca się stosowanie azytromycyny co najmniej jedną godzinę przed lub dwie godziny po zastosowaniu leków zobojętniających sok żołądkowy. U pacjentów stosujących doustne leki przeciwzakrzepowe z grupy pochodnych kumaryny należy zwrócić uwagę na właściwą częstość kontrolnych oznaczeń czasu protrombinowego podczas terapii azytromycyną ze względu na większą skłonność do krwawień. Należy również pamiętać, żeby zachować ostrożność podczas stosowania azytromycyny u pacjentów z wydłużonym odstępem QT oraz u przyjmujących produkty lecznicze, o których wiadomo, że wydłużają odstęp QT, ze względu na ryzyko wywołania zaburzeń rytmu serca, w tym torsade de pointes.
Wskazania do stosowania azytromycyny
Azytromycyna jest powszechnie stosowanym antybiotykiem, często jako alternatywa dla beta-laktamów (w przypadku alergii na beta-laktamy makrolidy uznawane są w wielu rekomendacjach za leki I rzutu) lub w skojarzeniu z beta-laktamami w leczeniu pozaszpitalnych zapaleń płuc. Biorąc pod uwagę szerokie spektrum przeciwbakteryjne i dystrybucję w tkankach, antybiotyk ten jest rekomendowany w leczeniu przede wszystkim zakażeń górnych i dolnych dróg oddechowych, w ostrym zapaleniu ucha środkowego, w zakażeniu skóry i tkanek miękkich o nasileniu niewielkim do umiarkowanego (np. w róży, liszajcu, ropnym zapaleniu skóry, rumieniu wędrującym, trądziku pospolitym) oraz w chorobach przenoszonych drogą płciową, np. w niepowikłanych zakażeniach wywołanych przez Chlamydia trachomatis. Miejscowo lek ten jest stosowany w zapaleniu spojówek. Wskazania do jego stosowania przedstawiono w tabeli 1.

Tab. 1. Wskazania do zastosowania azytromycyny (zgodnie z ChPL (nr piśm. 12)
W większości wskazań klinicznych dla pacjentów dorosłych i dzieci o masie > 45 kg całkowita dawka azytromycyny wynosi 1500 mg i może zostać podana w schemacie 3- lub 5-dniowym (patrz: tabela poniżej).
U dzieci i młodzieży o masie ciała < 45 kg dawką zazwyczaj zalecaną jest 10 mg/kg na dobę, podawane w pojedynczej dawce raz na dobę przez 3 kolejne dni (dawka maksymalna wynosi 30 mg/kg). Alternatywnie tę samą dawkę całkowitą można podać przez 5 kolejnych dni: 10 mg/kg m.c. pierwszego dnia, a następnie 5 mg/kg m.c. na dobę przez pozostałe cztery dni. Maksymalna dawka całkowita u dzieci wynosi 1500 mg.
Przykłady dawkowania leku w wybranych jednostkach chorobowych przedstawiono w tabeli 2.

Tab. 2. Dawkowanie azytromycyny w wybranych sytuacjach klinicznych dla pacjentów dorosłych i dzieci > 45 kg mc.
Do najczęstszych działań niepożądanych azytromycyny po podaniu doustnych należą: zaburzenia żołądkowo-jelitowe (np. nudności, biegunka, ból brzucha), reakcje nadwrażliwości (np. osutka, reakcja nadwrażliwości na światło), zawroty i bóle głowy, rzadko cholestatyczne zapalenie wątroby.
Azytromycyna a leczenie rumienia wędrującego
Choroba z Lyme – krótkie przedstawienie problemu
Borelioza (choroba z Lyme) jest chorobą wielonarządową coraz powszechniej występującą na świecie. Obserwuje się ją w Europie, Ameryce Północnej i Azji, a badania pokazują, że jej zasięg rośnie, co ma między innymi związek ze zmianami klimatu, w tym z globalnym ociepleniem. Czynnikiem etiologicznym są krętki z grupy Borrelia burgdorferi sensu lato (w Polsce są to gatunki B. burgdorferi, B. garinii i B. afzelii, rzadziej B. spielmanii). Wektorem choroby są kleszcze – w Polsce należące do rodzaju Ixodes (zwykle I. ricinus – kleszcz pospolity, rzadziej I. persulcatus – kleszcz tajgowy).
Pierwszą i często jedyną manifestacją choroby z Lyme jest rumień wędrujący (łac. erythema migrans – EM). Jest to zmiana skórna pojawiająca się we wczesnym stadium choroby, zwykle w 3.–5. dniu, w miejscu pokłucia przez kleszcza, o wielkości większej niż 5 cm z przejaśnieniem w miejscu ukłucia i z tendencją do rozprzestrzeniania się. Jest to objaw patognomoniczny choroby z Lyme – to znaczy na tyle charakterystyczny, że jego wystąpienie upoważnia do postawienia diagnozy i wdrożenia leczenia. Rumieniowi mogą towarzyszyć objawy ogólne, takie jak: gorączka, złe samopoczucie, zmęczenie, ból głowy, bóle stawów i mięśni. Leczenie pacjenta na tym etapie choroby jest istotne, by nie dopuścić do rozwoju dużo poważniejszych powikłań. W wyniku rozsiewu krętków w organizmie może, choć nie musi, dojść do zajęcia odległych układów/narządów, a powikłania związane z boreliozą mogą osiągnąć nasilenie od łagodnych po ciężkie, choć zasadniczo nie prowadzą do zgonu. Dotyczą one zwykle skóry, stawów, serca, układu nerwowego i występują średnio u kilku/kilkunastu procent pacjentów (zapalenie stawów w Europie obserwowano u 3–7% pacjentów, podczas gdy w Stanach Zjednoczonych do 30%).
Szacuje się, że w Polsce około 10–12% zdrowej populacji ma dodatnie wyniki badań serologicznych w kierunku zakażenia B. burdorferi sensu lato, choć biorąc pod uwagę fakt, że wyniki te zostały opublikowane kilkanaście lat temu, a od lat obserwuje się rosnącą zapadalność na boreliozę, wskaźniki te mogą być wyższe. Z drugiej strony należy podkreślić, że obecność przeciwciał nie jest tożsama z diagnozą choroby, która powinna opierać się zarówno na wynikach badań, jak i obecności charakterystycznych objawów (z wyjątkiem rumienia wędrującego, gdzie nie ma konieczności wykonywania badań serologicznych, co nierzadko opóźnia wdrożenie właściwego leczenia). Wdrażanie antybiotykoterapii „na wyniki” i przy braku typowych objawów choroby jest wbrew rekomendacjom i może okazać się szkodliwe dla pacjenta. Leczenie nigdy nie wyeliminuje przeciwciał przeciwko krętkom Borrelia – są one naturalną, prawidłową odpowiedzią humoralną na większość patogenów. Niestety nieprawidłowe interpretowanie wyników badań serologicznych, jak również pewna „moda” na boreliozę i wielość nieprawidłowych informacji krążących w internecie i mediach przyczyniają się do nadużywania antybiotyków i poszukiwania przez pacjentów innych, nierekomendowanych i nierzadko szkodliwych terapii.
Rosnąca zapadalność na boreliozę powoduje zwiększenie liczby zgłoszeń pacjentów zarówno z objawami choroby, jak i z samymi dodatnimi wynikami badań serologicznych do lekarzy różnych specjalności, szczególnie: rodzinnych, internistów, pediatrów, dermatologów. Stąd tak ważne jest przekazywanie aktualnej wiedzy medycznej dotyczącej standardów postępowania i leczenia oraz edukowanie pacjentów, zarówno z zakresu chorób odkleszczowych, jak i zagrożeń wynikających z nieprawidłowego, długotrwałego leczenia.
Epidemiologia
Zapadalność na boreliozę na terenach endemicznych jest wysoka i – jak pokazują badania – w ostatnich latach nadal rośnie. Według CDC (Centers for Disease Control and Prevention, Ośrodki Kontroli i Prewencji Chorób) liczba przypadków tej choroby wzrosła z 10 000 w 1991 r. do > 25 000 w roku 2014. Jest to obecnie najczęściej występująca choroba przenoszona przez wektory w Ameryce Północnej, gdzie stanowi istotny problem szczególnie w północno-wschodnich stanach USA. Również w Europie borelioza jest najczęstszą chorobą odkleszczową. Rejestrowanych jest coraz więcej przypadków boreliozy, głównie w jej centralnej i północnej części (ryc. 3.). Wśród krajów szczególnie narażonych na jej występowanie wymienia się m.in.: Niemcy, Austrię, Szwecję, Finlandię, Polskę, Bułgarię, Węgry, Czechy, Estonię, Litwę, Słowenię. Według danych opublikowanych przez WHO (World Health Organization, Światowa Organizacja Zdrowia) i ECDC cztery ostatnie wymienione państwa to kraje o najwyższej prewalencji. W jednym z badań wykazano, że około 27% populacji żyjącej w zachodniej Szwecji ma stwierdzane przeciwciała przeciwko Borrelia burgdorferii w klasie IgG.

Ryc. 3. Liczba przypadków choroby z Lyme w Europie zgłoszonych do WHO. (https://www.euro.who.int/__data/assets/pdf_file/0008/246167/Fact-sheet-Lymeborreliosis- Eng.pdf)
Borelioza jest najczęstszą chorobą odkleszczową w Polsce, a liczba rejestrowanych zachorowań systematycznie wzrasta. Według danych Państwowego Zakładu Higieny (PZH) w 2012 r. zarejestrowano 8794 zachorowań, rok później już 12 763, najwięcej w województwach podlaskim i warmińsko-mazurskim. W latach 2016 i 2017, wg danych opublikowanych na stronie PZH jeszcze sprzed pandemii SARS-CoV-2, wartości te wynosiły odpowiednio 21 201 i 21 514, z czego 10,8% i 12,6% pacjentów wymagało hospitalizacji (ryc. 4. i tab. 2.). Zmieniło się również geograficzne rozprzestrzenienie choroby. Choć najwyższa zapadalność nadal jest w województwie podlaskim, to w drugiej kolejności terenami, gdzie choroba powszechnie jest wykrywana, są województwa: małopolskie, lubelskie, warmińsko-mazurskie.

Ryc. 4. Zapadalność (na 100 tys.) na wybrane choroby zakaźne i zatrucia podlegające obowiązkowemu zgłoszeniu i objęte sprawozdaniami w latach 2003–2017 – borelioza z Lyme (A69.2) (Czarkowski M.P. i wsp., nr piśm. 2)

Tab. 3. Zapadalność na boreliozę w Polsce w latach 2016–2017 (Czarkowski M.P. i wsp., nr piśm. 2)
Rosnąca liczba przypadków zachorowań na chorobę z Lyme ma związek z ocieplaniem się klimatu, w wyniku czego zwiększa się liczba i zasięg występowania zakażonych kleszczy. W rozprzestrzenianiu się zakażonych kleszczy istotną rolę odgrywają zwierzęta, na których żerują kleszcze, są to m.in. zwierzęta jeleniowate czy migrujące ptaki. Innym czynnikiem wpływającym na wyniki raportów jest większa świadomość istnienia problemu w populacji oraz coraz powszechniejsze stosowanie diagnostyki w kierunku boreliozy, choć wyniki te nie zawsze są interpretowane prawidłowo (istnieje tendencja do nadrozpoznawalności choroby w oparciu tylko o wyniki badań serologicznych i bez typowych klinicznych objawów choroby). Niemniej liczba przypadków w Europie, zarówno boreliozy, jak i innych chorób odkleszczowych (takich jak wirus odkleszczowego zapalenia mózgu) systematycznie rośnie, podobnie rośnie sam zasięg choroby, która coraz częściej stwierdzana jest na obszarach, gdzie do tej pory nie była odnotowywana.
Najwyższa zapadalność na boreliozę przypada na okres wiosny i lata. Z badania przeprowadzonego w Stanach Zjednoczonych wynika, że najwięcej przypadków boreliozy z Lyme rejestrowanych jest od maja do października, z czego > 60% przypadków zgłasza się w czerwcu i lipcu. Ma to związek z aktywnością kleszczy, szczególnie ich wczesnych form rozwojowych, jakimi są nimfy. Są to niedojrzałe formy, ze względu na wielkość trudne do zauważenia, które aktywność rozpoczynają z początkiem wiosny. Dorosłe osobniki, większe i lepiej widoczne, rzadziej stanowią przyczynę zakażenia – ich aktywność wiąże się jednak z drugim wzrostem zachorowalności, który przypada na miesiące jesienne.
Etiologia i patofizjologia
Wektorem choroby jest kleszcz z rodzaju Ixodes. W Polsce za transmisję zakażenia odpowiada zwykle kleszcz pospolity – Ixodes ricinus, rzadziej kleszcz tajgowy – Ixodes persulcatus. W Ameryce Północnej chorobę przenoszą inne gatunki kleszczy – Ixodes scapularis oraz Ixodes pacificus. Kleszcze najliczniej występują na pograniczu poszczególnych biotopów – są powszechne w lasach mieszanych z przewagą gatunków liściastych (głównie na obrzeżach lasów, wzdłuż leśnych ścieżek, w miejscach, gdzie las liściasty styka się z iglastym), jak również na łąkach, w zaroślach, wysokich trawach. Natomiast, co warte podkreślenia, gdyż jest jednym z fałszywych mitów, nie „skaczą” z drzew.
Boreliozę wywołuje zakażenie krętkami Borrelia burgdorferi sensu lato, które dostają się do organizmu człowieka w wyniku ukłucia skóry przez zakażonego kleszcza, w tym jego postaci larwalnej i nimfy. Spośród kilkunastu genogatunków Borrelia udowodniono chorobotwórczość dla człowieka 9 z nich (B. burgdorferi sensu stricto, B. garinii, B. afzelii, B. bissetii, B. spielmanii, B. valaisiana, B. lusitaniae, B. bavariensis, B. kurtenbachii). Według badań w Polsce na większości obszarów dominuje B. afzelii.
Transmisja bakterii do organizmu człowieka nie następuje natychmiast po ukłuciu. Szacuje się, że po ukłuciu przez kleszcza klinicznie jawna choroba rozwija się u 0,3–1,4% pacjentów, natomiast prawdopodobieństwo wytworzenia przeciwciał przeciwko Borrelia burgdorferi wynosi 3–6%. Jest to ważne z kontekście interpretacji wyników badań, szczególnie pacjentów zaniepokojonych obecnością przeciwciał, którzy nie prezentują żadnych objawów choroby.
Po zakażeniu możliwy jest rozwój miejscowego stanu zapalnego (zwykle jest to rumień wędrujący) lub rozsiew bakterii do odległych miejsc. Krętki mogą ulec rozsiewowi przez naczynia krwionośne do różnych narządów/układów, takich jak: skóra, serce, układ nerwowy, stawy. Do rozsiewu może dojść po kilku tygodniach od inokulacji, ale może on również wystąpić u pacjentów z objawami trwającymi krócej niż tydzień. Dlatego tak istotne jest właściwe rozpoznanie choroby i jej leczenie – zmniejsza to ryzyko powikłań i wpływa na poprawę stanu pacjentów. Większość objawów boreliozy pojawia się w pierwszych 6 miesiącach od zakażenia. Oprócz rumienia wędrującego najczęstsze manifestacje choroby z Lyme to: porażenie nerwu twarzowego, aseptyczne zapalenie opon mózgowo-rdzeniowych, korzeniowe zespoły bólowe, nabyte bloki serca, przewlekłe zapalenie stawów.
Warto podkreślić, że poszczególne gatunki krętka wykazują odmienny organotropizm. Wykazano, że w Europie, gdzie dominują gatunki B. garinii i B. afzelii, znacząco częściej niż w Ameryce Północnej dochodzi do zajęcia układu nerwowego i skóry. Z kolei w USA częściej obserwuje się zakażenia gatunkami krętków związanych z rozwojem zapalenia stawów.
Obraz choroby – rumień wędrujący
Rumień wędrujący jest objawem wczesnego stadium boreliozy. Pojawia się u 60–80% pacjentów w okresie 5–30 dni od momentu zakażenia. Rozpoznaje się go na podstawie charakterystycznego obrazu klinicznego, choć w diagnostyce pomocny jest wywiad uwzględniający epidemiologię choroby. Warto jednak podkreślić, że duży odsetek pacjentów nie pamięta pokłucia przez kleszcza.
Sama obecność rumienia wędrującego, jako objawu patognomonicznego, wystarcza do rozpoznania boreliozy z Lyme i podjęcia decyzji o wdrożeniu antybiotykoterapii. Wykonywanie testów serologicznych na tym etapie jest zbędne, ponieważ u blisko połowy chorych nie wykrywa się przeciwciał w tym okresie. Zdecydowana większość pacjentów wytworzy je po około miesiącu od zachorowania, co nie powinno mieć wpływu ani na rozpoczęcie antybiotykoterapii, ani na ocenę skuteczności leczenia. I choć doświadczenie pokazuje, że ocena przeciwciał przy rumieniu jest powszechnie stosowaną praktyką, to przy obecności klasycznego rumienia nie ma uzasadnienia, by takie badanie wykonywać. Praktyka taka niejednokrotnie może okazać się dla pacjentka szkodliwa, choćby z powodu zaniechania wdrożenia antybiotykoterapii do czasu uzyskania dodatnich wyników badań. A warto podkreślić, że pomimo szybkiego rozprzestrzeniania się bakterii drogą krwi i do układu nerwowego właściwa antybiotykoterapia jest bardzo skuteczna, a także zapobiega wystąpieniu powikłań.
Typowy rumień wędrujący pojawia się zwykle w okolicy wcześniejszego ukłucia przez kleszcza. Stopniowo rozszerza się obwodowo, a średnica wynosi co najmniej 5 cm. U > 50% chorych rumień charakteryzuje się centralnym przejaśnieniem. U około połowy chorych rumieniowi towarzyszą niecharakterystyczne objawy, takie jak: zmęczenie (54%), bóle mięśni (44%), bóle stawów (44%), ból głowy (42%), gorączka lub dreszcze (39%). Pojawienie się rumienia o średnicy mniejszej niż 5 cm, szczególnie gdy pojawił się on w krótkim czasie od ukłucia, wymaga różnicowania z odczynem alergicznym. Poza tym diagnostyka różnicowa obejmuje: grzybice, zakażenia paciorkowcowe i gronkowcowe skóry, ziarniniaka obrączkowatego.
Leczenie rumienia wędrującego
Niezwłoczne leczenie rumienia wędrującego cechuje się bardzo dużą skutecznością, ocenianą tylko i wyłącznie na podstawie dynamiki obrazu klinicznego (ustąpienie objawów). W leczeniu stosuje się antybiotyki z trzech grup: beta-laktamów, tetracyklin lub makrolidów. Terapia trwa zwykle 10–14 dni i nie powinna trwać dłużej niż 28 dni. Poniżej przedstawiono rekomendacje polskie i międzynarodowe.
Niestety wielość nieprawdziwych informacji krążących w mediach i internecie powoduje, że pacjenci niejednokrotnie poszukują „alternatywnych” terapii. Warto zaznaczyć, że nie istnieją rzetelne dane naukowe potwierdzające celowość stosowania przedłużonej antybiotykoterapii czy antybiotykoterapii sekwencyjnej (popularnej formy leczenia wśród pacjentów), jaką zaleca towarzystwo ILADS (International Lyme and Associated Diseases Society). Nie jest ona także akceptowana przez WHO.
Podobnie nie udowodniono skuteczności następujących leków i sposobów leczenia: fluorochinolonów, wankomycyny, metronidazolu, tinidazolu, amantadyny, izoniazydu, trimetoprimu-sulfametoksazolu, flukonazolu, wielokrotnej i przedłużonej terapii tego samego epizodu choroby, antybiotykoterapii skojarzonej, przekraczania dawek antybiotyków, tzw. pulsacyjnego podawania antybiotyków, immunoglobulin, leczenia w komorze hiperbarycznej tlenowej, ozonoterapii, witamin i suplementów diety, preparatów magnezu i bizmutu.
Wytyczne PTEiLChZ
W Polsce rekomendacje leczenia boreliozy ustalane są przez Polskiego Towarzystwo Epidemiologów i Lekarzy Chorób Zakaźnych (PTEiLChZ). Ostatnie zalecenia zostały opublikowane w 2018 r. Według PTEiLChZ w leczeniu rumienia wędrującego należy zastosować jeden z czterech antybiotyków: doksycyklinę, amoksycylinę, aksetyl cefuroksymu lub azytromycynę. Leczenie innymi makrolidami, takimi jak klarytromycyna lub roksytromycyna, nie powinno być stosowane ze względu na niższą skuteczność w porównaniu z lekami wymienionymi wyżej. Warto zwrócić uwagę, że żadna z rekomendowanych terapii nie powinna być prowadzona dłużej niż 28 dni, a w przypadku azytromycyny nie dłużej niż 10 dni. U kobiet w ciąży i karmiących piersią przeciwwskazane jest stosowanie doksycykliny, podobnie lek ten nie powinien być stosowany u dzieci poniżej 8. r.ż. Rekomendacje PTEiLChZ przedstawiono w tab. 4.

Tab. 4. Wskazania do zastosowania azytromycyny (zgodnie z ChPL, nr piśm. 12)
Inne wytyczne
Podobne zalecenia zawierają inne europejskie i światowe wytyczne. Według rekomendacji CDC (Center for Disease Control and Prevention) w leczeniu rumienia wędrującego należy zastosować doksycyklinę, amoksycylinę lub aksetyl cefuroksymu, a w przypadku nietolerancji wyżej wymienionych leków – azytromycynę. Antybiotyki te należy stosować, zarówno u dorosłych, jak i u dzieci, z uwzględnieniem ograniczeń wynikających z charakterystyki produktu leczniczego.
Warto podkreślić, że zarówno autorzy powyższych zaleceń, jak i innych towarzystw, w oparciu o wyniki badań, sugerują krótsze terapie EM – i tak w przypadku leczenia doksycykliną wystarczająca powinna być terapia 10–14-dniowa, w przypadku beta-laktamów – 14-dniowa, a w przypadku azytromycyny czas leczenia powinien wynosić średnio 7 dni (5–10) [niezgodne z CHPL azytromycyny w Polsce, dawkowanie zgodne z CHPL – patrz: Miejsce azytromycyny w leczeniu rumienia wędrującego]. W oparciu o wyniki badań przeprowadzonych zarówno w Ameryce Północnej, jak i w Europie wykazano, że dłuższe terapie nie przynoszą pacjentom dodatkowych korzyści, za to wiążą się z wyższym ryzykiem wystąpienia działań niepożądanych.
Pod koniec 2020 r. zostały opublikowane wspólne rekomendacje leczenia boreliozy amerykańskiego towarzystwa zakaźniczego, neurologicznego i reumatologicznego (Infectious Diseases Society of America (IDSA), American Academy of Neurology (AAN), American College of Rheumatology (ACR)). Według nich w celu leczenia rumienia wędrującego należy zastosować jeden z czterech antybiotyków: doksycyklinę, amoksycyklinę, aksetyl cefuroksymu lub azytromycynę. Azytromycyna powinna być stosowana jako antybiotyk II linii u pacjentów z przeciwwskazaniami do stosowania doksycykliny lub beta-laktamów. Podsumowanie zaleceń dotyczących leczenia EM przedstawiono w tab. 5.

Tab. 5. Leczenie rumienia wędrującego (według Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA), American Academy of Neurology (AAN), American College of Rheumatology (ACR): 2020 Guidelines for the Prevention, Diagnosis and Treatment of Lyme Disease)
Miejsce azytromycyny w leczeniu rumienia wędrującego
Choć azytromycyna traktowana jest przez większość towarzystw jako antybiotyk II linii, warto podkreślić jej rolę w leczeniu szczególnych grup pacjentów, takich jak: dzieci, kobiety w ciążku, kobiety karmiące piersią, osoby z alergią/przeciwwskazaniami do stosowania doksycykliny lub beta-laktamów.
Według charakterystyki produktu leczniczego (ChPL) obowiązującej w Polsce w leczeniu rumienia wędrującego dawka całkowita azytromycyny powinna wynosić 3 g i należy ją podać w następującym schemacie: 1. dnia 1 g, a następnie 500 mg od 2. do 5. dnia, w pojedynczych dawkach dobowych (ryc. 5.). Powyższe dawkowanie dotyczy dorosłych i dzieci o masie ciała > 45 kg. U dzieci o masie ciała < 45 kg należy zastosować dawkowanie według poniższego schematu – 1. dnia 20 mg/kg m.c. 1 x dziennie, następnie od 2. do 5. dnia leczenia w dawce 10 mg/kg m.c. 1 x dziennie.

Ryc. 5. Dawkowanie azytromycyny w leczeniu rumienia wędrującego u pacjentów dorosłych i dzieci > 45 kg m.c.
Błędy w diagnostyce i leczeniu rumienia wędrującego
Do najczęstszych błędów popełnianych w diagnostyce i leczeniu należą:
• stosowanie wielotygodniowej, a nawet wielomiesięcznej antybiotykoterapii, stosowanie kilku antybiotyków jednocześnie lub w dawkach „pulsacyjnych”;
• stosowanie niewłaściwych antybiotyków, np. metronidazolu, tynidazolu, nieskutecznych wobec bakterii tlenowych, jakimi są Borrelia spp., czy leków pierwotniakobójczych, np. Malarone;
• opieranie się w ocenie skuteczności leczenia na wartościach stężeń przeciwciał zamiast na ocenie klinicznej (stopniowej poprawie); oczekiwanie, że po wdrożeniu antybiotykoterapii stężenie przeciwciał gwałtownie się obniży;
• ocena obecności/stężenia przeciwciał u pacjentów we wczesnym okresie zakażenia;
• monitorowanie miana przeciwciał po leczeniu lub w oderwaniu od obrazu klinicznego choroby (np. u pacjentów zdrowych).
Przypadek kliniczny
24-letnia pacjentka, bez istotnej przeszłości chorobowej, zgłosiła się w lipcu 2021 r. do izby przyjęć z powodu zaobserwowanego tydzień wcześniej rumienia na udzie. Zmiana nie swędziała ani nie bolała, za to powiększała się. Poza tym pacjentka zgłaszała pobolewanie mięśni. Miesiąc wcześniej była na wyjeździe w górach, ale pokłucia przez kleszcza nie pamiętała. Poza tym w wywiadzie: pacjentka zgłasza alergię na roztocza i złą tolerancję amoksycyliny, obecnie stara się o dziecko.
W badaniu fizykalnym lekarz stwierdził obecność rumienia na podudziu lewym o średnicy kilkunastu centymetrów. Zmiana nie bolała, była w poziomie skóry, miała nieregularny brzeg. Poza tym miała przejaśnienie z wyjątkiem ciemnoróżowego środka. Badający lekarz rozpoznał boreliozę i zaproponował leczenie.
Ze względu na nietolerancję beta-laktamów i prawdopodobną ciążę badający lekarz zalecił zastosowanie azytromycyny – pierwszego dnia 500 mg co 12 godzin, następnie 500 mg raz dziennie przez 4 kolejne dni. Pacjentka zastosowała zaordynowane leczenie. Po 3 dniach zmiana zaczęła ustępować.
Po dwóch tygodniach pacjentka zgłosiła się na kontrolę. Zmiana skórna ustąpiła, podobnie jak pozostałe objawy. Obecnie pacjentka czuje się dobrze, ale jest zaniepokojona dodatnim wynikiem p/Borrelia na obecność przeciwciał w klasie IgM i IgG, który poleciła jej wykonać koleżanka z pracy. Lekarz poinformował pacjentkę, że jest po skutecznym leczeniu boreliozy, nie prezentuje żadnych objawów, a dodatni wynik badania serologicznego jest tylko wyrazem „pamięci immunologicznej”, co nie jest tożsame z obecnością choroby. Poinformował również o braku wskazań do „kontroli serologicznej” przy braku typowych objawów.
Piśmiennictwo
1. Simon K, Kucharska M. Postępowanie terapeutyczne w rumieniu wędrującym w przebiegu boreliozy z Lyme. Wyd. Teva 2017; 1-23.
2. Czarkowski MP, Cielebąk E, Staszewska-Jakubik E, Barbara Kondej B. Choroby zakaźne i zatrucia w Polsce w 2017 roku. Warszawa 2018.
3. Pancewicz S, Moniszko-Malinowska A, Garlicki A i wsp. Diagnostyka i leczenie boreliozy z Lyme. Standardy Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych, 2018.
4. Karlsson J, Andréasson B, Kondori N i wsp. Comparative study of immune status to infectious agents in elderly patients with multiple myeloma, Waldenstrom’s macroglobulinemia, and monoclonal gammopathy of undetermined significance. Clin Vaccine Immunol 2011; 18: 969-77.
5. Stańczak J, Kubica-Biernat B, Racewicz M i wsp. Detection of three genospecies of Borrelia burgdorferi sensu lato in Ixodes ricinus ticks collected in different regions of Poland. Int J Med Microbiol 2000; 290: 559-566.
6. Lantos PM, Rumbaugh J, Bockenstedt L i wsp. Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA), American Academy of Neurology (AAN), and American College of Rheumatology (ACR): 2020 Guidelines for the Prevention, Diagnosis and Treatment of Lyme Disease. Clin Infect Dis 2021; 72: e1-e48.
7. Lucini V, Grosso S, Pannacci M, Scaglione F. Azithromycinkinetics in infected tissue evaluated by microdialysis, abstr A-335. Abstr. 46th Intersci. Conf Antimicrob Agents Chemother, San Francisco, CA, 2006.
8. Gonzalez D, Schmidt S, Derendorf H i wsp. Importance of Relating Efficacy Measures to Unbound Drug Concentrations for Anti-Infective Agents. Clin Microbiol Rev 2013; 26: 274-288.
9. Rothermel CD. Single-dose azithromycin for acute otitis media: a pharmacokinetic/ pharmacodynamic rationale. Curr Ther Res Clin Exp 2003; 64 (Suppl 1): 4-15.
10. Foulds G, Johnson RB. Selection of dose regimens of azithromycin. J Antimicrob Chemother 1993; 31 (Suppl E): 39–50.
11. Korzybski D, Nowiński A. Makrolidy – nie tylko działanie przeciwbakteryjne, 2013.
12. Azytromycyna – Charakterystyka produktu leczniczego.
13. Wormser GP, Dattwyler RJ, Shapiro ED i wsp. The clinical assessment, treatment, and prevention of lyme disease, human granulocytic anaplasmosis, and babesiosis: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2006; 43: 1089-1134.
14. https://www.euro.who.int/__data/assets/pdf_file/0008/246167/Fact-sheet-Lyme-borreliosis-Eng.pdf