Wysiłek fizyczny a stężenie BDNF w surowicy osób z chorobą Alzheimera

Aktywność fizyczna korzystnie wpływa na kluczowe dla pamięci struktury ośrodkowego układu nerwowego. U osób z chorobą Alzheimera odpowiedni wysiłek chroni obszary hipokampu wrażliwe na zmiany związane z procesem zwyrodnieniowym i poprawia funkcje poznawcze. Autorzy pracy badali związek między regularnym treningiem a stężeniem czynnika neurotrofowego pochodzenia mózgowego (BDNF) i mature BDNF (mBDNF) w osoczu chorych.
Autorzy: Marcin Górniak, Maria Skibińska, Filip Rybakowski, Jan Jaracz, Monika Dmitrzak-Węglarz, Janusz Rybakowski
Wstęp
W badaniach eksperymentalnych i klinicznych wykonanych w ostatnich dekadach wykazano, że pod wpływem wysiłku fizycznego wzrasta stężenie czynnika neurotrofowego pochodzenia mózgowego (BDNF, brain-derived neurotrophic factor). Indukcję produkcji BDNF (oraz NGF, nerve growth factor) w hipokampie pod wpływem wysiłku wykazali w badaniach eksperymentalnych Neeper i wsp. (1995), natomiast wzrost produkcji BDNF i nasilenie neurogenezy pod wpływem aktywności fizycznej (AF) stwierdziła Henriette van Praag i wsp. (1999).
W randomizowanym badaniu (RCT) z udziałem 120 starszych osób wykazano, że ćwiczenia aerobowe zwiększają rozmiar przedniego hipokampu i wpływają na poprawę pamięci przestrzennej (Erickson i wsp., 2011). Trening wysiłkowy zwiększył objętość hipokampu o 2%, i tym samym prowadził do spowolnienia o rok–2 lata procesu jego atrofii związanej z wiekiem. Wykazano, że zwiększona objętość hipokampu była związana z wyższym poziomem BDNF. W trwającym pół roku badaniu z udziałem 86 kobiet w wieku 70–80 lat, u których pojawiły się łagodne zaburzenia poznawcze (MCI, mild cognitive impairment), określano objętość hipokampu, pamięć werbalną i sprawność uczenia się. Prowadzony dwa razy w tygodniu trening wpłynął na powiększenie hipokampu (ten Brinke i wsp., 2015). Roczne badanie 90 osób w wieku średnio 66 lat dowiodło, że poprawa funkcji wykonawczych związana z prowadzonym treningiem jest skorelowana ze stopniem wzrostu BDNF (Leckie i wsp., 2014). Håkansson i wsp. (2017) wykazali związek między zmianą stężenia BDNF w surowicy a ostrym wysiłkiem fizycznym oraz sprawnością pamięci operacyjnej.
Poszczególne obszary hipokampu odpowiadają za różne zadania poznawcze, a zmiany patologiczne w przebiegu choroby Alzheimera (ChA) dotykają je nierównomiernie. W badaniu, które przeprowadzili Varma i wsp. (2016), z wykorzystaniem obiektywnych i ankietowych pomiarów codziennej aktywności (chodu) wykazano, że taka AF była skorelowana z większą powierzchnią struktury podkładki (subiculum) hipokampu u kobiet. Wyniki badania sugerują, że nawet niskiej intensywności AF może wpływać na strukturę hipokampu. Broadhouse i wsp. (2020) wykazali, że obszary hipokampu szczególnie podatne na utratę objętości w ChA (subiculum, pole CA1 i zakręt zębaty) są chronione przez ćwiczenia oporowe o wysokiej intensywności. Sześć miesięcy takiego treningu nie tylko poprawiło funkcje poznawcze osób z MCI, ale także chroniło obszary hipokampu wrażliwe na zmiany zachodzące w przebiegu ChA przed zwyrodnieniem co najmniej przez kolejne 12 miesięcy od zakończeniu interwencji, co wskazuje na znaczny terapeutyczny potencjał ćwiczeń oporowych.
Redukcja BDNF i mBDNF (dojrzałej, mature, aktywnej formy BDNF, stanowiącej część całkowitej puli BDNF) w mózgu następuje już we wczesnym okresie ChA. Peng i wsp. (2005) stwierdzili, że ilość mBDNF w korze ciemieniowej zmniejsza się o – odpowiednio – 34% i 62% u pacjentów z MCI i łagodnym lub umiarkowanym otępieniem w przebiegu ChA w stosunku do osób zdrowych. Zheng i wsp. (2010) wykazali, że amyloid β (Aβ) hamuje konwersję proBDNF do mBDNF. Niższy poziom BDNF w osoczu był istotnie związany z rozległą amyloidozą mózgu (Hwang i wsp., 2015). Gerenu i wsp. (2017) zwrócili uwagę na zaburzenia konwersji proBDNF do mBDNF jako ważny mechanizm patologiczny w ChA. Coelho i wsp. (2014) wykazali, że ćwiczenia aerobowe znacząco zwiększają poziom BDNF w osoczu pacjentów z ChA oraz u zdrowych osób. Gasquoine (2018) po dokonaniu metaanalizy 26 randomizowanych badań wpływu AF na poziom BDNF, tempo zaniku struktur OUN oraz tempo nasilania się deficytów poznawczych stwierdził, że ochronny efekt AF w ChA jest prawdopodobnie warunkowany zmianami poza OUN. Badanie RCT Enette’a i wsp. (2020) porównywało wpływ 9-tygodniowego treningu aerobowego m.in. na poziom BDNF u osób z ChA. Przeprowadzono 18 sesji 30-minutowej jazdy na rowerze, dwa razy w tygodniu przez 9 tygodni (a więc pod względem intensywności było bardzo podobne do prezentowanego tu badania). Poziom BDNF w osoczu został oznaczony na początku, po 9 tygodniach oraz miesiąc po zakończeniu badania. Nie stwierdzono istotnej zmiany stężeń BDNF i sprawności poznawczej po interwencjach we wszystkich grupach w porównaniu z wartościami wyjściowymi.
Celem niniejszej pracy było sprawdzenie, czy istnieje związek między podjęciem regularnej, trwającej trzy miesiące, umiarkowanej AF a stężeniem BDNF i mBDNF w surowicy krwi pacjentów z chorobą Alzheimera. Założono, że podjęcie regularnej AF spowoduje wzrost stężenia BDNF i mBDNF w surowicy krwi chorych. Wpływ podjętego treningu na funkcjonowanie ogólne i poziom deficytów poznawczych jest przedmiotem odrębnego artykułu (Górniak i wsp., 2021).
Procedura badania
Do udziału w badaniu zostali zaproszeni pacjenci leczeni ambulatoryjnie w poradni zdrowia psychicznego. Kryteria włączenia do badania obejmowały rozpoznanie prawdopodobnej ChA według ICD-10 (International Statistical Classification of Diseases, wersja 10) o nasileniu łagodnym (19–23 punkty w skali MMSE [Mini-Mental State Examination]) lub umiarkowanym (11–18 punktów), leczenie stałą dawką leków od co najmniej trzech miesięcy, bierny tryb życia przed badaniem, obecność opiekuna zdolnego do monitorowania badania i brak objawów depresji. W badaniu wzięły udział 32 osoby, a do grupy czynnej zostało zakwalifikowanych 16 osób (w tym 3 mężczyzn).
Przeprowadzone badanie miało charakter quasi-eksperymentu. Przydział uczestników do grupy aktywnej lub kontrolnej oparty był na deklaracji chorych oraz ich opiekunów. Pacjent i opiekun, po zapoznaniu się z przebiegiem badania i podjęciu decyzji o udziale w nim, wyrażali na nie pisemną zgodę. Uczestnicy badania i ich opiekunowie byli szczegółowo informowani o zaleceniach dotyczących prowadzenia ćwiczeń. Uczestników badania informowano, że do czasu pobrania krwi (oznaczenie poziomu BDNF) nie powinni zmieniać swojego trybu życia. Zalecaną formą aktywności był nordic walking w towarzystwie opiekuna chorego, którego zadaniem było czuwanie nad czasem trwania, intensywnością i regularnością treningów. Jako kryterium ostatecznego zakwalifikowania uczestnika do grupy czynnej przyjęto próg AF w drugim i trzecim miesiącu badania na poziomie 30 minut 3 razy w tygodniu ocenianej na podstawie dziennika aktywności prowadzonego przez opiekuna. W trakcie badania leczenie podstawowe ChA nie było modyfikowane.
Oznaczenia poziomu proBDNF i BDNF w surowicy dokonano na początku i po trzech miesiącach badania. Oznaczenie stężenia BDNF przeprowadził Zakład Genetyki Kliniki Psychiatrii Uniwersytetu Medycznego im. K. Marcinkowskiego w Poznaniu. Do oznaczenia BDNF pobierano 10 ml krwi żylnej między godziną 8 a 9 rano. Po godzinie surowicę oddzielano przez wirowanie i przechowywano do czasu wykonania oznaczenia w temperaturze -70°C. Stężenie BDNF oraz proBDNF w surowicy krwi oznaczone zostało metodą immunoenzymatyczną (enzyme-linked immunosorbent assay, ELISA) przy użyciu zestawów DuoSet human BDNF (nr kat. DY248) oraz proBDNF (nr kat. DY3175) firmy R&D Systems. Wszystkie pomiary stężenia proBDNF i BDNF wykonywano jednoczasowo, w tych samych warunkach, z użyciem tych samych odczynników. Stężenie mBDNF obliczano jako różnicę stężeń BDNF i proBDNF. Stężenia wszystkich frakcji BDNF podano w pg/ml.
Badanie uzyskało zgodę Komisji Bioetycznej Uniwersytetu Medycznego im Karola Marcinkowskiego w Poznaniu nr: 45/15 z dnia 8 stycznia 2015 r.
Metodyka obliczeń statystycznych
Wykorzystano test Shapiro–Wilka, pozwalający stwierdzić, czy dane można przybliżyć rozkładem normalnym, oraz test Bartletta dla stwierdzenia homoskedastyczności wariancji (równości wariancji między grupami). Ze względu na to, że tylko niewielka liczba cech wykazywała rozkład normalny zdecydowano się na zastosowanie nieparametrycznych metod wnioskowania statystycznego. Analizowane grupy zebrano w odpowiednich tabelach, w których dane podsumowano za pomocą mediany oraz rozstępu międzykwartylowego. W celu porównania danych na początku i na końcu badania w obrębie grupy aktywnej oraz biernej wykorzystano test Wilcoxona dla danych sparowanych, natomiast porównanie grupy aktywnej oraz biernej przeprowadzono z wykorzystaniem testu Manna-Whitneya. Dodatkowo przy każdej wartości istotności statystycznej podano w nawiasie moc testu (prawdopodobieństwo odrzucenia hipotezy zerowej wtedy, gdy jest ona fałszywa) wyliczoną za pomocą oprogramowania GPower (wersja 3.1). Analizę korelacji cech przeprowadzono metodą korelacji Spearmana, natomiast w przypadku testu istotności współczynnika korelacji zastosowano poprawkę na wielokrotne testowanie. We wszystkich testach statystycznych wykorzystanych w badaniu przyjęto poziom istotności α < 0,05.
Wyniki
Dane demograficzne uczestników badania prezentuje tabela 1.
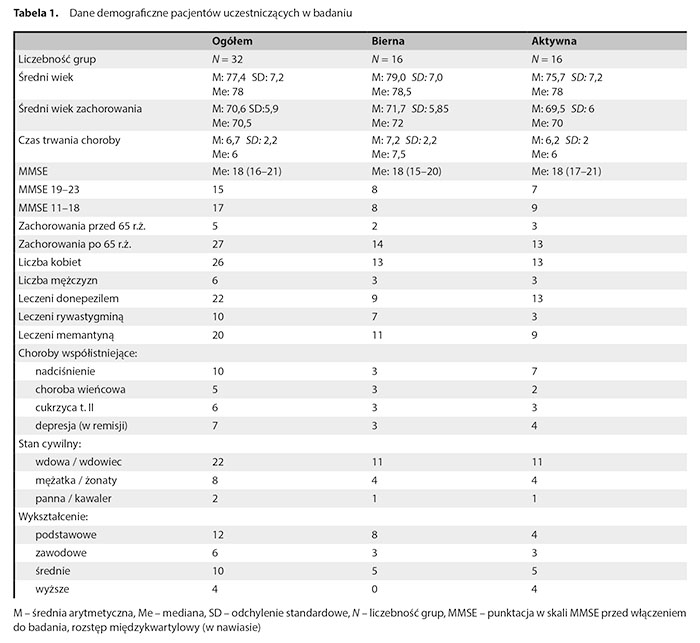
Poza poziomem wykształcenia oraz nieznacznie wyższym wiekiem osób w grupie niećwiczących grupa czynna i aktywna nie wykazują różnic. Większość uczestników badania stanowiły kobiety. Pacjenci z późnym początkiem przeważali nad przypadkami z wczesnym początkiem choroby. Wszyscy uczestnicy badania otrzymywali leczenie jednym z inhibitorów cholinoesterazy, a większość przyjmowała również memantynę.
W tabeli 2 przedstawiono wyniki dotyczące wpływu aktywności fizycznej na stężenie BDNF i mBDNF zależnie od początkowego wyniku w skali MMSE.
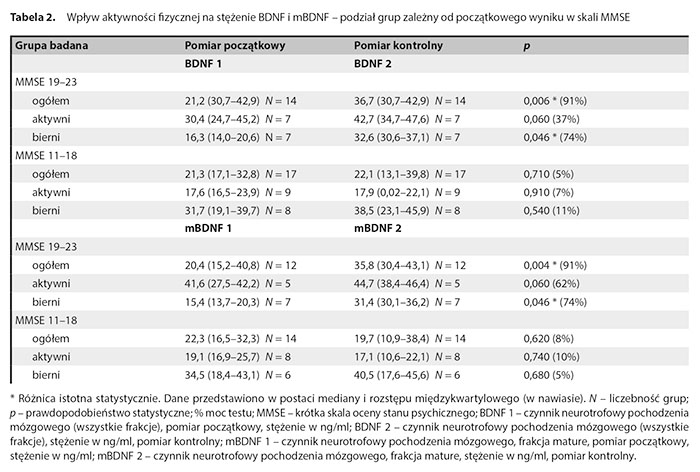
Podział badanych grup uwzględniający początkową punktację w skali MMSE pozwolił zaobserwować istotne statystycznie różnice (wzrost stężeń) pomiędzy BDNF1 a BDNF2 w całej grupie badanej z MMSE 19–23 pkt oraz w grupie biernej z MMSE 19–23 pkt. Nie stwierdzono istotnych różnic w grupie z MMSE 11–18 pkt. Podział badanych grup uwzględniający początkową punktację w skali MMSE pozwolił zaobserwować istotne statystycznie różnice (wzrost stężeń) pomiędzy mBDNF1 a mBDNF2 w całej grupie z MMSE 19–23 pkt oraz w grupie biernej. Nie stwierdzono istotnych różnic między wynikami proBDNF1 i proBDNF2, mBDNF1 i mBDNF2 oraz w relacji mBDNF1/proBDNF1 i mBDNF2/proBDNF2 zależnych od podziału na początkowy wynik MMSE i aktywność.
W tabeli 3 zaprezentowano wyniki dotyczące wpływu aktywności fizycznej na stężenie BDNF i mBDNF w całej badanej grupie oraz z uwzględnieniem podziału na podgrupy ze względu na płeć.
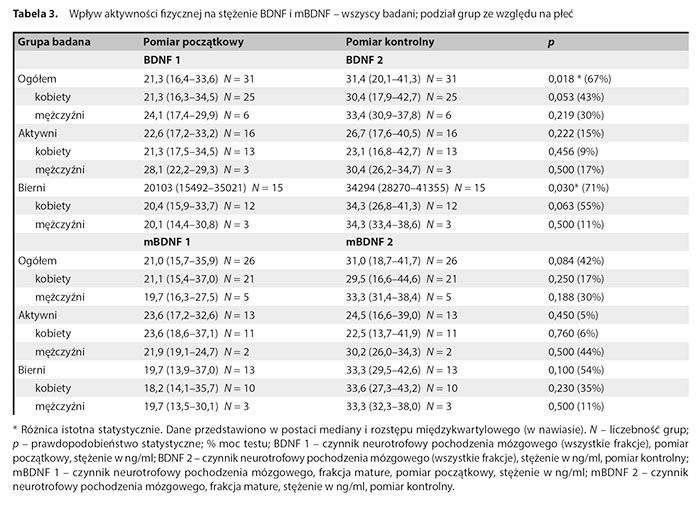
Stwierdzono istotną statystycznie różnicę między początkowym i końcowym stężeniem BDNF (wzrost w badaniu kontrolnym) w całej grupie badanych pacjentów oraz w grupie biernej. Nie stwierdzono takiej różnicy w grupie aktywnej. Nie stwierdzono różnic istotnych statystycznie po dokonaniu dodatkowych podziałów z uwzględnieniem zarówno płci, jak i AF. Nie stwierdzono istotnych różnic między stężeniami proBDNF1 a proBDNF2, mBDNF1 i mBDNF2 oraz w relacji mBDNF1 do proBDNF1 i mBDNF2 do proBDNF2 zależnych od podziału na płeć i aktywność.
W tabeli 4 zaprezentowano wyniki wpływu aktywności fizycznej na stężenie BDNF i mBDNF w podgrupie badanych o późnym początku choroby z uwzględnieniem dodatkowego podziału ze względu na płeć.
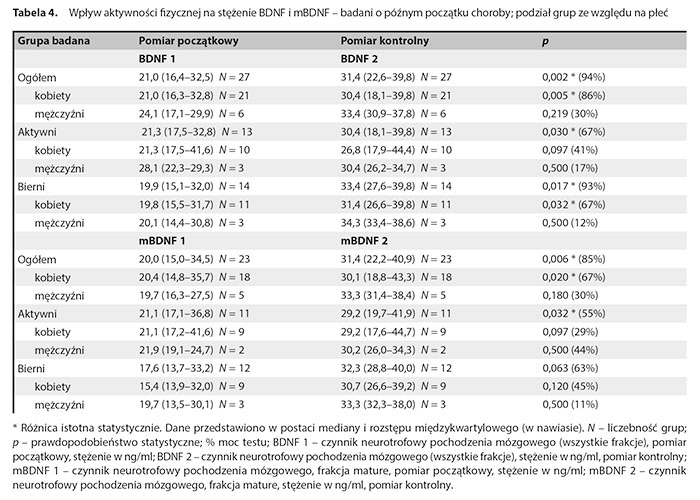
Stwierdzono istotny statystycznie wzrost stężenia BDNF w badaniu kontrolnym w całej podgrupie pacjentów z późnym początkiem choroby, w grupie aktywnej pacjentów z późnym początkiem choroby i w grupie biernej pacjentów z późnym początkiem choroby. Po dokonaniu dodatkowych podziałów z uwzględnieniem zarówno płci, jak i AF stwierdzono istotny statystycznie wzrost stężenia BDNF w badaniu kontrolnym w grupie wszystkich kobiet oraz grupie nieaktywnych kobiet. W podgrupie pacjentów z późnym początkiem choroby stwierdzono istotny statystycznie wzrost stężenia mBDNF w całej grupie oraz podgrupach: wszystkich kobiet oraz podgrupie wszystkich aktywnych osób. W podgrupie pacjentów z późnym początkiem choroby nie stwierdzono istotnych różnic w relacji mBDNF1 do proBDNF1 i mBDNF2 do proBDNF2 zależnych od podziału na płeć i aktywność.
Omówienie wyników
W badaniu stwierdzono istotny statystycznie wzrost stężenia BDNF w całej populacji badanych osób oraz w grupie kontrolnej. Trudno jest znaleźć racjonalne wytłumaczenie wzrostu BDNF w grupie kontrolnej. Być może pod wpływem informacji o korzystnym wpływie wysiłku na funkcje poznawcze osoby z grupy kontrolnej – mimo początkowej odmowy udziału w badaniu w roli osoby aktywnej – zwiększały jednak swoją aktywność, ale nie informowały o tym badaczy. Brak zmian w stężeniu BDNF (i zmian w zakresie sprawności poznawczej) u chorych z łagodną i umiarkowaną ChA pod wpływem trwającego 9 tygodni treningu aerobowego o podobnym nasileniu odnotowano jednak w jednym z niedawno prowadzonych badań (Enette i wsp., 2020).
Nowe światło na związek AF z poziomem BDNF rzucają również wyniki opublikowanego w listopadzie 2021 badania Spartano i wsp. (2021). Stwierdzono w nim, że u dorosłych w średnim wieku BDNF nie jest przewlekle podwyższony w grupie osób przejawiających regularną AF, a nawet może być obniżony w podgrupie intensywniej ćwiczących (oraz u palaczy papierosów). Wyniki te nie są sprzeczne z wcześniejszymi badaniami wykazującymi, że krążący BDNF gwałtownie wzrasta po jednorazowej AF.
Podobne rezultaty dało badanie Szuhany i wsp. (2015), w którym wykazano zróżnicowany wpływ AF na stężenia BDNF, zależny od regularności bądź epizodycznego charakteru AF oraz płci badanych. U kobiet, które w prezentowanym badaniu stanowiły zdecydowaną większość uczestników – wzrost ten miał być istotnie słabszy niż u mężczyzn. Z pewnością istnieje górna granica zalecanej intensywności wysiłku, czego dowodzą badania Roeh i wsp. wykazujące spadek stężenia BDNF w osoczu 3 dni po tak ekstremalnym rodzaju wysiłku jak bieg maratoński. Podobne rezultaty uzyskano, gdy przyjęto jako kryterium podziału grup zaawansowanie choroby: u wszystkich uczestników badania z łagodnie nasilonym otępieniem stwierdzono istotny wzrost stężenia BDNF; istotny wzrost stwierdzono również w grupie biernych uczestników z łagodnym otępieniem. W grupie aktywnej z łagodnym otępieniem stwierdzono wzrost stężenia BDNF na granicy istotności statystycznej. Należy jednak zauważyć, że najwyższym wynikiem początkowym i kontrolnym BDNF w tej podgrupie osób z łagodnym otępieniem cechowali się uczestnicy grupy aktywnej. Wspiera to hipotezę, że niektóre osoby z grupy aktywnej podjęły aktywność fizyczną przed pierwszym oznaczeniem stężenia BDNF. Należy pamiętać, że stężenie BDNF rośnie gwałtownie nawet po podjęciu jednorazowego, krótkiego wysiłku fizycznego i utrzymuje się przez wiele godzin (Håkansson i wsp., 2017).
Nieco inne wyniki otrzymano, gdy z całej badanej populacji wyodrębniono osoby o późnym początku choroby. Była to zdecydowana większość, bo 27 z 32 włączonych do badania chorych. W tym wypadku istotny statystycznie wzrost stężenia BDNF stwierdzono zarówno w całej grupie badanej, jak i w grupie aktywnej oraz w grupie biernej. W tej podgrupie chorych zaobserwowano również istotne statystycznie wzrosty w grupie wszystkich kobiet i grupie biernych kobiet. Na odmienność wyników uzyskanych przez osoby z późną postacią choroby wpływ mogły mieć odmienne interakcje między różnymi podtypami APOE a BDNF. Sen i wsp. (2017) w swym badaniu dowodzą, że wydzielanie BDNF u osób z genotypem APOE-ε4 jest istotnie upośledzone w porównaniu z pozostałymi genotypami (ε2 i ε3), co może się jednak zmieniać pod wpływem wysiłku fizycznego jako czynnika epigenetycznego. APOE-ε4 jest czynnikiem ryzyka późnej postaci ChA i, jak wspominano wcześniej, osoby bierne obciążone nosicielstwem APOE-ε4 są obarczone większym ryzykiem choroby niż osoby aktywne o tym samym genotypie.
W zakresie pomiarów mBDNF nie stwierdzono w badanej populacji istotnych statystycznie różnic między początkiem a końcem badania. Nie stwierdzono takich różnic po dokonaniu podziału na grupę aktywną i bierną, także po dokonaniu dodatkowych podziałów uwzględniających płeć uczestników. Dodatkowe kryterium podziału związane z zaawansowaniem choroby pozwoliło na stwierdzenie istotnych statystycznie wzrostów mBDNF w całej podgrupie z łagodnym otępieniem i podgrupie osób biernych z łagodnym otępieniem. Podobnie jak w przypadku BDNF, najwyższe stężenia mBDNF obserwowano w podgrupie aktywnych uczestników z łagodnym otępieniem. Różnica między pomiarami była na granicy istotności statystycznej. Także i w tym przypadku rozpoczęcie treningów przed pobraniem krwi na oznaczenie BDNF wydaje się najbardziej racjonalnym wytłumaczeniem otrzymanych wyników.
W podgrupie osób z późnym początkiem choroby istotne statystycznie wzrosty mBDNF obserwowano w całej grupie badanej oraz w grupie aktywnych uczestników, nie stwierdzono natomiast takiego wzrostu w grupie biernej. Po podziale badanych ze względu na płeć stwierdzono istotny wzrost w grupie wszystkich kobiet. Wyniki mBDNF otrzymane w populacji pacjentów z późną postacią choroby byłyby więc zgodne z przesłankami (silna korelacja dodatnia między BDNF a mBDNF; wzrosty stężeń BDNF wywołane AF) wynikającymi z innych badań, należy jednak podkreślić brak badań wpływu AF na stężenia mBDNF w populacji z otępieniem. Otrzymane rezultaty mogłyby też sugerować, że mBDNF jest czulszym niż BDNF wskaźnikiem zmian zachodzących pod wpływem AF u pacjentów z ChA. Byłoby to zgodne z wnioskami z badania Sartori i wsp. (2011), według którego AF wpływa szczególnie na wzrost dostępności mBDBF.
W zakresie stężeń proBDNF i relacji stężeń mBDNF do proBDNF nie stwierdzono istotnych różnic niezależnie od dokonywanych podziałów całej badanej populacji. Nie stwierdzono istotnych statystycznie różnic między jakimikolwiek frakcjami BDNF w analizach między grupami aktywną i bierną, ani na początku, ani na końcu badania.
Wzrost stężenia mBDNF stwierdzony jedynie w grupie aktywnej (z późnym początkiem choroby) może przemawiać za większą przydatnością oznaczania tej frakcji neurotrofiny dla określenia ewentualnego korzystnego wpływu AF. W badaniu nie wykazano, aby wychwycone zmiany stężeń BDNF wiązały się z poprawą stanu klinicznego chorych kontrolowanego przy użyciu skal ADL i MoCA.
Jako ograniczenie badania i kwestię wymagającą oddzielnej dyskusji należy potraktować przydatność jednorazowych (czy choćby, jak w niniejszym badaniu, dwukrotnych) oznaczeń BDNF. Wziąwszy pod uwagę liczbę czynników wpływających na zmiany stężenia BDNF (Walsh i wsp., 2020), może należy zastanowić się, czy nie ma ono podobnej wartości jak jednorazowe oznaczenie stężenia glukozy dla kontroli leczenia cukrzycy i czy – analogicznie – pomiar zmian objętości hipokampu (lub zmian w badaniach czynnościowych) zależny od średnich wartości BDNF na przestrzeni tygodni nie byłby odpowiednikiem oznaczenia glikozylowanej hemoglobiny (HbA1C) i nie lepiej odzwierciedlał potencjalny korzystny wpływ AF na neurogenezę. W badaniu nie zbierano na przykład informacji na temat sposobu dotarcia uczestników do punktu pobrania krwi (dojazd pod punkt pobrań samochodem/taksówką vs skorzystanie z komunikacji miejskiej i kilkusetmetrowy spacer z przystanku do laboratorium). Wydaje się, że uwzględnienie tej dodatkowej zmiennej mogłoby wpłynąć na interpretację uzyskanych wyników. Poza tym w świetle wyników jednego z ostatnich badań (Spartano i wsp., 2021) wpływ AF na metabolizm BDNF jest prawdopodobnie o wiele bardziej skomplikowany i subtelny, niż wynikałoby to z pionierskich badań tego zjawiska. Być może, jak w innych przypadkach, istotna jest nie tylko bezwzględna ilość BDNF (mBDNF), ale sprawność całej kaskady aktywowanych przez tę neurotrofinę zjawisk, poczynając od cech takich jak wrażliwość receptorów TrkB (tropomyosin receptor kinase B) przez ewentualny proces ich downregulacji aż po długotrwałe efekty genowe. Niejednoznaczne wyniki dotyczące wpływu różnych rodzajów AF (ostry vs regularny) na stężenie BDNF nie podważają odkryć potwierdzających korzystny wpływ treningu na kluczowe dla pamięci struktury OUN.
Wnioski
W okresie obserwacji w całej grupie badanej (32 osoby) oraz w grupie MMSE 19–23 pkt (15 osób) stwierdzono istotny wzrost stężenia BDNF w surowicy. W grupie osób z późnym początkiem choroby (N = 27) stwierdzono istotny wzrost stężenia BDNF w surowicy niezależnie od AF, natomiast istotny wzrost stężenia mBDNF tylko w grupie aktywnej. Uzyskane wyniki mogą wskazywać na to, że u osób z ChA mBDNF jest czulszym wskaźnikiem wpływu AF na zmiany stężenia neurotrofin. Nie stwierdzono istotnych korelacji między zmianami poziomów BDNF i mBDNF a funkcjonowaniem ogólnym i sprawnością poznawczą, których istnienie zakładano w hipotezach badawczych.
Piśmiennictwo
1. ten Brinke LF, Bolandzadeh N, Nagamatsu LS, Hsu CL, Davis JC, Miran-Khan K et al. Aerobic exercise increases hippocampal volume in older women with probable mild cognitive impairment: a 6-month randomised controlled trial. Br J Sports Med. 2015; 49: 248-54.
2. Broadhouse KM, Singh MF, Suo C, Gates N, Wen W, Brodaty H et al. Hippocampal plasticity underpins long-term cognitive gains from resistance exercise in MCI. Neuroimage Clin. 2020; 25: 102182.
3. Coelho FG, Vital TM, Stein AM, Arantes FJ, Rueda AV, Camarini R et al. Acute aerobic exercise increases brain-derived neurotrophic factor levels in elderly with Alzheimer’s disease. J Alzheimers Dis. 2014; 39: 401-8.
4. Enette L, Vogel T, Merle S, Valard-Guiguet AG, Ozier-Lafontaine N, Neviere R et al. Effect of 9 weeks continuous vs. interval aerobic training on plasma BDNF levels, aerobic fitness, cognitive capacity and quality of life among seniors with mild to moderate Alzheimer’s disease: a randomized controlled trial. Eur Rev Aging Phys Act 2020; 17: 2.
5. Erickson KI, Voss MW, Prakash RS, Basak C, Szabo A, Chaddock L et al. Exercise training increases size of hippocampus and improves memory. Proceedings Of The National Academy Of Sciences Of The United States 2011; 7: 3017-3022.
6. Gasquoine PG. Effects of physical activity on delayed memory measures in randomized controlled trials with nonclinical older, mild cognitive impairment, and dementia participants. J Clin Exp Neuropsychol 2018; 40: 874-886.
7. Gerenu G, Martisova E, Ferrero H, Carracedo M, Rantamäki T, Ramirez MJ et al. Modulation of BDNF cleavage by plasminogen-activator inhibitor-1 contributes to Alzheimer’s neuropathology and cognitive deficits. Biochim Biophys Acta Mol Basis Dis. 2017; 1863: 991-1001.
8. Górniak M, Rybakowski F, Jaracz J, Rybakowski J. The influence of Nordic walking on the general functioning and cognitive performance of patients with Alzheimer’s disease. Adv Psychiatry Neurol 2021; 30 (3): 154-161.
9. Håkansson K, Ledreux A, Daffner K, Terjestam Y, Bergman P, Carlson R et al. BDNF responses in healthy older persons to 35 minutes of physical exercise, cognitive training, and mindfulness: associations with working memory function. Journal of Alzheimer’s Disease 2017; 55: 645-657
10. Hwang KS, Lazaris AS, Eastman JA, Teng E, Thompson PM, Gylys KH et al. Alzheimer’s Disease Neuroimaging Initiative. Plasma BDNF levels associate with Pittsburgh compound B binding in the brain. Alzheimers Dement (Amst) 2015; 1: 187-193.
11. Leckie RL, Oberlin LE, Voss MW, Prakash RS, Szabo-Reed A, Chaddock-Heyman L et al. BDNF mediates improvements in executive function following a 1-year exercise intervention. Front Hum Neurosci 2014; 8: 985.
12. Neeper SA, Gómez-Pinilla F, Choi J, Cotman C. Exercise and brain neurotrophins. Nature 1995; 373: 109.
13. Peng S, Wuu J, Mufson EJ, Fahnestock M. Precursor form of brain-derived neurotrophic factor and mature brain-derived neurotrophic factor are decreased in the pre-clinical stages of Alzheimer’s disease. J Neurochem. 2005; 93: 1412-21.
14. van Praag H, Brian R, Christie A, Terrence J, Sejnowski A, Fred H et al. Running enhances neurogenesis, learning, and long-term potentiation in mice. Proceedings of the National Academy of Sciences of the United States Of America. 1999; 96: 13427-31.
15. Roeh A, Holdenrieder S, Schoenfeld J, Haeckert J, Halle M, Falkai P et al. Decreased Serum Brain-Derived Neurotrophic Factor Concentrations 72 Hours Following Marathon Running. Front Physiol 2021; 12: 668454.
16. Sartori CR, Vieira AS, Ferrari EM, Langone F, Tongiorgi E, Parada CA. The antidepressive effect of the physical exercise correlates with increased levels of mature BDNF, and proBDNF proteolytic cleavage-related genes, p11 and tPA. Neuroscience 2011; 180: 9-18.
17. Sen A, Nelson TJ, Alkon DL. ApoE isoforms differentially regulates cleavage and secretion of BDNF. Mol Brain 2017; 10: 19.
18. Spartano NL, Himali JJ, Trinquart L, Yang Q, Weinstein G, Satizabal CL et al. Accelerometer-Measured, Habitual Physical Activity and Circulating Brain-Derived Neurotrophic Factor: A Cross-Sectional Study. J Alzheimers Dis 2021 Nov 29. doi: 10.3233/JAD-215109.
19. Szuhany KL, Bugatti M, Otto MW. A meta-analytic review of the effects of exercise on brain-derived neurotrophic factor. J Psychiatr Res 2015; 60: 56-64.
20. Varma VR, Tang X, Carlson MC. Hippocampal sub-regional shape and physical activity in older adults. Hippocampus. 2016; 26: 1051-60.
21. Walsh EI, Smith L, Northey J, Rattray B, Cherbuin N. Towards an understanding of the physical activity-BDNF-cognition triumvirate: A review of associations and dosage. Ageing Res Rev 2020; 60: 101044.
22. Zheng Z, Sabirzhanov B, Keifer J. Oligomeric amyloid β inhibits the proteolytic conversion of brain-derived neurotrophic factor (BDNF), AMPA receptor trafficking, and classical conditioning. J Biol Chem 2010; 285: 34708-17.
Pełna treść artykułu: Marcin Górniak, Maria Skibińska, Filip Rybakowski, Jan Jaracz, Monika Dmitrzak-Węglarz, Janusz Rybakowski. Wpływ umiarkowanego wysiłku fizycznego na stężenie poszczególnych frakcji czynnika neurotrofowego pochodzenia mózgowego w surowicy krwi osób z chorobą Alzheimera. Farmakoterapia w Psychiatrii i Neurologii 2021; 37 (3-4): 205-219.
Wstęp
W badaniach eksperymentalnych i klinicznych wykonanych w ostatnich dekadach wykazano, że pod wpływem wysiłku fizycznego wzrasta stężenie czynnika neurotrofowego pochodzenia mózgowego (BDNF, brain-derived neurotrophic factor). Indukcję produkcji BDNF (oraz NGF, nerve growth factor) w hipokampie pod wpływem wysiłku wykazali w badaniach eksperymentalnych Neeper i wsp. (1995), natomiast wzrost produkcji BDNF i nasilenie neurogenezy pod wpływem aktywności fizycznej (AF) stwierdziła Henriette van Praag i wsp. (1999).
W randomizowanym badaniu (RCT) z udziałem 120 starszych osób wykazano, że ćwiczenia aerobowe zwiększają rozmiar przedniego hipokampu i wpływają na poprawę pamięci przestrzennej (Erickson i wsp., 2011). Trening wysiłkowy zwiększył objętość hipokampu o 2%, i tym samym prowadził do spowolnienia o rok–2 lata procesu jego atrofii związanej z wiekiem. Wykazano, że zwiększona objętość hipokampu była związana z wyższym poziomem BDNF. W trwającym pół roku badaniu z udziałem 86 kobiet w wieku 70–80 lat, u których pojawiły się łagodne zaburzenia poznawcze (MCI, mild cognitive impairment), określano objętość hipokampu, pamięć werbalną i sprawność uczenia się. Prowadzony dwa razy w tygodniu trening wpłynął na powiększenie hipokampu (ten Brinke i wsp., 2015). Roczne badanie 90 osób w wieku średnio 66 lat dowiodło, że poprawa funkcji wykonawczych związana z prowadzonym treningiem jest skorelowana ze stopniem wzrostu BDNF (Leckie i wsp., 2014). Håkansson i wsp. (2017) wykazali związek między zmianą stężenia BDNF w surowicy a ostrym wysiłkiem fizycznym oraz sprawnością pamięci operacyjnej.
Poszczególne obszary hipokampu odpowiadają za różne zadania poznawcze, a zmiany patologiczne w przebiegu choroby Alzheimera (ChA) dotykają je nierównomiernie. W badaniu, które przeprowadzili Varma i wsp. (2016), z wykorzystaniem obiektywnych i ankietowych pomiarów codziennej aktywności (chodu) wykazano, że taka AF była skorelowana z większą powierzchnią struktury podkładki (subiculum) hipokampu u kobiet. Wyniki badania sugerują, że nawet niskiej intensywności AF może wpływać na strukturę hipokampu. Broadhouse i wsp. (2020) wykazali, że obszary hipokampu szczególnie podatne na utratę objętości w ChA (subiculum, pole CA1 i zakręt zębaty) są chronione przez ćwiczenia oporowe o wysokiej intensywności. Sześć miesięcy takiego treningu nie tylko poprawiło funkcje poznawcze osób z MCI, ale także chroniło obszary hipokampu wrażliwe na zmiany zachodzące w przebiegu ChA przed zwyrodnieniem co najmniej przez kolejne 12 miesięcy od zakończeniu interwencji, co wskazuje na znaczny terapeutyczny potencjał ćwiczeń oporowych.
Redukcja BDNF i mBDNF (dojrzałej, mature, aktywnej formy BDNF, stanowiącej część całkowitej puli BDNF) w mózgu następuje już we wczesnym okresie ChA. Peng i wsp. (2005) stwierdzili, że ilość mBDNF w korze ciemieniowej zmniejsza się o – odpowiednio – 34% i 62% u pacjentów z MCI i łagodnym lub umiarkowanym otępieniem w przebiegu ChA w stosunku do osób zdrowych. Zheng i wsp. (2010) wykazali, że amyloid β (Aβ) hamuje konwersję proBDNF do mBDNF. Niższy poziom BDNF w osoczu był istotnie związany z rozległą amyloidozą mózgu (Hwang i wsp., 2015). Gerenu i wsp. (2017) zwrócili uwagę na zaburzenia konwersji proBDNF do mBDNF jako ważny mechanizm patologiczny w ChA. Coelho i wsp. (2014) wykazali, że ćwiczenia aerobowe znacząco zwiększają poziom BDNF w osoczu pacjentów z ChA oraz u zdrowych osób. Gasquoine (2018) po dokonaniu metaanalizy 26 randomizowanych badań wpływu AF na poziom BDNF, tempo zaniku struktur OUN oraz tempo nasilania się deficytów poznawczych stwierdził, że ochronny efekt AF w ChA jest prawdopodobnie warunkowany zmianami poza OUN. Badanie RCT Enette’a i wsp. (2020) porównywało wpływ 9-tygodniowego treningu aerobowego m.in. na poziom BDNF u osób z ChA. Przeprowadzono 18 sesji 30-minutowej jazdy na rowerze, dwa razy w tygodniu przez 9 tygodni (a więc pod względem intensywności było bardzo podobne do prezentowanego tu badania). Poziom BDNF w osoczu został oznaczony na początku, po 9 tygodniach oraz miesiąc po zakończeniu badania. Nie stwierdzono istotnej zmiany stężeń BDNF i sprawności poznawczej po interwencjach we wszystkich grupach w porównaniu z wartościami wyjściowymi.
Celem niniejszej pracy było sprawdzenie, czy istnieje związek między podjęciem regularnej, trwającej trzy miesiące, umiarkowanej AF a stężeniem BDNF i mBDNF w surowicy krwi pacjentów z chorobą Alzheimera. Założono, że podjęcie regularnej AF spowoduje wzrost stężenia BDNF i mBDNF w surowicy krwi chorych. Wpływ podjętego treningu na funkcjonowanie ogólne i poziom deficytów poznawczych jest przedmiotem odrębnego artykułu (Górniak i wsp., 2021).
Procedura badania
Do udziału w badaniu zostali zaproszeni pacjenci leczeni ambulatoryjnie w poradni zdrowia psychicznego. Kryteria włączenia do badania obejmowały rozpoznanie prawdopodobnej ChA według ICD-10 (International Statistical Classification of Diseases, wersja 10) o nasileniu łagodnym (19–23 punkty w skali MMSE [Mini-Mental State Examination]) lub umiarkowanym (11–18 punktów), leczenie stałą dawką leków od co najmniej trzech miesięcy, bierny tryb życia przed badaniem, obecność opiekuna zdolnego do monitorowania badania i brak objawów depresji. W badaniu wzięły udział 32 osoby, a do grupy czynnej zostało zakwalifikowanych 16 osób (w tym 3 mężczyzn).
Przeprowadzone badanie miało charakter quasi-eksperymentu. Przydział uczestników do grupy aktywnej lub kontrolnej oparty był na deklaracji chorych oraz ich opiekunów. Pacjent i opiekun, po zapoznaniu się z przebiegiem badania i podjęciu decyzji o udziale w nim, wyrażali na nie pisemną zgodę. Uczestnicy badania i ich opiekunowie byli szczegółowo informowani o zaleceniach dotyczących prowadzenia ćwiczeń. Uczestników badania informowano, że do czasu pobrania krwi (oznaczenie poziomu BDNF) nie powinni zmieniać swojego trybu życia. Zalecaną formą aktywności był nordic walking w towarzystwie opiekuna chorego, którego zadaniem było czuwanie nad czasem trwania, intensywnością i regularnością treningów. Jako kryterium ostatecznego zakwalifikowania uczestnika do grupy czynnej przyjęto próg AF w drugim i trzecim miesiącu badania na poziomie 30 minut 3 razy w tygodniu ocenianej na podstawie dziennika aktywności prowadzonego przez opiekuna. W trakcie badania leczenie podstawowe ChA nie było modyfikowane.
Oznaczenia poziomu proBDNF i BDNF w surowicy dokonano na początku i po trzech miesiącach badania. Oznaczenie stężenia BDNF przeprowadził Zakład Genetyki Kliniki Psychiatrii Uniwersytetu Medycznego im. K. Marcinkowskiego w Poznaniu. Do oznaczenia BDNF pobierano 10 ml krwi żylnej między godziną 8 a 9 rano. Po godzinie surowicę oddzielano przez wirowanie i przechowywano do czasu wykonania oznaczenia w temperaturze -70°C. Stężenie BDNF oraz proBDNF w surowicy krwi oznaczone zostało metodą immunoenzymatyczną (enzyme-linked immunosorbent assay, ELISA) przy użyciu zestawów DuoSet human BDNF (nr kat. DY248) oraz proBDNF (nr kat. DY3175) firmy R&D Systems. Wszystkie pomiary stężenia proBDNF i BDNF wykonywano jednoczasowo, w tych samych warunkach, z użyciem tych samych odczynników. Stężenie mBDNF obliczano jako różnicę stężeń BDNF i proBDNF. Stężenia wszystkich frakcji BDNF podano w pg/ml.
Badanie uzyskało zgodę Komisji Bioetycznej Uniwersytetu Medycznego im Karola Marcinkowskiego w Poznaniu nr: 45/15 z dnia 8 stycznia 2015 r.
Metodyka obliczeń statystycznych
Wykorzystano test Shapiro–Wilka, pozwalający stwierdzić, czy dane można przybliżyć rozkładem normalnym, oraz test Bartletta dla stwierdzenia homoskedastyczności wariancji (równości wariancji między grupami). Ze względu na to, że tylko niewielka liczba cech wykazywała rozkład normalny zdecydowano się na zastosowanie nieparametrycznych metod wnioskowania statystycznego. Analizowane grupy zebrano w odpowiednich tabelach, w których dane podsumowano za pomocą mediany oraz rozstępu międzykwartylowego. W celu porównania danych na początku i na końcu badania w obrębie grupy aktywnej oraz biernej wykorzystano test Wilcoxona dla danych sparowanych, natomiast porównanie grupy aktywnej oraz biernej przeprowadzono z wykorzystaniem testu Manna-Whitneya. Dodatkowo przy każdej wartości istotności statystycznej podano w nawiasie moc testu (prawdopodobieństwo odrzucenia hipotezy zerowej wtedy, gdy jest ona fałszywa) wyliczoną za pomocą oprogramowania GPower (wersja 3.1). Analizę korelacji cech przeprowadzono metodą korelacji Spearmana, natomiast w przypadku testu istotności współczynnika korelacji zastosowano poprawkę na wielokrotne testowanie. We wszystkich testach statystycznych wykorzystanych w badaniu przyjęto poziom istotności α < 0,05.
Wyniki
Dane demograficzne uczestników badania prezentuje tabela 1.

Poza poziomem wykształcenia oraz nieznacznie wyższym wiekiem osób w grupie niećwiczących grupa czynna i aktywna nie wykazują różnic. Większość uczestników badania stanowiły kobiety. Pacjenci z późnym początkiem przeważali nad przypadkami z wczesnym początkiem choroby. Wszyscy uczestnicy badania otrzymywali leczenie jednym z inhibitorów cholinoesterazy, a większość przyjmowała również memantynę.
W tabeli 2 przedstawiono wyniki dotyczące wpływu aktywności fizycznej na stężenie BDNF i mBDNF zależnie od początkowego wyniku w skali MMSE.

Podział badanych grup uwzględniający początkową punktację w skali MMSE pozwolił zaobserwować istotne statystycznie różnice (wzrost stężeń) pomiędzy BDNF1 a BDNF2 w całej grupie badanej z MMSE 19–23 pkt oraz w grupie biernej z MMSE 19–23 pkt. Nie stwierdzono istotnych różnic w grupie z MMSE 11–18 pkt. Podział badanych grup uwzględniający początkową punktację w skali MMSE pozwolił zaobserwować istotne statystycznie różnice (wzrost stężeń) pomiędzy mBDNF1 a mBDNF2 w całej grupie z MMSE 19–23 pkt oraz w grupie biernej. Nie stwierdzono istotnych różnic między wynikami proBDNF1 i proBDNF2, mBDNF1 i mBDNF2 oraz w relacji mBDNF1/proBDNF1 i mBDNF2/proBDNF2 zależnych od podziału na początkowy wynik MMSE i aktywność.
W tabeli 3 zaprezentowano wyniki dotyczące wpływu aktywności fizycznej na stężenie BDNF i mBDNF w całej badanej grupie oraz z uwzględnieniem podziału na podgrupy ze względu na płeć.

Stwierdzono istotną statystycznie różnicę między początkowym i końcowym stężeniem BDNF (wzrost w badaniu kontrolnym) w całej grupie badanych pacjentów oraz w grupie biernej. Nie stwierdzono takiej różnicy w grupie aktywnej. Nie stwierdzono różnic istotnych statystycznie po dokonaniu dodatkowych podziałów z uwzględnieniem zarówno płci, jak i AF. Nie stwierdzono istotnych różnic między stężeniami proBDNF1 a proBDNF2, mBDNF1 i mBDNF2 oraz w relacji mBDNF1 do proBDNF1 i mBDNF2 do proBDNF2 zależnych od podziału na płeć i aktywność.
W tabeli 4 zaprezentowano wyniki wpływu aktywności fizycznej na stężenie BDNF i mBDNF w podgrupie badanych o późnym początku choroby z uwzględnieniem dodatkowego podziału ze względu na płeć.

Stwierdzono istotny statystycznie wzrost stężenia BDNF w badaniu kontrolnym w całej podgrupie pacjentów z późnym początkiem choroby, w grupie aktywnej pacjentów z późnym początkiem choroby i w grupie biernej pacjentów z późnym początkiem choroby. Po dokonaniu dodatkowych podziałów z uwzględnieniem zarówno płci, jak i AF stwierdzono istotny statystycznie wzrost stężenia BDNF w badaniu kontrolnym w grupie wszystkich kobiet oraz grupie nieaktywnych kobiet. W podgrupie pacjentów z późnym początkiem choroby stwierdzono istotny statystycznie wzrost stężenia mBDNF w całej grupie oraz podgrupach: wszystkich kobiet oraz podgrupie wszystkich aktywnych osób. W podgrupie pacjentów z późnym początkiem choroby nie stwierdzono istotnych różnic w relacji mBDNF1 do proBDNF1 i mBDNF2 do proBDNF2 zależnych od podziału na płeć i aktywność.
Omówienie wyników
W badaniu stwierdzono istotny statystycznie wzrost stężenia BDNF w całej populacji badanych osób oraz w grupie kontrolnej. Trudno jest znaleźć racjonalne wytłumaczenie wzrostu BDNF w grupie kontrolnej. Być może pod wpływem informacji o korzystnym wpływie wysiłku na funkcje poznawcze osoby z grupy kontrolnej – mimo początkowej odmowy udziału w badaniu w roli osoby aktywnej – zwiększały jednak swoją aktywność, ale nie informowały o tym badaczy. Brak zmian w stężeniu BDNF (i zmian w zakresie sprawności poznawczej) u chorych z łagodną i umiarkowaną ChA pod wpływem trwającego 9 tygodni treningu aerobowego o podobnym nasileniu odnotowano jednak w jednym z niedawno prowadzonych badań (Enette i wsp., 2020).
Nowe światło na związek AF z poziomem BDNF rzucają również wyniki opublikowanego w listopadzie 2021 badania Spartano i wsp. (2021). Stwierdzono w nim, że u dorosłych w średnim wieku BDNF nie jest przewlekle podwyższony w grupie osób przejawiających regularną AF, a nawet może być obniżony w podgrupie intensywniej ćwiczących (oraz u palaczy papierosów). Wyniki te nie są sprzeczne z wcześniejszymi badaniami wykazującymi, że krążący BDNF gwałtownie wzrasta po jednorazowej AF.
Podobne rezultaty dało badanie Szuhany i wsp. (2015), w którym wykazano zróżnicowany wpływ AF na stężenia BDNF, zależny od regularności bądź epizodycznego charakteru AF oraz płci badanych. U kobiet, które w prezentowanym badaniu stanowiły zdecydowaną większość uczestników – wzrost ten miał być istotnie słabszy niż u mężczyzn. Z pewnością istnieje górna granica zalecanej intensywności wysiłku, czego dowodzą badania Roeh i wsp. wykazujące spadek stężenia BDNF w osoczu 3 dni po tak ekstremalnym rodzaju wysiłku jak bieg maratoński. Podobne rezultaty uzyskano, gdy przyjęto jako kryterium podziału grup zaawansowanie choroby: u wszystkich uczestników badania z łagodnie nasilonym otępieniem stwierdzono istotny wzrost stężenia BDNF; istotny wzrost stwierdzono również w grupie biernych uczestników z łagodnym otępieniem. W grupie aktywnej z łagodnym otępieniem stwierdzono wzrost stężenia BDNF na granicy istotności statystycznej. Należy jednak zauważyć, że najwyższym wynikiem początkowym i kontrolnym BDNF w tej podgrupie osób z łagodnym otępieniem cechowali się uczestnicy grupy aktywnej. Wspiera to hipotezę, że niektóre osoby z grupy aktywnej podjęły aktywność fizyczną przed pierwszym oznaczeniem stężenia BDNF. Należy pamiętać, że stężenie BDNF rośnie gwałtownie nawet po podjęciu jednorazowego, krótkiego wysiłku fizycznego i utrzymuje się przez wiele godzin (Håkansson i wsp., 2017).
Nieco inne wyniki otrzymano, gdy z całej badanej populacji wyodrębniono osoby o późnym początku choroby. Była to zdecydowana większość, bo 27 z 32 włączonych do badania chorych. W tym wypadku istotny statystycznie wzrost stężenia BDNF stwierdzono zarówno w całej grupie badanej, jak i w grupie aktywnej oraz w grupie biernej. W tej podgrupie chorych zaobserwowano również istotne statystycznie wzrosty w grupie wszystkich kobiet i grupie biernych kobiet. Na odmienność wyników uzyskanych przez osoby z późną postacią choroby wpływ mogły mieć odmienne interakcje między różnymi podtypami APOE a BDNF. Sen i wsp. (2017) w swym badaniu dowodzą, że wydzielanie BDNF u osób z genotypem APOE-ε4 jest istotnie upośledzone w porównaniu z pozostałymi genotypami (ε2 i ε3), co może się jednak zmieniać pod wpływem wysiłku fizycznego jako czynnika epigenetycznego. APOE-ε4 jest czynnikiem ryzyka późnej postaci ChA i, jak wspominano wcześniej, osoby bierne obciążone nosicielstwem APOE-ε4 są obarczone większym ryzykiem choroby niż osoby aktywne o tym samym genotypie.
W zakresie pomiarów mBDNF nie stwierdzono w badanej populacji istotnych statystycznie różnic między początkiem a końcem badania. Nie stwierdzono takich różnic po dokonaniu podziału na grupę aktywną i bierną, także po dokonaniu dodatkowych podziałów uwzględniających płeć uczestników. Dodatkowe kryterium podziału związane z zaawansowaniem choroby pozwoliło na stwierdzenie istotnych statystycznie wzrostów mBDNF w całej podgrupie z łagodnym otępieniem i podgrupie osób biernych z łagodnym otępieniem. Podobnie jak w przypadku BDNF, najwyższe stężenia mBDNF obserwowano w podgrupie aktywnych uczestników z łagodnym otępieniem. Różnica między pomiarami była na granicy istotności statystycznej. Także i w tym przypadku rozpoczęcie treningów przed pobraniem krwi na oznaczenie BDNF wydaje się najbardziej racjonalnym wytłumaczeniem otrzymanych wyników.
W podgrupie osób z późnym początkiem choroby istotne statystycznie wzrosty mBDNF obserwowano w całej grupie badanej oraz w grupie aktywnych uczestników, nie stwierdzono natomiast takiego wzrostu w grupie biernej. Po podziale badanych ze względu na płeć stwierdzono istotny wzrost w grupie wszystkich kobiet. Wyniki mBDNF otrzymane w populacji pacjentów z późną postacią choroby byłyby więc zgodne z przesłankami (silna korelacja dodatnia między BDNF a mBDNF; wzrosty stężeń BDNF wywołane AF) wynikającymi z innych badań, należy jednak podkreślić brak badań wpływu AF na stężenia mBDNF w populacji z otępieniem. Otrzymane rezultaty mogłyby też sugerować, że mBDNF jest czulszym niż BDNF wskaźnikiem zmian zachodzących pod wpływem AF u pacjentów z ChA. Byłoby to zgodne z wnioskami z badania Sartori i wsp. (2011), według którego AF wpływa szczególnie na wzrost dostępności mBDBF.
W zakresie stężeń proBDNF i relacji stężeń mBDNF do proBDNF nie stwierdzono istotnych różnic niezależnie od dokonywanych podziałów całej badanej populacji. Nie stwierdzono istotnych statystycznie różnic między jakimikolwiek frakcjami BDNF w analizach między grupami aktywną i bierną, ani na początku, ani na końcu badania.
Wzrost stężenia mBDNF stwierdzony jedynie w grupie aktywnej (z późnym początkiem choroby) może przemawiać za większą przydatnością oznaczania tej frakcji neurotrofiny dla określenia ewentualnego korzystnego wpływu AF. W badaniu nie wykazano, aby wychwycone zmiany stężeń BDNF wiązały się z poprawą stanu klinicznego chorych kontrolowanego przy użyciu skal ADL i MoCA.
Jako ograniczenie badania i kwestię wymagającą oddzielnej dyskusji należy potraktować przydatność jednorazowych (czy choćby, jak w niniejszym badaniu, dwukrotnych) oznaczeń BDNF. Wziąwszy pod uwagę liczbę czynników wpływających na zmiany stężenia BDNF (Walsh i wsp., 2020), może należy zastanowić się, czy nie ma ono podobnej wartości jak jednorazowe oznaczenie stężenia glukozy dla kontroli leczenia cukrzycy i czy – analogicznie – pomiar zmian objętości hipokampu (lub zmian w badaniach czynnościowych) zależny od średnich wartości BDNF na przestrzeni tygodni nie byłby odpowiednikiem oznaczenia glikozylowanej hemoglobiny (HbA1C) i nie lepiej odzwierciedlał potencjalny korzystny wpływ AF na neurogenezę. W badaniu nie zbierano na przykład informacji na temat sposobu dotarcia uczestników do punktu pobrania krwi (dojazd pod punkt pobrań samochodem/taksówką vs skorzystanie z komunikacji miejskiej i kilkusetmetrowy spacer z przystanku do laboratorium). Wydaje się, że uwzględnienie tej dodatkowej zmiennej mogłoby wpłynąć na interpretację uzyskanych wyników. Poza tym w świetle wyników jednego z ostatnich badań (Spartano i wsp., 2021) wpływ AF na metabolizm BDNF jest prawdopodobnie o wiele bardziej skomplikowany i subtelny, niż wynikałoby to z pionierskich badań tego zjawiska. Być może, jak w innych przypadkach, istotna jest nie tylko bezwzględna ilość BDNF (mBDNF), ale sprawność całej kaskady aktywowanych przez tę neurotrofinę zjawisk, poczynając od cech takich jak wrażliwość receptorów TrkB (tropomyosin receptor kinase B) przez ewentualny proces ich downregulacji aż po długotrwałe efekty genowe. Niejednoznaczne wyniki dotyczące wpływu różnych rodzajów AF (ostry vs regularny) na stężenie BDNF nie podważają odkryć potwierdzających korzystny wpływ treningu na kluczowe dla pamięci struktury OUN.
Wnioski
W okresie obserwacji w całej grupie badanej (32 osoby) oraz w grupie MMSE 19–23 pkt (15 osób) stwierdzono istotny wzrost stężenia BDNF w surowicy. W grupie osób z późnym początkiem choroby (N = 27) stwierdzono istotny wzrost stężenia BDNF w surowicy niezależnie od AF, natomiast istotny wzrost stężenia mBDNF tylko w grupie aktywnej. Uzyskane wyniki mogą wskazywać na to, że u osób z ChA mBDNF jest czulszym wskaźnikiem wpływu AF na zmiany stężenia neurotrofin. Nie stwierdzono istotnych korelacji między zmianami poziomów BDNF i mBDNF a funkcjonowaniem ogólnym i sprawnością poznawczą, których istnienie zakładano w hipotezach badawczych.
Piśmiennictwo
1. ten Brinke LF, Bolandzadeh N, Nagamatsu LS, Hsu CL, Davis JC, Miran-Khan K et al. Aerobic exercise increases hippocampal volume in older women with probable mild cognitive impairment: a 6-month randomised controlled trial. Br J Sports Med. 2015; 49: 248-54.
2. Broadhouse KM, Singh MF, Suo C, Gates N, Wen W, Brodaty H et al. Hippocampal plasticity underpins long-term cognitive gains from resistance exercise in MCI. Neuroimage Clin. 2020; 25: 102182.
3. Coelho FG, Vital TM, Stein AM, Arantes FJ, Rueda AV, Camarini R et al. Acute aerobic exercise increases brain-derived neurotrophic factor levels in elderly with Alzheimer’s disease. J Alzheimers Dis. 2014; 39: 401-8.
4. Enette L, Vogel T, Merle S, Valard-Guiguet AG, Ozier-Lafontaine N, Neviere R et al. Effect of 9 weeks continuous vs. interval aerobic training on plasma BDNF levels, aerobic fitness, cognitive capacity and quality of life among seniors with mild to moderate Alzheimer’s disease: a randomized controlled trial. Eur Rev Aging Phys Act 2020; 17: 2.
5. Erickson KI, Voss MW, Prakash RS, Basak C, Szabo A, Chaddock L et al. Exercise training increases size of hippocampus and improves memory. Proceedings Of The National Academy Of Sciences Of The United States 2011; 7: 3017-3022.
6. Gasquoine PG. Effects of physical activity on delayed memory measures in randomized controlled trials with nonclinical older, mild cognitive impairment, and dementia participants. J Clin Exp Neuropsychol 2018; 40: 874-886.
7. Gerenu G, Martisova E, Ferrero H, Carracedo M, Rantamäki T, Ramirez MJ et al. Modulation of BDNF cleavage by plasminogen-activator inhibitor-1 contributes to Alzheimer’s neuropathology and cognitive deficits. Biochim Biophys Acta Mol Basis Dis. 2017; 1863: 991-1001.
8. Górniak M, Rybakowski F, Jaracz J, Rybakowski J. The influence of Nordic walking on the general functioning and cognitive performance of patients with Alzheimer’s disease. Adv Psychiatry Neurol 2021; 30 (3): 154-161.
9. Håkansson K, Ledreux A, Daffner K, Terjestam Y, Bergman P, Carlson R et al. BDNF responses in healthy older persons to 35 minutes of physical exercise, cognitive training, and mindfulness: associations with working memory function. Journal of Alzheimer’s Disease 2017; 55: 645-657
10. Hwang KS, Lazaris AS, Eastman JA, Teng E, Thompson PM, Gylys KH et al. Alzheimer’s Disease Neuroimaging Initiative. Plasma BDNF levels associate with Pittsburgh compound B binding in the brain. Alzheimers Dement (Amst) 2015; 1: 187-193.
11. Leckie RL, Oberlin LE, Voss MW, Prakash RS, Szabo-Reed A, Chaddock-Heyman L et al. BDNF mediates improvements in executive function following a 1-year exercise intervention. Front Hum Neurosci 2014; 8: 985.
12. Neeper SA, Gómez-Pinilla F, Choi J, Cotman C. Exercise and brain neurotrophins. Nature 1995; 373: 109.
13. Peng S, Wuu J, Mufson EJ, Fahnestock M. Precursor form of brain-derived neurotrophic factor and mature brain-derived neurotrophic factor are decreased in the pre-clinical stages of Alzheimer’s disease. J Neurochem. 2005; 93: 1412-21.
14. van Praag H, Brian R, Christie A, Terrence J, Sejnowski A, Fred H et al. Running enhances neurogenesis, learning, and long-term potentiation in mice. Proceedings of the National Academy of Sciences of the United States Of America. 1999; 96: 13427-31.
15. Roeh A, Holdenrieder S, Schoenfeld J, Haeckert J, Halle M, Falkai P et al. Decreased Serum Brain-Derived Neurotrophic Factor Concentrations 72 Hours Following Marathon Running. Front Physiol 2021; 12: 668454.
16. Sartori CR, Vieira AS, Ferrari EM, Langone F, Tongiorgi E, Parada CA. The antidepressive effect of the physical exercise correlates with increased levels of mature BDNF, and proBDNF proteolytic cleavage-related genes, p11 and tPA. Neuroscience 2011; 180: 9-18.
17. Sen A, Nelson TJ, Alkon DL. ApoE isoforms differentially regulates cleavage and secretion of BDNF. Mol Brain 2017; 10: 19.
18. Spartano NL, Himali JJ, Trinquart L, Yang Q, Weinstein G, Satizabal CL et al. Accelerometer-Measured, Habitual Physical Activity and Circulating Brain-Derived Neurotrophic Factor: A Cross-Sectional Study. J Alzheimers Dis 2021 Nov 29. doi: 10.3233/JAD-215109.
19. Szuhany KL, Bugatti M, Otto MW. A meta-analytic review of the effects of exercise on brain-derived neurotrophic factor. J Psychiatr Res 2015; 60: 56-64.
20. Varma VR, Tang X, Carlson MC. Hippocampal sub-regional shape and physical activity in older adults. Hippocampus. 2016; 26: 1051-60.
21. Walsh EI, Smith L, Northey J, Rattray B, Cherbuin N. Towards an understanding of the physical activity-BDNF-cognition triumvirate: A review of associations and dosage. Ageing Res Rev 2020; 60: 101044.
22. Zheng Z, Sabirzhanov B, Keifer J. Oligomeric amyloid β inhibits the proteolytic conversion of brain-derived neurotrophic factor (BDNF), AMPA receptor trafficking, and classical conditioning. J Biol Chem 2010; 285: 34708-17.
Pełna treść artykułu: Marcin Górniak, Maria Skibińska, Filip Rybakowski, Jan Jaracz, Monika Dmitrzak-Węglarz, Janusz Rybakowski. Wpływ umiarkowanego wysiłku fizycznego na stężenie poszczególnych frakcji czynnika neurotrofowego pochodzenia mózgowego w surowicy krwi osób z chorobą Alzheimera. Farmakoterapia w Psychiatrii i Neurologii 2021; 37 (3-4): 205-219.
