Redaktor:
Aleksandra Lang
Rola dobezylanu wapnia w farmakoterapii przewlekłej niewydolności żylnej
W artykule omówiono skrótowo podstawowe informacje dotyczące przewlekłej choroby żylnej, przybliżając wskazania do stosowania leków wenoaktywnych, ze szczególnym uwzględnieniem CaD.
Przewlekła choroba żylna (chronic venous disease – CVD) to spektrum chorób żył od teleangiektazji (pajączków) i żył siatkowych poprzez żylaki i obrzęki kończyn dolnych po zmiany troficzne, w tym owrzodzenia goleni. Ważne w tej definicji jest kryterium czasowe – musi trwać długo oraz wywoływać objawy podmiotowe i przedmiotowe wymagające diagnostyki lub leczenia. Leczenie zachowawcze CVD ma na celu zmniejszenie ciśnienia w układzie żylnym kończyny, eliminację obrzęków i stanu zapalnego oraz poprawę działania pompy mięśniowej.
Celem niniejszego artykułu jest przedstawienie w sposób skrótowy i usystematyzowanie wiedzy przydatnej w leczeniu zachowawczym CVD we wczesnym stadium zaawansowania tej rozpowszechnionej choroby i przybliżenie wskazań z obszernych dokumentów, jakimi są wytyczne opublikowane w ostatnich latach.
Przewlekła choroba żylna manifestująca się utrwalonymi objawami jest określana jako przewlekła niewydolność żylna (chronic venous insufficiency – CVI). Cechą różnicującą CVD i CVI jest to, że CVI oznacza bardziej zaawansowane postaci CVD. W związku z powyższym CVI obejmuje takie objawy, jak przebarwienia skóry, egzema, lipodermatosclerosis, atrophie blanche z wygojonymi lub czynnymi owrzodzeniami. Objawy związane z CVI są bardzo rozpowszechnione i mają duży wpływ zarówno na indywidualny stan zdrowia pacjenta, jak i całe systemy opieki zdrowotnej. Szacuje się, że żylaki kończyn dolnych występują u ok. 5–30% dorosłej populacji, chociaż w różnych doniesieniach odsetek ten wynosi od 1% aż do 70% [1]. Wyniki prospektywnego badania przeprowadzonego w Szwajcarii potwierdziły występowanie żylaków kończyn dolnych u 19% mężczyzn i 25% kobiet [2]. Zmiany skórne w przebiegu CVI odnotowano u 3% mężczyzn i 3,7% kobiet w badaniu Tecumseh, a chorobowość niezależnie od płci znacznie wzrastała z wiekiem i wynosiła w grupie osób w wieku 30–39 lat 1,8% dla kobiet (wzrost do 20,7% po 70. roku życia) i 1,1% dla mężczyzn (wzrost do 24,2% po 70. roku życia) [3].
Przewlekła niewydolność żylna z definicji jest utrwalonym zaburzeniem odpływu krwi żylnej z kończyn dolnych. Co to oznacza w praktyce? Prawdopodobnie większość osób spędzających dużo czasu w pozycji siedzącej będzie miała po kilku – kilkunastu godzinach objawy w postaci ciężkości nóg, obrzęków czy kurczy. Jeśli jest to spowodowane tylko brakiem ruchu i słabym używaniem pompy mięśniowej, to objawy te ustąpią, kiedy osoby te zaczną się ruszać i ich aktywność fizyczna będzie na normalnym poziomie. Jeśli objawy nie będą ustępowały mimo aktywności, to w tej grupie powinniśmy podejrzewać przewlekłą niewydolność żylną. Objawy związane z CVI są bardzo rozpowszechnione i mają duży wpływ na indywidualny stan zdrowia pacjenta, jego jakość życia, a także na system opieki zdrowotnej [4, 5]. Spora część chorych nie ma objawów widocznych gołym okiem, ale skarży się na kurcze nocne, bóle łydek pod koniec dnia czy tzw. objaw niespokojnych nóg.
Naturalny postęp CVD oceniono w wieloletniej obserwacji w badaniu Bochum I–IV. Początkowo obejmowało ono 740 uczniów w wieku 10–12 lat (Bochum I), z których 136 było poddawanych okresowej kontroli do wieku 30 lat (Bochum IV). Badanie to wykazało, że bezobjawowy refluks żylny w żyle odpiszczelowej stwierdzony w młodej populacji wiązał się z 30-procentowym ryzykiem wystąpienia żylaków w ciągu 4 lat [6]. Te dane pokazują ważną praktyczną informację, że przewlekła choroba żylna może się pojawić wcześnie w naszym życiu i ma dużą tendencję do progresji. Do czynników predysponujących do wystąpienia CVD należą: obciążenia genetyczne/rodzinne (nie ma jednego genu związanego z dziedziczeniem predyspozycji do żylaków), wiek (im starszy, tym większe ryzyko), alkoholizm, stojąca lub siedząca (statyczna) pozycja pracy, ciąża i przebyte porody, płeć żeńska, stosowanie środków antykoncepcyjnych, zaburzenia hormonalne. Można też wskazać czynniki wywołujące lub nasilające. Wśród nich wyróżnia się czynniki działające stopniowo (progresywnie), takie jak starzenie się, czynniki działające w krótkim okresie, np. ciąża, oraz czynniki działające skrycie, np. przebyta zakrzepica żył głębokich, menopauza. Za istotny czynnik ryzyka zawsze uważano płeć żeńską, choć najnowsze badania wskazują, że w krajach uprzemysłowionych różnice między płciami się zacierają. Inne czynniki behawioralne, takie jak palenie tytoniu, aktywność fizyczna, dieta uboga w błonnik, również mogą mieć znaczenie. W Polsce badania przeprowadzone przez prof. Jawienia, które określały częstość występowania CVI u chorych zgłaszających się do lekarza, wykazały, że dotyczy ona ok. 40% kobiet i 30% mężczyzn [7].
Początek diagnostyki zawsze powinien być związany z lekarzem pierwszego kontaktu/rodzinnym. Ma to bardzo ważne uzasadnienie. Po pierwsze pozwoli wykluczyć inne choroby o ostrym przebiegu, np. zakrzepicę żył głębokich czy różę. Po drugie pozwoli różnicować CVD z innymi schorzeniami, np. stawowymi. Po trzecie wizyta u specjalisty musi mieć uzasadnienie, a dodatkowo często wiąże się z kilkumiesięcznym oczekiwaniem. Należy podkreślić, że lekarz rodzinny może zalecić leczenie zachowawcze, które może być wystarczające i zupełnie zlikwidować objawy, jak pozwoli różnicować CVD z innymi schorzeniami, np. stawowymi. Po trzecie wizyta u specjalisty musi mieć uzasadnienie, a dodatkowo często wiąże się z kilkumiesięcznym oczekiwaniem. Należy podkreślić, że lekarz rodzinny może zalecić leczenie zachowawcze, które może być wystarczające i zupełnie zlikwidować objawy, jak również spowolnić lub zahamować postęp CVD.
W zaleceniach ogólnych należy dążyć do obniżenia ciśnienia w układzie żylnym poprzez elewację kończyn, zwiększenie aktywności ruchowej oraz w wybranych przypadkach redukcję masy ciała. Używanie wyrobów uciskowych jest obligatoryjne, jeśli tylko nie ma ku temu przeciwwskazań. Dodatkowo włącza się leki flebotropowe, np. dobezylan wapnia (calcium dobesilate – CaD). W przypadku niezadowalających wyników stosuje się leczenie inwazyjne. Zawsze należy uwzględnić anatomię i patofizjologię CVD, a także preferencje pacjenta. Powszechność występowania CVD jest związana ze starzeniem się społeczeństwa, zmianami w nawykach żywieniowych i mniejszą aktywnością ruchową. Powinno to skłaniać do wysoce selektywnego i bardzo spersonalizowanego dobierania terapii. Dane z dużych badań wskazują, że na świecie CVD dotyka 84% dorosłych pacjentów przyjmowanych przez lekarzy POZ (średnia wieku: 50,6 roku), przy czym 64% z nich sklasyfikowano jako mających wynik CEAP od C1 do C6, a 20% jest w grupie C0s [8]. Klasyfikacja CEAP (clinical class – C, etiology – E, anatomy – A, pathophysiology – P) systematyzuje objawy chorobowe, ich przyczynę i lokalizację, a dodanie litery s oznacza zmiany objawowe. Pacjenci z CVD we wczesnym stadium (C0) mają objawy podmiotowe związane z chorobą (uczucie ciężkości w pozycji stojącej, zespół niespokojnych nóg, obrzęki – zwłaszcza wieczorem), ale nie występują u nich widoczne objawy kliniczne. Postęp choroby skutkuje rozwojem kolejnych jej stadiów, tj. teleangiektazji (C1), żylaków (C2), obrzęków (C3), hiperpigmentacji lub lipodermatosklerozy (C4) i najwyższej formy zaawansowania – owrzodzenia żylnego (zagojone C5, czynne C6). Żylaki kończyn dolnych (C2) występują u 25–40% dorosłych, a wyższe stopnie zaawansowane choroby (C3–C6) stwierdza się u 17–20% populacji.
Praktycznym wnioskiem z powyżej przytoczonych danych epidemiologicznych jest to, że chorzy z CVD są w dużej części w wieku produkcyjnym i ok. ¼ z nich ma tylko objawy podmiotowe tej choroby, a więc potrzebuje często leków umożliwiających normalne funkcjonowanie przez uwolnienie od dolegliwości. Coraz lepiej znamy patofizjologię CVI, a w związku z tym możemy określić cele właściwego leczenia farmakologicznego. Należą do nich: zwiększenie opróżniania żył, oddziaływanie na ściany naczyń krwionośnych – zwiększenie tonusu, zmniejszenie przepuszczalności, zmniejszenie gotowości zakrzepowej w układzie chłonnym, ograniczenie niszczenia komórek śródbłonka.
Główne wskazania do stosowania leków nazywanych ogólnie flebotropowymi lub wenoaktywnymi obejmują objawy związane z zaburzeniami czynnościowymi układu żylnego kończyn dolnych (np. bóle nóg, uczucie ciężkości i zmęczenia nóg, nocne kurcze).
Leki flebotropowe wpływają na zmiany w obrębie naczyń włosowatych, przywracając ich normalną przepuszczalność. Powodują ograniczenie ilości płynu śródmiąższowego, poprawę drenażu chłonnego i w ten sposób zmniejszają obrzęk limfatyczno-żylny oraz dynamiczne przepełnienie układu chłonnego w zaawansowanych stadiach przewlekłej niewydolności żylnej. Dzięki temu ich działanie przerywa błędne koło przewlekłej niewydolności żylnej.
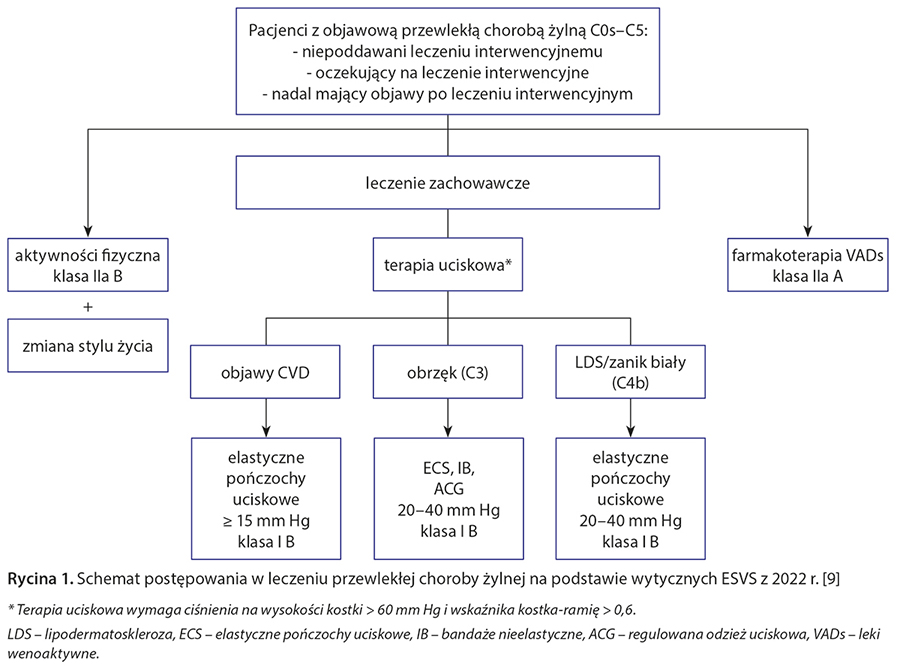
Leki flebotropowe działają profilaktycznie i leczniczo na następstwa przewlekłej niewydolności żylnej. Powinny być stosowane nie zamiast, lecz jako uzupełnienie leczenia bezpośredniego, np. kompresjoterapii. Warto podkreślić, że leczenie farmakologiczne może być stosowane na każdym etapie CVD. Jego oddziaływanie na mikrokrążenie zapobiega powstawaniu obrzęków i odczynów zapalnych oraz towarzyszących im dolegliwości bólowych lub powoduje ich zmniejszenie. Często się zdarza, że pacjenci są bardziej zdyscyplinowani w kwestii zażywania leków niż noszenia pończoch. Dzięki ostatnim wytycznym leczenia CVD farmakoterapia lekami wenoaktywnymi (venoactiv drugs – VADs) została bardziej usystematyzowana [8, 9]. Mylące jest jednak to, że niejako z automatu stawia się znak równości między różnymi substancjami zaliczanymi do tej grupy. Brakuje publikacji w sposób obiektywny porównujących działanie tych leków, a większość dostępnego piśmiennictwa, a co za tym idzie – wytycznych, oparta jest na pracach dotyczących pojedynczych preparatów. Zalecenia mówią o przydatności całej grupy leków wenoaktywnych w leczeniu objawowym CVD, choć wyjątkiem jest stopień 6 w klasyfikacji CEAP, gdzie zdecydowanie rekomenduje się tylko kilka z nich [8, 9]. Schemat postępowania w leczeniu przewlekłej choroby żylnej na podstawie wytycznych European Society Vascular Surgery (ESVS ) z 2022 r. przedstawiono na rycinie 1 [9].
Opcje postępowania z pacjentami we wczesnym stadium przewlekłej choroby żylnej CVD (od C0 do C2) obejmują leki wenoaktywne, które mogą być stosowane samodzielnie lub w połączeniu z leczeniem interwencyjnym (np. skleroterapią), leczenie operacyjne lub zabiegi wewnątrznaczyniowe. Celem takiego postępowania u chorych z CVD jest złagodzenie lub usunięcie klinicznych objawów choroby (pajączki, żylaki) i zapobieganie jej postępowi. W takim podejściu silne uzasadnienie ma leczenie chorych już w najniższym stopniu zaawansowania CVD (C0s). Włączenie postępowania leczniczego przy pojawianiu się objawów podmiotowych przewlekłej choroby żylnej, w tym zmiana stylu życia (np. redukcja wagi, większa aktywność fizyczna, rezygnacja z noszenia butów na wysokim obcasie, unikanie wysokich temperatur), może spowolnić przebieg choroby, a w konsekwencji zapobiegać lub opóźniać początek poważniejszych objawów oraz nieodwracalnych zmian w obrębie struktury ścian naczyń żylnych [10].
W leczeniu zachowawczym CVD stosuje się cztery sposoby postępowania, które nie są dla siebie alternatywą, lecz mogą – a często powinny – być stosowane razem. Należą do nich leczenie uciskiem (kompresjoterapia), drenaż ułożeniowy, ćwiczenia fizyczne (fizjoterapia) oraz leczenie farmakologiczne. Z całą mocą należy podkreślić, że mówimy tu
o lekach, a nie o suplementach diety, które często przez brak odpowiedniego efektu leczniczego zniechęcają pacjentów do farmakoterapii.
O wszystkich tych metodach należy myśleć jako uzupełniających się wzajemnie i tak też edukować chorych z CVD. Wskazane jest monitorowanie dwukierunkowe – z jednej strony progresji choroby, z drugiej zaś skuteczności zaleconej terapii. Można to robić, dokumentując poprawę w zakresie oznak i objawów, a także jakości życia oraz parametrów morfologicznych i czynnościowych żył. Wynik leczenia CVD zależy w dużym stopniu od obrazu klinicznego. Zawsze należy brać pod uwagę preferencje chorych i akceptację różnych metod leczenia. Główny mechanizm działania VADs to zmniejszenie przepuszczalności naczyń włosowatych, zmniejszenie aktywności mediatorów zapalnych i poprawa tonusu żylnego. Obecnie możemy się posłużyć aktualną interpretacją wpływu poszczególnych leków na objawy przedmiotowe i podmiotowe opublikowaną w dwóch ważnych dokumentach: Management of chronic venous disorders of the lower limbs oraz Clinical practice guidelines on the management of chronic venous disease of the lower limbs [8, 9]. Autorzy tych wytycznych opartych nadowodach naukowych podsumowali dotychczasowe metaanalizy, skutecznie wykluczając badanianiewiarygodne. W efekcie uzyskano spójne dane
potwierdzające istotne znaczenie VADs w leczeniuCVI w monoterapii we wczesnych stadiach choroby lub w terapii skojarzonej z zabiegami interwencyjnymi w zaawansowanych stadiach. Wpływ VADs na objawy podmiotowe związane z CVD zestawiono w tabeli 1 [11].
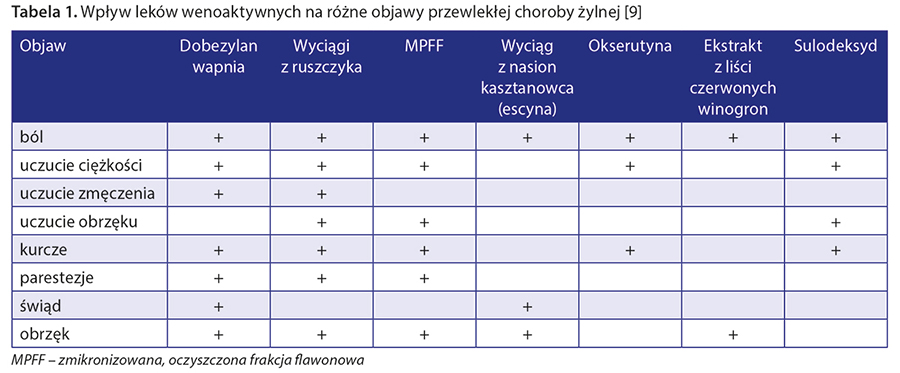
Większość VADs jest pochodzenia roślinnego. Składają się one z czystych substancji, wyciągów roślinnych, syntetycznych cząsteczek wzorowanych na naturalnych molekułach, z połączenia kilku aktywnych substancji lub z wyciągów roślinnych o budowie niedokładnie poznanej [12]. Jak można zauważyć (tab. 1), wymienione leki nie działają na wszystkie objawy podmiotowe CVD [11]. Największe spektrum wskazań związanych z objawami podmiotowymi pokrywają calcium dobesilate, wyciąg z ruszczyka oraz zmikronizowana, oczyszczona frakcja flawonowa (micronised purified flavonoid fraction – MPFF). Ponadto z uwagi na niskie wskaźniki przestrzegania zaleceń dotyczących kompresjoterapii, zwłaszcza kiedy jest ciepło (lato czy ogrzewanie domów), VADs mogą być jedyną dostępną opcją leczenia [11].
Obecne wytyczne odnoszące się do grupy chorych z przewlekłymi chorobami żył sugerują stosowanie VADs jako opcji leczenia w przypadku obrzęku i objawów podmiotowych powodowanych przez przewlekłą chorobę żylną [12].
Wszystkie powyżej wspomniane zalecania i wytyczne jednomyślnie rekomendują wyraźne rozróżnienie leków od suplementów diety i jednoznacznienie zalecają stosowania tych drugich u chorych z CVD [9].
Z praktycznego punktu widzenia najbardziej formalne i obiektywne wnioski można wyciągnąć z przeglądów systematycznych i metaanaliz dotyczących leków stosowanych w CVD. Metaanalizy miały największy wpływ na tworzenie wytycznych ESVS 2022 [9, 12].
Potwierdzenie przydatności CaD w leczeniu CVD wynika z wielu przeprowadzonych badań. Według charakterystyki produktu leczniczego (ChPL) CaD działa na ściany naczyń włosowatych, zmniejszając ich nadmierną przepuszczalność i zwiększając wytrzymałość. Dobezylan wapnia zwiększa elastyczność erytrocytów, a u pacjentów z retinopatią cukrzycową zmniejsza nadmierną lepkość krwi, poprawiając jej właściwości reologiczne. Jego działanie antyagregacyjne polega na hamowaniu agregacji płytek wywołanej przez kolagen i trombinę, bez wpływu na agregację stymulowaną przez kwas arachidonowy. Do zmniejszenia lepkości krwi dochodzi poprzez zmianę składu białek osocza oraz normalizację mechanicznych właściwości krwinek czerwonych (zwiększona odkształcalność). Dodatkowo działanie to jest zwiększane dzięki właściwościom antyagregacyjnym. Wymienione działania powodują usprawnienie obwodowego krążenia żylnego, zmniejszając zastój w naczyniach żylnych i hamując rozwój zmian zakrzepowych towarzyszących powstawaniu żylaków, zwłaszcza kończyn dolnych. Dobezylan wapnia zmniejsza przepuszczalność naczyń limfatycznych i ich łamliwość, poprawia drenaż układu limfatycznego, powodując zmniejszenie obrzęków, zwiększa napięcie naczyń żylnych oraz ma właściwości antyoksydacyjne [13–15]. Wykazano, że patofizjologia obrzęków występujących w przebiegu przewlekłej choroby żylnej jest związana nie tylko z nadmierną przepuszczalnością wynikającą z podwyższonego ciśnienia w mikronaczyniach. Potwierdzono znaczenie mechanizmów zapalnych w patologicznej przepuszczalności ściany naczyń, w tym wpływu neutrofili na śródbłonek. Polega on na ich aktywacji, przyleganiu i migracji oraz uwalnianiu reaktywnych form tlenu [16–20]. Dobezylan wapnia jako przeciwutleniacz i lek o działaniu przeciwzapalnym hamuje powstawanie obrzęku, zmniejszając przepuszczalność naczyń włosowatych [21, 22].
Metaanaliza z 2004 r., której autorami są Ciapponi i wsp., obejmowała systematyczny przegląd skuteczności leczenia CaD w odniesieniu do poszczególnych objawów CVD. Uwzględniono w niej wyniki siedmiu badań klinicznych, w których łącznie uczestniczyło 778 chorych. Dobezylan wapnia podawany doustnie przez 4 tygodnie istotnie zmniejszał nasilenie objawów podmiotowych związanych z CVD, takich jak kurcze nocne i uczucie dyskomfortu. Największe subiektywne korzyści w zakresie zmniejszenia dolegliwości bólowych, uczucia ciężkości i obrzęku kończyn osiągnęli pacjenci z najbardziej zaawansowanymi zmianami w przebiegu CVD (stopień C5 i C6 wg klasyfikacji CEAP). Warto podkreślić, że metaanaliza dostępnych wyników badań nie wykazała, aby dawka 1000 mg na dobę calcium dobesilate była mniej skuteczna od dawki 1500 mg. Działania niepożądane odnotowano u 0–39% chorych (w zależności od analizowanej populacji), z podobną częstością w grupie przyjmującej lek i w grupie otrzymującej placebo [22].
Rabe i wsp. opublikowali dane z randomizowanego, podwójnie zaślepionego badania na grupie 256 chorych (C3–C5 wg klasyfikacji CEAP). W trakcie badania pacjenci przez 8 tygodni otrzymywali CaD w dawce 3 razy dziennie 500 mg (132 chorych) lub placebo (124 chorych). Skuteczność leku oceniono na podstawie wpływu na zmiany objętości kończyn dolnych i redukcji objawów podmiotowych, tj. bólu, uczucia zmęczenia lub ciężkości kończyn, mrowienia, świądu i kurczy. Pomiary wolumetryczne wykazały istotną statystycznie (p < 0,001) redukcję objętości kończyn w porównaniu z grupą kontrolną stosującą placebo, w której obserwowano przyrost objętości [23].
Metaanaliza dotycząca stosowania calcium dobesilate w CVD, którą przeprowadzili Martinez-Zapata i wsp. w 2016 r., wykazała wyższą skuteczność CaD względem placebo w leczeniu obrzęków – większa redukcja obwodu łydki [24].
Jak każdy lek, również calcium cobesilate może powodować działania niepożądane. Ważne jest, że nie stwierdzono występowania interakcji preparatu z innymi lekami. Rzadko mogą wystąpić zaburzenia ze strony przewodu pokarmowego (takie jak biegunka, ból w nadbrzuszu, nudności, wymioty), bóle stawów, skórne reakcje nadwrażliwości (wysypka, pokrzywka). Dobezylan wapnia w rzadkich przypadkach może powodować agranulocytozę, związaną prawdopodobnie z reakcją nadwrażliwości. Agranulocytoza może się objawiać wysoką gorączką, zakażeniami w obrębie jamy ustnej (zapaleniem
gardła i migdałków), stanami zapalnymi w obrębie odbytu i narządów płciowych. Należy poinformować pacjenta, że w przypadku pojawienia się jakichkolwiek objawów zakażenia podczas stosowania CaD powinien się skontaktować z lekarzem. Wystąpienie wymienionych objawów jest wskazaniem do odstawienia leku i wykonania badania morfologii krwi z rozmazem.
Podsumowując – wśród leków wenoaktywnych stosowanych w leczeniu objawów CVD jednym z najbardziej rekomendowanych jest calcium dobesilate. Korzyści z jego stosowania zostały potwierdzone w badaniach naukowych. Zalecanie CaD w leczeniu objawowym przewlekłej choroby żylnej może się przyczynić do poprawy jakości życia w tej grupie chorych i opóźnić postęp choroby.
Piśmiennictwo
1. Beebe-Dimmer JL, Pfeifer JR, Engle JS, Schottenfeld D. The epidemiology of chronic venous insufficiency and varicose veins. Ann Epidemiol 2005; 15: 175-184.
2. Widmer LK. Peripheral venous disorders: prevalence and socio-medical importance. Observations in 4529 apparently healthy persons. Basle Study III. Hans Huber Publisher, Bern 1978.
3. Coon WW, Willis PW, Keller JB. Venous thromboembolism and other venous disease in the Tecumseh Community Health Study. Circulation 1973; 48: 839.
4. Robertson LA, Evans CJ, Lee AJ i wsp. Incidence andrisk factors for venous reflux in the general population: Edinburgh Vein Study. Eur J Vasc Endovasc Surg 2014; 48: 208-214.
5. Lee AJ, Robertson LA, Boghossian SM i wsp. Progression of varicose veins and chronic venous insufficiency in the general population in the Edinburgh Vein Study. J Vasc Surg Venous Lymphat Disord 2015; 3: 18-26.
6. Schultz-Ehrenburg U, Reich-Schupke S, Robak-Pawelczyk B i wsp. Prospective epidemiological study on the beginning of varicose veins. Bochum Study I-IV. Phlebologie 2009; 38: 17-25.
7. Jawień A, Grzela T, Ochwat A. Prevalence of chronic venous insufficiency in men and women in Poland: multicentre cross-sectional study in 40,095 patients. Phlebology 2003; 18: 110-122.
8. Mosti G, Partsch H. Bandages or double stockings for the initial therapy of venous oedema? A randomized, controlled pilotstudy. Eur J Vasc Endovasc Surg 2013; 46: 142-148.
9. Nicolaides A, Kakkos S, Baekgaard N i wsp. Management of chronic venous disorders of the lower limbs. Guide lines according to scientific evidence. Part I. Int Angiol 2018; 37: 181-254.
10. De Maeseneer MG, Kakkos SK, Aherne T i wsp. Editor’s Choice – European Society for Vascular Surgery (ESVS) 2022 Clinical Practice Guidelines on the management of chronic venous disease of the lower limbs. Eur J Vasc Endovasc Surg 2022; 63: 184-267.
11. Krasiński Z, Błaszak J, Begier-Krasińska A. Wazoprotekcja układu naczyniowego w świetle aktualnych rekomendacji. Lekarz POZ 2022; 8: 297-302.
12. Androulakis G, Panoysis PA. Plethysmographic confirmation of the beneficial effect of calcium dobesilate in primary varicose veins. Angiology 1989; 40: 1-4.
13. Brunet J, Farine JC, Garay RP, Hannaert P. In vitro antioxidant properties of calcium dobesilate. Fundam Clin Pharmacol 1998; 12: 205-212.
14. Alda O, Valero MS, Pereboom D i wsp. In vitro effect of calcium dobesilate on oxidative/inflammatory stress in human varicose veins. Phlebology 2011; 26: 332-337.
15. Tinsley JH, Wu MH, Ma W i wsp. Activated neutrophils induce hyperpermeability and phosphorylation of adherens junction proteins in coronary venular endothelial cells. J Biol Chem 1999; 274: 24930-24934.
16. He P, Wang J, Zeng M. Leukocyte adhesion and microvessel permeability. Am J Physiol Heart Circ Physiol 2000; 278: H1686- H1694.
17. DiStasi MR, Ley K. Opening the flood-gates: how neutrophil-endothelial interactions regulate permeability. Trends Immunol 2009; 30: 547-556.
18. Curry FR, Noll T. Spotlight on microvascular permeability. Cardiovasc Res 2010; 87: 195-197.
19. He P. Leucocyte/endothelium interactions and microvessel permeability: coupled or uncoupled? Cardiovasc Res 2010; 87: 281-90.
20. Brunet J, Farine JC, Garay RP, Hannaert P. Angioprotective action of calcium dobesilate against reactiveoxygen species-induced capillary permeability in the rat. Eur J Pharmacol 1998; 358: 213-220.
21. Hannaert P, Brunet J, Farine JC, Garay RP. Antioxidant-angioprotective actions of calcium dobesilate indiabetic rats. Int J Angiol 1999; 8: 2-4.
22. Ciapponi A, Laffaire E, Roque M. Calcium dobesilate for chronic venousinsufficiency: a systematic review. Angiology 2004; 55: 147-154.
23. Rabe E, Jaeger KA, Bulitta M, Pannier F. Calcium dobesilate in patients suffering from chronic venous insufficiency: a double-blind, placebo-controlled, clinical trial. Phlebology 2011; 26: 162-168.
24. Martinez-Zapata MJ, Vernooij RW, Uriona Tuma SM i wsp. Phlebotonics for venous insufficiency. Cochrane Database Syst Rev 2016; 4: CD003229.


Celem niniejszego artykułu jest przedstawienie w sposób skrótowy i usystematyzowanie wiedzy przydatnej w leczeniu zachowawczym CVD we wczesnym stadium zaawansowania tej rozpowszechnionej choroby i przybliżenie wskazań z obszernych dokumentów, jakimi są wytyczne opublikowane w ostatnich latach.
Przewlekła choroba żylna manifestująca się utrwalonymi objawami jest określana jako przewlekła niewydolność żylna (chronic venous insufficiency – CVI). Cechą różnicującą CVD i CVI jest to, że CVI oznacza bardziej zaawansowane postaci CVD. W związku z powyższym CVI obejmuje takie objawy, jak przebarwienia skóry, egzema, lipodermatosclerosis, atrophie blanche z wygojonymi lub czynnymi owrzodzeniami. Objawy związane z CVI są bardzo rozpowszechnione i mają duży wpływ zarówno na indywidualny stan zdrowia pacjenta, jak i całe systemy opieki zdrowotnej. Szacuje się, że żylaki kończyn dolnych występują u ok. 5–30% dorosłej populacji, chociaż w różnych doniesieniach odsetek ten wynosi od 1% aż do 70% [1]. Wyniki prospektywnego badania przeprowadzonego w Szwajcarii potwierdziły występowanie żylaków kończyn dolnych u 19% mężczyzn i 25% kobiet [2]. Zmiany skórne w przebiegu CVI odnotowano u 3% mężczyzn i 3,7% kobiet w badaniu Tecumseh, a chorobowość niezależnie od płci znacznie wzrastała z wiekiem i wynosiła w grupie osób w wieku 30–39 lat 1,8% dla kobiet (wzrost do 20,7% po 70. roku życia) i 1,1% dla mężczyzn (wzrost do 24,2% po 70. roku życia) [3].
Przewlekła niewydolność żylna z definicji jest utrwalonym zaburzeniem odpływu krwi żylnej z kończyn dolnych. Co to oznacza w praktyce? Prawdopodobnie większość osób spędzających dużo czasu w pozycji siedzącej będzie miała po kilku – kilkunastu godzinach objawy w postaci ciężkości nóg, obrzęków czy kurczy. Jeśli jest to spowodowane tylko brakiem ruchu i słabym używaniem pompy mięśniowej, to objawy te ustąpią, kiedy osoby te zaczną się ruszać i ich aktywność fizyczna będzie na normalnym poziomie. Jeśli objawy nie będą ustępowały mimo aktywności, to w tej grupie powinniśmy podejrzewać przewlekłą niewydolność żylną. Objawy związane z CVI są bardzo rozpowszechnione i mają duży wpływ na indywidualny stan zdrowia pacjenta, jego jakość życia, a także na system opieki zdrowotnej [4, 5]. Spora część chorych nie ma objawów widocznych gołym okiem, ale skarży się na kurcze nocne, bóle łydek pod koniec dnia czy tzw. objaw niespokojnych nóg.
Naturalny postęp CVD oceniono w wieloletniej obserwacji w badaniu Bochum I–IV. Początkowo obejmowało ono 740 uczniów w wieku 10–12 lat (Bochum I), z których 136 było poddawanych okresowej kontroli do wieku 30 lat (Bochum IV). Badanie to wykazało, że bezobjawowy refluks żylny w żyle odpiszczelowej stwierdzony w młodej populacji wiązał się z 30-procentowym ryzykiem wystąpienia żylaków w ciągu 4 lat [6]. Te dane pokazują ważną praktyczną informację, że przewlekła choroba żylna może się pojawić wcześnie w naszym życiu i ma dużą tendencję do progresji. Do czynników predysponujących do wystąpienia CVD należą: obciążenia genetyczne/rodzinne (nie ma jednego genu związanego z dziedziczeniem predyspozycji do żylaków), wiek (im starszy, tym większe ryzyko), alkoholizm, stojąca lub siedząca (statyczna) pozycja pracy, ciąża i przebyte porody, płeć żeńska, stosowanie środków antykoncepcyjnych, zaburzenia hormonalne. Można też wskazać czynniki wywołujące lub nasilające. Wśród nich wyróżnia się czynniki działające stopniowo (progresywnie), takie jak starzenie się, czynniki działające w krótkim okresie, np. ciąża, oraz czynniki działające skrycie, np. przebyta zakrzepica żył głębokich, menopauza. Za istotny czynnik ryzyka zawsze uważano płeć żeńską, choć najnowsze badania wskazują, że w krajach uprzemysłowionych różnice między płciami się zacierają. Inne czynniki behawioralne, takie jak palenie tytoniu, aktywność fizyczna, dieta uboga w błonnik, również mogą mieć znaczenie. W Polsce badania przeprowadzone przez prof. Jawienia, które określały częstość występowania CVI u chorych zgłaszających się do lekarza, wykazały, że dotyczy ona ok. 40% kobiet i 30% mężczyzn [7].
Początek diagnostyki zawsze powinien być związany z lekarzem pierwszego kontaktu/rodzinnym. Ma to bardzo ważne uzasadnienie. Po pierwsze pozwoli wykluczyć inne choroby o ostrym przebiegu, np. zakrzepicę żył głębokich czy różę. Po drugie pozwoli różnicować CVD z innymi schorzeniami, np. stawowymi. Po trzecie wizyta u specjalisty musi mieć uzasadnienie, a dodatkowo często wiąże się z kilkumiesięcznym oczekiwaniem. Należy podkreślić, że lekarz rodzinny może zalecić leczenie zachowawcze, które może być wystarczające i zupełnie zlikwidować objawy, jak pozwoli różnicować CVD z innymi schorzeniami, np. stawowymi. Po trzecie wizyta u specjalisty musi mieć uzasadnienie, a dodatkowo często wiąże się z kilkumiesięcznym oczekiwaniem. Należy podkreślić, że lekarz rodzinny może zalecić leczenie zachowawcze, które może być wystarczające i zupełnie zlikwidować objawy, jak również spowolnić lub zahamować postęp CVD.
W zaleceniach ogólnych należy dążyć do obniżenia ciśnienia w układzie żylnym poprzez elewację kończyn, zwiększenie aktywności ruchowej oraz w wybranych przypadkach redukcję masy ciała. Używanie wyrobów uciskowych jest obligatoryjne, jeśli tylko nie ma ku temu przeciwwskazań. Dodatkowo włącza się leki flebotropowe, np. dobezylan wapnia (calcium dobesilate – CaD). W przypadku niezadowalających wyników stosuje się leczenie inwazyjne. Zawsze należy uwzględnić anatomię i patofizjologię CVD, a także preferencje pacjenta. Powszechność występowania CVD jest związana ze starzeniem się społeczeństwa, zmianami w nawykach żywieniowych i mniejszą aktywnością ruchową. Powinno to skłaniać do wysoce selektywnego i bardzo spersonalizowanego dobierania terapii. Dane z dużych badań wskazują, że na świecie CVD dotyka 84% dorosłych pacjentów przyjmowanych przez lekarzy POZ (średnia wieku: 50,6 roku), przy czym 64% z nich sklasyfikowano jako mających wynik CEAP od C1 do C6, a 20% jest w grupie C0s [8]. Klasyfikacja CEAP (clinical class – C, etiology – E, anatomy – A, pathophysiology – P) systematyzuje objawy chorobowe, ich przyczynę i lokalizację, a dodanie litery s oznacza zmiany objawowe. Pacjenci z CVD we wczesnym stadium (C0) mają objawy podmiotowe związane z chorobą (uczucie ciężkości w pozycji stojącej, zespół niespokojnych nóg, obrzęki – zwłaszcza wieczorem), ale nie występują u nich widoczne objawy kliniczne. Postęp choroby skutkuje rozwojem kolejnych jej stadiów, tj. teleangiektazji (C1), żylaków (C2), obrzęków (C3), hiperpigmentacji lub lipodermatosklerozy (C4) i najwyższej formy zaawansowania – owrzodzenia żylnego (zagojone C5, czynne C6). Żylaki kończyn dolnych (C2) występują u 25–40% dorosłych, a wyższe stopnie zaawansowane choroby (C3–C6) stwierdza się u 17–20% populacji.
Praktycznym wnioskiem z powyżej przytoczonych danych epidemiologicznych jest to, że chorzy z CVD są w dużej części w wieku produkcyjnym i ok. ¼ z nich ma tylko objawy podmiotowe tej choroby, a więc potrzebuje często leków umożliwiających normalne funkcjonowanie przez uwolnienie od dolegliwości. Coraz lepiej znamy patofizjologię CVI, a w związku z tym możemy określić cele właściwego leczenia farmakologicznego. Należą do nich: zwiększenie opróżniania żył, oddziaływanie na ściany naczyń krwionośnych – zwiększenie tonusu, zmniejszenie przepuszczalności, zmniejszenie gotowości zakrzepowej w układzie chłonnym, ograniczenie niszczenia komórek śródbłonka.
Główne wskazania do stosowania leków nazywanych ogólnie flebotropowymi lub wenoaktywnymi obejmują objawy związane z zaburzeniami czynnościowymi układu żylnego kończyn dolnych (np. bóle nóg, uczucie ciężkości i zmęczenia nóg, nocne kurcze).
Leki flebotropowe wpływają na zmiany w obrębie naczyń włosowatych, przywracając ich normalną przepuszczalność. Powodują ograniczenie ilości płynu śródmiąższowego, poprawę drenażu chłonnego i w ten sposób zmniejszają obrzęk limfatyczno-żylny oraz dynamiczne przepełnienie układu chłonnego w zaawansowanych stadiach przewlekłej niewydolności żylnej. Dzięki temu ich działanie przerywa błędne koło przewlekłej niewydolności żylnej.
Leki flebotropowe działają profilaktycznie i leczniczo na następstwa przewlekłej niewydolności żylnej. Powinny być stosowane nie zamiast, lecz jako uzupełnienie leczenia bezpośredniego, np. kompresjoterapii. Warto podkreślić, że leczenie farmakologiczne może być stosowane na każdym etapie CVD. Jego oddziaływanie na mikrokrążenie zapobiega powstawaniu obrzęków i odczynów zapalnych oraz towarzyszących im dolegliwości bólowych lub powoduje ich zmniejszenie. Często się zdarza, że pacjenci są bardziej zdyscyplinowani w kwestii zażywania leków niż noszenia pończoch. Dzięki ostatnim wytycznym leczenia CVD farmakoterapia lekami wenoaktywnymi (venoactiv drugs – VADs) została bardziej usystematyzowana [8, 9]. Mylące jest jednak to, że niejako z automatu stawia się znak równości między różnymi substancjami zaliczanymi do tej grupy. Brakuje publikacji w sposób obiektywny porównujących działanie tych leków, a większość dostępnego piśmiennictwa, a co za tym idzie – wytycznych, oparta jest na pracach dotyczących pojedynczych preparatów. Zalecenia mówią o przydatności całej grupy leków wenoaktywnych w leczeniu objawowym CVD, choć wyjątkiem jest stopień 6 w klasyfikacji CEAP, gdzie zdecydowanie rekomenduje się tylko kilka z nich [8, 9]. Schemat postępowania w leczeniu przewlekłej choroby żylnej na podstawie wytycznych European Society Vascular Surgery (ESVS ) z 2022 r. przedstawiono na rycinie 1 [9].

Opcje postępowania z pacjentami we wczesnym stadium przewlekłej choroby żylnej CVD (od C0 do C2) obejmują leki wenoaktywne, które mogą być stosowane samodzielnie lub w połączeniu z leczeniem interwencyjnym (np. skleroterapią), leczenie operacyjne lub zabiegi wewnątrznaczyniowe. Celem takiego postępowania u chorych z CVD jest złagodzenie lub usunięcie klinicznych objawów choroby (pajączki, żylaki) i zapobieganie jej postępowi. W takim podejściu silne uzasadnienie ma leczenie chorych już w najniższym stopniu zaawansowania CVD (C0s). Włączenie postępowania leczniczego przy pojawianiu się objawów podmiotowych przewlekłej choroby żylnej, w tym zmiana stylu życia (np. redukcja wagi, większa aktywność fizyczna, rezygnacja z noszenia butów na wysokim obcasie, unikanie wysokich temperatur), może spowolnić przebieg choroby, a w konsekwencji zapobiegać lub opóźniać początek poważniejszych objawów oraz nieodwracalnych zmian w obrębie struktury ścian naczyń żylnych [10].
W leczeniu zachowawczym CVD stosuje się cztery sposoby postępowania, które nie są dla siebie alternatywą, lecz mogą – a często powinny – być stosowane razem. Należą do nich leczenie uciskiem (kompresjoterapia), drenaż ułożeniowy, ćwiczenia fizyczne (fizjoterapia) oraz leczenie farmakologiczne. Z całą mocą należy podkreślić, że mówimy tu
o lekach, a nie o suplementach diety, które często przez brak odpowiedniego efektu leczniczego zniechęcają pacjentów do farmakoterapii.
O wszystkich tych metodach należy myśleć jako uzupełniających się wzajemnie i tak też edukować chorych z CVD. Wskazane jest monitorowanie dwukierunkowe – z jednej strony progresji choroby, z drugiej zaś skuteczności zaleconej terapii. Można to robić, dokumentując poprawę w zakresie oznak i objawów, a także jakości życia oraz parametrów morfologicznych i czynnościowych żył. Wynik leczenia CVD zależy w dużym stopniu od obrazu klinicznego. Zawsze należy brać pod uwagę preferencje chorych i akceptację różnych metod leczenia. Główny mechanizm działania VADs to zmniejszenie przepuszczalności naczyń włosowatych, zmniejszenie aktywności mediatorów zapalnych i poprawa tonusu żylnego. Obecnie możemy się posłużyć aktualną interpretacją wpływu poszczególnych leków na objawy przedmiotowe i podmiotowe opublikowaną w dwóch ważnych dokumentach: Management of chronic venous disorders of the lower limbs oraz Clinical practice guidelines on the management of chronic venous disease of the lower limbs [8, 9]. Autorzy tych wytycznych opartych nadowodach naukowych podsumowali dotychczasowe metaanalizy, skutecznie wykluczając badanianiewiarygodne. W efekcie uzyskano spójne dane
potwierdzające istotne znaczenie VADs w leczeniuCVI w monoterapii we wczesnych stadiach choroby lub w terapii skojarzonej z zabiegami interwencyjnymi w zaawansowanych stadiach. Wpływ VADs na objawy podmiotowe związane z CVD zestawiono w tabeli 1 [11].

Większość VADs jest pochodzenia roślinnego. Składają się one z czystych substancji, wyciągów roślinnych, syntetycznych cząsteczek wzorowanych na naturalnych molekułach, z połączenia kilku aktywnych substancji lub z wyciągów roślinnych o budowie niedokładnie poznanej [12]. Jak można zauważyć (tab. 1), wymienione leki nie działają na wszystkie objawy podmiotowe CVD [11]. Największe spektrum wskazań związanych z objawami podmiotowymi pokrywają calcium dobesilate, wyciąg z ruszczyka oraz zmikronizowana, oczyszczona frakcja flawonowa (micronised purified flavonoid fraction – MPFF). Ponadto z uwagi na niskie wskaźniki przestrzegania zaleceń dotyczących kompresjoterapii, zwłaszcza kiedy jest ciepło (lato czy ogrzewanie domów), VADs mogą być jedyną dostępną opcją leczenia [11].
Obecne wytyczne odnoszące się do grupy chorych z przewlekłymi chorobami żył sugerują stosowanie VADs jako opcji leczenia w przypadku obrzęku i objawów podmiotowych powodowanych przez przewlekłą chorobę żylną [12].
Wszystkie powyżej wspomniane zalecania i wytyczne jednomyślnie rekomendują wyraźne rozróżnienie leków od suplementów diety i jednoznacznienie zalecają stosowania tych drugich u chorych z CVD [9].
Z praktycznego punktu widzenia najbardziej formalne i obiektywne wnioski można wyciągnąć z przeglądów systematycznych i metaanaliz dotyczących leków stosowanych w CVD. Metaanalizy miały największy wpływ na tworzenie wytycznych ESVS 2022 [9, 12].
Potwierdzenie przydatności CaD w leczeniu CVD wynika z wielu przeprowadzonych badań. Według charakterystyki produktu leczniczego (ChPL) CaD działa na ściany naczyń włosowatych, zmniejszając ich nadmierną przepuszczalność i zwiększając wytrzymałość. Dobezylan wapnia zwiększa elastyczność erytrocytów, a u pacjentów z retinopatią cukrzycową zmniejsza nadmierną lepkość krwi, poprawiając jej właściwości reologiczne. Jego działanie antyagregacyjne polega na hamowaniu agregacji płytek wywołanej przez kolagen i trombinę, bez wpływu na agregację stymulowaną przez kwas arachidonowy. Do zmniejszenia lepkości krwi dochodzi poprzez zmianę składu białek osocza oraz normalizację mechanicznych właściwości krwinek czerwonych (zwiększona odkształcalność). Dodatkowo działanie to jest zwiększane dzięki właściwościom antyagregacyjnym. Wymienione działania powodują usprawnienie obwodowego krążenia żylnego, zmniejszając zastój w naczyniach żylnych i hamując rozwój zmian zakrzepowych towarzyszących powstawaniu żylaków, zwłaszcza kończyn dolnych. Dobezylan wapnia zmniejsza przepuszczalność naczyń limfatycznych i ich łamliwość, poprawia drenaż układu limfatycznego, powodując zmniejszenie obrzęków, zwiększa napięcie naczyń żylnych oraz ma właściwości antyoksydacyjne [13–15]. Wykazano, że patofizjologia obrzęków występujących w przebiegu przewlekłej choroby żylnej jest związana nie tylko z nadmierną przepuszczalnością wynikającą z podwyższonego ciśnienia w mikronaczyniach. Potwierdzono znaczenie mechanizmów zapalnych w patologicznej przepuszczalności ściany naczyń, w tym wpływu neutrofili na śródbłonek. Polega on na ich aktywacji, przyleganiu i migracji oraz uwalnianiu reaktywnych form tlenu [16–20]. Dobezylan wapnia jako przeciwutleniacz i lek o działaniu przeciwzapalnym hamuje powstawanie obrzęku, zmniejszając przepuszczalność naczyń włosowatych [21, 22].
Metaanaliza z 2004 r., której autorami są Ciapponi i wsp., obejmowała systematyczny przegląd skuteczności leczenia CaD w odniesieniu do poszczególnych objawów CVD. Uwzględniono w niej wyniki siedmiu badań klinicznych, w których łącznie uczestniczyło 778 chorych. Dobezylan wapnia podawany doustnie przez 4 tygodnie istotnie zmniejszał nasilenie objawów podmiotowych związanych z CVD, takich jak kurcze nocne i uczucie dyskomfortu. Największe subiektywne korzyści w zakresie zmniejszenia dolegliwości bólowych, uczucia ciężkości i obrzęku kończyn osiągnęli pacjenci z najbardziej zaawansowanymi zmianami w przebiegu CVD (stopień C5 i C6 wg klasyfikacji CEAP). Warto podkreślić, że metaanaliza dostępnych wyników badań nie wykazała, aby dawka 1000 mg na dobę calcium dobesilate była mniej skuteczna od dawki 1500 mg. Działania niepożądane odnotowano u 0–39% chorych (w zależności od analizowanej populacji), z podobną częstością w grupie przyjmującej lek i w grupie otrzymującej placebo [22].
Rabe i wsp. opublikowali dane z randomizowanego, podwójnie zaślepionego badania na grupie 256 chorych (C3–C5 wg klasyfikacji CEAP). W trakcie badania pacjenci przez 8 tygodni otrzymywali CaD w dawce 3 razy dziennie 500 mg (132 chorych) lub placebo (124 chorych). Skuteczność leku oceniono na podstawie wpływu na zmiany objętości kończyn dolnych i redukcji objawów podmiotowych, tj. bólu, uczucia zmęczenia lub ciężkości kończyn, mrowienia, świądu i kurczy. Pomiary wolumetryczne wykazały istotną statystycznie (p < 0,001) redukcję objętości kończyn w porównaniu z grupą kontrolną stosującą placebo, w której obserwowano przyrost objętości [23].
Metaanaliza dotycząca stosowania calcium dobesilate w CVD, którą przeprowadzili Martinez-Zapata i wsp. w 2016 r., wykazała wyższą skuteczność CaD względem placebo w leczeniu obrzęków – większa redukcja obwodu łydki [24].
Jak każdy lek, również calcium cobesilate może powodować działania niepożądane. Ważne jest, że nie stwierdzono występowania interakcji preparatu z innymi lekami. Rzadko mogą wystąpić zaburzenia ze strony przewodu pokarmowego (takie jak biegunka, ból w nadbrzuszu, nudności, wymioty), bóle stawów, skórne reakcje nadwrażliwości (wysypka, pokrzywka). Dobezylan wapnia w rzadkich przypadkach może powodować agranulocytozę, związaną prawdopodobnie z reakcją nadwrażliwości. Agranulocytoza może się objawiać wysoką gorączką, zakażeniami w obrębie jamy ustnej (zapaleniem
gardła i migdałków), stanami zapalnymi w obrębie odbytu i narządów płciowych. Należy poinformować pacjenta, że w przypadku pojawienia się jakichkolwiek objawów zakażenia podczas stosowania CaD powinien się skontaktować z lekarzem. Wystąpienie wymienionych objawów jest wskazaniem do odstawienia leku i wykonania badania morfologii krwi z rozmazem.
Podsumowując – wśród leków wenoaktywnych stosowanych w leczeniu objawów CVD jednym z najbardziej rekomendowanych jest calcium dobesilate. Korzyści z jego stosowania zostały potwierdzone w badaniach naukowych. Zalecanie CaD w leczeniu objawowym przewlekłej choroby żylnej może się przyczynić do poprawy jakości życia w tej grupie chorych i opóźnić postęp choroby.
Piśmiennictwo
1. Beebe-Dimmer JL, Pfeifer JR, Engle JS, Schottenfeld D. The epidemiology of chronic venous insufficiency and varicose veins. Ann Epidemiol 2005; 15: 175-184.
2. Widmer LK. Peripheral venous disorders: prevalence and socio-medical importance. Observations in 4529 apparently healthy persons. Basle Study III. Hans Huber Publisher, Bern 1978.
3. Coon WW, Willis PW, Keller JB. Venous thromboembolism and other venous disease in the Tecumseh Community Health Study. Circulation 1973; 48: 839.
4. Robertson LA, Evans CJ, Lee AJ i wsp. Incidence andrisk factors for venous reflux in the general population: Edinburgh Vein Study. Eur J Vasc Endovasc Surg 2014; 48: 208-214.
5. Lee AJ, Robertson LA, Boghossian SM i wsp. Progression of varicose veins and chronic venous insufficiency in the general population in the Edinburgh Vein Study. J Vasc Surg Venous Lymphat Disord 2015; 3: 18-26.
6. Schultz-Ehrenburg U, Reich-Schupke S, Robak-Pawelczyk B i wsp. Prospective epidemiological study on the beginning of varicose veins. Bochum Study I-IV. Phlebologie 2009; 38: 17-25.
7. Jawień A, Grzela T, Ochwat A. Prevalence of chronic venous insufficiency in men and women in Poland: multicentre cross-sectional study in 40,095 patients. Phlebology 2003; 18: 110-122.
8. Mosti G, Partsch H. Bandages or double stockings for the initial therapy of venous oedema? A randomized, controlled pilotstudy. Eur J Vasc Endovasc Surg 2013; 46: 142-148.
9. Nicolaides A, Kakkos S, Baekgaard N i wsp. Management of chronic venous disorders of the lower limbs. Guide lines according to scientific evidence. Part I. Int Angiol 2018; 37: 181-254.
10. De Maeseneer MG, Kakkos SK, Aherne T i wsp. Editor’s Choice – European Society for Vascular Surgery (ESVS) 2022 Clinical Practice Guidelines on the management of chronic venous disease of the lower limbs. Eur J Vasc Endovasc Surg 2022; 63: 184-267.
11. Krasiński Z, Błaszak J, Begier-Krasińska A. Wazoprotekcja układu naczyniowego w świetle aktualnych rekomendacji. Lekarz POZ 2022; 8: 297-302.
12. Androulakis G, Panoysis PA. Plethysmographic confirmation of the beneficial effect of calcium dobesilate in primary varicose veins. Angiology 1989; 40: 1-4.
13. Brunet J, Farine JC, Garay RP, Hannaert P. In vitro antioxidant properties of calcium dobesilate. Fundam Clin Pharmacol 1998; 12: 205-212.
14. Alda O, Valero MS, Pereboom D i wsp. In vitro effect of calcium dobesilate on oxidative/inflammatory stress in human varicose veins. Phlebology 2011; 26: 332-337.
15. Tinsley JH, Wu MH, Ma W i wsp. Activated neutrophils induce hyperpermeability and phosphorylation of adherens junction proteins in coronary venular endothelial cells. J Biol Chem 1999; 274: 24930-24934.
16. He P, Wang J, Zeng M. Leukocyte adhesion and microvessel permeability. Am J Physiol Heart Circ Physiol 2000; 278: H1686- H1694.
17. DiStasi MR, Ley K. Opening the flood-gates: how neutrophil-endothelial interactions regulate permeability. Trends Immunol 2009; 30: 547-556.
18. Curry FR, Noll T. Spotlight on microvascular permeability. Cardiovasc Res 2010; 87: 195-197.
19. He P. Leucocyte/endothelium interactions and microvessel permeability: coupled or uncoupled? Cardiovasc Res 2010; 87: 281-90.
20. Brunet J, Farine JC, Garay RP, Hannaert P. Angioprotective action of calcium dobesilate against reactiveoxygen species-induced capillary permeability in the rat. Eur J Pharmacol 1998; 358: 213-220.
21. Hannaert P, Brunet J, Farine JC, Garay RP. Antioxidant-angioprotective actions of calcium dobesilate indiabetic rats. Int J Angiol 1999; 8: 2-4.
22. Ciapponi A, Laffaire E, Roque M. Calcium dobesilate for chronic venousinsufficiency: a systematic review. Angiology 2004; 55: 147-154.
23. Rabe E, Jaeger KA, Bulitta M, Pannier F. Calcium dobesilate in patients suffering from chronic venous insufficiency: a double-blind, placebo-controlled, clinical trial. Phlebology 2011; 26: 162-168.
24. Martinez-Zapata MJ, Vernooij RW, Uriona Tuma SM i wsp. Phlebotonics for venous insufficiency. Cochrane Database Syst Rev 2016; 4: CD003229.


Źródło:
Lekarz POZ 2/2023 Zbigniew Krasiński, Klinika Chirurgii Naczyniowej, Wewnątrznaczyniowej, Angiologii i Flebologii, Instytut Chirurgii, Uniwersytet Medyczny w Poznaniu
Lekarz POZ 2/2023 Zbigniew Krasiński, Klinika Chirurgii Naczyniowej, Wewnątrznaczyniowej, Angiologii i Flebologii, Instytut Chirurgii, Uniwersytet Medyczny w Poznaniu




