Fondaparynuks – alternatywa dla heparyn nie tylko w czasach ich niedoboru
W dobie stałej obecności heparyn drobnocząsteczkowych na "liście antywywozowej" Ministerstwa Zdrowia oraz możliwego ograniczenia podaży z powodu trwającej epidemii Covid-19 warto brać pod uwagę alternatywne możliwości.
Heparyna, w postaci niefrakcjonowanej oraz drobnocząsteczkowej/frakcjonowanej, jest powszechnie stosowana w praktyce klinicznej. Do podstawowych wskazań dla heparyny niefrakcjonowanej należą: leczenie zakrzepowego zapalenia żył głębokich oraz ostrych obwodowych zatorów tętniczych i zatoru tętnicy płucnej jak również hemodializa, natomiast heparyny drobnocząsteczkowe (HDCz), znajdują przede wszystkim zastosowanie w zapobieganiu żylnej chorobie zakrzepowo-zatorowej (ŻChZZ) w chirurgii (np. u pacjentów poddawanych zabiegom ortopedycznym, zabiegom w chirurgii ogólnej i onkologicznej), u unieruchomionych pacjentów internistycznych (np. z niewydolnością serca, ciężkimi infekcjami). Dodatkowo są wskazane w leczeniu zakrzepicy żył głębokich i zatorowości płucnej oraz znalazły zastosowanie w leczeniu ostrych zespołów wieńcowych.
Mechanizm działania heparyny niefrakcjonowanej i HDCz jest podobny, lecz nie całkowicie jednakowy. Niefrakcjonowana heparyna jest siarczanowanym polisacharydem o masie cząsteczkowej zakres od 3000 do 30 000 Da (średnio 15 000 Da) obdarzonym ładunkiem ujemnym (heparyna jest najsilniej naładowanym biopolimerem występującym naturalnie). Zbudowana jest z powtarzających się jednostek disacharydowych: kwas iduronowy/kwas glukuronowy-glukozamina. Działanie przeciwzakrzepowe heparyny jest uwarunkowane wiązaniem się sekwencji pentasacharydowej heparyny z antytrombiną, co umożliwia zwiększa jej aktywność wobec trombiny i aktywowanego czynnika X (czynnik Xa). Interakcja z trombiną lub też czynnikiem Xa zależy od wielkości cząsteczki heparyny. Cząsteczki heparyny zawierające 18 lub więcej jednostek sacharydowych (o masie cząsteczkowej > 5400 Da) posiadają wielkość umożliwiającą wiązanie antytrombiny z trombiną. Cząsteczki heparyny o mniejszej masie, tj. HDCz (średnia masa cząsteczkowa 5000 Da, ~ 17 jednostek sacharydowych stanowiące co najmniej połowę wszystkich cząsteczek HDCz) są zbyt krótkie, aby zapewnić wiązanie antytrombiny z trombiną, natomiast nadal możliwe jest wiązanie z czynnikiem Xa. Stosunek aktywności wobec czynnika Xa vs. czynnika IIa (trombiny) wynosi od 3:1 do 2:1, w zależności od rodzaju HDCz. Oprócz wiązania z czynnikami krzepnięcia poprzez antytrombinę, heparyna obdarzona ładunkiem ujemnym oddziałuje z dodatnio naładowanymi cząsteczkami (błonami biologicznymi, białkami), co poszerza zakres jej biologicznego działania (np. małopłytkowość, osteopenia) oraz warunkuje właściwości farmakokinetyczne (wiązanie z makrofagami i komórkami śródbłonka). Oddziaływania zależne od ładunku są znacznie silniej wyrażone w przypadku heparyny niefrakcjonowanej (Hirsh et al., 2001).
Fondaparynuks, będący rezultatem ewolucji heparyny, składa się jedynie z sekwencji pentasacharydowej, warunkującej przeciwzakrzepowe działanie heparyny (niefrakcjonowanej i drobnocząsteczkowej). Fondaparynuks poprzez wybiórcze i odwracalne łącznie się z cząsteczką antytrombiny zwiększa jej aktywność inaktywującą czynnik Xa układu krzepnięcia (powstały kompleks nie wiąże się z trombiną). Wykazano, że fondaparinux zwiększa hamujący wpływ antytrombiny na czynnik Xa aż 300-krotnie i wykazuje 7-krotnie silniejsze działanie w porównaniu do HDCz (Walenga et al., 2002). Farmakokinetyka
fondaparynuksu, ze względu na brak nieswoistych interakcji z innymi białkami osocza i płytkami krwi, jest bardziej przewidywalna od heparyny (farmakokinetyka liniowa w zakresie dawek od 2 do 8 mg), okres półtrwania leku wynosi ok. 17 godzin, co umożliwia jednokrotne podanie na dobę (stan stacjonarny uzyskuje po 3-4 dniach stosowania). Podobnie jak heparyny, fondaparynuks wydalany jest w postaci niezmienionej z moczem, w związku z tym konieczne jest dostosowanie dawki u pacjentów z niewydolnością nerek Należy również zwrócić uwagę na fakt, że fondaparynuks prawie w całości wiąże się z antytrombiną, co warunkuje swoistość jego działania ograniczoną do hamowania czynnika Xa, a tym samym ogranicza jego działania niepożądane. W przypadku heparyn jedynie około 30% ich łańcuchów polisacharydowych wiąże się z antytrombiną, co jest przyczyną mniej przewidywalnej farmakokinetyki i efektu przeciwkrzepliwego oraz działań niepożądanych m.in. małopłytkowości indukowanej heparyną (HIT, ang. heparin-induced trombocytopenia), których nie obserwuje się podczas stosowania fondaparynuksu. Zakres wskazań terapeutycznych fondaparynuksu jest podobny do heparyn. Lek jest zarejestrowany przez Europejską Agencję Leków (ang. European Medicines Agency, EMA) do stosowania w jednorazowej, podawanej podskórnie dawce dziennej 1,5-2,5 mg w zapobieganiu żylnym incydentom zakrzepowo-zatorowym (VTE, ang. venous thromboembolic events) u dorosłych pacjentów poddawanych dużym operacjom ortopedycznym kończyn dolnych, takich jak operacja złamań okolicy biodrowej, duże zabiegi operacyjne stawu kolanowego lub operacja wymiany stawu biodrowego, poddawanych zabiegom chirurgicznym w obrębie jamy brzusznej, u których istnieje duże ryzyko powikłań zakrzepowo-zatorowych i nie poddawanych leczeniu zabiegowemu, którzy są w grupie dużego ryzyka wystąpienia VTE i którzy są unieruchomieni z powodu ostrej choroby, takiej jak niewydolność serca i (lub) ostre zaburzenia oddechowe i (lub) ostre zakażenia lub choroba zapalna oraz w leczeniu osób dorosłych z ostrą, objawową, samoistną zakrzepicą żył powierzchownych kończyn dolnych bez współistniejącej zakrzepicy żył głębokich; jak również w dawce 5-10 mg w leczeniu ostrej zakrzepicy żył głębokich (DVT, ang. deep vein thrombosis) i ostrego zatoru płucnego (PE, ang. pulmonary embolism), z wyjątkiem pacjentów niestabilnych hemodynamicznie i pacjentów, u których konieczna jest tromboliza lub płucna embolektomia. Ponadto dawka fondaparynuksu 2,5 mg jest wskazana w leczeniu niestabilnej choroby wieńcowej lub zawału mięśnia sercowego bez uniesienia odcinka ST w elektrokardiogramie (UA/NSTEMI) u pacjentów, u których nie ma wskazań do pilnego (< 120 minut) wykonania zabiegu inwazyjnego (PCI) oraz w leczeniu zawału mięśnia sercowego z uniesieniem odcinka ST w elektrokardiogramie (STEMI) u pacjentów leczonych trombolitycznie lub nie poddanych początkowo innemu leczeniu reperfuzyjnemu oraz w leczeniu osób dorosłych z ostrą, objawową, samoistną zakrzepicą żył powierzchownych kończyn dolnych bez współistniejącej zakrzepicy żył głębokich (Arixtra, 2018). Terapia fondaparynuksem nie wymaga monitorowania, należy jednakże dostosować dawkę leku u pacjentów z wagą poniżej 50 kg oraz powyżej 100 kg w przypadku leczenia ŻChZZ.
Przeprowadzone meta-analizy badań klinicznych porównujące fondaparynuks z heparyną, głównie drobnocząsteczkową, wskazują na korzystniejszy profil działania pentasacharydu, uwzględniający zarówno skuteczność jak i działania niepożądane. Kumar et al. opublikowali w 2019 roku metaanalizę (12 kontrolowanych, randomizowanych badań, 14 906 pacjentów), dotyczących okołooperacyjnej chirurgicznej profilaktyki przeciwzakrzepowej z zastosowaniem soli sodowej fondaparynuksu oraz heparyn o małej masie cząsteczkowej. Systematyczna weryfikacja badań wskazuje, że zastosowanie pentasacharydu wiązało się z wyższą skutecznością terapeutyczną, tj. w zakresie zmniejszenia żylnej choroby zakrzepowo-zatorowej, jednakże wiązało się to również ze zwiększonym prawdopodobieństwem poważnego krwawienia. Niemniej jednak fondaparynuks charakteryzował się korzystniejszym ogólnym profilem działania klinicznego w porównaniu do HDCz (Kumar A et al., 2019). Z kolei metaanaliza kontrolowanych, randomizowanych badań klinicznych analizująca działania niepożądane u pacjentów z ostrymi zespołami wieńcowymi, głównie z zawałem mięśnia sercowego bez uniesienia odcinka ST (NSTEMI) (obejmująca 7 badań, 9618 pacjentów) opublikowana w 2017 roku wskazuje, że fondaparynuks może być lepszym wyborem w porównaniu do enoksaparyny w kategoriach krótko- i średnioterminowych krwawień (przy porównywalnej śmiertelności) (Kumar P et al., 2017). Wcześniejsza metaanaliza (z 2016 roku) pacjentów z ostrymi zespołami wieńcowymi (6 badań, 60 000 pacjentów) wykazała, że postępowanie terapeutyczne oparte na fondaparynuksie charakteryzowało się istotnie mniejszą liczbą poważnych niepożądanych zdarzeń sercowo-naczyniowych i dużych krwawień w porównaniu do HDCz. Także porównanie całkowitej klinicznej korzyści (netto) wykazało wyższość fondaparynuksu w odniesieniu do HDCz (Qiao et al. 2016).
Obecnie heparyna (produkowana przez komórki tuczne) jest pozyskiwana prawie wyłącznie z jednego źródła, tj. jelit wieprzowych, choć w niewielkiej ilości (Argentyna, Brazylia) również z płuc wołowych (ze względu na ryzyko zanieczyszczenia prionami wywołującymi gąbczastą encefalopatię bydła, BSE odstąpiono od jej stosowania w większości krajów). W początkowym etapie produkcji oddziela się mechanicznie błonę śluzową jelita, którą następnie poddaje się degradacji i wstępnemu rozdziałowi, prowadzącemu do otrzymania surowej heparyny (będącej mieszaniną wielu komponentów, m.in. resztkowych biomateriałów, takich jak białka, kwasy nukleinowe i lipidy, a sama surowa heparyna stanowi mieszaninę kompleksowych polisacharydów i glikozaminoglikanów, takich jak kwas hialuronowy, siarczan chondroityny, a także dwa dominujące składniki – heparynę i siarczan dermatanu). Przygotowanie surowej heparyny jest zwykle wykonywane w jednostkach nie stosujących procedur GMP (ang. Good Manufacturing Practices), zazwyczaj w Chinach skąd pochodzi ponad 80% światowej produkcji surowej heparyny. Kolejne etapy produkcji, po przetransportowaniu surowej heparyny (zazwyczaj do Europy lub USA), podlegają już procedurom GMP i obejmują m.in. dodatkowe wytrącanie, oczyszczanie, wymianę jonów oraz depirogenację. Po zakończeniu ostatnich etapów produkcji heparyna jest dość dobrze zdefiniowanym materiałem, złożonym głównie z glikozaminoglikanów zawierającym łańcuchy o średniej masie cząsteczkowej w zakresie 12–20 kDa (Shriver et al., 2012). W przypadku heparyn drobnocząsteczkowych przeprowadza się dodatkową depolimeryzację (chemiczna β-eliminacja, enzymatyczna depolimeryzacja, depolimeryzacja kwasem azotawym, oksydacyjne rozszczepianie) prowadzącą do otrzymania glikozaminoglikanów o średniej masie cząsteczkowej ok. 4 kDa.
Otrzymywanie heparyny jest więc całkowicie uzależnione od dostępności surowca biologicznego o odpowiedniej jakości, głównie jelit wieprzowych. Pierwszy światowy kryzys zaopatrzenia w heparynę obserwowano w 2007 roku. Był on spowodowany ograniczeniem dostępności surowca do produkcji heparyny wywołanym znacznym zmniejszeniem populacji świń w Chinach przez wysoce zakaźnego wirusa zespołu rozrodczo-oddechowego świń (PRRS). Producenci surowej heparyny wobec braku dostępności surowca i konieczności/chęci wywiązania się z umów kontraktowych świadomie zanieczyszczali surową heparynę przesulfonowanym siarczanem chondroityny (OSCS) o podobnej do heparyny charakterystyce chromatograficznej utrudniającej jego wykrycie. OSCS będący półsyntetycznym polimerem uzyskiwanym przez chemiczne sulfonowanie siarczanu chondroityny wykazuje jednakże aktywność biologiczną [aktywator czynnika krzepnięcia XII, szlaku kalikreina-kininy (powstawanie wazoaktywnej bradykininy) i indukcji anafilotoksyny (składowe C3a i C5a dopełniacza)]. Zanieczyszczenie heparyny spowodowało łącznie 178 zgonów w Stanach Zjednoczonych i setki działań niepożądanych na całym świecie, ukazując podatność złożonego globalnego łańcucha dostaw na produkty nie spełniające wymaganych standardów. Po szczegółowych badaniach większość produktów zawierających heparynę zanieczyszczoną OSCS dopuszczono do zastosowania klinicznego z wyłączeniem podania dożylnego. Decyzje o warunkowym dopuszczeniu do stosowania tych produktów podjęto po analizie ryzyka, wskazującej że ich całkowite wycofanie z lecznictwa może doprowadzić do ok. 80 tys. zgonów pacjentów we wszystkich państwach UE. Skutkiem powyższego kryzysu było opracowanie nowych norm jakościowych heparyny (Fijałek et al., 2013; Szajek et al., 2016).
Kolejny kryzys wynikający z niedoboru heparyny może wkrótce pojawić się ponownie. W listopadzie 2019 roku producenci heparyny w USA (Baxter, Hospira), Australii (Pfizer) oraz Europie (Frasenius Kabi) zgłosili niedobory heparyny, wynikające zarówno z zaburzeń produkcji jak również niedostatecznej podaży surowej heparyny. Ta ostatnia przyczyna jest uwarunkowana wybuchem epidemii afrykańskiego pomoru świń (ASF) w Chinach, która ograniczyła populację świń o 30-40% (szacuje się, że osiągnie nawet 50%, co stanowi ok. 25% światowej populacji). Przy braku danych dotyczących zahamowania szerzenia się choroby, może to skutkować zmniejszeniem dostępności heparyny. W związku z powyższą sytuacją europejski producent heparyny, Fresenius Kabi, ograniczył eksport leku z USA (McCarthy et al., 2020).
Kryzys niedoboru heparyny z roku 2007/08 dotyczył przede wszystkim fiolek heparyny do iniekcji oraz niektórych wyrobów medycznych pokrytych heparyną (Vilanova et al., 2019). Obecnie obserwuje się zmniejszenie dostaw worków z heparyną niefrakcjonowaną do infuzji oraz fiolek z heparyną niefrakcjonowaną do wstrzyknięć w USA. W przypadku utrzymywania się niedoboru surowca do produkcji heparyny, pojawić się mogą również niedobory heparyny drobnocząsteczkowej (jej produkcja jest bardziej wydajna w porównaniu do heparyny niefrakcjonowanej, ponieważ z tej samej ilości surowej heparyny powstaje, w wyniku depolimeryzacji, większa ilość heparyny drobnocząsteczkowej). Szacunkowe dane amerykańskie, powstałe w oparciu o analizę kryzysu z 2008 roku, wskazują na 6-9 miesięczny okres opóźnienia wystąpienia niedoborów heparyny od chwili wystąpienia ograniczenia podaży surowej heparyny (Fareed et al., 2019). W oparciu o powyższe dane wskazuje się, że zmniejszona podaż heparyny może wystąpić w drugiej połowie 2020 roku. Wśród proponowanych środków zaradczych wymienia się racjonalizację stosowania heparyny do niezbędnych sytuacji klinicznych wymagających zastosowania leku (m. in. wymienia się alternatywne zastosowanie fondaparynuksu) lub też rozważenie odstąpienia od profilaktyki żylnej choroby zakrzepowo-zatorowej u pacjentów ambulatoryjnych o niskim ryzyku, poszukiwanie nowych źródeł dostaw surowej heparyny wieprzowej oraz rozważenie ponownego wdrożenia do praktyki klinicznej heparyny wołowej (Vilanova et al., 2019).
Fondaparynuks powstał w wyniku naturalnej ewolucji heparyny, jest pentasacharydem zwiększającym aktywność antytrombiny wobec aktywnego czynnika X (Xa). Jednakże w przeciwieństwie do heparyny i jej pochodnych (tj. HDCz) jest lekiem syntetycznym, nie powstającym w oparciu o surowiec pochodzenia naturalnego. W przypadku ograniczonej dostępności jelit wieprzowych jego dostępność do zastosowań klinicznych nie jest zagrożona. Zakres wskazań terapeutycznych fondaparynuksu jest szeroki i w znacznej mierze jest porównywalny z zastosowaniem heparyn drobnocząsteczkowych. Spełnia więc kryteria leku przeciwzakrzepowego zapewniającego skuteczność i bezpieczeństwo terapii przeciwzakrzepowej, zwłaszcza w sytuacji ograniczonej dostępności heparyny. Przewidując możliwość wystąpienia niedoborów heparyny Massachusetts General Hospital w Bostonie wprowadził plan stopniowego zmniejszania jej stosowania w okresie marzec/kwiecień do wrzesień/październik 2019 roku. W wyniku tego procesu kliniczne zastosowanie fondaparynuksu wzrosło prawie 2,5-krotnie, który stosowano wg wskazań m.in. umieszczonych w tabeli (Rosovsky et al., 2020).
Fondaparynuks jako alternatywa dla heparyny (Benge et al., 2019; Rosovsky et al., 2020).
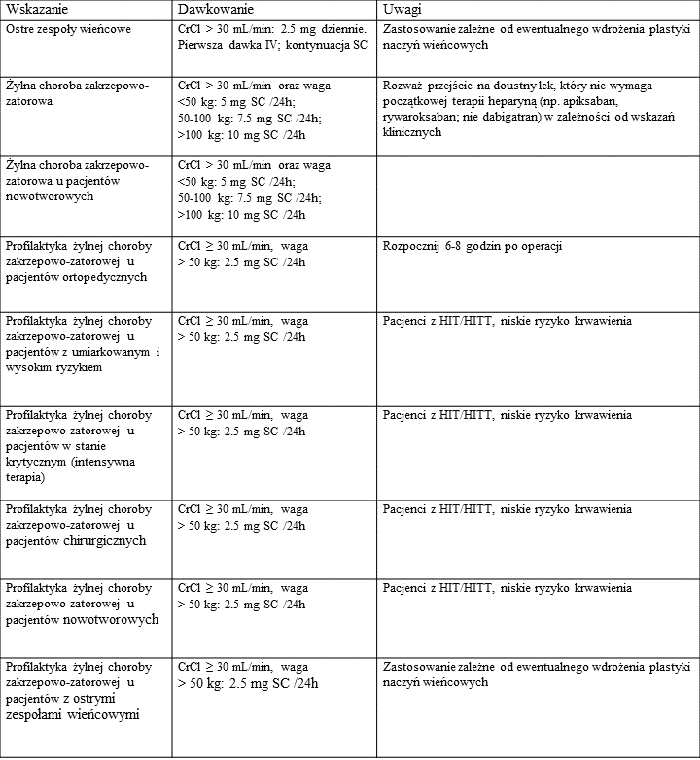
Doświadczenia wiodącego szpitala USA wskazują, że wobec istniejącego zagrożenia niedoboru heparyny należy rozważyć wdrożenie schematów postępowania terapeutycznego w oparciu o inne leki przeciwzakrzepowe, w tym fondaparynuks, o udokumentowanej skuteczności klinicznej, przy jednoczesnym zapewnieniu stałej ich dostępności.
Piśmiennictwo
Hirsh J. et al., Mechanism of action and pharmacology of unfractionated heparin. Arterioscler Thromb Vasc Biol. 2001;21:1094-1096
Walenga JM. et al. Development of a synthetic heparin pentasaccharide: Fondaparinux. Turk J Haematol 2002;19:137-150
Charakterystyka Produktu Leczniczego Arixtra 08/2018, https://www.ema.europa.eu/en/medicines/human/EPAR/arixtra#product-information-section (dostęp w dn. 25.05.2020)
Kumar A. et al. Fondaparinux sodium compared with low‐molecular‐weight heparins for perioperative surgical thromboprophylaxis: a systematic review and meta‐analysis. J Am Heart Assoc. 2019;8:e012184
Kumar P. et al. Choosing between enoxaparin and fondaparinux for the management of patients with acute coronary syndrome: a systematic review and meta-analysis BMC Cardiovasc Disord. 2017;17:116
Qiao J. et al. Comparison between fondaparinux and low-molecular-weight heparin in patients with acute coronary syndrome: a meta-analysis. Cardiology 2016;133:163-172
Shriver Z. et al. Heparin and heparan sulfate: analyzing structure and microheterogeneity. Handb Exp Pharmacol. 2012;207:159–176
Szajek J. et al. The US regulatory and pharmacopeia response to the global heparin contamination crisis. Nature Biotechnolog 2016;34:625–630
Fijałek Z. et al. Farmacja po kryzysie heparynowym – czy możliwa jest skuteczna ochrona pacjentów przed substandardowymi i sfałszowanymi produktami? Farm Pol. 2013;69:26-31
McCarthy CP. et al. Running thin: implications of a heparin shortage. Lancet. 2020;395:534-536
Vilanova E. et al. Imminent risk of a global shortage of heparin caused by the African swine fever afflicting the Chinese pig herd. J Thrombo Haemost. 2019;17:254–56.
Fareed J. et al. Porcine mucosal heparin shortage crisis! What are the options? Clin Appl Thromb Hemost. 2019;25:1076029619878786.
Benge CD. et al. Heparin drug shortage conservation strategies. Fed Pract. 2019;36:449-454
Rosovsky P. et al. When Pigs Fly: A Multidisciplinary approach to navigating a critical heparin shortage. Oncologist. 2020;25:334-347
Mechanizm działania heparyny niefrakcjonowanej i HDCz jest podobny, lecz nie całkowicie jednakowy. Niefrakcjonowana heparyna jest siarczanowanym polisacharydem o masie cząsteczkowej zakres od 3000 do 30 000 Da (średnio 15 000 Da) obdarzonym ładunkiem ujemnym (heparyna jest najsilniej naładowanym biopolimerem występującym naturalnie). Zbudowana jest z powtarzających się jednostek disacharydowych: kwas iduronowy/kwas glukuronowy-glukozamina. Działanie przeciwzakrzepowe heparyny jest uwarunkowane wiązaniem się sekwencji pentasacharydowej heparyny z antytrombiną, co umożliwia zwiększa jej aktywność wobec trombiny i aktywowanego czynnika X (czynnik Xa). Interakcja z trombiną lub też czynnikiem Xa zależy od wielkości cząsteczki heparyny. Cząsteczki heparyny zawierające 18 lub więcej jednostek sacharydowych (o masie cząsteczkowej > 5400 Da) posiadają wielkość umożliwiającą wiązanie antytrombiny z trombiną. Cząsteczki heparyny o mniejszej masie, tj. HDCz (średnia masa cząsteczkowa 5000 Da, ~ 17 jednostek sacharydowych stanowiące co najmniej połowę wszystkich cząsteczek HDCz) są zbyt krótkie, aby zapewnić wiązanie antytrombiny z trombiną, natomiast nadal możliwe jest wiązanie z czynnikiem Xa. Stosunek aktywności wobec czynnika Xa vs. czynnika IIa (trombiny) wynosi od 3:1 do 2:1, w zależności od rodzaju HDCz. Oprócz wiązania z czynnikami krzepnięcia poprzez antytrombinę, heparyna obdarzona ładunkiem ujemnym oddziałuje z dodatnio naładowanymi cząsteczkami (błonami biologicznymi, białkami), co poszerza zakres jej biologicznego działania (np. małopłytkowość, osteopenia) oraz warunkuje właściwości farmakokinetyczne (wiązanie z makrofagami i komórkami śródbłonka). Oddziaływania zależne od ładunku są znacznie silniej wyrażone w przypadku heparyny niefrakcjonowanej (Hirsh et al., 2001).
Fondaparynuks, będący rezultatem ewolucji heparyny, składa się jedynie z sekwencji pentasacharydowej, warunkującej przeciwzakrzepowe działanie heparyny (niefrakcjonowanej i drobnocząsteczkowej). Fondaparynuks poprzez wybiórcze i odwracalne łącznie się z cząsteczką antytrombiny zwiększa jej aktywność inaktywującą czynnik Xa układu krzepnięcia (powstały kompleks nie wiąże się z trombiną). Wykazano, że fondaparinux zwiększa hamujący wpływ antytrombiny na czynnik Xa aż 300-krotnie i wykazuje 7-krotnie silniejsze działanie w porównaniu do HDCz (Walenga et al., 2002). Farmakokinetyka
fondaparynuksu, ze względu na brak nieswoistych interakcji z innymi białkami osocza i płytkami krwi, jest bardziej przewidywalna od heparyny (farmakokinetyka liniowa w zakresie dawek od 2 do 8 mg), okres półtrwania leku wynosi ok. 17 godzin, co umożliwia jednokrotne podanie na dobę (stan stacjonarny uzyskuje po 3-4 dniach stosowania). Podobnie jak heparyny, fondaparynuks wydalany jest w postaci niezmienionej z moczem, w związku z tym konieczne jest dostosowanie dawki u pacjentów z niewydolnością nerek Należy również zwrócić uwagę na fakt, że fondaparynuks prawie w całości wiąże się z antytrombiną, co warunkuje swoistość jego działania ograniczoną do hamowania czynnika Xa, a tym samym ogranicza jego działania niepożądane. W przypadku heparyn jedynie około 30% ich łańcuchów polisacharydowych wiąże się z antytrombiną, co jest przyczyną mniej przewidywalnej farmakokinetyki i efektu przeciwkrzepliwego oraz działań niepożądanych m.in. małopłytkowości indukowanej heparyną (HIT, ang. heparin-induced trombocytopenia), których nie obserwuje się podczas stosowania fondaparynuksu. Zakres wskazań terapeutycznych fondaparynuksu jest podobny do heparyn. Lek jest zarejestrowany przez Europejską Agencję Leków (ang. European Medicines Agency, EMA) do stosowania w jednorazowej, podawanej podskórnie dawce dziennej 1,5-2,5 mg w zapobieganiu żylnym incydentom zakrzepowo-zatorowym (VTE, ang. venous thromboembolic events) u dorosłych pacjentów poddawanych dużym operacjom ortopedycznym kończyn dolnych, takich jak operacja złamań okolicy biodrowej, duże zabiegi operacyjne stawu kolanowego lub operacja wymiany stawu biodrowego, poddawanych zabiegom chirurgicznym w obrębie jamy brzusznej, u których istnieje duże ryzyko powikłań zakrzepowo-zatorowych i nie poddawanych leczeniu zabiegowemu, którzy są w grupie dużego ryzyka wystąpienia VTE i którzy są unieruchomieni z powodu ostrej choroby, takiej jak niewydolność serca i (lub) ostre zaburzenia oddechowe i (lub) ostre zakażenia lub choroba zapalna oraz w leczeniu osób dorosłych z ostrą, objawową, samoistną zakrzepicą żył powierzchownych kończyn dolnych bez współistniejącej zakrzepicy żył głębokich; jak również w dawce 5-10 mg w leczeniu ostrej zakrzepicy żył głębokich (DVT, ang. deep vein thrombosis) i ostrego zatoru płucnego (PE, ang. pulmonary embolism), z wyjątkiem pacjentów niestabilnych hemodynamicznie i pacjentów, u których konieczna jest tromboliza lub płucna embolektomia. Ponadto dawka fondaparynuksu 2,5 mg jest wskazana w leczeniu niestabilnej choroby wieńcowej lub zawału mięśnia sercowego bez uniesienia odcinka ST w elektrokardiogramie (UA/NSTEMI) u pacjentów, u których nie ma wskazań do pilnego (< 120 minut) wykonania zabiegu inwazyjnego (PCI) oraz w leczeniu zawału mięśnia sercowego z uniesieniem odcinka ST w elektrokardiogramie (STEMI) u pacjentów leczonych trombolitycznie lub nie poddanych początkowo innemu leczeniu reperfuzyjnemu oraz w leczeniu osób dorosłych z ostrą, objawową, samoistną zakrzepicą żył powierzchownych kończyn dolnych bez współistniejącej zakrzepicy żył głębokich (Arixtra, 2018). Terapia fondaparynuksem nie wymaga monitorowania, należy jednakże dostosować dawkę leku u pacjentów z wagą poniżej 50 kg oraz powyżej 100 kg w przypadku leczenia ŻChZZ.
Przeprowadzone meta-analizy badań klinicznych porównujące fondaparynuks z heparyną, głównie drobnocząsteczkową, wskazują na korzystniejszy profil działania pentasacharydu, uwzględniający zarówno skuteczność jak i działania niepożądane. Kumar et al. opublikowali w 2019 roku metaanalizę (12 kontrolowanych, randomizowanych badań, 14 906 pacjentów), dotyczących okołooperacyjnej chirurgicznej profilaktyki przeciwzakrzepowej z zastosowaniem soli sodowej fondaparynuksu oraz heparyn o małej masie cząsteczkowej. Systematyczna weryfikacja badań wskazuje, że zastosowanie pentasacharydu wiązało się z wyższą skutecznością terapeutyczną, tj. w zakresie zmniejszenia żylnej choroby zakrzepowo-zatorowej, jednakże wiązało się to również ze zwiększonym prawdopodobieństwem poważnego krwawienia. Niemniej jednak fondaparynuks charakteryzował się korzystniejszym ogólnym profilem działania klinicznego w porównaniu do HDCz (Kumar A et al., 2019). Z kolei metaanaliza kontrolowanych, randomizowanych badań klinicznych analizująca działania niepożądane u pacjentów z ostrymi zespołami wieńcowymi, głównie z zawałem mięśnia sercowego bez uniesienia odcinka ST (NSTEMI) (obejmująca 7 badań, 9618 pacjentów) opublikowana w 2017 roku wskazuje, że fondaparynuks może być lepszym wyborem w porównaniu do enoksaparyny w kategoriach krótko- i średnioterminowych krwawień (przy porównywalnej śmiertelności) (Kumar P et al., 2017). Wcześniejsza metaanaliza (z 2016 roku) pacjentów z ostrymi zespołami wieńcowymi (6 badań, 60 000 pacjentów) wykazała, że postępowanie terapeutyczne oparte na fondaparynuksie charakteryzowało się istotnie mniejszą liczbą poważnych niepożądanych zdarzeń sercowo-naczyniowych i dużych krwawień w porównaniu do HDCz. Także porównanie całkowitej klinicznej korzyści (netto) wykazało wyższość fondaparynuksu w odniesieniu do HDCz (Qiao et al. 2016).
Obecnie heparyna (produkowana przez komórki tuczne) jest pozyskiwana prawie wyłącznie z jednego źródła, tj. jelit wieprzowych, choć w niewielkiej ilości (Argentyna, Brazylia) również z płuc wołowych (ze względu na ryzyko zanieczyszczenia prionami wywołującymi gąbczastą encefalopatię bydła, BSE odstąpiono od jej stosowania w większości krajów). W początkowym etapie produkcji oddziela się mechanicznie błonę śluzową jelita, którą następnie poddaje się degradacji i wstępnemu rozdziałowi, prowadzącemu do otrzymania surowej heparyny (będącej mieszaniną wielu komponentów, m.in. resztkowych biomateriałów, takich jak białka, kwasy nukleinowe i lipidy, a sama surowa heparyna stanowi mieszaninę kompleksowych polisacharydów i glikozaminoglikanów, takich jak kwas hialuronowy, siarczan chondroityny, a także dwa dominujące składniki – heparynę i siarczan dermatanu). Przygotowanie surowej heparyny jest zwykle wykonywane w jednostkach nie stosujących procedur GMP (ang. Good Manufacturing Practices), zazwyczaj w Chinach skąd pochodzi ponad 80% światowej produkcji surowej heparyny. Kolejne etapy produkcji, po przetransportowaniu surowej heparyny (zazwyczaj do Europy lub USA), podlegają już procedurom GMP i obejmują m.in. dodatkowe wytrącanie, oczyszczanie, wymianę jonów oraz depirogenację. Po zakończeniu ostatnich etapów produkcji heparyna jest dość dobrze zdefiniowanym materiałem, złożonym głównie z glikozaminoglikanów zawierającym łańcuchy o średniej masie cząsteczkowej w zakresie 12–20 kDa (Shriver et al., 2012). W przypadku heparyn drobnocząsteczkowych przeprowadza się dodatkową depolimeryzację (chemiczna β-eliminacja, enzymatyczna depolimeryzacja, depolimeryzacja kwasem azotawym, oksydacyjne rozszczepianie) prowadzącą do otrzymania glikozaminoglikanów o średniej masie cząsteczkowej ok. 4 kDa.
Otrzymywanie heparyny jest więc całkowicie uzależnione od dostępności surowca biologicznego o odpowiedniej jakości, głównie jelit wieprzowych. Pierwszy światowy kryzys zaopatrzenia w heparynę obserwowano w 2007 roku. Był on spowodowany ograniczeniem dostępności surowca do produkcji heparyny wywołanym znacznym zmniejszeniem populacji świń w Chinach przez wysoce zakaźnego wirusa zespołu rozrodczo-oddechowego świń (PRRS). Producenci surowej heparyny wobec braku dostępności surowca i konieczności/chęci wywiązania się z umów kontraktowych świadomie zanieczyszczali surową heparynę przesulfonowanym siarczanem chondroityny (OSCS) o podobnej do heparyny charakterystyce chromatograficznej utrudniającej jego wykrycie. OSCS będący półsyntetycznym polimerem uzyskiwanym przez chemiczne sulfonowanie siarczanu chondroityny wykazuje jednakże aktywność biologiczną [aktywator czynnika krzepnięcia XII, szlaku kalikreina-kininy (powstawanie wazoaktywnej bradykininy) i indukcji anafilotoksyny (składowe C3a i C5a dopełniacza)]. Zanieczyszczenie heparyny spowodowało łącznie 178 zgonów w Stanach Zjednoczonych i setki działań niepożądanych na całym świecie, ukazując podatność złożonego globalnego łańcucha dostaw na produkty nie spełniające wymaganych standardów. Po szczegółowych badaniach większość produktów zawierających heparynę zanieczyszczoną OSCS dopuszczono do zastosowania klinicznego z wyłączeniem podania dożylnego. Decyzje o warunkowym dopuszczeniu do stosowania tych produktów podjęto po analizie ryzyka, wskazującej że ich całkowite wycofanie z lecznictwa może doprowadzić do ok. 80 tys. zgonów pacjentów we wszystkich państwach UE. Skutkiem powyższego kryzysu było opracowanie nowych norm jakościowych heparyny (Fijałek et al., 2013; Szajek et al., 2016).
Kolejny kryzys wynikający z niedoboru heparyny może wkrótce pojawić się ponownie. W listopadzie 2019 roku producenci heparyny w USA (Baxter, Hospira), Australii (Pfizer) oraz Europie (Frasenius Kabi) zgłosili niedobory heparyny, wynikające zarówno z zaburzeń produkcji jak również niedostatecznej podaży surowej heparyny. Ta ostatnia przyczyna jest uwarunkowana wybuchem epidemii afrykańskiego pomoru świń (ASF) w Chinach, która ograniczyła populację świń o 30-40% (szacuje się, że osiągnie nawet 50%, co stanowi ok. 25% światowej populacji). Przy braku danych dotyczących zahamowania szerzenia się choroby, może to skutkować zmniejszeniem dostępności heparyny. W związku z powyższą sytuacją europejski producent heparyny, Fresenius Kabi, ograniczył eksport leku z USA (McCarthy et al., 2020).
Kryzys niedoboru heparyny z roku 2007/08 dotyczył przede wszystkim fiolek heparyny do iniekcji oraz niektórych wyrobów medycznych pokrytych heparyną (Vilanova et al., 2019). Obecnie obserwuje się zmniejszenie dostaw worków z heparyną niefrakcjonowaną do infuzji oraz fiolek z heparyną niefrakcjonowaną do wstrzyknięć w USA. W przypadku utrzymywania się niedoboru surowca do produkcji heparyny, pojawić się mogą również niedobory heparyny drobnocząsteczkowej (jej produkcja jest bardziej wydajna w porównaniu do heparyny niefrakcjonowanej, ponieważ z tej samej ilości surowej heparyny powstaje, w wyniku depolimeryzacji, większa ilość heparyny drobnocząsteczkowej). Szacunkowe dane amerykańskie, powstałe w oparciu o analizę kryzysu z 2008 roku, wskazują na 6-9 miesięczny okres opóźnienia wystąpienia niedoborów heparyny od chwili wystąpienia ograniczenia podaży surowej heparyny (Fareed et al., 2019). W oparciu o powyższe dane wskazuje się, że zmniejszona podaż heparyny może wystąpić w drugiej połowie 2020 roku. Wśród proponowanych środków zaradczych wymienia się racjonalizację stosowania heparyny do niezbędnych sytuacji klinicznych wymagających zastosowania leku (m. in. wymienia się alternatywne zastosowanie fondaparynuksu) lub też rozważenie odstąpienia od profilaktyki żylnej choroby zakrzepowo-zatorowej u pacjentów ambulatoryjnych o niskim ryzyku, poszukiwanie nowych źródeł dostaw surowej heparyny wieprzowej oraz rozważenie ponownego wdrożenia do praktyki klinicznej heparyny wołowej (Vilanova et al., 2019).
Fondaparynuks powstał w wyniku naturalnej ewolucji heparyny, jest pentasacharydem zwiększającym aktywność antytrombiny wobec aktywnego czynnika X (Xa). Jednakże w przeciwieństwie do heparyny i jej pochodnych (tj. HDCz) jest lekiem syntetycznym, nie powstającym w oparciu o surowiec pochodzenia naturalnego. W przypadku ograniczonej dostępności jelit wieprzowych jego dostępność do zastosowań klinicznych nie jest zagrożona. Zakres wskazań terapeutycznych fondaparynuksu jest szeroki i w znacznej mierze jest porównywalny z zastosowaniem heparyn drobnocząsteczkowych. Spełnia więc kryteria leku przeciwzakrzepowego zapewniającego skuteczność i bezpieczeństwo terapii przeciwzakrzepowej, zwłaszcza w sytuacji ograniczonej dostępności heparyny. Przewidując możliwość wystąpienia niedoborów heparyny Massachusetts General Hospital w Bostonie wprowadził plan stopniowego zmniejszania jej stosowania w okresie marzec/kwiecień do wrzesień/październik 2019 roku. W wyniku tego procesu kliniczne zastosowanie fondaparynuksu wzrosło prawie 2,5-krotnie, który stosowano wg wskazań m.in. umieszczonych w tabeli (Rosovsky et al., 2020).
Fondaparynuks jako alternatywa dla heparyny (Benge et al., 2019; Rosovsky et al., 2020).

Doświadczenia wiodącego szpitala USA wskazują, że wobec istniejącego zagrożenia niedoboru heparyny należy rozważyć wdrożenie schematów postępowania terapeutycznego w oparciu o inne leki przeciwzakrzepowe, w tym fondaparynuks, o udokumentowanej skuteczności klinicznej, przy jednoczesnym zapewnieniu stałej ich dostępności.
Piśmiennictwo
Hirsh J. et al., Mechanism of action and pharmacology of unfractionated heparin. Arterioscler Thromb Vasc Biol. 2001;21:1094-1096
Walenga JM. et al. Development of a synthetic heparin pentasaccharide: Fondaparinux. Turk J Haematol 2002;19:137-150
Charakterystyka Produktu Leczniczego Arixtra 08/2018, https://www.ema.europa.eu/en/medicines/human/EPAR/arixtra#product-information-section (dostęp w dn. 25.05.2020)
Kumar A. et al. Fondaparinux sodium compared with low‐molecular‐weight heparins for perioperative surgical thromboprophylaxis: a systematic review and meta‐analysis. J Am Heart Assoc. 2019;8:e012184
Kumar P. et al. Choosing between enoxaparin and fondaparinux for the management of patients with acute coronary syndrome: a systematic review and meta-analysis BMC Cardiovasc Disord. 2017;17:116
Qiao J. et al. Comparison between fondaparinux and low-molecular-weight heparin in patients with acute coronary syndrome: a meta-analysis. Cardiology 2016;133:163-172
Shriver Z. et al. Heparin and heparan sulfate: analyzing structure and microheterogeneity. Handb Exp Pharmacol. 2012;207:159–176
Szajek J. et al. The US regulatory and pharmacopeia response to the global heparin contamination crisis. Nature Biotechnolog 2016;34:625–630
Fijałek Z. et al. Farmacja po kryzysie heparynowym – czy możliwa jest skuteczna ochrona pacjentów przed substandardowymi i sfałszowanymi produktami? Farm Pol. 2013;69:26-31
McCarthy CP. et al. Running thin: implications of a heparin shortage. Lancet. 2020;395:534-536
Vilanova E. et al. Imminent risk of a global shortage of heparin caused by the African swine fever afflicting the Chinese pig herd. J Thrombo Haemost. 2019;17:254–56.
Fareed J. et al. Porcine mucosal heparin shortage crisis! What are the options? Clin Appl Thromb Hemost. 2019;25:1076029619878786.
Benge CD. et al. Heparin drug shortage conservation strategies. Fed Pract. 2019;36:449-454
Rosovsky P. et al. When Pigs Fly: A Multidisciplinary approach to navigating a critical heparin shortage. Oncologist. 2020;25:334-347
Źródło:
Marek Droździk Katedra Farmakologii, Pomorski Uniwersytet Medyczny w Szczecinie
Marek Droździk Katedra Farmakologii, Pomorski Uniwersytet Medyczny w Szczecinie




