Wprowadzenie Krwawienie z górnego odcinka przewodu pokarmowego (GOPP) jest najczęstszym stanem nagłym w gastroenterologii. Zapadalność na krwawienie z GOPP wynosi 50–170/100 tys./rok i jest względnie stała w czasie, natomiast wyższa w populacjach o niższym statusie socjoekonomicznym [1, 2]. Przyczyny krwawienia z GOPP i zakres ich względnych częstości zestawiono w tabeli I [3]. Śmiertelność w ostrym krwawieniu z GOPP jest również względnie stała w ostatnich latach i wynosi 6–11%, mimo oczywistych postępów medycyny w zakresie intensywnej terapii i endoskopii zabiegowej [1, 2, 4]. Przyczyną jest starzenie się społeczeństwa. Około 1/4 chorych z krwawieniem z GOPP jest w wieku >80. roku życia, a znaczną większość zgonów z powodu krwawienia z GOPP obserwuje się u ludzi starszych obciążonych licznymi ciężkimi chorobami [1, 2, 5]. Śmiertelność wydaje się być niższa w ośrodkach specjalistycznych. Uważa się jednak, że nie jest to wynikiem zaawansowania technologicznego, ale przestrzegania opracowanych w tych jednostkach protokołów postępowania [1, 2]. Stwierdza się również, że stosowanie wytycznych przynosi istotne korzyści ekonomiczne [1, 6]. Ma to duże znaczenie zwłaszcza w krajach, w których finansowanie służby zdrowia jest dalekie od optymalnego.
 Definicje i objawy
Definicje i objawy Krwawienie z GOPP to krwawienie, którego źródło znajduje się w przełyku, żołądku lub dwunastnicy (powyżej więzadła Treitza). Może ono manifestować się wymiotami krwistymi lub fusowatymi, powrotem krwi lub treści fusowatej przez założoną sondę żołądkową oraz stolcami smolistymi lub krwistymi [4]. Występowanie wymiotów krwistych lub fusowatych świadczy z reguły o większym nasileniu krwawienia niż w przypadku smolistych stolców. Występowanie stolców krwistych przy lokalizacji źródła krwawienia w GOPP świadczy o znacznej masywności krwawienia [1, 4]. Nawrót krwawienia (ang. re-bleeding) z reguły definiuje się jako ponowne wystąpienie powyższych objawów, połączone z objawami niestabilności hemodynamicznej (tachykardia, spadek ciśnienia tętniczego) i/lub spadek stężenia hemoglobiny o przynajmniej 2 g/dl w ciągu 24 godz. [1].
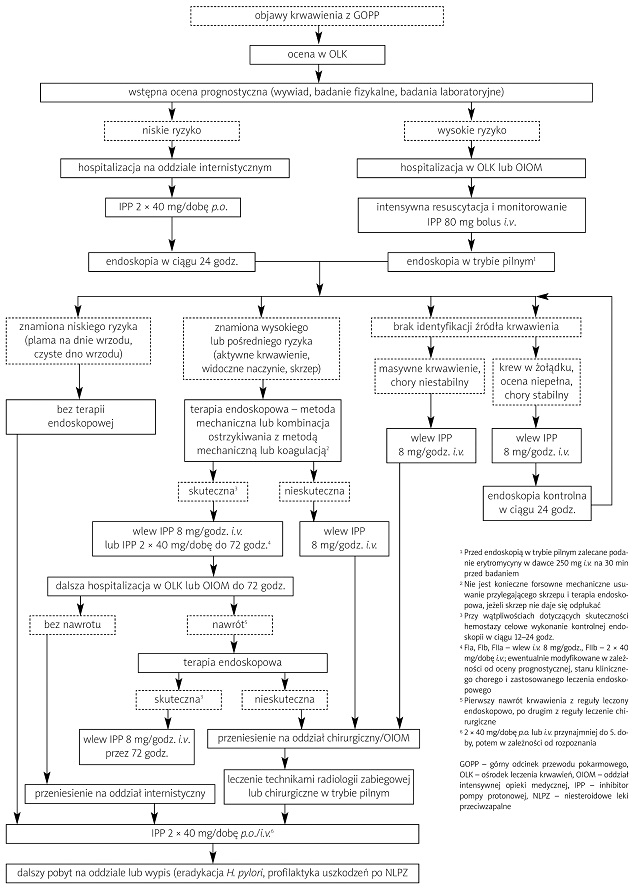
Miejsce leczenia, wyposażenie i personel medyczny W sytuacji idealnej chorzy z krwawieniem z GOPP powinni być leczeni w regionalnych ośrodkach leczenia krwawień (OLK) z przewodu pokarmowego [1]. Biorąc pod uwagę zapadalność (ok. 40 tys. pacjentów rocznie) i uwarunkowania demograficzno-administracyjne, w Polsce powinno istnieć ok. 50–60 OLK zlokalizowanych w dużych szpitalach wielospecjalistycznych mających oddziały gastroenterologii i hepatologii, chirurgii przewodu pokarmowego, anestezjologii i intensywnej opieki medycznej oraz dobrze wyposażone pracownie endoskopii przewodu pokarmowego i radiologii zabiegowej. W Polsce z reguły przyjmuje się, że chory z krwawieniem z przewodu pokarmowego powinien być hospitalizowany na oddziale chirurgicznym. Przy opracowaniu protokołu postępowania dla danego OLK, alokacja pacjentów na oddziały powinna być oparta raczej na obiektywnej ocenie ryzyka nawrotu krwawienia i zgonu oraz wyniku wykonanego badania endoskopowego [1, 2]. Chorzy z niskim ryzykiem wystąpienia nawrotu krwawienia i zgonu mogą być hospitalizowani na oddziale internistycznym lub nawet wypisani do domu po wykonaniu endoskopii [7, 8], podczas gdy chorzy z najwyższym ryzykiem wystąpienia nawrotu krwawienia i zgonu powinni być hospitalizowani na oddziałach mających odpowiednio wyszkolony personel i sprzęt umożliwiający zastosowanie intensywnej opieki medycznej. Rozsądne wydaje się wyodrębnienie na potrzeby OLK kilkułóżkowego (6–10) oddziału do prowadzenia postępowania leczniczego przed wykonaniem endoskopii i w razie potrzeby po jej przeprowadzeniu. Wyposażenie takiego oddziału powinno umożliwiać intensywny nadzór i leczenie chorych (automatyczne monitorowanie podstawowych funkcji życiowych, resuscytację krążeniowo-oddechową itd.). Liczba personelu w takim ośrodku, także w godzinach dyżurowych, powinna odpowiadać standardom przewidzianym dla oddziałów intensywnej opieki medycznej (OIOM) [1, 2]. Warunkiem niezbędnym funkcjonowania OLK jest dobrze wyposażona pracownia endoskopowa umożliwiająca wykonanie endoskopii terapeutycznej przez 24 godz./dobę. W przypadkach najcięższych krwawień powinna istnieć możliwość wykonania endoskopii na OIOM lub sali operacyjnej. Konieczna jest odpowiednia liczba wyszkolonych endoskopistów i pielęgniarek w celu zapewnienia prowadzenia stałego dyżuru [1, 2] (minimalną wydaje się być 3–4 endoskopistów i pielęgniarek). Nie jest konieczne prowadzenie dyżuru stacjonarnego, jednak dyżur telefoniczny powinien umożliwiać przygotowanie zespołu do pracy w czasie nie dłuższym niż godzina. Konieczne jest także zapewnienie zespołu anestezjologicznego, składającego się z lekarza i pielęgniarki, do prowadzenia znieczulenia i monitorowania podczas endoskopii. Minimalnym standardem wyposażenia sprzętowego są przynajmniej 3 gastroskopy, plazmowy koagulator argonowy, urządzenie do elektrokoagulacji lub sonda cieplna (ang. heater probe unit – HPU) oraz akcesoria (igły do terapii iniekcyjnej, urządzenia do zakładania klipsów hemostatycznych, zestawy do opaskowania żylaków przełyku). Celowe jest posiadanie gastroskopu z kanałem biopsyjnym o dużej średnicy (6 mm) oraz urządzenia umożliwiającego intensywne odsysanie treści żołądkowej bezpośrednio przez kanał biopsyjny (np. BioVac lub podobne). Szpitalny bank krwi musi zapewniać odpowiednią liczbę preparatów krwiopochodnych do transfuzji. Celowe jest zabezpieczenie koncentratu krwinek czerwonych grupy 0 Rh– do transfuzji w wypadkach wyjątkowo nagłych [1]. Ośrodki leczenia krwawień powinny opracować protokoły postępowania z chorym z krwawieniem z GOPP, przystosowane do warunków lokalnych [1, 2].
Postępowanie wstępne Po przyjęciu pacjenta z ostrym krwawieniem z GOPP do szpitala należy równocześnie przeprowadzić ocenę ciężkości krwawienia, resuscytację płynową (jeśli potrzebna) oraz wykonać niezbędne badania laboratoryjne.
Ocena ciężkości krwawienia i postępowanie prognostyczne Ocena ciężkości krwawienia i prognozowanie jego przebiegu ma olbrzymie znaczenie dla całości postępowania medycznego, w tym decyzji o hospitalizacji, wyborze miejsca hospitalizacji, pilności wykonania endoskopii, intensywności monitorowania czy leczenia farmakologicznego [1, 2]. Chociaż doświadczony lekarz powinien bez problemu ocenić ciężkość stanu chorego z krwawieniem z GOPP, poleca się zastosowanie punktowej skali prognostycznej wg Rockalla i wsp. [9] (tabela II). Wyliczenie oceny prognostycznej przedendoskopowej w powyższej skali zajmuje zaledwie kilkadziesiąt sekund, wymagając jedynie, oprócz oceny wieku i chorób towarzyszących, pomiaru częstości tętna i ciśnienia tętniczego krwi. Ocena w wysokości 0 pkt (chory przed 60. rokiem życia, bez chorób towarzyszących, zaburzeń hemodynamicznych) jest równoznaczna z bardzo dobrym rokowaniem, podczas gdy ocena w wysokości 7 pkt (chory w wieku >80 lat, z ciężkimi chorobami towarzyszącymi i we wstrząsie) wiąże się z ok. 50-procentowym ryzykiem wystąpienia zgonu. Chorzy z oceną w wysokości 0–2 pkt mogą być hospitalizowani na oddziale internistycznym i poddani endoskopii w trybie elektywnym przyspieszonym (ang. semi-elecitve) – w praktyce następnego dnia roboczego rano, ale nie później niż 24 godz. po przyjęciu. Chorzy z oceną ł3 pkt powinni być poddani endoskopii w trybie pilnym, natychmiast po wyrównaniu zaburzeń hemodynamicznych. Decyzję dotyczącą miejsca ich hospitalizacji należy podjąć po wykonaniu endoskopii i uzależnić ją od pełnej oceny prognostycznej obejmującej kryteria endoskopowe. W przypadku dużego nasilenia krwawienia, gdy istnieje duże ryzyko konieczności leczenia operacyjnego, należy przeprowadzić konsultację chirurgiczną jeszcze przed wykonaniem endoskopii.
Badania laboratoryjne Podczas przyjęcia należy wykonać badania laboratoryjne wg wykazu z tabeli III.
Resuscytacja i monitorowanie Podstawą leczenia jest uzupełnienie płynów i utrzymanie prawidłowego ciśnienia krwi tętniczej. Postępowanie resuscytacyjne zależy od nasilenia krwawienia. • Chorzy z niewielkim nasileniem krwawienia i bez istotnych czynników ryzyka (młody wiek, bez istotnych chorób towarzyszących, zaburzeń hemodynamicznych, prawidłowe stężenie hemoglobiny) Należy we wszystkich przypadkach zapewnić dostęp do żyły obwodowej. Należy nawodnić chorego drogą parenteralną i do czasu wykonania endoskopii powinien on pozostawać na diecie „0”. Monitorowanie może być prowadzone klinicznie, początkowo konieczny jest pomiar ciśnienia tętniczego i częstości tętna co godzinę. Należy kontrolować diurezę. • Chorzy z dużym nasileniem krwawienia i/lub istotnymi czynnikami ryzyka (starszy wiek, istotne choroby towarzyszące, częstość akcji serca >100/min i/lub skurczowe ciśnienie tętnicze krwi <100 mmHg, stężenie hemoglobiny <10 g/dl) Chory powinien pozostawać na diecie „0”. Należy zapewnić dostęp do żył obwodowych (przynajmniej 2 kaniule typu wenflon o dużej średnicy) lub żyły centralnej i wprowadzić cewnik do pęcherza. Monitorowanie (częstość akcji serca, ciśnienie tętnicze krwi, częstość oddechów, wysycenie tlenem krwi tętniczej, EKG) powinno być prowadzone w sposób automatyczny. Dla oceny wyrównania utraty płynu należy kontrolować diurezę godzinową i w wybranych przypadkach ośrodkowe ciśnienie żylne (OCŻ) (zwłaszcza u osób z chorobami układu krążenia). Wskaźnikami należytego wyrównania utraty płynów są diureza ł30 ml/godz. i OCŻ ł5 cm H
2O [1]. W celu uzyskania prawidłowego wypełnienia łożyska naczyniowego wystarcza zazwyczaj przetoczenie 1000–2000 ml roztworu soli fizjologicznej lub płynu wieloelektrolitowego. Brak wyrównania zaburzeń hemodynamicznych po przetoczeniu 2000 ml roztworów krystaloidów jest wskazaniem do przetoczenia płynów krwiozastępczych lub krwi [1]. Krwawienie z GOPP jest chorobą przebiegającą dynamicznie i decydowanie o przetoczeniu krwi lub preparatów krwiopochodnych wyłącznie na podstawie stężenia hemoglobiny może być błędem, gdyż w początkowym okresie choroby – nawet przy dużym nasileniu krwawienia – stężenie to przez pewien czas może pozostawać prawidłowe. Istotnym czynnikiem wpływającym na podjęcie decyzji o transfuzji jest także obecność chorób towarzyszących (np. choroby niedokrwiennej serca). Należy rozważyć przeprowadzenie transfuzji, jeśli krwawienie jest na tyle obfite, że manifestuje się krwistymi wymiotami i/lub krwistymi stolcami, zwłaszcza z towarzyszącym wstrząsem. Tachykardia przekraczająca 120 uderzeń/min i/lub tachypnöe przekraczające 30 oddechów/min mogą świadczyć o utracie krwi powyżej 1500 ml, tj. ok. 30% całkowitej objętości krwi, i wydają się istotnymi wskazaniami do transfuzji. U osób w starszym wieku bez przewlekłej niedokrwistości wskazaniem do transfuzji może być obniżenie stężenia hemoglobiny w wyniku ostrego krwawienia do wartości <10 g/dl [1].
Leczenie farmakologiczne przed wykonaniem endoskopii Znaczna większość przyczyn krwawień z GOPP jest wskazaniem do leczenia hamującego wydzielanie kwasu solnego. Istnieją przesłanki, aby leczenie to włączać już w momencie przyjęcia chorego do szpitala, przed wykonaniem endoskopii. Parenteralne podanie dużej dawki inhibitora pompy protonowej (IPP) prowadzi do zmniejszenia odsetka chorych aktywnie krwawiących podczas endoskopii i zmniejszenia konieczności stosowania endoskopowych zabiegów hemostatycznych z trendem w kierunku zmniejszenia odsetka nawrotów krwawienia [10–14]. Również analizy efektywności kosztowej wskazują, że wczesne zastosowanie IPP może obniżać całkowity koszt leczenia [15, 16]. Grupa robocza zaleca wczesne zastosowanie IPP w jednorazowym wstrzyknięciu dożylnym, w dawce 80 mg u wszystkich oczekujących na wykonanie endoskopii w trybie pilnym (z objawami krwawienia o dużym nasileniu, obecnością zaburzeń hemodynamicznych lub spadkiem stężenia hemoglobiny oraz obecnością innych niekorzystnych czynników prognostycznych). Pozostałym chorym można podać IPP drogą doustną. Chorym, u których planuje się wykonanie endoskopii w trybie pilnym, zaleca się 30–60 min przed badaniem podanie erytromycyny w dawce 3 mg/kg m.c. (w praktyce 250 mg), w jednorazowym wstrzyknięciu dożylnym lub wlewie kroplowym trwającym 30 min. Erytromycyna – jako lek o silnych właściwościach gastrokinetycznych – podana przed endoskopią powoduje opróżnienie żołądka z krwi i skrzepów, poprawia subiektywną jakość badania oraz redukuje konieczność powtórzenia endoskopii z powodu niedostatecznego uwidocznienia zmian w GOPP [17–19].
Endoskopia górnego odcinka przewodu pokarmowego Celem wykonania endoskopii w krwawieniu z GOPP jest lokalizacja i identyfikacja źródła krwawienia, postawienie prognozy przebiegu choroby na podstawie tzw. endoskopowych znamion krwawienia oraz zastosowanie endoskopowych zabiegów hemostatycznych. Należy podkreślić, że endoskopia może być wykonana jedynie w warunkach umożliwiających jej bezpieczne przeprowadzenie, co wymaga realizacji odpowiednich wytycznych dotyczących miejsca jej wykonania, sprzętu i akcesoriów endoskopowych, liczby i kwalifikacji personelu oraz przygotowania i monitorowania stanu chorego podczas endoskopii.
Tryb wykonania endoskopii Endoskopia w krwawieniu z GOPP może być wykonana w trybie pilnym (natychmiast po przeprowadzeniu resuscytacji) lub elektywnym przyspieszonym (następnego dnia roboczego rano, ale nie później niż w ciągu 24 godz. od przyjęcia do szpitala). Decyzję o trybie wykonania endoskopii podejmuje się na podstawie klinicznej oceny ciężkości krwawienia. Endoskopia powinna być wykonana w trybie pilnym u wszystkich chorych z ł3 pkt w przedendoskopowej klasyfikacji Rockalla i wsp. [9]. Wykonanie endoskopii podczas pierwszych 24 godz. hospitalizacji pozwala na ustalenie precyzyjnego rozpoznania w postaci identyfikacji źródła krwawienia i podjęcie optymalnego leczenia przyczynowego, a ponadto przynosi wiele wymiernych korzyści – zmniejszenie konieczności transfuzji krwi i leczenia operacyjnego, znaczne skrócenie czasu hospitalizacji, możliwość leczenia ambulatoryjnego chorych z niskim ryzykiem wystąpienia nawrotu krwawienia oraz obniżenie kosztów leczenia [2, 8, 20–23]. Endoskopia powinna być wykonana jedynie po przeprowadzeniu adekwatnej resuscytacji płynowej, najlepiej po uzyskaniu stabilizacji parametrów hemodynamicznych (tętna i ciśnienia krwi). Tylko w sytuacjach zupełnie wyjątkowych endoskopię można wykonać u pacjenta znajdującego się we wstrząsie (masywne krwawienie, kiedy nie udaje się uzyskać wyprowadzenia chorego ze wstrząsu, mimo prawidłowo prowadzonej resuscytacji) – jako zabieg ratujący życie.
Miejsce wykonania endoskopii Endoskopia w trybie pilnym powinna być wykonywana w pracowni endoskopowej ze względu na dostęp do odpowiednich urządzeń i akcesoriów endoskopowych [1]. U chorych, których transport do pracowni endoskopowej jest przeciwwskazany ze względu na zbyt ciężki stan ogólny, endoskopia może być wykonana przy łóżku chorego, ale takie sytuacje powinny być raczej wyjątkiem niż regułą (dotyczy to głównie osób hospitalizowanych na OIOM). W przypadkach krwawień o wyjątkowo dużym nasileniu, zwłaszcza kiedy istnieje wysokie prawdopodobieństwo konieczności leczenia operacyjnego, należy rozważyć wykonanie endoskopii na sali operacyjnej [1]. Jeśli endoskopię wykonuje się w pracowni endoskopowej, ważny jest udział w badaniu konsultującego chirurga w celu bezpośredniego zapoznania go z obrazem endoskopowym.
Znieczulenie i monitorowanie Endoskopia w trybie pilnym powinna być wykonana z zastosowaniem analgosedacji lub znieczulenia ogólnego dożylnego [1]. Niepokój chorego poddanego endoskopii bez znieczulenia może uniemożliwić zastosowanie endoskopowych zabiegów hemostatycznych wymagających bardzo często maksymalnej precyzji. Znieczulenie do endoskopii w trybie pilnym może być prowadzone jedynie przez zespół lekarza anestezjologa i pielęgniarki anestezjologicznej. Nie jest dopuszczalne prowadzenie znieczulenia lub analgosedacji przez lekarza endoskopistę i/lub pielęgniarkę endoskopową, którzy muszą koncentrować się na endoskopowych aspektach zabiegu. W przypadku, kiedy konieczne jest wykonanie endoskopii w trybie pilnym, a pomoc zespołu anestezjologicznego jest niedostępna, monitorowanie stanu pacjenta musi być prowadzone przez dodatkową osobę, najlepiej lekarza leczącego chorego na oddziale. W razie masywnego krwawienia u pacjentów w ciężkim stanie ogólnym należy rozważyć wykonanie endoskopii po uprzedniej intubacji dotchawiczej [1].
Znamiona krwawienia i ich znaczenie prognostyczne W przypadku krwawienia z GOPP pochodzenia nieżylakowego ryzyko wystąpienia nawrotu krwawienia można oszacować na podstawie obrazu endoskopowego (etapu gojenia się) zmiany będącej źródłem krwawienia, czyli tzw. endoskopowych znamion krwawienia. Klasyfikację endoskopowych znamion krwawienia jako pierwsi przedstawili Forrest i wsp. [24]. Doczekała się ona kilku modyfikacji, z których najczęściej stosowaną przedstawiono w tabeli IV [25]. W tabeli V zaprezentowano ryzyko wystąpienia nawrotu krwawienia w zależności od stwierdzonych znamion krwawienia [26]. Z danych tych wynika, że korzyści z leczenia endoskopowego mogą odnieść jedynie chorzy, u których prawdopodobieństwo nawrotu krwawienia jest największe, czyli z: 1) aktywnym krwawieniem (Forrest Ia i Ib), 2) widocznym, niekrwawiącym naczyniem krwionośnym (Forrest IIa). Z kolei chorzy ze znamionami krwawienia o najniższym ryzyku wystąpienia nawrotu krwawienia nie muszą być leczeni endoskopowo, gdyż wystarczająco dobry wynik osiąga się po leczeniu zachowawczym. Dotyczy to chorych z: 1) czerwoną lub czarną płaską plamą na dnie wrzodu, bez widocznego naczynia krwionośnego (Forrest IIc), 2) zidentyfikowanym źródłem krwawienia, bez widocznych jego znamion – czyste dno wrzodu (Forrest III) [1, 2, 4, 27–31]. Zmianą o pośrednim ryzyku wystąpienia krwawienia budzącą najwięcej kontrowersji dotyczących postępowania endoskopowego jest obecność skrzepu pokrywającego zmianę będącą źródłem krwawienia (Forrest IIb). W większości przypadków pod skrzepem znajduje się widoczne naczynie krwionośne, które powinno być poddane endoskopowym zabiegom hemostatycznym, co sugeruje konieczność usunięcia przylegającego skrzepu i dalsze postępowanie wg stwierdzonego obrazu endoskopowego [29, 32–34]. Z drugiej strony, powstanie skrzepu jest naturalnym etapem procesu gojenia się zmiany krwawiącej, a mechaniczne usunięcie skrzepu może przedłużać proces gojenia oraz indukować niebezpieczne krwawienie. Dotyczyć to może zwłaszcza skrzepów wytworzonych w optymalnych warunkach pH, a więc po zastosowaniu intensywnego leczenia antysekrecyjnego, gdzie odsetek nawrotów krwawienia jest niski [35, 36]. Część ekspertów zaleca więc agresywne usunięcie skrzepu za pomocą pętli diatermicznej lub koszyczka Dormia, po wcześniejszym wstrzyknięciu adrenaliny w okolicę centralnej części owrzodzenia pokrytego skrzepem [30]. Natomiast inni, chociaż brak jest pewnych dowodów naukowych uzasadniających takie postępowanie, polecają obecnie próbę usunięcia skrzepu jedynie przez jego odpłukanie. Jeżeli skrzep nie daje się odpłukać, prawdopodobnie może być pozostawiony bez leczenia endoskopowego [31, 35]. Endoskopowa identyfikacja znamion krwawienia sklasyfikowanych w stopniu II wg klasyfikacji Forresta jest trudna, a eksperci podają różne kryteria kwalifikacji tych znamion do odpowiednich stopni [32, 33, 37]. Według Jensena różnicowanie ustala się na podstawie oceny uniesienia zmiany powyżej dna owrzodzenia, jej barwy oraz wielkości. Skrzep pokrywający naczynie (FIIb) ma zawsze kolor czerwony, a jego średnica przekracza 5 mm. Widoczne naczynie (FIIa) może mieć różną barwę (nawet półprzezroczystą), a jego średnica nie przekracza 4 mm. Obydwie zmiany są wyraźnie uniesione powyżej dna owrzodzenia. Plama na dnie owrzodzenia (FIIc) jest płaska, może mieć różną barwę, a jej średnica nie przekracza 5 mm [30]. Klasyfikację Forresta i wsp. opracowano dla krwawienia z wrzodu trawiennego, ale z pewnym przybliżeniem może być zastosowana do wszystkich krwawień w zakresie GOPP. Oprócz identyfikacji znamion krwawienia konieczna jest oczywiście, także dla celów prognostycznych, identyfikacja zmiany będącej źródłem krwawienia. Wykazano bowiem, że np. krwawienie z rozdarcia błony śluzowej wpustu Mallory’ego-Weissa z reguły ustępuje samoistnie i bardzo rzadko wymaga stosowania leczenia chirurgicznego lub bywa przyczyną zgonu, natomiast – z oczywistych powodów – krwawienie z zaawansowanej zmiany nowotworowej rokuje źle [9].
Endoskopowe metody hemostazy Główną korzyścią z wykonania endoskopii w krwawieniu z GOPP jest zastosowanie endoskopowych zabiegów hemostatycznych, które przynoszą znamienne obniżenie odsetka nawrotów krwawienia, konieczności leczenia chirurgicznego i zgonów będących następstwem krwawienia [1, 2, 4, 27–29, 38]. Obecnie stosowane metody tamowania krwawienia obejmują techniki iniekcyjne, koagulacji kontaktowej i bezkontaktowej oraz mechaniczne.
Techniki iniekcyjne (ostrzykiwanie) Techniki iniekcyjne obejmują podawanie za pomocą igły jednorazowego użytku wielu substancji (tabela VI). Związkiem najczęściej stosowanym w terapii iniekcyjnej jest roztwór adrenaliny w soli fizjologicznej w stężeniu objętościowym 1:10 tys. [39]. Mechanizm tamowania krwawienia w terapii iniekcyjnej polega na uciśnięciu krwawiącego naczynia przez wytworzenie w błonie śluzowej i podśluzowej zbiorników podanej substancji [40] oraz działaniu swoistym dla podawanej substancji (obkurczenie naczyń przy podaniu adrenaliny, wywołanie odczynu zapalnego przy podaniu substancji drażniących, wytworzenie skrzepu przy podaniu trombiny lub klejów fibrynowych itd.). Technika wykonania iniekcji polega na wstrzyknięciu stosowanej substancji w 4 kwadranty dookoła źródła krwawienia i ewentualnie następnie bezpośrednio do krwawiącego naczynia. Całkowita objętość podawanego roztworu adrenaliny mieści się z reguły w granicach 4–16 ml [1], chociaż proponuje się także stosowanie większych objętości, nawet do 45 ml, co może jednak wiązać się z ubocznymi efektami działania ogólnoustrojowego adrenaliny [41–43]. Na podstawie dostępnych badań można stwierdzić, że żadna z powyższych substancji nie wykazuje wyraźnej wyższości nad pozostałymi [2], co może sugerować, że najbardziej istotnym mechanizmem terapii iniekcyjnej jest tamponada mechaniczna. Terapia iniekcyjna z zastosowaniem adrenaliny pozwala na uzyskanie wczesnej hemostazy u prawie wszystkich chorych, ale z reguły wykazuje wysoki odsetek nawrotu krwawienia sięgający 15–20% [31, 39, 44, 45]. W metaanalizie podsumowującej skuteczność terapii iniekcyjnej w 17 badaniach na materiale 885 chorych iniekcja roztworu adrenaliny pozwoliła na osiągnięcie początkowej hemostazy u 96,5% osób, jednak nawrót krwawienia wystąpił aż u 18,5% [46]. Zastosowanie środków drażniących (polidokanol, etanolamina, alkohol absolutny) nie poprawia wyników leczenia w porównaniu z zastosowaniem adrenaliny [44, 47, 48], a może wiązać się ze zwiększonym ryzykiem perforacji spowodowanej martwicą ściany narządu w miejscu wstrzyknięcia [47, 49]. Bardziej obiecujące wydaje się zastosowanie środków stymulujących powstanie skrzepu (kleje fibrynowe) [50], ale doświadczenie z ich użyciem jest niewielkie; poza tym podawanie tych środków wymaga specjalnych dwukanałowych, niedostępnych rutynowo igieł. Grupa robocza nie zaleca do rutynowego stosowania substancji innych niż roztwór adrenaliny.
Techniki koagulacji Techniki koagulacji pozwalają na uzyskanie hemostazy przez koagulację naczynia i tkanek bezpośrednio je otaczających (tabela VII). Lasery nie są już praktycznie stosowane ze względu na niewielką mobilność. Z pozostałych metod koagulacji odróżnienia wymaga koagulacja kontaktowa (koaptywna) i bezkontaktowa. Tak zwane techniki koaptywne (ang. mutli-polar electro-coagulation – MPEC/ang. bipolar circumactive probe – BICAP, ang. heater probe unit – HPU) polegają na zastosowaniu energii po silnym uciśnięciu krwawiącego naczynia końcówką sondy, co teoretycznie powinno prowadzić do sklejenia ścian naczynia. Wymaga to jednak odpowiedniej lokalizacji zmiany krwawiącej, umożliwiającej względnie prostopadłe ustawienie końcówki sondy do krwawiącego naczynia. W technikach elektrokoagulacji dwubiegunowej/wielobiegunowej koagulacja tkanki jest wynikiem przepływu prądu między elektrodami umieszczonymi na końcówce cewnika. W odróżnieniu od nich, HPU koaguluje tkanki bez przepływu prądu przez bezpośrednie zastosowanie ciepła, którego źródłem jest pokryty teflonem metalowy cylinder umieszczony na końcu cewnika. W technikach tych stosuje się aplikację energii o niskiej mocy przez względnie długi czas – 2–10 s przy mocy 15–20 W dla BICAP lub 2–4 pulsów o energii 10–30 J dla HPU na jedno koagulowane miejsce [51]. Punktem końcowym aplikacji jest zatamowanie wypływu krwi i/lub uzyskanie płaskiego, skoagulowanego obszaru w miejscu widocznego uprzednio naczynia [51, 52]. W przypadku obu technik lepsze wyniki uzyskuje się, stosując sondy o średnicy 3,2 mm [30, 51], co wymaga zastosowania endoskopu o dużej średnicy kanału roboczego. Koagulacja jednobiegunowa jest odmienną techniką koagulacji kontaktowej, w której przepływ prądu odbywa się między elektrodą czynną (na końcu cewnika) i bierną (na skórze chorego). Ze względu na znacznie głębszą penetrację prądu, stosuje się krótkie aplikacje energii o dużej mocy (pulsy półsekundowe o mocy 50–100 W) bez istotnego ucisku elektrodą na ścianę [51]. W badaniach doświadczalnych koagulacja jednobiegunowa powoduje znacznie głębsze uszkodzenie tkanki niż techniki koaptywne, co niesie za sobą obawę o perforację ściany przewodu pokarmowego [53]. Z tego powodu jest ona stosowana najczęściej w tamowaniu krwawień jatrogennych (podczas polipektomii lub sfinkterotomii endoskopowej). Jedynym obecnie stosowanym systemem koagulacji bezkontaktowej jest plazmowa koagulacja argonowa (ang. argon plasma coagulation – APC). APC jest systemem elektrokoagulacji jednobiegunowej, gdzie nośnikiem energii jest strumień zjonizowanego argonu. Z tych względów APC stosuje się głównie do zmian zlokalizowanych powierzchownie (zmiany naczyniowe błony śluzowej – ektazje naczyniowe) [4, 54, 55]. Niewątpliwą jednak zaletą tego systemu jest możliwość terapii niezależnie od kąta ustawienia końcówki sondy do ściany, gdyż strumień gazu przenoszący prąd dąży do elektrody pasywnej zawsze jak najkrótszą drogą. Możliwe jest przeprowadzanie koagulacji z odległości 2–8 mm [56]. Z tego powodu APC może być zastosowana przy najbardziej niekorzystnych lokalizacjach zmian krwawiących, gdzie niemożliwe jest wykorzystanie innych metod koagulacji ani hemostazy mechanicznej. Głębokość koagulacji zależy od stosowanej mocy prądu, czasu aplikacji i odległości sondy od zmiany [57]. Do tamowania krwawienia w górnym odcinku przewodu pokarmowego stosuje się aplikacje energii o czasie trwania do 2 s przy mocy 40–50 W i przepływie gazu 0,8 l/min [55]. Zastosowanie technik koagulacji pozwala na uzyskanie hemostazy w odsetku podobnym jak w przypadku terapii iniekcyjnej [2, 4, 41]. W publikowanych ostatnio metaanalizach koagulacja koaptywna pozwoliła na uzyskanie odsetka początkowej hemostazy w wysokości 94,5%, z nawrotem krwawienia 13–16% [58, 59]. Dostępne porównania technik koagulacji kontaktowej wskazują, że żadna z nich nie wykazuje wyraźnej wyższości nad pozostałymi [2, 38]. Badania porównujące techniki koagulacji kontaktowej do APC są nieliczne, ale również wskazują na ich porównywalny wynik [56, 60, 61]. W jedynej opublikowanej dotychczas metaanalizie skuteczność APC w osiągnięciu początkowej hemostazy wynosiła 96,5% przy odsetku nawrotów krwawienia 17% [62]. Grupa robocza zaleca stosowanie którejkolwiek z metod koagulacji koaptywnej lub APC w zależności od sytuacji klinicznej.
Techniki hemostazy mechanicznej Obecnie dostępne są 3 techniki umożliwiające mechaniczne zaciśnięcie krwawiącego naczynia, tj. zakładanie klipsów hemostatycznych, opasek gumowych i pętli z tworzywa sztucznego. Te ostatnie w krwawieniach pochodzenia nieżylakowego stosuje się jedynie do niewielkich zmian zlokalizowanych w obszarze niezmienionej błony śluzowej (np. zmiana Dieulafoy, angiodysplazje) [63, 64], chociaż opisano skuteczne próby leczenia za pomocą opasek gumowych krwawienia z małych (o średnicy do 10 mm) owrzodzeń niewykazujących dużego zwłóknienia dna [65]. Klipsy hemostatyczne mogą być natomiast używane do wszystkich typów zmian krwawiących (zwłaszcza krwawień tętniących i widocznych niekrwawiących naczyń) [66]. Agencja ds. Żywności i Leków FDA (Food and Drug Administration) w rekomendacjach zaleca stosowanie metody klipsowania w przypadku krwawienia z naczyń o średnicy do 2 mm oraz w ubytkach śluzówki i błony podśluzowej o średnicy nieprzekraczającej 3 cm [67]. Optymalną metodą klipsowania jest bezpośrednie zaciśnięcie klipsem hemostatycznym krwawiącego naczynia, co wymaga prostopadłego lub lekko skośnego ustawienia klipsa do naczynia i zachowania odpowiedniej odległości między końcówką endoskopu i zmianą. Zaleca się zakładanie klipsów w pewnej odległości od krwawiącego/widocznego naczynia, co pozwala na uchwycenie klipsem także tkanki otaczającej naczynie [67, 68]. Techniczne trudności w założeniu klipsów mogą występować w przypadku lokalizacji zmian krwawiących na tylnej ścianie opuszki dwunastnicy oraz tylnej ścianie i krzywiźnie mniejszej trzonu żołądka [68, 69]. Pomocne jest wówczas zastosowanie przezroczystej nasadki nałożonej na końcówkę endoskopu, co pozwala na lepsze uwidocznienie zmian i stabilizuje endoskop w kanale odźwiernika w przypadku krwawienia z tylnej ściany opuszki dwunastnicy [68]. Innym ograniczeniem stosowania klipsów jest względna trudność ich założenia na naczynia zlokalizowane w środku dna dużych owrzodzeń o dużym stopniu zwłóknienia [41]. Tkanka otaczająca naczynie bywa wtedy często zbyt twarda, aby mogła być uciśnięta za pomocą klipsa. Do uzyskania hemostazy konieczne może być wówczas zaciśnięcie kilkoma klipsami brzegów owrzodzenia. Taka sama technika może być zastosowana, jeśli nie udaje się uzyskać dobrej pozycji do założenia klipsa [67, 68]. Przy aktywnym krwawieniu, w celu lepszej wizualizacji miejsca krwawienia i prawidłowego założenia klipsa, pomocne może być wcześniejsze ostrzyknięcie krwawiącego miejsca roztworem adrenaliny [70]. Większość ekspertów uważa, że chociaż założenie klipsów hemostatycznych jest technicznie trudniejsze, stanowi najskuteczniejszą metodę hemostazy endoskopowej, lepszą od terapii iniekcyjnej i lepszą lub porównywalną z termokoagulacją [2, 41, 58, 66, 69, 71, 72]. W zestawieniu ostatnio opublikowanych 14 badań na materiale 465 chorych zastosowanie klipsów hemostatycznych pozwoliło na uzyskanie początkowej hemostazy u 93% osób z odsetkiem nawrotów krwawienia 8% [58].
Kombinacje endoskopowych technik hemostatycznych Jeśli żadna z technik hemostatycznych nie daje 100-procentowej skuteczności, logiczne wydaje się łączenie technik wykorzystujących różne mechanizmy. Dostępne metaanalizy oceniają kombinacje sekwencyjnej terapii iniekcyjnej (podanie 2 różnych środków) oraz kombinacje terapii iniekcyjnej z dodatkiem koagulacji lub metod mechanicznych. Prowadzą one do następujących wniosków: • ogólnie – kombinacja 2 terapii jest lepsza niż monoterapia [38], • kombinacja terapii iniekcyjnej z koagulacją lub hemostazą mechaniczną jest lepsza od kombinacji 2 terapii iniekcyjnych i monoterapii iniekcyjnej [46, 59, 73–76], • dane dotyczące ewentualnej przewagi kombinacji terapii iniekcyjnej z koagulacją lub hemostazą mechaniczną nad koagulacją lub hemostazą mechaniczną w monoterapii są sprzeczne; znane są bowiem badania, które nie potwierdzają takiej przewagi [38, 59, 75, 76].
Zalecana metoda hemostazy endoskopowej W zaleceniach dotyczących wyboru techniki hemostazy endoskopowej należy uwzględnić także dostępność poszczególnych metod (vide zalecenia dotyczące wyposażenia OLK) oraz preferencje zespołu endoskopisty i asystenta endoskopowego wynikające z osobistego doświadczenia. Grupa robocza proponuje poniższe postępowanie. • Jeżeli możliwe jest technicznie założenie klipsa (klipsów) hemostatycznego, należy w pierwszej kolejności podjąć próbę takiego postępowania. Jeśli przy-czyną niepowodzenia jest nasilenie aktywnego krwawienia uniemożliwiające precyzyjne umiejscowienie klipsa, należy przed próbą założenia klipsa przeprowadzić terapię iniekcyjną z zastosowaniem roztworu adrenaliny. • Jeżeli założenie klipsów jest niemożliwe z innych powodów (np. niekorzystna lokalizacja zmiany krwawiącej, duży wrzód o twardym dnie), należy zastosować kombinację metody iniekcyjnej z którąkolwiek z metod koagulacji koaptywnej. Dopuszczalne jest wykorzystanie metod koagulacji koaptywnej w monoterapii. Jeśli zastosowanie koagulacji kontaktowej jest technicznie niemożliwe, należy użyć kombinacji metody iniekcyjnej i APC. • Jeżeli zastosowanie żadnej z powyższych technik nie jest możliwe z powodów technicznych lub ich niedostępności, dopuszczalne jest użycie którejkolwiek z powyższych metod w dowolnej kombinacji lub monoterapii.
Dokumentacja badania/zabiegu endoskopowego Dokumentacja endoskopii wykonywanej z powodu krwawienia z GOPP, oprócz typowych elementów, musi zawierać: • ocenę obecności świeżej lub zhemolizowanej krwi w GOPP, • ocenę kompletności uwidocznienia błony śluzowej przełyku, żołądka i dwunastnicy, • ewentualną identyfikację źródła krwawienia wraz z opisem jego dokładnej lokalizacji i charakterystycznych cech typowych dla stwierdzanej zmiany (liczba, wielkość itd.) • ewentualną klasyfikację znamion krwawienia wg Forresta i wsp., • ewentualny opis zastosowanych metod endoskopowego uzyskania hemostazy wraz z oceną ich skuteczności.
Ograniczenia w stosowaniu endoskopowych metod hemostazy Nie należy podejmować prób leczenia endoskopowego w sytuacji, kiedy prawdopodobieństwo odniesienia sukcesu jest niewielkie. Podanie ścisłych wskazań w tym zakresie jest niemożliwe i decyzja musi być podejmowana indywidualnie u każdego chorego. Jako przykład można podać krwawienie tak masywne, że niemożliwe jest uzyskanie pola widzenia, czy krwawienie tętniące z naczynia o dużej średnicy (>2 mm) [1, 41]. Każde krwawienie o dużej masywności (manifestujące się wstrząsem lub niskim stężeniem hemoglobiny Ł10 g/dl), aktywne krwawienie tętniące, duża (>2 cm) średnica niszy wrzodowej oraz lokalizacja wrzodu na tylnej ścianie opuszki dwunastnicy lub w górnej części krzywizny mniejszej żołądka są wskaźnikami sugerującymi możliwość braku skuteczności hemostazy endoskopowej [77–81].
Postępowanie endoskopowe w krwawieniu spowodowanym innymi przyczynami niż wrzód trawienny • Zespół Mallory’ego-Weissa Krwawienie to z reguły ustępuje samoistnie. W przypadku aktywnego krwawienia z rozdarcia Mallory’ego-Weissa w większości przypadków skuteczne jest zastosowanie którejkolwiek z technik hemostastycznych (iniekcyjnej, koagulacji lub mechanicznej) [82–85]. • ewentualną identyfikację źródła krwawienia wraz z opisem jego dokładnej lokalizacji i charakterystycznych cech typowych dla stwierdzanej zmiany (liczba, wielkość itd.) • ewentualną klasyfikację znamion krwawienia wg Forresta i wsp., • ewentualny opis zastosowanych metod endoskopowego uzyskania hemostazy wraz z oceną ich skuteczności. Ograniczenia w stosowaniu endoskopowych metod hemostazy Nie należy podejmować prób leczenia endoskopowego w sytuacji, kiedy prawdopodobieństwo odniesienia sukcesu jest niewielkie. Podanie ścisłych wskazań w tym zakresie jest niemożliwe i decyzja musi być podejmowana indywidualnie u każdego chorego. Jako przykład można podać krwawienie tak masywne, że niemożliwe jest uzyskanie pola widzenia, czy krwawienie tętniące z naczynia o dużej średnicy (>2 mm) [1, 41]. Każde krwawienie o dużej masywności (manifestujące się wstrząsem lub niskim stężeniem hemoglobiny Ł10 g/dl), aktywne krwawienie tętniące, duża (>2 cm) średnica niszy wrzodowej oraz lokalizacja wrzodu na tylnej ścianie opuszki dwunastnicy lub w górnej części krzywizny mniejszej żołądka są wskaźnikami sugerującymi możliwość braku skuteczności hemostazy endoskopowej [77–81].
Postępowanie endoskopowe w krwawieniu spowodowanym innymi przyczynami niż wrzód trawienny • Zespół Mallory’ego-Weissa Krwawienie to z reguły ustępuje samoistnie. W przypadku aktywnego krwawienia z rozdarcia Mallory’ego-Weissa w większości przypadków skuteczne jest zastosowanie którejkolwiek z technik hemostastycznych (iniekcyjnej, koagulacji lub mechanicznej) [82–85]. • Malformacje naczyniowe Zmiany naczyniowe mogą być leczone dowolną techniką, chociaż najlepsze wydaje się zastosowanie technik koagulacji, a zwłaszcza APC [4, 54, 55, 63, 86, 87]. • Zmiana Dieulafoy Ze względu na niewielką liczbę opisanych w literaturze przypadków, podanie pewnych zaleceń jest trudne. Zastosowanie iniekcji adrenaliny w monoterapii wiąże się z dużym odsetkiem nawrotów. Z tego powodu celowe może być użycie metod mechanicznych, w tym opaskowania [63, 64, 88–93]. • Inne przyczyny krwawienia Tamowanie krwawienia z nowotworów GOPP wiąże się z bardzo dużym odsetkiem nawrotów sięgającym 80% [94–97]. Z tego powodu należy w tych przypadkach rozważyć postępowanie chirurgiczne lub techniki radiologii zabiegowej. Krwawienie z przetoki aortalno-dwunastniczej stanowi oczywiste przeciwwskazanie do leczenia endoskopowego i wymaga pilnego leczenia chirurgicznego [4].
Postępowanie po wykonaniu endoskopii Po wykonaniu endoskopii należy wykonać ponowną ocenę prognostyczną chorego w skali Rockalla z uwzględnieniem wskaźników endoskopowych i ustalić dalsze postępowanie dotyczące miejsca hospitalizacji, monitorowania, diety i leczenia farmakologicznego. W tabeli VIII przedstawiono ryzyko nawrotu krwawienia i zgonu w zależności od całkowitej punktacji w skali Rockalla [9]. Ocena w zakresie 0–2 pkt wiąże się z bardzo dobrą prognozą nawrotu krwawienia (<5%) i prawie zerowym ryzykiem zgonu. Chorzy z taką prognozą w większości mogą być leczeni ambulatoryjnie [6–9]. Chorzy z oceną ł7 pkt są zagrożeni nawrotem krwawienia i zgonem, odpowiednio w ok. 40 i 30%. Celowa wydaje się ich hospitalizacja na OIOM lub oddziałach chirurgicznych/gastroenterologicznych w salach umożliwiających intensywny nadzór i leczenie. Chorym stabilnym hemodynamicznie można wprowadzić płynoterapię i żywienie doustne po ok. 4–6 godz. od wykonania endoskopii [1, 98], chociaż pacjenci z największym ryzykiem wystąpienia nawrotu krwawienia lub planowani do kontrolnej endoskopii powinni pozostać na diecie „0”. Monitorowanie musi obejmować parametry hemodynamiczne, diurezę, bilans płynów, wymienione wcześniej badania laboratoryjne. Zaleca się intensywne monitorowanie (w tym hospitalizację w OIOM/OLK) przez 24–48 godz. po wykonaniu endoskopii [1]. U zagrożonych wystąpieniem nawrotu krwawienia i niehospitalizowanych na oddziale chirurgicznym konieczne jest przeprowadzenie konsultacji chirurgicznej, jeśli nie wykonano jej przed endoskopią [1]. Wskaźniki rokownicze – chociaż bardzo pomocne w podejmowaniu decyzji – nie mogą zastąpić troskliwe oceny klinicznej. Na przykład, młody chory bez zaburzeń hemodynamicznych i chorób towarzyszących, u którego w endoskopii stwierdza się rozdarcie Mallory’ego-Weissa z widocznym naczyniem, będzie miał jedynie 2 pkt w skali Rockalla, ale zagrożony jest wystąpieniem nawrotu krwawienia i musi być odpowiednio monitorowany i leczony.
Leczenie farmakologiczne Leczenie farmakologiczne stanowi drugi, oprócz hemostazy endoskopowej, główny element postępowania w krwawieniu z GOPP. Podstawą farmakoterapii jest leczenie antysekrecyjne. Niskie pH powoduje zaburzenia agregacji krwinek płytkowych oraz lizę skrzepu, a więc celem leczenia farmakologicznego jest podwyższenie pH do wartości >6 umożliwiające prawidłowe gojenie krwawiącej zmiany [99–101]. Z obecnie stosowanych leków jedynie IPP umożliwiają uzyskanie takich wartości pH. Chociaż logika takiego postępowania wydaje się oczywista, ocena wyników farmakoterapii krwawienia z GOPP i podanie zaleceń jego stosowania jest utrudnione z kilku powodów. Badania wykonane do tej pory są znacznie niejednorodne w zakresie stosowanych dawek i sposobów podania leku (doustnie, dożylnie w bolusie, dożylnie we wlewie), grupy kontrolnej (
placebo, mannitol lub antagoniści receptora histaminowego H2, H2RA) czy równoczesnego stosowania terapii endoskopowej. Znaczną liczbę badań wykonano w populacji azjatyckiej, która inaczej niż rasa kaukaska metabolizuje IPP [102]. Dostępne dane pozwalają na wyciągnięcie poniższych wniosków: • Podstawą leczenia farmakologicznego krwawienia z GOPP jest zastosowanie IPP. Są one skuteczniejsze niż H2RA lub
placebo w zapobieganiu nawrotom krwawienia (bezwzględne zmniejszenie ryzyka [ang. absolute risk reduction – ARR] odpowiednio ok. 7 i 9%) i zmniejszeniu konieczności leczenia operacyjnego (ARR odpowiednio ok. 3 i 5%) [102–110]. • Obydwa powyższe efekty są wyraźniejsze w grupie chorych najbardziej zagrożonych wystąpieniem nawrotu krwawienia (pacjenci z aktywnym krwawieniem z wrzodu i niekrwawiącym widocznym naczyniem) [103, 107, 109, 110]. • W tej samej grupie pacjentów zastosowanie IPP prowadzi do obniżenia śmiertelności w porównaniu z H2RA i
placebo o ok. 2–3% [105, 108–110]. U chorych z niskim ryzykiem wystąpienia nawrotu krwawienia użycie IPP nie wpływa istotnie na śmiertelność. • Korzystny efekt zastosowania IPP w zapobieganiu nawrotowi krwawienia i zmniejszeniu konieczności leczenia operacyjnego wydaje się być niezależny od drogi podania leku (dożylnie lub doustnie) [104, 106, 109, 110]. Wydaje się on natomiast być większy przy użyciu wyższych dawek leków [104, 108]. Korzyści ze stosowania leczenia antysekrecyjnego są także prawdopodobnie większe u chorych, u których nie przeprowadzono endoskopowych zabiegów hemostatycznych [103, 104], jednak dane te nie są spójne we wszystkich publikowanych ostatnio metaanalizach. • Zastosowanie IPP prowadzi także do zmniejszenia konieczności transfuzji krwi oraz skrócenia czasu hospitalizacji [104, 111]. • Korzystny efekt IPP wydaje się być obserwowany przede wszystkim u pacjentów z krwawieniem z wrzodu trawiennego (niezależnie od lokalizacji wrzodu w żołądku lub dwunastnicy). U chorych z pozawrzodowymi przyczynami krwawienia z GOPP zastosowanie IPP wydaje się nie poprawiać wyników leczenia [107]. • Efekty zastosowania IPP są znacznie korzystniejsze w populacji azjatyckiej niż u rasy białej [102, 110]. W największej z opublikowanych ostatnio metaanaliz (21 badań, 4224 pacjentów) zastosowanie IPP wiązało się z odsetkiem nawrotów krwawienia w wysokości 10,6% przy 17,3% w grupie kontrolnej (H2RA lub
placebo) [110]. Badania epidemiologiczne także potwierdzają skuteczność IPP w redukcji nawrotów krwawienia i zgonów z powodu krwawienia z GOPP [112]. Wyciąganie wniosków dotyczących optymalnej drogi podania, dawek i czasu stosowania IPP jest trudne, ze względu na niejednorodność danych z badań z randomizacją [113]. Na podstawie badań pH-metrycznych stwierdzono, że w celu uzyskania wartości pH ok. 6, konieczne jest zastosowanie IPP w bolusie w dawce 80 mg z następowym ciągłym wlewem dożylnym w dawce 8 mg/godz. [114–116]. Utrzymywanie wlewu w takiej dawce powinno wynosić ok. 72 godz., gdyż w takim właśnie czasie dokonuje się naturalna ewolucja od aktywnego krwawienia do znamion niskiego ryzyka [117]. Pośrednio potwierdzają to badania kliniczne, w których nawrót krwawienia występuje najczęściej także w ciągu pierwszych 72 godz. [2]. Na tej podstawie powyższe dawkowanie zastosowano w wielu badaniach klinicznych i jest ono zalecane u chorych wysokiego ryzyka przez wszystkie ostatnio opublikowane konsensusy postępowania w krwawieniu z GOPP [1, 2, 4]. Z drugiej strony, korzystny efekt IPP w zapobieganiu nawrotowi krwawienia i zmniejszeniu konieczności leczenia operacyjnego wydaje się być niezależny od drogi podania leku [110]. W bezpośrednich porównaniach skuteczności leczenia IPP nie udowodniono wyraźnie przewagi podawania IPP w dużej dawce, w ciągłym wlewie dożylnym nad innymi sposobami dawkowania IPP [118–122]. W ostatnich badaniach ankietowych we Francji i Danii stwierdzono, że jedynie 15–20% ośrodków podaje IPP w ciągłym wlewie dożylnym [123, 124]. Inhibitory pompy protonowej w lecznictwie zamkniętym są bardzo często (30–70%) stosowane w sposób niewłaściwy, co może prowadzić do znacznego zwiększenia kosztów leczenia przy braku pożądanych efektów terapeutycznych [125–129]. Dopóki nie zostaną opublikowane wyniki nowych, prospektywnych badań klinicznych z randomizacją, grupa robocza proponuje poniższe zasady stosowania IPP. • W grupie chorych z aktywnym krwawieniem, u których nie udało się zidentyfikować jego źródła, endoskopowo uzyskać hemostazy lub nie ma pewności co do uzyskania hemostazy, zaleca się zastosowanie IPP w bolusie
i.v. 80 mg z następowym ciągłym wlewem
i.v. w dawce 8 mg/godz. do czasu wyjaśnienia sytuacji, tj. wykonania kontrolnej endoskopii lub skutecznego zastosowania innego rodzaju terapii (np. leczenia chirurgicznego). • W grupie chorych najbardziej zagrożonych wystąpieniem nawrotu krwawienia z wrzodu trawiennego (z aktywnym krwawieniem i niekrwawiącym widocznym naczyniem), u których uzyskano endoskopowo hemostazę, zaleca się zastosowanie IPP w bolusie
i.v. 80 mg z następowym ciągłym wlewem
i.v. w dawce 8 mg/godz. przez 72 godz. Leczenie wysokimi dawkami IPP
i.v. lub p.o. (40 mg co 12 godz.) powinno być kontynuowane przynajmniej do 5. doby choroby. • W grupie chorych z pośrednim ryzykiem wystąpienia nawrotu krwawienia (chorzy z niedającym się odpłukać skrzepem, bez aktywnego krwawienia) zaleca się zastosowanie IPP dożylnie w dawce 40 mg co 12 godz. • W grupie chorych z niskim ryzykiem wystąpienia nawrotu krwawienia (bez aktywnego krwawienia i bez znamion wysokiego ryzyka) zaleca się podanie IPP doustnie w dawce 40 mg co 12 godz. (w przypadku leków konfekcjonowanych w tabletkach 30-miligramowych prawdopodobnie dopuszczalne jest zastosowanie dawki 30 mg co 12 godz., jednak nie ma danych naukowych uzasadniających takie postępowanie). • U chorych z innymi niż wrzodowe przyczyny krwawienia z GOPP zastosowanie IPP w dużych dawkach podawanych drogą dożylną może być uzasadnione w przypadkach aktywnego krwawienia o dużym ryzyku wystąpienia nawrotu (np. ze zmiany Dieulafoy), w pozostałych przypadkach wystarczające jest użycie wysokich dawek IPP drogą doustną. Powyższe zalecenia mogą być modyfikowane w zależności od stanu klinicznego pacjenta i wyników terapii endoskopowej, nie jest bowiem możliwe skategoryzowanie wszystkich sytuacji klinicznych mających miejsce w krwawieniu z GOPP. U chorego w zaawansowanym wieku z licznymi chorobami towarzyszącymi i rozległym owrzodzeniem pokrytym skrzepem bez aktywnego krwawienia celowe będzie zastosowanie IPP w ciągłym wlewie dożylnym przez 72 godz. Z kolei u pacjenta młodego bez chorób towarzyszących, ze stwierdzonym widocznym naczyniem na dnie niewielkiej niszy wrzodowej, którą w całości zamknięto klipsami hemostatycznymi, dopuszczalne będzie skrócenie dożylnego wlewu IPP do 24 godz. i kontynuowanie leczenia dawkami 40 mg IPP podawanymi
i.v. lub p.o. co 12 godz. [130]. Po 5 dniach od wystąpienia krwawienia leczenie może być kontynuowane u wszystkich chorych drogą doustną w dawkach standardowych. Nie zaleca się rutynowego stosowania w krwawieniu z GOPP antagonistów receptora H2 (H2RA). Wywierają one niewielki wpływ na wyniki leczenia (zmniejszenie nawrotów krwawienia, konieczności leczenia operacyjnego i liczby zgonów wobec
placebo, odpowiednio o ok. 7, 7 i 3%) u osób z wrzodem żołądka, jednak nie u pacjentów z wrzodem dwunastnicy [131–133]. Ponadto H2RA są znamiennie mniej skuteczne od IPP [105, 134]. Brak skuteczności H2RA wynika zapewne z szybkiego rozwoju tolerancji farmakologicznej (tachyfilaksji), nawet już po 24 godz. stosowania [135, 136]. W przypadku braku IPP nie jest jednak błędem podanie H2RA po rozpoznaniu krwawienia z GOPP, gdyż pierwsza dawka H2RA stosunkowo szybko i skutecznie podwyższa pH soku żołądkowego. Nie zaleca się rutynowego stosowania somatostatyny lub jej analogów w krwawieniu z GOPP. W jednej z metaanaliz somatostatyna była skuteczniejsza od
placebo/H2RA w zapobieganiu nawrotowi krwawienia [137], jednak zastosowanie IPP wiąże się z osiągnięciem lepszych wyników leczenia [138]. Ze względu na dodatkowy, poza hamowaniem wydzielania żołądkowego (w tym hamowaniem wydzielania gastryny), mechanizm działania polegający na zmniejszeniu trzewnego przepływu krwi [139], zastosowanie somatostatyny może być celowe u chorych, u których nie udaje się wyrównać zaburzeń hemodynamicznych przed wykonaniem endoskopii lub kiedy endoskopia jest przeciwwskazana lub niedostępna. Celowe może być też użycie somatostatyny w razie niepowodzenia leczenia endoskopowego, w trakcie oczekiwania na leczenie operacyjne lub kiedy leczenie operacyjne jest przeciwwskazane [2, 4]. Nie zaleca się rutynowego stosowania w krwawieniu z GOPP jakichkolwiek innych leków uważanych za przeciwkrwotoczne, wpływające na tworzenie się skrzepu (etamsylat), lub przeciwfibrynolityczne (kwas e-aminokapronowy, kwas traneksamowy). Nie udowodniono, aby ich zastosowanie poprawiało wyniki leczenia w krwawieniu z GOPP.
Wskazania do wykonania endoskopii kontrolnej Niektóre badania sugerują, że wczesne (12–24 godz. po pierwszym zabiegu), planowe wykonanie endoskopii kontrolnej (tzw. second-look endoscopy) i ponowne zastosowanie hemostazy endoskopowej może korzystnie wpływać na wynik leczenia, zwłaszcza na redukcję wystąpienia nawrotów krwawienia. Korzyści te mogą być stosunkowo największe w grupie chorych z najbardziej niekorzystnymi prognostycznie znamionami krwawienia, jednak dostępne dane są stosunkowo skąpe i niespójne [140–144]. Większość ekspertów nie zaleca rutynowego wykonywania endoskopii kontrolnej. Wskazania do jej wykonania muszą być ustalane indywidualnie [1, 2, 4]. Grupa robocza zaleca planowe wykonanie endoskopii kontrolnej w następujących przypadkach: • niekompletnego uwidocznienia błony śluzowej z powodu zalegającej krwi, • braku identyfikacji źródła krwawienia w przypadku obecności krwi w GOPP, • braku pewności co do skuteczności zastosowanych metod hemostatycznych.
Nawrót krwawienia Każde kliniczne podejrzenie nawrotu krwawienia z GOPP powinno być zweryfikowane endoskopowo w trybie pilnym po ewentualnym wcześniejszym wyrównaniu zaburzeń hemodynamicznych. Decyzje dotyczące dalszego postępowania terapeutycznego muszą być podejmowane indywidualnie, na podstawie wyników badania endoskopowego i ogólnego stanu chorego. W razie stwierdzenia zmian endoskopowych, będących wskazaniem do stosowania endoskopowych technik hemostatycznych, celowe jest podjęcie przynajmniej jednej próby ponownego leczenia endoskopowego [1, 2]. Postępowanie takie wydaje się być obarczone mniejszym ryzykiem wystąpienia powikłań, przy podobnej skuteczności, jak leczenie chirurgiczne w trybie pilnym [145]. W razie wystąpienia kolejnego nawrotu krwawienia, w większości przypadków celowe jest leczenie operacyjne. W sumie 25–50% chorych z nawrotem krwawienia po leczeniu endoskopowym wymaga leczenia chirurgicznego [2, 145]. Za czynniki ryzyka wystąpienia nawrotu krwawienia po leczeniu endoskopowym uważa się te same wskaźniki, które przewidują nieskuteczność początkowej terapii endoskopowej, a więc znamiona krwawienia wysokiego ryzyka wg Forresta, masywność krwawienia, duża średnica niszy wrzodowej oraz zły stan ogólny pacjenta (wg klasyfikacji ASA) [146, 147]. Nawrót krwawienia o dużej intensywności (przebiegającego ze wstrząsem) oraz średnica niszy wrzodowej >2 cm są wskaźnikami prognozującymi brak skuteczności ponownego leczenia endoskopowego [145].
Wskazania do leczenia chirurgicznego/technikami radiologii zabiegowej Poza powyższymi przypadkami nawrotu krwawienia po leczeniu endoskopowym, wskazaniami do pierwotnego leczenia zabiegowymi metodami nieendoskopowymi są: • masywne krwawienie, w którym niemożliwa jest identyfikacja źródła krwawienia, • aktywne krwawienie z naczynia o dużej średnicy, kiedy w ocenie endoskopisty zastosowanie technik endoskopowych nie ma szans powodzenia, • aktywne krwawienie lub widoczne niekrwawiące naczynie o lokalizacji uniemożliwiającej zastosowanie technik endoskopowych (np. na tylnej ścianie opuszki dwunastnicy). Oczywistym wskazaniem do leczenia innymi technikami zabiegowymi jest niepowodzenie leczenia endoskopowego z jakiejkolwiek przyczyny. Wybór między zastosowaniem technik radiologii zabiegowej i leczenia operacyjnego zależy od miejscowej dostępności obu metod postępowania, lokalizacji i źródła krwawienia.
Radiologia zabiegowa Leczenie technikami radiologii zabiegowej, przy odpowiednim doświadczeniu w tym zakresie, może być cenną alternatywą dla leczenia chirurgicznego ze względu na znacznie mniejszą inwazyjność przy zachowaniu wysokiej skuteczności [148–152]. W terapii przezcewnikowej można stosować środki do embolizacji zarówno trwałej (kleje akrylowe, mikrocząsteczki polimeru alkoholu winylowego, spirale), jak i czasowej (skrzepy krwi własnej chorego, Gelfoam). Z reguły naczyniem poddawanym embolizacji jest tętnica żołądkowo-dwunastnicza (w przypadku krwawienia z dwunastnicy) lub żołądkowa lewa (w krwawieniu z żołądka). Oba naczynia można poddać tzw. ślepej embolizacji w przypadku braku wynaczynienia środka kontrastowego podczas angiografii [148, 149, 152]. W ocenie skuteczności metody trzeba zwrócić uwagę na fakt, że leczeniu przez- cewnikowemu poddawani są z reguły najciężej chorzy, u których nie uzyskano hemostazy endoskopowo. W tej grupie embolizacja pozwala na uzyskanie ostatecznego sukcesu klinicznego u 50–80% pacjentów, przy odsetku powikłań sięgającym 10% [148–151]. Nawet jeśli radiologia zabiegowa nie pozwala na trwałe zatrzymanie krwawienia, z reguły umożliwia ustabilizowanie stanu chorego przed definitywnym leczeniem chirurgicznym [152].
Leczenie chirurgiczne Chociaż rola leczenia chirurgicznego w ostatnich latach uległa znacznemu ograniczeniu, wciąż jest istotnym elementem strategii wielodyscyplinarnego leczenia chorych z krwawieniem z GOPP. W większości przypadków krwawienia z GOPP błędem jest podejmowanie próby leczenia chirurgicznego bez uprzedniego wykonania badania endoskopowego i próby terapii endoskopowej. Bezspornym pozostaje natomiast wskazanie do pilnego leczenia operacyjnego w każdym przypadku niepowodzenia uzyskania hemostazy technikami endoskopowymi. Każde opóźnienie może prowadzić do śmierci i nawet u chorych we wstrząsie odpowiednią resuscytację należy prowadzić równolegle do leczenia operacyjnego. Innym wskazaniem do leczenia chirurgicznego jest zapobieganie zagrażającemu życiu nawrotowi krwawienia u osób z grupy wysokiego ryzyka zgonu. W zależności od zastosowanego leczenia farmakologicznego i endoskopowego, odsetek nawrotów krwawienia mieści się w granicach od ok. 10 do ok. 15–20% [46, 58, 59, 110]. Zatamowanie ponownego krwawienia technikami endoskopowymi jest zwykle trudne i u 25–50% chorych koniecznością staje się leczenie operacyjne w trybie pilnym [2, 145], obarczone zwiększoną śmiertelnością sięgającą 30–40% [50, 145, 153–157]. Wydaje się, że również w razie powtórnego krwawienia u większości pacjentów można podjąć próbę leczenia endoskopowego, chociaż należy zwrócić uwagę na fakt, że zabieg operacyjny po 2 próbach leczenia endoskopowego jest obarczony wyższym ryzykiem wystąpienia powikłań i wyższym odsetkiem zgonów niż po operacjach wykonanych po pierwszej próbie leczenia endoskopowego. Dlatego też u starszych chorych z chorobami towarzyszącymi, gdzie procesy regeneracyjne są znacznie upośledzone, i w przypadkach z wysokim ryzykiem wystąpienia nawrotu masywnego krwawienia (krwawienie tętnicze, widoczne naczynie o średnicy >2 mm, lokalizacja na tylnej ścianie opuszki dwunastnicy lub wysoko na krzywiźnie mniejszej żołądka, konieczność przetoczenia więcej niż 5–6 jednostek koncentratu krwinek czerwonych), po uzyskaniu wstępnej hemostazy technikami endoskopowymi wskazane jest rozważenie wczesnego, planowego leczenia operacyjnego [158–160]. Wybór techniki zabiegu operacyjnego zależy od lokalizacji, przyczyny krwawienia, wieku i stanu chorego. Postęp w rozumieniu patofizjologii choroby wrzodowej i nowe możliwości terapeutyczne (dożylne IPP, eradykacja Helicobacter pylori) sprawiają, że leczenie chirurgiczne – zamiast stosowanego wcześniej postępowania resekcyjnego [161, 162] – powinno być raczej oszczędzające (wycięcie owrzodzenia, podkłucie krwawiącego naczynia, podwiązanie odpowiedniej tętnicy) i nakierowane bardziej na zatamowanie krwawienia niż na leczenie choroby wrzodowej [158–160]. W przypadku niszy wrzodowej żołądka z reguły wykonuje się miejscową resekcję wrzodu (zwłaszcza w przypadku dużej średnicy zmiany) z podwiązaniem sąsiadujących gałęzi tętnicy żołądkowej lewej. W przypadku niszy wrzodowej dwunastnicy wykonuje się podkłucie naczyń zaopatrujących wrzód, z ewentualnym pokryciem dna owrzodzenia otaczającą błoną śluzową i podwiązaniem tętnicy żołądkowo-dwunastniczej [158–160]. Chociaż zasady techniki operacyjnej przez lata nie uległy zmianie, to postęp w chirurgii minimalnie inwazyjnej przynosi nowe możliwości. W ośrodkach specjalistycznych te same zabiegi dotychczas wykonywane metodą na otwarto można wykonać z dostępu laparoskopowego, zmniejszając uraz okołooperacyjny i ułatwiając szybszy powrót do zdrowia [163]. W celu uzyskania najlepszej relacji korzyści i ryzyka przy kwalifikacji chorych z krwawieniem z GOPP do leczenia operacyjnego niezbędna jest właściwa współpraca całego interdyscyplinarnego zespołu terapeutycznego, a w szczególności endoskopisty i chirurga.
Postępowanie po zakończeniu ostrego okresu choroby Pacjenci, u których źródłem krwawienia był wrzód trawienny, powinni otrzymać standardowe leczenie choroby wrzodowej. Z reguły zaleca się podawanie IPP w dawce 20–40 mg/dobę p.o. przez 4 tyg. we wrzodzie dwunastnicy i 6–8 tyg. we wrzodzie żołądka. Większe dawki są skuteczniejsze w gojeniu dużych wrzodów żołądka [164, 165]. Wszyscy chorzy z krwawieniem z GOPP pochodzenia nieżylakowego powinni zostać poddani badaniu na obecność H. pylori, a w przypadku wyniku dodatniego – leczeniu eradykacyjnemu [1, 2, 4, 166–171]. Leczenie eradykacyjne jest podstawową metodą zapobiegania wystąpieniu późnych nawrotów choroby wrzodowej i krwawienia z wrzodu trawiennego. U pacjentów po skutecznej eradykacji H. pylori nawrotowość krwawienia z wrzodu trawiennego nie powinna przekroczyć 1% w ciągu roku (w porównaniu z 5% u osób stale leczonych antysekrecyjnie i 20% u chorych nieleczonych). Po skutecznej eradykacji nawroty krwawienia są następstwem reinfekcji H. pylori lub stosowania niesteroidowych leków przeciwzapalnych [170, 171]. Z tego powodu zaleca się kontrolę skuteczności leczenia eradykacyjnego [172]. Z niejasnych przyczyn czułość większości metod rozpoznawania infekcji H. pylori w krwawieniu z GOPP jest niska i wynosi od 67% dla testu ureazowego i 70% dla badania histologicznego, do 88% dla badania serologicznego i 93% dla testu oddechowego (natomiast swoistość testów nie ulega obniżeniu) [173–175]. Ponadto zastosowanie IPP może obniżyć czułość testu oddechowego, jeśli nie jest on wykonany odpowiednio wcześnie. W tej sytuacji proponuje się następujące postępowanie: • podczas badania endoskopowego należy pobrać wycinki do testu urazowego i ewentualnie badania histologicznego, • w przypadku wyniku ujemnego należy wykonać test oddechowy lub badanie serologiczne, • w razie kolejnego wyniku ujemnego należy wykonać test oddechowy w odstępie 14 dni od zakończenia leczenia IPP [175]. Każdy wynik dodatni jest wskazaniem do podjęcia leczenia eradykacyjnego. Leczenie to należy rozpocząć po opanowaniu krwawienia i rozpoczęciu odżywiania doustnego. Nie ma jednak potrzeby pilnego włączania leczenia eradykacyjnego drogą dożylną w ostrym okresie choroby [2]. W przypadku, gdy przyczyną krwawienia było stosowanie niesteroidowych leków z tej grupy, należy dążyć do ich odstawienia. Jeśli jest to niemożliwe, należy rozważyć podawanie leków z tej grupy o możliwie najmniejszej toksyczności, stosując rów- nocześnie profilaktyczne leczenie antysekrecyjne [176–178]. W przypadku wrzodu żołądka konieczne jest wykonanie endoskopii kontrolnej po upływie 6–8 tyg. dla oceny wygojenia wrzodu i wykluczenia jego nowotworowej etiologii. W przypadku wrzodu dwunastnicy po uzyskaniu eradykacji H. pylori nie ma bezwzględnej konieczności wykonywania endoskopii kontrolnej, jednak postępowanie takie nie jest błędem. Wykonanie endoskopii kontrolnej jest konieczne u osób stale przyjmujących niesteroidowe leki przeciwzapalne [1].
Podsumowanie postępowania w leczeniu krwawienia z górnego odcinka przewodu pokarmowego pochodzenia nieżylakowego
1. Leczenie powinno być prowadzone w wyspecjalizowanym, odpowiednio wyposażonym ośrodku leczenia krwawień. 2. Należy ocenić ciężkość krwawienia i postawić prognozę jego przebiegu za pomocą obiektywnego systemu punktowego oraz wykonać odpowiednie badania laboratoryjne. 3. Zaawansowany wiek, zły stan ogólny chorego (obecność chorób towarzyszących) oraz masywność krwawienia są negatywnymi czynnikami rokowniczymi. 4. Leczenie krwawienia rozpoczyna się od wyrównania ewentualnych zaburzeń hemodynamicznych. 5. Podanie przed wykonaniem endoskopii inhibitora pompy protonowej i erytromycyny jako leku gastrokinetycznego ułatwia ustalenie rozpoznania i przeprowadzenie terapii endoskopowej. 6. Endoskopia wykonana w trybie pilnym jest najważniejszym elementem procesu diagnostyczno-terapeutycznego, a główną korzyścią z niej płynącą jest możliwość endoskopowego tamowania krwawienia. 7. Wskazaniem do leczenia endoskopowego jest obecność tzw. znamion krwawienia wysokiego ryzyka, tj. aktywnego krwawienia, widocznego niekrwawiącego naczynia i w części przypadków skrzepu pokrywającego niszę wrzodową. 8. Zalecane techniki hemostazy endoskopowej obejmują terapię iniekcyjną, koagulację koaptywną, koagulację plazmą argonową oraz metody mechaniczne. 9. Terapia iniekcyjna z użyciem adrenaliny charakteryzuje się dużym odsetkiem nawrotów i w monoterapii jest mniej skuteczna niż pozostałe techniki lub kombinacja terapii iniekcyjnej z pozostałymi technikami. 10. Techniki koagulacji i zastosowanie klipsów hemostatycznych są skuteczne w monoterapii. Zastosowanie klipsów jest technicznie trudniejsze, ale charakteryzuje się najmniejszym odsetkiem nawrotów krwawienia. 11. Podstawą leczenia farmakologicznego jest zahamowanie wydzielania kwasu solnego za pomocą dużych dawek inhibitora pompy protonowej. 12. Wczesne, planowe wykonanie kontrolnej endoskopii może być korzystne u chorych z największym ryzykiem wystąpienia nawrotu krwawienia. 13. W przypadku nawrotu krwawienia z reguły celowe jest podjęcie przynajmniej jednej próby ponownego leczenia endoskopowego. 14. Wskazaniami do leczenia chirurgicznego w trybie pilnym są niskie prawdopodobieństwo powodzenia terapii endoskopowej oraz jej niepowodzenie zarówno pierwotne, jak i w przypadku nawrotu krwawienia. 15. Pacjenci z chorobą wrzodową powinni być poddani badaniu na obecność Helicobacter pylori i leczeniu eradykacyjnemu w razie wyniku dodatniego.
Piśmiennictwo 1. British Society of Gastroenterology Endoscopy Committee. Non-variceal upper gastrointestinal haemorrhage: guidelines. Gut 2002; 51 (Suppl IV): iv1–iv6. 2. Barkun A, Bardou M, Marshall JK for the Nonvariceal Upper GI Bleeding Consensus Conference Group. Consensus Recommendations for Managing Patients with Nonvariceal Upper Gastrointestinal Bleeding. Ann Intern Med 2003; 139: 843-57. 3. Lundell L. GI haemorrhage – surgical aspects. EAGE 2nd European Postgraduate School in Gastroenterology. Abstracts 28-29. 4. The Standard of Practice Committeee of the ASGE (Adler DG, Leighton JA, Davila RE i wsp.). ASGE guideline: the role of endoscopy in acute non-variceal upper-GI hemorrhage. Gastrointest Endosc 2004; 60: 497-504. 5. Rockall TA, Logan RF, Devlin HB, Northfield TC. Incidence of and mortality from acute upper gastrointestinal haemorrhage in the United Kingdom. Steering Committee and members of the National Audit of Acute Upper Gastrointestinal Haemorrhage. BMJ 1995; 311: 222-6. 6. Dulai GS, Gralnek IM, Oei TT i wsp. Utilization of health care resources for low-risk p














