Komisja Europejska zarejestrowała Ipilimumab do leczenia pacjentów pediatrycznych w wieku 12 lat i starszych z nieoperacyjnym lub przerzutowym czerniakiem
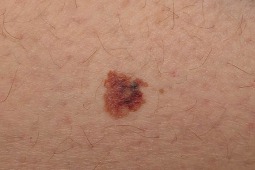
Komisja Europejska rozszerzyła wskazanie dla ipilimumabu o pacjentów pediatrycznych w wieku 12 lat i starszych z nieoperacyjnym lub przerzutowym czerniakiem. Decyzja Komisji Europejskiej oznacza pierwszą w Unii Europejskiej rejestrację leku immunoonkologicznego we wskazaniu do pediatrycznego zastosowania. Ipilimumab w tym wskazaniu będzie dostępny we wszystkich 28 krajach członkowskich Unii Europejskiej.
Ipilimumab oceniano w populacji pediatrycznych i nastoletnich pacjentów w dwóch badaniach klinicznych: badanie określające dawkę obejmujące 33 pacjentów w wieku od 2 do 21 lat z nawrotowymi lub opornymi na leczenie guzami litymi; oraz otwarte badanie z jednym ramieniem obejmującym 12 nastolatków (w wieku od 12 do 16 lat) z uprzednio leczonym lub nieleczonym, nieoperacyjnym czerniakiem złośliwym w stadium III lub IV.
Amerykańska Agencja ds. Żywności i Leków (FDA) zarejestrowała ipilimumab do leczenia pediatrycznych pacjentów w wieku 12 lat i starszych z nieoperacyjnym lub przerzutowym czerniakiem w lipcu 2017 r.
Informacje na temat badań nad ipilimumabem u pacjentów pediatrycznych
W badaniu klinicznym określającym dawkę, obejmującym pacjentów z nawrotowymi lub opornymi na leczenie guzami litymi, mediana wieku pacjentów wyniosła 13 lat, a 18 pacjentów miało 12 lat lub więcej. Ipilimumab podawano dożylnie w dawkach 1, 3, 5 i 10 mg/kg przez 90 minut co trzy tygodnie w czterech cyklach, a następnie co 12 tygodni do czasu progresji choroby lub przerwania leczenia.
W otwartym badaniu klinicznym z pojedynczym ramieniem, obejmującym pacjentów z uprzednio leczonym lub nieleczonym, nieoperacyjnym czerniakiem złośliwym w stadium III lub IV, pacjenci otrzymywali ipilimumab dożylnie w dawce 3 mg/kg (czterech pacjentów) lub 10 mg/kg (ośmiu pacjentów) przez 90 minut co trzy tygodnie w czterech kursach. Spośród 17 pacjentów z czerniakiem w wieku 12 lat i starszych, leczonych ipilimumabem w obu badaniach, u dwóch pacjentów osiągnięto obiektywną odpowiedź, włącznie z jedną częściową odpowiedzią, która utrzymała się przez ponad rok.
Zastosowanie ipilimumabu w tej grupie wiekowej jest również poparte dowodami z adekwatnych i dobrze kontrolowanych badań klinicznych nad ipilimumabem obejmujących dorosłych, w których dane farmakokinetyczne wykazały, że działanie dawki 3 mg/kg w populacji pediatrycznej oraz w populacji dorosłych jest porównywalne. Ponadto, biologia guza oraz proces rozwoju zaawansowanego czerniaka jest na tyle podobny u dorosłych jak i u pediatrycznych pacjentów w wieku 12 lat i starszych, że pozwala na ekstrapolację wyników z populacji dorosłych na populację pediatryczną.
Zarejestrowana dawka ipilimumabu u pacjentów pediatrycznych z nieoperacyjnym lub przerzutowym czerniakiem wynosi 3 mg/kg, podawane dożylnie przez 90 minut, co trzy tygodnie przez całkowity okres czterech cykli.
Informacje na temat leku ipilimumab
Ipilimumab jest rekombinowanym ludzkim przeciwciałem monoklonalnym, które wiąże cytotoksyczny antygen-4 limfocytów T (CTLA-4). CTLA-4 jest negatywnym regulatorem aktywacji limfocytów T. Ipilimumab łączy się z CTLA-4 i blokuje interakcje CTLA-4 ze swoimi ligandami, CD80/CD86. Wykazano, że blokowanie CTLA-4 wspiera aktywację komórek T i proliferacje, włącznie z aktywacją i proliferacją komórek T przenikających do guza. Hamowanie sygnałów CTLA-4 może również zredukować działanie komórek regulacyjnych T, co może się przyczynić do ogólnego wzrostu odpowiedzi komórek T, włącznie z przeciwnowotworową odpowiedzią immunologiczną. 25 Marca 2011 r. Amerykańska Agencja ds. Żywności i Leków (FDA) zarejestrowała ipilimumab w dawce 3 mg/kg we wskazaniu do monoterapii pacjentów z nieoperacyjnym lub przerzutowym czerniakiem. Ipilimumab jest zarejestrowany we wskazaniu do leczenia nieoperacyjnego lub przerzutowego czerniaka w ponad 50 krajach. Obecnie prowadzony jest szeroki program rozwoju zastosowań ipilimumabu w leczeniu wielu różnych typów nowotworów.
.
Amerykańska Agencja ds. Żywności i Leków (FDA) zarejestrowała ipilimumab do leczenia pediatrycznych pacjentów w wieku 12 lat i starszych z nieoperacyjnym lub przerzutowym czerniakiem w lipcu 2017 r.
Informacje na temat badań nad ipilimumabem u pacjentów pediatrycznych
W badaniu klinicznym określającym dawkę, obejmującym pacjentów z nawrotowymi lub opornymi na leczenie guzami litymi, mediana wieku pacjentów wyniosła 13 lat, a 18 pacjentów miało 12 lat lub więcej. Ipilimumab podawano dożylnie w dawkach 1, 3, 5 i 10 mg/kg przez 90 minut co trzy tygodnie w czterech cyklach, a następnie co 12 tygodni do czasu progresji choroby lub przerwania leczenia.
W otwartym badaniu klinicznym z pojedynczym ramieniem, obejmującym pacjentów z uprzednio leczonym lub nieleczonym, nieoperacyjnym czerniakiem złośliwym w stadium III lub IV, pacjenci otrzymywali ipilimumab dożylnie w dawce 3 mg/kg (czterech pacjentów) lub 10 mg/kg (ośmiu pacjentów) przez 90 minut co trzy tygodnie w czterech kursach. Spośród 17 pacjentów z czerniakiem w wieku 12 lat i starszych, leczonych ipilimumabem w obu badaniach, u dwóch pacjentów osiągnięto obiektywną odpowiedź, włącznie z jedną częściową odpowiedzią, która utrzymała się przez ponad rok.
Zastosowanie ipilimumabu w tej grupie wiekowej jest również poparte dowodami z adekwatnych i dobrze kontrolowanych badań klinicznych nad ipilimumabem obejmujących dorosłych, w których dane farmakokinetyczne wykazały, że działanie dawki 3 mg/kg w populacji pediatrycznej oraz w populacji dorosłych jest porównywalne. Ponadto, biologia guza oraz proces rozwoju zaawansowanego czerniaka jest na tyle podobny u dorosłych jak i u pediatrycznych pacjentów w wieku 12 lat i starszych, że pozwala na ekstrapolację wyników z populacji dorosłych na populację pediatryczną.
Zarejestrowana dawka ipilimumabu u pacjentów pediatrycznych z nieoperacyjnym lub przerzutowym czerniakiem wynosi 3 mg/kg, podawane dożylnie przez 90 minut, co trzy tygodnie przez całkowity okres czterech cykli.
Informacje na temat leku ipilimumab
Ipilimumab jest rekombinowanym ludzkim przeciwciałem monoklonalnym, które wiąże cytotoksyczny antygen-4 limfocytów T (CTLA-4). CTLA-4 jest negatywnym regulatorem aktywacji limfocytów T. Ipilimumab łączy się z CTLA-4 i blokuje interakcje CTLA-4 ze swoimi ligandami, CD80/CD86. Wykazano, że blokowanie CTLA-4 wspiera aktywację komórek T i proliferacje, włącznie z aktywacją i proliferacją komórek T przenikających do guza. Hamowanie sygnałów CTLA-4 może również zredukować działanie komórek regulacyjnych T, co może się przyczynić do ogólnego wzrostu odpowiedzi komórek T, włącznie z przeciwnowotworową odpowiedzią immunologiczną. 25 Marca 2011 r. Amerykańska Agencja ds. Żywności i Leków (FDA) zarejestrowała ipilimumab w dawce 3 mg/kg we wskazaniu do monoterapii pacjentów z nieoperacyjnym lub przerzutowym czerniakiem. Ipilimumab jest zarejestrowany we wskazaniu do leczenia nieoperacyjnego lub przerzutowego czerniaka w ponad 50 krajach. Obecnie prowadzony jest szeroki program rozwoju zastosowań ipilimumabu w leczeniu wielu różnych typów nowotworów.
.
Źródło:
mat press/MK
mat press/MK
Kategorie:
Czerniak