Eradykacja Helicobacter pylori – siedem grzechów głównych
Zgodnie z aktualnymi wytycznymi w eradykacji H. pylori należy stosować schemat terapii poczwórnej z bizmutem lub bez bizmutu przez 10–14 dni. W razie niepowodzenia jako leczenie drugiego wyboru zaleca się terapię potrójną z lewofloksacyną lub poczwórną z bizmutem (jeśli nie była wcześniej stosowana). W artykule przedstawiono najczęstsze błędy popełniane przez lekarzy i pacjentów w trakcie terapii eradykacyjnej.
Autor: Jarosław Daniluk
Wstęp
Infekcja Helicobacter pylori (H. pylori) jest jednym z najczęstszych przewlekłych zakażeń bakteryjnych u ludzi, dotyczącym ok. 4,4 mld osób na świecie, z bardzo dużym zróżnicowaniem geograficznym, sięgającym od 35% do 90% w poszczególnych krajach [1, 2]. Ocenia się, że w Polsce infekcja dotyczy aż 66,9% populacji, czyli 25,5 mln ludzi [3]. Helicobacter pylori jest bakterią patogenną, powodującą rozwój zapalenia żołądka u każdego zakażonego, a u części z nich choroby wrzodowej (1–10%), chłoniaka MALT (lymphoid mucosa associated tissue lymphoma, 0,5%) lub raka żołądka (0,1–3%) [4]. Obecnie można się zastanawiać, czy zakażenie H. pylori wpływa w jakiś sposób na przebieg infekcji SARS-CoV-2. W jednej z najnowszych publikacji autorzy zauważyli, że występowanie bólu brzucha i biegunki silnie korelowało z obecnością H. pylori u chorych na COVID-19. Ból brzucha (19,4% vs 2,6%) i biegunka (32,3% vs 9,1%) były istotnie częstsze u pacjentów z obecnością H. pylori w porównaniu z chorymi bez tej bakterii (odpowiednio p = 0,007 i p = 0,006). Nie wykazano statystycznie istotnej zależności między zakażeniem H. pylori a liczbą dni hospitalizacji czy ciężkością przebiegu COVID-19 (p > 0,05) [5].
W aktualnych wytycznych europejskich (Maastricht V/Florencja) znalazło się stwierdzenie, że zapalenie żołądka wywołane H. pylori jest chorobą zakaźną, dlatego eradykacja tej bakterii jest zalecana u wszystkich zainfekowanych osób dorosłych niezależnie od objawów [6]. Wobec powyższego aktualnie nie podaje się wskazań do leczenia zakażenia H. pylori, a jedynie do jego wykrycia. Diagnostyka w kierunku H. pylori jest wskazana w przypadku aktywnej lub przebytej choroby wrzodowej, wczesnego raka żołądka, wśród krewnych pierwszego stopnia chorych na raka żołądka, chłoniaka MALT, w przypadku dyspepsji niediagnozowanej lub czynnościowej, planowanego długotrwałego leczenia niesteroidowymi lekami przeciwzapalnymi (NLPZ) oraz niektórych chorób hematologicznych (niedokrwistość z niedoboru żelaza o niewyjaśnionej przyczynie, samoistna małopłytkowość u dorosłych oraz niedobór witaminy B12) (tab. 1).

W przeciwieństwie do większości chorób zakaźnych, w których terapia opiera się na znanej wrażliwości drobnoustroju na antybiotyki, leczenie H. pylori pozostaje w dużej mierze empiryczne. Uważa się, że efektywna terapia eradykacyjna powinna charakteryzować się co najmniej 90-procentową skutecznością. Niestety w praktyce klinicznej takie wartości są rzadko spotykane i coraz częściej zmagamy się z problemem nieskuteczności terapii, którą definiujemy jako utrzymujący się dodatni wynik nieserologicznego testu w kierunku H. pylori co najmniej 4 tygodnie po ukończonym leczeniu eradykacyjnym zgodnym z aktualnymi wytycznymi i po odstawieniu wszelkich leków, które mogą wpływać na czułość testu, takich jak inhibitory pompy protonowej (IPP) [7]. Jest to niejednokrotnie trudne do zrealizowania, szczególnie u osób z objawami choroby refluksowej przełyku, u których warto wtedy czasowo zastosować terapię pomostową lekami osłaniającymi, np. alkaliami, alginianami czy preparatem będącym ich połączeniem z Mucosave®, które nie wpływają na czułość testów diagnostycznych w kierunku H. pylori.
Konsekwencje nieskutecznej eradykacji są bardzo istotne i obejmują powikłania kliniczne związane z przetrwałą infekcją H. pylori, wielokrotną ekspozycją na antybiotyki, wytwarzaniem oporności na antybiotyki przez inne drobnoustroje, a także związane z tym bezpośrednie i pośrednie koszty opieki zdrowotnej. Aktualne wytyczne głównych towarzystw gastroenterologicznych na świecie (Maastricht V/Florencja, konsensus z Toronto, wytyczne American College of Gastroenterology) zgodnie stwierdzają, że optymalne leczenie eradykacyjne powinno być skuteczne już przy pierwszej próbie [6, 8, 9]. Prawdopodobieństwo pomyślnej eradykacji maleje z każdą kolejną próbą terapii, dlatego należy dołożyć wszelkich starań, aby wyeliminować czynniki, które mogą się przyczynić do niepowodzenia leczenia. W artykule wyszczególniono najczęstsze błędy popełniane w trakcie eradykacji H. pylori oraz metody zapobiegania im, aby zwiększyć skuteczność tej terapii w codziennej praktyce lekarza POZ.
1 – Nieprzestrzeganie wytycznych dotyczących schematów eradykacji H. pylori
Pomimo niemal 40 lat doświadczeń w leczeniu H. pylori idealna terapia eradykacyjna nadal nie została opracowana. Na przestrzeni lat obserwujemy stale zmieniające się schematy leczenia, co jest spowodowane przede wszystkim narastającą opornością bakterii na antybiotyki. W związku z tym Światowa Organizacja Zdrowia (World Health Organization – WHO) uznała H. pylori za jeden z 12 patogenów o najwyższym priorytecie do stworzenia nowych, skutecznych antybiotyków [10]. Niestety aktualna lista antybiotyków mających zastosowanie w eradykacji H. pylori jest bardzo ograniczona. Zaliczamy do nich klarytromycynę, amoksycylinę, metronidazol, lewofloksacynę, tetracyklinę, ryfabutynę. Klasyczna terapia potrójna (IPP + klarytromycyna + amoksycylina lub metronidazol), która była podstawowym leczeniem eradykacyjnym u schyłku ubiegłego wieku, nie powinna być obecnie stosowana w większości krajów (w tym w Polsce) ze względu na wysoką (> 15%) oporność bakterii na klarytromycynę. W metaanalizie 50 tys. pacjentów z 45 krajów pierwotna oporność na klarytromycynę wynosiła od 10% do 34%, a na metronidazol od 23% do 56% [11]. W polskim badaniu na podstawie analizy populacji pediatrycznej i dorosłej stwierdzono oporność na klarytromycynę na poziomie 28%, a na metronidazol 46% [12]. Wykazano ponadto, że w przypadku oporności in vitro na klarytromycynę zastosowanie tego antybiotyku w terapii eradykacyjnej in vivo zwiększa 7-krotnie ryzyko niepowodzenia leczenia [11]. Mimo tych niepokojących wskaźników oporności analiza 21 533 pacjentów z 27 krajów europejskich (w tym z Polski) zakażonych H. pylori wykazała, że terapia potrójna z klarytromycyną była najczęściej przepisywanym schematem leczenia pierwszego wyboru, a wskaźnik jej skuteczności w eradykacji wyniósł zaledwie 81,5% [13]. Te dane jednoznacznie wskazują, że terapia zakażenia H. pylori w codziennej praktyce jest obecnie nieoptymalna i niezgodna z wytycznymi, nawet wśród specjalistów gastroenterologów.
Jaki schemat eradykacji H. pylori powinien zostać wybrany przez lekarza POZ w Polsce? Ogólny porządek postępowania przedstawiono na rycinie 1. Zgodnie z wytycznymi europejskimi (Maastricht V/Florencja) leczeniem pierwszego wyboru powinna być terapia poczwórna z bizmutem (IPP + bizmut + metronidazol + tetracyklina), ponieważ charakteryzuje się bardzo dobrą, ponad 90-procentową skutecznością [6, 14, 15]. Jeśli preparaty bizmutu są niedostępne lub nietolerowane, alternatywą jest terapia poczwórną bez bizmutu (IPP + amoksycylina + metronidazol + klarytromycyna). Potwierdzono istotną statystycznie przewagę terapii poczwórnej bez bizmutu nad klasyczną terapią potrójną (92% vs 70%, p = 0,02) oraz porównywalną skuteczność z terapią poczwórną z bizmutem (97,7% vs 96,2%, p = 0,605) [15, 16].
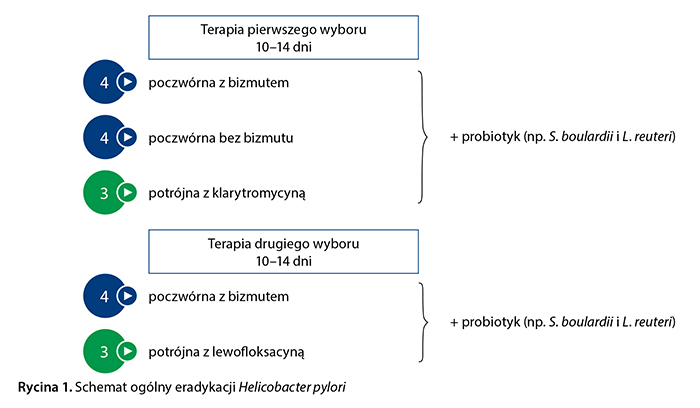
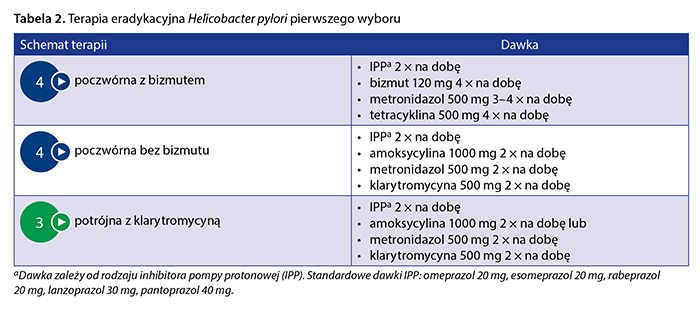
Trzecią możliwością terapii pierwszego wyboru według wytycznych europejskich jest klasyczna potrójna terapia z klarytromycyną [6], jednak ten schemat może być zastosowany tylko w krajach o niskiej oporności na klarytromycynę (< 15%) i przy braku wcześniejszej ekspozycji pacjenta na makrolidy, co praktycznie wyklucza jego stosowanie w Polsce. Mimo wcześniejszych zachęcających wyników aktualne wytyczne zarówno europejskie, jak i kanadyjskie nie zalecają stosowania terapii sekwencyjnej lub hybrydowej w leczeniu zakażenia H. pylori [6, 9]. Ważnym problemem, przed którym niejednokrotnie stają lekarze POZ, jest zgłaszane przez pacjenta uczulenie na pochodne penicyliny, w tym amoksycylinę. W takich przypadkach eksperci amerykańscy zalecają wykonanie testów alergicznych w celu potwierdzenia lub wykluczenia nietolerancji tych antybiotyków [7]. U pacjentów z rzeczywistą alergią na penicylinę zaleca się terapię poczwórną z bizmutem lub ewentualnie terapię potrójną z klarytromycyną i metronidazolem (przy oporności na klarytromycynę < 15%) [6, 8, 9]. Szczegóły dotyczące schematu, dawek leków oraz czasu trwania terapii pierwszego wyboru przedstawiono w tabeli 2.
W razie niepowodzenia leczenia wytyczne europejskie oraz północnoamerykańskie zgodnie zalecają w leczeniu drugiego wyboru terapię poczwórną z bizmutem lub potrójną z lewofloksacyną, w zależności od tego, który lek stosowano wcześniej [6, 8, 9] (tab. 3). Jeśli na przykład wcześniej podawano metronidazol, korzystne może być włączenie schematu z lewofloksacyną, jednak należy pamiętać o narastającej oporności na ten drugi antybiotyk.

Po dwóch nieskutecznych terapiach eradykacyjnych konsensus Maastricht V/Florencja zaleca określenie wrażliwości szczepu H. pylori na antybiotyki przed wdrożeniem kolejnego leczenia [6]. Niestety w praktyce klinicznej, szczególnie w warunkach gabinetu lekarza POZ, rzadko dysponujemy możliwością wykonania posiewu. Dlatego aktualne wytyczne dopuszczają możliwość empirycznej terapii ratunkowej: terapii poczwórnej z bizmutem (w przypadku wcześniejszej ekspozycji na klarytromycynę, lewofloksacynę lub nawet metronidazol w terapii bez bizmutu), terapii z lewofloksacyną (w przypadku wcześniejszej ekspozycji na klarytromycynę i metronidazol), terapii poczwórnej bez bizmutu [6, 8, 9]. Jedynie w europejskich wytycznych dopuszcza się zastosowanie w leczeniu ratunkowym terapii potrójnej opartej na klarytromycynie na obszarze o znanej niskiej oporności na ten antybiotyk [6]. W ostatnim czasie przedstawiono dwie nowe obiecujące formy terapii ratunkowej. Pierwsza z nich, polegająca na podawaniu wysokich dawek amoksycyliny (4 × 750 mg) i IPP (rabeprazol 4 × 20 mg) przez 14 dni, charakteryzowała się bardzo wysoką, 95-procentową skutecznością eradykacji H. pylori [17]. Alternatywną może być terapia z ryfabutyną (2 × 150 mg lub 1 × 300 mg), amoksycyliną (2 × 1000 mg) i PPI (2 × dziennie), której skuteczność w terapii trzeciego wyboru wynosiła 66% [18].
2 – Ponowne stosowanie tych samych antybiotyków w kolejnych terapiach eradykacyjnych, przy ich uprzedniej nieskuteczności
W razie niepowodzenia terapii eradykacyjnej pierwszego wyboru aktualne wytyczne zalecają unikanie ponownego stosowania antybiotyków, które wcześniej okazały się nieskuteczne [6, 8, 9]. Zalecenie to jest szczególnie istotne w przypadku kolejnej próby użycia klarytromycyny i lewofloksacyny, ponieważ jak wykazano, w takich sytuacjach wskaźnik oporności na klarytromycynę sięga 15–67%, a na lewofloksacynę 19–30% [11]. Ze względu na synergistyczny efekt połączenia metronidazolu z bizmutem jego ponowne zastosowanie w terapii czterolekowej może być rozważaną opcją. Również amoksycylina lub tetracyklina mogą być ponownie wykorzystane w terapii drugiego wyboru z uwagi na bardzo niski wskaźnik oporności H. pylori na te antybiotyki, nieprzekraczający 1–2% [11]. Badanie ankietowe przeprowadzone wśród lekarzy w Stanach Zjednoczonych wykazało, że zaledwie 38% z nich uzyskało informacje od pacjenta dotyczące antybiotyków stosowanych przed przepisaniem eradykacji H. pylori [19]. W badaniu europejskim potwierdzono ponowne zastosowanie klarytromycyny w terapii drugiego wyboru w 15% przypadków, co skutkowała bardzo niską (< 80%) skutecznością leczenia [20]. Podobne zastrzeżenia dotyczą ponownego stosowania lewofloksacyny (w 32% przypadków) pomimo wcześniejszej ekspozycji na chinolony. Należy podkreślić kluczową rolę lekarza, który przed przepisaniem kolejnej terapii eradykacyjnej powinien zebrać dokładny wywiad na temat wcześniejszej ekspozycji pacjenta na antybiotyki.
3 – Stosowanie zbyt niskich dawek IPP w terapii eradykacyjnej H. pylori
Odpowiednia supresja wydzielania kwasu żołądkowego jest niezmiernie istotnym elementem terapii eradykacyjnej, ponieważ wrażliwość H. pylori na działanie antybiotyków jest największa przy pH w żołądku w zakresie 6–8. Jest to optymalne pH, w którym zachodzi intensywna replikacja bakterii. Wykazano, że okres półtrwania amoksycyliny i klarytromycyny przy pH żołądka < 2 wynosi odpowiednio 15,2 ±0,3 godziny i 1,0 ±0,04 godziny, podczas gdy dla pH żołądka > 7 okresy półtrwania obu antybiotyków wydłużają się powyżej 68 godzin [21]. Siła hamowania kwasu żołądkowego przez IPP w dużym stopniu zależy od zdolności metabolizowania leku przez podjednostkę 2CYP2C19 cytochromu P450. Stwierdzono, że nawet 81% populacji rasy kaukaskiej cechuje się polimorfizmem genetycznym CYP2C19 odpowiedzialnym za szybki metabolizm tych leków [22]. Omeprazol jest metabolizowany przez podjednostki CYP2C19 i CYP3A4 cytochromu P450 w stosunku 9 : 1, a esomeprazol 3 : 1. Ze względu na niedostępność testów oceniających polimorfizm genetyczny CYP2C19 w celu zwiększenia skuteczności leczenia powinniśmy stosować wyższe dawki i/lub zwiększyć częstość podawania leków pierwszej generacji lub stosować nowsze leki, których metabolizm nie zależy w takim stopniu od CYP2C19 (np. esomeprazol) [7]. Wykazano, że stosowanie wyższych dawek IPP (esomeprazol 40 mg zamiast omeprazol 20 mg) w terapii potrójnej z klarytromycyną zwiększało o 11% skuteczność eradykacji [23]. Stwierdzono ponadto, że podawanie IPP dwa razy dziennie miało przewagę nad dawkami jednorazowymi [24], dlatego konsensus Maastricht V/Florencja sugeruje stosowanie esomeprazolu (40 mg 2 × dziennie) lub rabeprazolu (20 mg 2 × dziennie) w terapii eradykacyjnej w Europie i Ameryce Północnej ze względu na przewagę osób intensywnie metabolizujących IPP w tych regionach [6]. Niestety w praktyce klinicznej te zalecenia nie zawsze są przestrzegane. Analiza 26 340 chorych z europejskiego rejestru terapii H. pylori (European Registry on H. pylori Management, Hp-EuReg) wykazała, że aż 48% pacjentów było leczonych niskimi dawkami IPP [20]. Na szczęście ten niekorzystny trend zmniejsza się w ostatnich latach. W 2013 r. niskie dawki IPP stosowano u 67% pacjentów, natomiast w 2019 r. ten odsetek zmniejszył się do 20% [20].
Być może problemy z nieadekwatnym hamowaniem kwasu żołądkowego zostaną rozwiązane wraz z wprowadzeniem na rynek nowych leków blokujących wydzielanie żołądkowe. Wonoprazan (zarejestrowany w Japonii, niedostępny w Europie), jest pierwszym lekiem, który w sposób kompetycyjny, zależny od potasu hamuje pompę ATP-H+/K+ w komórkach okładzinowych żołądka. W porównaniu z IPP wonoprazan działa szybciej, dłużej i silniej hamuje wydzielanie kwasu żołądkowego, niezależnie od przyjmowania posiłków oraz od polimorfizmu CYP2C19 [25, 26]. Zastąpienie IPP wonoprazanem w terapii potrójnej z klarytromycyną zwiększyło skuteczność eradykacji o 10–20%, a najsilniejszy efekt obserwowano w przypadku szczepów H. pylori opornych na klarytromycynę [27].
4 – Zbyt krótki czas stosowania terapii eradykacyjnej
W przypadku klasycznej terapii potrójnej 7-dniowy okres podawania leków był przez wiele lat standardem leczenia. Dopiero w wytycznych Maastricht IV/Florencja w 2012 r. znalazło się stwierdzenie, że wydłużenie terapii do 10–14 dni zwiększa skuteczność eradykacji o 5% [28]. Wyniki metaanalizy bazy danych Cochrane wskazują, że optymalny czas terapii potrójnej to 14 dni [29]. W celu poprawy efektywności leczenia wytyczne europejskie i kanadyjskie zalecają wydłużenie czasu potrójnej terapii eradykacyjnej z klarytromycyną do 14 dni, pod warunkiem oczywiście, że oporność na ten antybiotyk na danym obszarze nie przekracza 15% [6, 9]. W przypadku terapii potrójnej z amoksycyliną i metronidazolem wydłużenie czasu leczenia do 14 dni może przełamać istniejącą oporność na metronidazol [30]. Niestety dane z cytowanego wcześniej europejskiego rejestru Hp-EuReg pokazują, że wytyczne dotyczące długości trwania terapii eradykacyjnej nie są przestrzegane w codziennej praktyce klinicznej. Stwierdzono, że 69% pacjentów stosujących terapię potrójną otrzymywało ją przez zaledwie 7–10 dni, a skuteczność w tym przypadku wynosiła jedynie 81%, w porównaniu z 88% wyleczeń, gdy terapię przedłużono do 14 dni [20]. Jednocześnie w ostatnich latach obserwuje się korzystny trend wydłużenia czasu terapii potrójnej z 9,9 dnia w 2013 r. do 13,1 dnia w 2019 r. [20].
W przypadku terapii poczwórnej (z bizmutem lub bez bizmutu) czas leczenia również powinien wynosić 14 dni, chyba że na danym terenie wykazano skuteczność terapii 10-dniowej [6, 8, 9]. Dane dotyczące czasu trwania terapii poczwórnej raportowane przez lekarzy z Europy ponownie odbiegają od wytycznych. W analizie dotyczącej lat 2013–2019 terapia poczwórna bez bizmutu była stosowana przez 7–10 dni aż u 58% pacjentów, co przyczyniło się do istotnego pogorszenia skuteczności eradykacji (80%) w porównaniu z leczeniem 14-dniowym (90%) [20]. W przypadku terapii z lewofloksacyną wytyczne europejskie i kanadyjskie zalecają 14-dniowy okres leczenia, podczas gdy wytyczne amerykańskie dopuszczają terapię 10-dniową [6, 8, 9]. Terapia ratunkowa przy użyciu wysokich dawek amoksycyliny i IPP powinna być stosowana przez 14 dni, natomiast w schemacie z ryfabutyną ograniczona do 10 dni ze względu na jej potencjalne działanie mielotoksyczne [8, 9].
Podsumowując – przepisując terapię eradykacyjną lekarz powinien, oprócz właściwego wyboru schematu leczenia, zwrócić szczególną uwagę na okres, przez jaki te leki będą przyjmowane.
5 – Nieprzestrzeganie zaleceń lekarskich
Do najczęstszych przyczyn nieprzestrzegania zaleceń lekarskich zaliczamy złożoność schematów eradykacyjnych i związaną z tym dużą liczbę tabletek do przyjęcia, nietolerancję leków, utrudniony dostęp do lekarza POZ lub gastroenterologa, brak zrozumienia przez pacjenta, dlaczego wskazane jest leczenie. W warunkach polskich 14-dniowa terapia z bizmutem (4 × 120 mg), metronidazolem (4 × 500 mg), tetracykliną (4 × 500 mg) i IPP (2 × 20 mg) wiąże się z koniecznością przyjęcia aż 238 tabletek. W przypadku zastosowania preparatu złożonego (Pylera®) zawierającego 40 mg tlenku bizmutu, 125 mg metronidazolu oraz 125 mg chlorowodorku tetracykliny 10-dniowa terapia z IPP wymaga przyjęcia 140 tabletek. Dlatego przed przepisaniem terapii należy dokładnie omówić z pacjentem schemat leczenia, korzyści i możliwe działania niepożądane. Na podstawie przeprowadzonej analizy wykazano, że ok. 10% pacjentów przyjmuje < 60% leków przepisanych w terapii eradykacyjnej [31]. Zgodnie z danymi rejestru Hp-EuReg przestrzeganie zaleceń dotyczących leczenia H. pylori w Europie było na bardzo wysokim poziomie i wyniosło aż 97%, co miało bezpośrednie odzwierciedlenie w wysokim współczynniku eradykacji – 87%, podczas gdy u osób niestosujących się do zaleceń wskaźnik ten spadł do 56% [20]. Do zwiększenia przestrzegania zaleceń lekarskich może się przyczynić stosowanie nowoczesnych metod, w tym specjalnych aplikacji medycznych na telefonie komórkowym pomagających w prawidłowym przyjmowaniu leków [32].
Przepisując terapię eradykacyjną, lekarz powinien uprzedzić pacjenta o niekorzystnym wpływie palenia tytoniu na skuteczność leczenia. Palenie zwiększa wydzielanie kwasu żołądkowego, upośledza wydzielanie śluzu oraz redukuje podśluzówkowy przepływ krwi w żołądku, przez co zmniejsza miejscową penetrację antybiotyków. Niekorzystny wpływ palenia na wyniki leczenia potwierdzono w jednej z niedawno opublikowanych metaanaliz, w której wykazano, że pacjenci palący mieli istotnie wyższe ryzyko niepowodzenia terapii eradykacyjnej (OR = 1,70) w porównaniu z niepalącymi [33].
6 – Brak terapii uzupełniającej poprawiającej skuteczność leczenia eradykacyjnego i zmniejszającej częstość zdarzeń niepożądanych
W algorytmie leczenia infekcji H. pylori zawartym w wytycznych Kolegium Lekarzy Rodzinnych w Polsce oraz European Society for Primary Care Gastroenterology (ESPCG) probiotyki są istotnym elementem terapii eradykacyjnej [34]. Badania ostatnich lat wskazują, że probiotyki poprzez oddziaływanie przeciwdrobnoustrojowe i immunomodulujące mogą wspomagać leczenie infekcji H. pylori. Mechanizm działania przeciwdrobnoustrojowego probiotyków jest wielopłaszczyznowy i obejmuje wydzielanie substancji przeciwbakteryjnych, osłabienie aktywności ureazy, zwiększanie wytwarzania śluzu, hamowanie przylegania H. pylori do komórek nabłonkowych żołądka oraz wzmacnianie bariery śluzówkowej [35]. Modulacja odpowiedzi immunologicznej i zapalnej gospodarza odbywa się poprzez hamowanie produkcji interleukiny 8, zwiększanie wytwarzania IgA, stymulację przeciwzapalnej odpowiedzi Treg oraz hamowanie prozapalnych Th1 i Th17 [35]. W obowiązujących wytycznych europejskich znalazło się stwierdzenie, że niektóre probiotyki mogą mieć korzystny wpływ na eradykację H. pylori, jak również zmniejszać częstość występowania efektów ubocznych terapii eradykacyjnej [6]. W metaanalizie obejmującej 5792 pacjentów wykazano, że suplementacja probiotykami poprawiła wskaźnik eradykacji o ok. 10% w stosunku do grupy kontrolnej (OR = 1,94) oraz zmniejszyła częstość występowania działań niepożądanych związanych z antybiotykoterapią (OR = 0,56) [36]. Korzyści wynikające z przyjmowania probiotyków były istotnie większe przy ich dłuższym stosowaniu (> 10 dni).
Należy pamiętać, że skuteczność probiotyków zależy od gatunku mikroorganizmów, jaki zostanie zastosowany w określonej jednostce chorobowej, ich dawki, jak również czasu przyjmowania. Wybór określonych gatunków probiotyków powinien być oparty na ich udowodnionej skuteczności w badaniach klinicznych. Najwięcej dowodów naukowych dotyczących skuteczności probiotyków w eradykacji H. pylori dotyczy szczepów Lactobacillus i Saccharomyces boulardii [6]. Od niedawna na rynku polskim jest dostępny preparat probiotyczny łączący S. bou-lardii z Lactobacillus reuteri, który ze względu na synergistyczne działanie tych dwóch szczepów wydaje się ciekawą opcją w terapii eradykacyjnej. Szczep L. reuteri DSM17648 wykazuje wyjątkowy mechanizm działania. Ma on unikalną zdolność rozpoznawania i łączenia się ze strukturami powierzchniowymi H. pylori, co w istotny sposób upośledza ruchliwość bakterii, a powstałe w ten sposób agregaty bakteryjne (L. reuteri DSM17648 + H. pylori) są następnie eliminowane z żołądka [37]. Cytometria przepływowa wykazała, że w ciągu kilku sekund po kontakcie jedna komórka L. reuteri koagreguje z 2–3 komórkami H. pylori i w formie takiego koagregatu opuszcza przewód pokarmowy [37]. W badaniu 24 pacjentów z dyspepsją zakażonych H. pylori wykazano, że w porównaniu z placebo suplementacja L. reuteri DSM17648 (2 × 1010 komórek na dobę) przez 28 dni powodowała zmniejszenie populacji H. pylori w żołądku u 62,5% badanych oraz poprawę objawów dyspepsji u 66,7% [38]. W innym badaniu potwierdzono, że połączenie 28-dniowej suplementacji L. reuteri DSM17648 z klasyczną 10-dniową terapią potrójną zwiększyło o 10% odsetek eradykacji, wpłynęło korzystnie na redukcję bólów brzucha, charakteryzowało się dobrą tolerancją leczenia i wysokim profilem bezpieczeństwa [39]. Również w przypadku S. boulardii wyniki dwóch metaanaliz potwierdziły, że dołączenie tego probiotyku zwiększyło wskaźnik eradykacji H. pylori (RR 1,11–1,13) i istotnie zmniejszyło ryzyko wystąpienia działań niepożądanych terapii [40, 41].
Podsumowując – dostępne badania wykazały korzystne działanie probiotyków w skojarzeniu z antybiotykami w poprawie skuteczności eradykacji H. pylori i zmniejszaniu działań niepożądanych antybiotykoterapii. Pacjent nie tylko może być skuteczniej leczony, lecz także istnieje większa szansa, że nie zaniecha terapii ze względu na działania niepożądane antybiotyków.
7 – Brak oceny skuteczności eradykacji H. pylori
Rutynowe wykonywanie testów potwierdzających eradykację H. pylori pozwala na zebranie lokalnych wskaźników powodzenia leczenia dla każdego schematu wraz z danymi demograficznymi i klinicznymi dotyczącymi pacjentów. Takie informacje powinny być upubliczniane, aby pomóc lekarzom w wyborze najskuteczniejszego schematu eradykacyjnego. W badaniu ankietowym przeprowadzonym w kilku krajach wykazano, że odsetek pacjentów, u których potwierdzono eradykację H. pylori, był bardzo zróżnicowany i wahał się od 8% do 92% [20]. W analizie europejskiej skuteczność eradykacji nie została potwierdzona w mniej niż 10% przypadków, co jest bardzo korzystnym zjawiskiem [20]. Wobec ograniczonej dostępności informacji na temat wrażliwości H. pylori na poszczególne antybiotyki dane dotyczące odsetka skutecznych wyleczeń mogą pomóc w wyborze terapii lekarzom POZ.
Podsumowanie
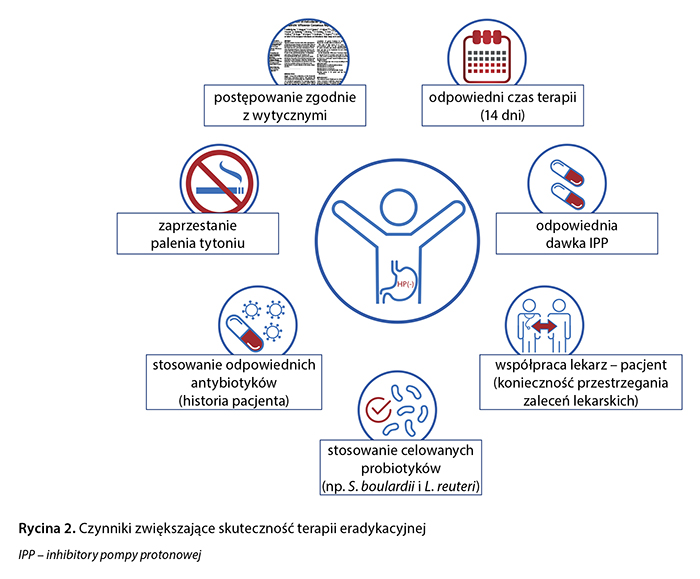
Ze względu na duże rozpowszechnienie w populacji oraz możliwe istotne konsekwencje kliniczne infekcja H. pylori stanowi doniosły problem kliniczny i społeczny. Pomimo niemal 40 lat intensywnych badań klinicznych idealna terapia eradykacyjna nie istnieje. W obliczu rosnącej oporności na antybiotyki kluczowym zagadnieniem jest nie tylko znajomość, lecz także przestrzeganie aktualnych wytycznych, tak aby zrealizować przesłanie prof. Davida Grahama: The only good Helicobacter pylori is a dead Helicobacter pylori. Lekarze powinni wystrzegać się najczęstszych błędów popełnianych w leczeniu zakażenia tą bakterią. Do działań, które mogą zwiększyć skuteczność terapii eradykacyjnej, zaliczamy stosowanie schematów leczenia z uwzględnieniem danych o oporności na antybiotyki, unikanie powtórnego podawania tych samych leków przeciwdrobnoustrojowych, wydłużenie czasu trwania terapii, adekwatne hamowanie wydzielania kwasu żołądkowego, wytłumaczenie pacjentowi konieczności przestrzegania zaleceń lekarskich oraz (w świetle nowych doniesień i obowiązujących rekomendacji: wytyczne Kolegium Lekarzy Rodzinnych w Polsce, ESPCG) podawanie probiotyków, których dobór nie może być przypadkowy (ryc. 2).
Zgodnie z wytycznymi Maastricht V/Florencja powinny to być ściśle określone szczepy, przebadane w tym wskazaniu, np. S. boulardii i L. reuteri (najlepiej w jednym preparacie), które w połączeniu z antybiotykami zwiększają skuteczność leczenia i zmniejszają częstość występowania działań niepożądanych. Optymalizacja eradykacji H. pylori poprzez zastosowanie ściśle określonych probiotyków jest zasadna szczególnie u pacjentów, którzy:
• w przeszłości mieli objawy niepożądane w trakcie stosowania antybiotykoterapii (biegunki, bóle brzucha itp.),
• byli już poddawani terapii eradykacyjnej (nieskutecznie) – w celu zwiększenia szansy powodzenia ponownego leczenia,
• należą do grupy tzw. pacjentów wrażliwych (osoby starsze, dzieci), u których dysbioza poantybiotykowa może mieć negatywny wpływ na funkcjonowanie organizmu.
Chociaż nie jest to obligatoryjne, zalecana jest również ocena skuteczności przebytej terapii eradykacyjnej H. pylori. Pozwoli to nie tylko na wykazanie eliminacji tej bakterii, lecz także na ocenę skuteczności poszczególnych schematów leczenia i ewentualnej oporności na określone antybiotyki.
Piśmiennictwo
1. Saleem N, Howden CW. Update on the management of Helicobacter pylori infection. Curr Treat Options Gastroenterol 2020; 1-12.
2. Reshetnyak VI, Burmistrov AI, Maev IV. Helicobacter pylori: commensal, symbiont or pathogen? World
J Gastroenterol 2021; 27: 545-560.
3. Zamani M, Ebrahimtabar F, Zamani V i wsp. Systematic review with meta-analysis: the worldwide prevalence of Helicobacter pylori infection. Aliment Pharmacol Ther 2018; 47: 868-876.
4. McColl KE. Clinical practice. Helicobacter pylori infection. N Engl J Med 2010; 362: 1597-1604.
5. Balamtekin N, Artuk C, Arslan M i wsp. The effect of Helicobacter pylori on the presentation and clinical course of coronavirus disease 2019 infection. J Pediatr Gastroenterol Nutr 2021; 72: 511-513.
6. Malfertheiner P, Megraud F, O’Morain CA i wsp. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut 2017; 66: 6-30.
7. Shah SC, Iyer PG, Moss SF. AGA clinical practice update on the management of refractory Helicobacter pylori infection: expert review. Gastroenterology 2021; 160: 1831-1841.
8. Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG Clinical Guideline: treatment of Helicobacter pylori infection. Am J Gastroenterol 2017; 112: 212-239.
9. Fallone CA, Chiba N, van Zanten SV i wsp. The Toronto consensus for the treatment of Helicobacter pylori infection in adults. Gastroenterology 2016; 151: 51-69.e14.
10. Tacconelli E, Carrara E, Savoldi A i wsp. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. Lancet Infect Dis 2018; 18: 318-327.
11. Savoldi A, Carrara E, Graham DY i wsp. Prevalence of antibiotic resistance in Helicobacter pylori: a systematic review and meta-analysis in World Health Organization regions. Gastroenterology 2018; 155: 1372-1382.e17.
12. Dzierzanowska-Fangrat K, Rozynek E, Celińska-Cedro D i wsp. Antimicrobial resistance of Helicobacter pylori in Poland: a multicentre study. Int J Antimicrob Agents 2005; 26: 230-234.
13. Nyssen OP, Bordin D, Tepes B i wsp. European registry on Helicobacter pylori management (Hp-EuReg): patterns and trends in first-line empirical eradication prescription and outcomes of 5 years and 21 533 patients. Gut 2021; 70: 40-54.
14. Liu KS, Hung IF, Seto WK i wsp. Ten day sequential versus 10 day modified bismuth quadruple therapy as empirical firstline and secondline treatment for Helicobacter pylori in Chinese patients: an open label, randomised, crossover trial. Gut 2014; 63: 1410-1415.
15. Macías-García F, Bastón-Rey I, de la Iglesia-García D i wsp. Bismuth-containing quadruple therapy versus concomitant quadruple therapy as first-line treatment for Helicobacter pylori infection in an area of high resistance to clarithromycin: a prospective, cross-sectional, comparative, open trial. Helicobacter 2019; 24: e12546.
16. Molina-Infante J, Pazos-Pacheco C, Vinagre-Rodriguez G i wsp. Nonbismuth quadruple (concomitant) therapy: empirical and tailored efficacy versus standard triple therapy for clarithromycin-susceptible Helicobacter pylori and versus sequential therapy for clarithromycin-resistant strains. Helicobacter 2012; 17: 269-276.
17. Yang JC, Lin CJ, Wang HL i wsp. High-dose dual therapy is superior to standard first-line or rescue therapy for Helicobacter pylori infection. Clin Gastroenterol Hepatol 2015; 13: 895-905.e5.
18. Gisbert JP, Calvet X. Review article: rifabutin in the treatment of refractory Helicobacter pylori infection. Aliment Pharmacol Ther 2012; 35: 209-221.
19. Murakami TT, Scranton RA, Brown HE i wsp. Management of Helicobacter pylori in the United States: results from a national survey of gastroenterology physicians. Prev Med 2017; 100: 216-222.
20. Nyssen OP, Vaira D, Tepes B i wsp. Room for improvement in the treatment of Helicobacter pylori infection: lessons from the European registry on H. pylori management (Hp-EuReg). J Clin Gastroenterol 2021; doi: 10.1097/MCG.0000000000001482.
21. Erah PO, Goddard AF, Barrett DA i wsp. The stability of amoxycillin, clarithromycin and metronidazole in gastric juice: relevance to the treatment of Helicobacter pylori infection. J Antimicrob Chemother 1997; 39: 5-12.
22. Kuo CH, Lu CY, Shih HY i wsp. CYP2C19 polymorphism influences Helicobacter pylori eradication. World J Gastroenterol 2014; 20: 16029-16036.
23. Villoria A, Garcia P, Calvet X i wsp. Meta-analysis: high-dose proton pump inhibitors vs. standard dose in triple therapy for Helicobacter pylori eradication. Aliment Pharmacol Ther 2008; 28: 868-877.
24. Vallve M, Vergara M, Gisbert JP, Calvet X. Single vs. double dose of a proton pump inhibitor in triple therapy for Helicobacter pylori eradication: a meta-analysis. Aliment Pharmacol Ther 2002; 16: 1149-1156.
25. Fallone CA, Moss SF, Malfertheiner P. Reconciliation of recent Helicobacter pylori treatment guidelines in a time of increasing resistance to antibiotics. Gastroenterol 2019; 157: 44-53.
26. Jung YS, Kim EH, Park CH. Systematic review with meta-analysis: the efficacy of vonoprazan-based triple therapy on Helicobacter pylori eradication. Aliment Pharmacol Ther 2017; 46: 106-114.
27. Li M, Oshima T, Horikawa T i wsp. Systematic review with meta-analysis: vonoprazan, a potent acid blocker, is superior to proton-pump inhibitors for eradication of clarithromycin-resistant strains of Helicobacter pylori. Helicobacter 2018; 23: e12495.
28. Malfertheiner P, Megraud F, O’Morain CA i wsp. Management of Helicobacter pylori infection – the Maastricht IV/ Florence Consensus Report. Gut 2012; 61: 646-664.
29. Yuan Y, Ford AC, Khan KJ i wsp. Optimum duration of regimens for Helicobacter pylori eradication. Cochrane Database Syst Rev 2013; (12): CD008337.
30. Graham DY, Osato MS, Hoffman J i wsp. Metronidazole containing quadruple therapy for infection with metronidazole resistant Helicobacter pylori: a prospective study. Aliment Pharmacol Ther 2000; 14: 745-750.
31. Lee M, Kemp JA, Canning A i wsp. A randomized controlled trial of an enhanced patient compliance program for Helicobacter pylori therapy. Arch Intern Med 1999; 159: 2312-2316.
32. Luo M, Hao Y, Tang M i wsp. Application of a social media platform as a patient reminder in the treatment of Helicobacter pylori. Helicobacter 2020; 25: e12682.
33. Yu J, Yang P, Qin X i wsp. Impact of smoking on the eradication of Helicobacter pylori. Helicobacter 2021: e12860.
34. Mach T, Zwolińska-Wcisło M, Palka M i wsp. Zasady postępowania w dyspepsji, chorobie wrzodowej i infekcji Helicobacter pylori. Wytyczne Kolegium Lekarzy Rodzinnych w Polsce oraz European Society for Primary Care Gastroenterology (ESPCG), 2016. https://klrwp.pl/strona/174/wytyczne-h-pylori/pl.
35. Compare D, Sgamato C, Nardone OM i wsp. Probiotics in gastrointestinal diseases: all that glitters is not gold. Dig Dis 2021; doi: 10.1159/000516023.
36. Zhang M, Zhang C, Zhao J i wsp. Meta-analysis of the efficacy of probiotic-supplemented therapy on the eradication of H. pylori and incidence of therapy-associated side effects. Microb Pathog 2020; 147: 104403.
37. Holz C, Busjahn A, Mehling H i wsp. Significant reduction in Helicobacter pylori load in humans with non-viable Lactobacillus reuteri DSM17648: a pilot study. Probiotics Antimicrob Proteins 2015; 7: 91-100.
38. Buckley M, Lacey S, Doolan A i wsp. The effect of Lactobacillus reuteri supplementation in Helicobacter pylori infection: a placebo-controlled, single blind study. BMC Nutr 2018; 4: 48.
39. Uspienskiy YP, Fomin YА, Ivanov SV, Menaker IO. Evolution in eradication therapy of HP-associated diseases: beyond the standards? RMJ 2016; 17: 3 11.
40. Szajewska H, Horvath A, Piwowarczyk A. Meta-analysis: the effects of Saccharomyces boulardii supplementation on Helicobacter pylori eradication rates and side effects during treatment. Aliment Pharmacol Ther 2010; 32: 1069-1079.
41. Szajewska H, Horvath A, Kołodziej M. Systematic review with meta-analysis: Saccharomyces boulardii supplementation and eradication of Helicobacter pylori infection. Aliment Pharmacol Ther 2015; 41: 1237-1245.
Pełna treść artykułu: Jarosław Daniluk. Eradykacja Helicobacter pylori – siedem grzechów głównych. Lekarz POZ 2021; 7 (6): 411-420.
Wstęp
Infekcja Helicobacter pylori (H. pylori) jest jednym z najczęstszych przewlekłych zakażeń bakteryjnych u ludzi, dotyczącym ok. 4,4 mld osób na świecie, z bardzo dużym zróżnicowaniem geograficznym, sięgającym od 35% do 90% w poszczególnych krajach [1, 2]. Ocenia się, że w Polsce infekcja dotyczy aż 66,9% populacji, czyli 25,5 mln ludzi [3]. Helicobacter pylori jest bakterią patogenną, powodującą rozwój zapalenia żołądka u każdego zakażonego, a u części z nich choroby wrzodowej (1–10%), chłoniaka MALT (lymphoid mucosa associated tissue lymphoma, 0,5%) lub raka żołądka (0,1–3%) [4]. Obecnie można się zastanawiać, czy zakażenie H. pylori wpływa w jakiś sposób na przebieg infekcji SARS-CoV-2. W jednej z najnowszych publikacji autorzy zauważyli, że występowanie bólu brzucha i biegunki silnie korelowało z obecnością H. pylori u chorych na COVID-19. Ból brzucha (19,4% vs 2,6%) i biegunka (32,3% vs 9,1%) były istotnie częstsze u pacjentów z obecnością H. pylori w porównaniu z chorymi bez tej bakterii (odpowiednio p = 0,007 i p = 0,006). Nie wykazano statystycznie istotnej zależności między zakażeniem H. pylori a liczbą dni hospitalizacji czy ciężkością przebiegu COVID-19 (p > 0,05) [5].
W aktualnych wytycznych europejskich (Maastricht V/Florencja) znalazło się stwierdzenie, że zapalenie żołądka wywołane H. pylori jest chorobą zakaźną, dlatego eradykacja tej bakterii jest zalecana u wszystkich zainfekowanych osób dorosłych niezależnie od objawów [6]. Wobec powyższego aktualnie nie podaje się wskazań do leczenia zakażenia H. pylori, a jedynie do jego wykrycia. Diagnostyka w kierunku H. pylori jest wskazana w przypadku aktywnej lub przebytej choroby wrzodowej, wczesnego raka żołądka, wśród krewnych pierwszego stopnia chorych na raka żołądka, chłoniaka MALT, w przypadku dyspepsji niediagnozowanej lub czynnościowej, planowanego długotrwałego leczenia niesteroidowymi lekami przeciwzapalnymi (NLPZ) oraz niektórych chorób hematologicznych (niedokrwistość z niedoboru żelaza o niewyjaśnionej przyczynie, samoistna małopłytkowość u dorosłych oraz niedobór witaminy B12) (tab. 1).

W przeciwieństwie do większości chorób zakaźnych, w których terapia opiera się na znanej wrażliwości drobnoustroju na antybiotyki, leczenie H. pylori pozostaje w dużej mierze empiryczne. Uważa się, że efektywna terapia eradykacyjna powinna charakteryzować się co najmniej 90-procentową skutecznością. Niestety w praktyce klinicznej takie wartości są rzadko spotykane i coraz częściej zmagamy się z problemem nieskuteczności terapii, którą definiujemy jako utrzymujący się dodatni wynik nieserologicznego testu w kierunku H. pylori co najmniej 4 tygodnie po ukończonym leczeniu eradykacyjnym zgodnym z aktualnymi wytycznymi i po odstawieniu wszelkich leków, które mogą wpływać na czułość testu, takich jak inhibitory pompy protonowej (IPP) [7]. Jest to niejednokrotnie trudne do zrealizowania, szczególnie u osób z objawami choroby refluksowej przełyku, u których warto wtedy czasowo zastosować terapię pomostową lekami osłaniającymi, np. alkaliami, alginianami czy preparatem będącym ich połączeniem z Mucosave®, które nie wpływają na czułość testów diagnostycznych w kierunku H. pylori.
Konsekwencje nieskutecznej eradykacji są bardzo istotne i obejmują powikłania kliniczne związane z przetrwałą infekcją H. pylori, wielokrotną ekspozycją na antybiotyki, wytwarzaniem oporności na antybiotyki przez inne drobnoustroje, a także związane z tym bezpośrednie i pośrednie koszty opieki zdrowotnej. Aktualne wytyczne głównych towarzystw gastroenterologicznych na świecie (Maastricht V/Florencja, konsensus z Toronto, wytyczne American College of Gastroenterology) zgodnie stwierdzają, że optymalne leczenie eradykacyjne powinno być skuteczne już przy pierwszej próbie [6, 8, 9]. Prawdopodobieństwo pomyślnej eradykacji maleje z każdą kolejną próbą terapii, dlatego należy dołożyć wszelkich starań, aby wyeliminować czynniki, które mogą się przyczynić do niepowodzenia leczenia. W artykule wyszczególniono najczęstsze błędy popełniane w trakcie eradykacji H. pylori oraz metody zapobiegania im, aby zwiększyć skuteczność tej terapii w codziennej praktyce lekarza POZ.
1 – Nieprzestrzeganie wytycznych dotyczących schematów eradykacji H. pylori
Pomimo niemal 40 lat doświadczeń w leczeniu H. pylori idealna terapia eradykacyjna nadal nie została opracowana. Na przestrzeni lat obserwujemy stale zmieniające się schematy leczenia, co jest spowodowane przede wszystkim narastającą opornością bakterii na antybiotyki. W związku z tym Światowa Organizacja Zdrowia (World Health Organization – WHO) uznała H. pylori za jeden z 12 patogenów o najwyższym priorytecie do stworzenia nowych, skutecznych antybiotyków [10]. Niestety aktualna lista antybiotyków mających zastosowanie w eradykacji H. pylori jest bardzo ograniczona. Zaliczamy do nich klarytromycynę, amoksycylinę, metronidazol, lewofloksacynę, tetracyklinę, ryfabutynę. Klasyczna terapia potrójna (IPP + klarytromycyna + amoksycylina lub metronidazol), która była podstawowym leczeniem eradykacyjnym u schyłku ubiegłego wieku, nie powinna być obecnie stosowana w większości krajów (w tym w Polsce) ze względu na wysoką (> 15%) oporność bakterii na klarytromycynę. W metaanalizie 50 tys. pacjentów z 45 krajów pierwotna oporność na klarytromycynę wynosiła od 10% do 34%, a na metronidazol od 23% do 56% [11]. W polskim badaniu na podstawie analizy populacji pediatrycznej i dorosłej stwierdzono oporność na klarytromycynę na poziomie 28%, a na metronidazol 46% [12]. Wykazano ponadto, że w przypadku oporności in vitro na klarytromycynę zastosowanie tego antybiotyku w terapii eradykacyjnej in vivo zwiększa 7-krotnie ryzyko niepowodzenia leczenia [11]. Mimo tych niepokojących wskaźników oporności analiza 21 533 pacjentów z 27 krajów europejskich (w tym z Polski) zakażonych H. pylori wykazała, że terapia potrójna z klarytromycyną była najczęściej przepisywanym schematem leczenia pierwszego wyboru, a wskaźnik jej skuteczności w eradykacji wyniósł zaledwie 81,5% [13]. Te dane jednoznacznie wskazują, że terapia zakażenia H. pylori w codziennej praktyce jest obecnie nieoptymalna i niezgodna z wytycznymi, nawet wśród specjalistów gastroenterologów.
Jaki schemat eradykacji H. pylori powinien zostać wybrany przez lekarza POZ w Polsce? Ogólny porządek postępowania przedstawiono na rycinie 1. Zgodnie z wytycznymi europejskimi (Maastricht V/Florencja) leczeniem pierwszego wyboru powinna być terapia poczwórna z bizmutem (IPP + bizmut + metronidazol + tetracyklina), ponieważ charakteryzuje się bardzo dobrą, ponad 90-procentową skutecznością [6, 14, 15]. Jeśli preparaty bizmutu są niedostępne lub nietolerowane, alternatywą jest terapia poczwórną bez bizmutu (IPP + amoksycylina + metronidazol + klarytromycyna). Potwierdzono istotną statystycznie przewagę terapii poczwórnej bez bizmutu nad klasyczną terapią potrójną (92% vs 70%, p = 0,02) oraz porównywalną skuteczność z terapią poczwórną z bizmutem (97,7% vs 96,2%, p = 0,605) [15, 16].

Trzecią możliwością terapii pierwszego wyboru według wytycznych europejskich jest klasyczna potrójna terapia z klarytromycyną [6], jednak ten schemat może być zastosowany tylko w krajach o niskiej oporności na klarytromycynę (< 15%) i przy braku wcześniejszej ekspozycji pacjenta na makrolidy, co praktycznie wyklucza jego stosowanie w Polsce. Mimo wcześniejszych zachęcających wyników aktualne wytyczne zarówno europejskie, jak i kanadyjskie nie zalecają stosowania terapii sekwencyjnej lub hybrydowej w leczeniu zakażenia H. pylori [6, 9]. Ważnym problemem, przed którym niejednokrotnie stają lekarze POZ, jest zgłaszane przez pacjenta uczulenie na pochodne penicyliny, w tym amoksycylinę. W takich przypadkach eksperci amerykańscy zalecają wykonanie testów alergicznych w celu potwierdzenia lub wykluczenia nietolerancji tych antybiotyków [7]. U pacjentów z rzeczywistą alergią na penicylinę zaleca się terapię poczwórną z bizmutem lub ewentualnie terapię potrójną z klarytromycyną i metronidazolem (przy oporności na klarytromycynę < 15%) [6, 8, 9]. Szczegóły dotyczące schematu, dawek leków oraz czasu trwania terapii pierwszego wyboru przedstawiono w tabeli 2.

W razie niepowodzenia leczenia wytyczne europejskie oraz północnoamerykańskie zgodnie zalecają w leczeniu drugiego wyboru terapię poczwórną z bizmutem lub potrójną z lewofloksacyną, w zależności od tego, który lek stosowano wcześniej [6, 8, 9] (tab. 3). Jeśli na przykład wcześniej podawano metronidazol, korzystne może być włączenie schematu z lewofloksacyną, jednak należy pamiętać o narastającej oporności na ten drugi antybiotyk.

Po dwóch nieskutecznych terapiach eradykacyjnych konsensus Maastricht V/Florencja zaleca określenie wrażliwości szczepu H. pylori na antybiotyki przed wdrożeniem kolejnego leczenia [6]. Niestety w praktyce klinicznej, szczególnie w warunkach gabinetu lekarza POZ, rzadko dysponujemy możliwością wykonania posiewu. Dlatego aktualne wytyczne dopuszczają możliwość empirycznej terapii ratunkowej: terapii poczwórnej z bizmutem (w przypadku wcześniejszej ekspozycji na klarytromycynę, lewofloksacynę lub nawet metronidazol w terapii bez bizmutu), terapii z lewofloksacyną (w przypadku wcześniejszej ekspozycji na klarytromycynę i metronidazol), terapii poczwórnej bez bizmutu [6, 8, 9]. Jedynie w europejskich wytycznych dopuszcza się zastosowanie w leczeniu ratunkowym terapii potrójnej opartej na klarytromycynie na obszarze o znanej niskiej oporności na ten antybiotyk [6]. W ostatnim czasie przedstawiono dwie nowe obiecujące formy terapii ratunkowej. Pierwsza z nich, polegająca na podawaniu wysokich dawek amoksycyliny (4 × 750 mg) i IPP (rabeprazol 4 × 20 mg) przez 14 dni, charakteryzowała się bardzo wysoką, 95-procentową skutecznością eradykacji H. pylori [17]. Alternatywną może być terapia z ryfabutyną (2 × 150 mg lub 1 × 300 mg), amoksycyliną (2 × 1000 mg) i PPI (2 × dziennie), której skuteczność w terapii trzeciego wyboru wynosiła 66% [18].
2 – Ponowne stosowanie tych samych antybiotyków w kolejnych terapiach eradykacyjnych, przy ich uprzedniej nieskuteczności
W razie niepowodzenia terapii eradykacyjnej pierwszego wyboru aktualne wytyczne zalecają unikanie ponownego stosowania antybiotyków, które wcześniej okazały się nieskuteczne [6, 8, 9]. Zalecenie to jest szczególnie istotne w przypadku kolejnej próby użycia klarytromycyny i lewofloksacyny, ponieważ jak wykazano, w takich sytuacjach wskaźnik oporności na klarytromycynę sięga 15–67%, a na lewofloksacynę 19–30% [11]. Ze względu na synergistyczny efekt połączenia metronidazolu z bizmutem jego ponowne zastosowanie w terapii czterolekowej może być rozważaną opcją. Również amoksycylina lub tetracyklina mogą być ponownie wykorzystane w terapii drugiego wyboru z uwagi na bardzo niski wskaźnik oporności H. pylori na te antybiotyki, nieprzekraczający 1–2% [11]. Badanie ankietowe przeprowadzone wśród lekarzy w Stanach Zjednoczonych wykazało, że zaledwie 38% z nich uzyskało informacje od pacjenta dotyczące antybiotyków stosowanych przed przepisaniem eradykacji H. pylori [19]. W badaniu europejskim potwierdzono ponowne zastosowanie klarytromycyny w terapii drugiego wyboru w 15% przypadków, co skutkowała bardzo niską (< 80%) skutecznością leczenia [20]. Podobne zastrzeżenia dotyczą ponownego stosowania lewofloksacyny (w 32% przypadków) pomimo wcześniejszej ekspozycji na chinolony. Należy podkreślić kluczową rolę lekarza, który przed przepisaniem kolejnej terapii eradykacyjnej powinien zebrać dokładny wywiad na temat wcześniejszej ekspozycji pacjenta na antybiotyki.
3 – Stosowanie zbyt niskich dawek IPP w terapii eradykacyjnej H. pylori
Odpowiednia supresja wydzielania kwasu żołądkowego jest niezmiernie istotnym elementem terapii eradykacyjnej, ponieważ wrażliwość H. pylori na działanie antybiotyków jest największa przy pH w żołądku w zakresie 6–8. Jest to optymalne pH, w którym zachodzi intensywna replikacja bakterii. Wykazano, że okres półtrwania amoksycyliny i klarytromycyny przy pH żołądka < 2 wynosi odpowiednio 15,2 ±0,3 godziny i 1,0 ±0,04 godziny, podczas gdy dla pH żołądka > 7 okresy półtrwania obu antybiotyków wydłużają się powyżej 68 godzin [21]. Siła hamowania kwasu żołądkowego przez IPP w dużym stopniu zależy od zdolności metabolizowania leku przez podjednostkę 2CYP2C19 cytochromu P450. Stwierdzono, że nawet 81% populacji rasy kaukaskiej cechuje się polimorfizmem genetycznym CYP2C19 odpowiedzialnym za szybki metabolizm tych leków [22]. Omeprazol jest metabolizowany przez podjednostki CYP2C19 i CYP3A4 cytochromu P450 w stosunku 9 : 1, a esomeprazol 3 : 1. Ze względu na niedostępność testów oceniających polimorfizm genetyczny CYP2C19 w celu zwiększenia skuteczności leczenia powinniśmy stosować wyższe dawki i/lub zwiększyć częstość podawania leków pierwszej generacji lub stosować nowsze leki, których metabolizm nie zależy w takim stopniu od CYP2C19 (np. esomeprazol) [7]. Wykazano, że stosowanie wyższych dawek IPP (esomeprazol 40 mg zamiast omeprazol 20 mg) w terapii potrójnej z klarytromycyną zwiększało o 11% skuteczność eradykacji [23]. Stwierdzono ponadto, że podawanie IPP dwa razy dziennie miało przewagę nad dawkami jednorazowymi [24], dlatego konsensus Maastricht V/Florencja sugeruje stosowanie esomeprazolu (40 mg 2 × dziennie) lub rabeprazolu (20 mg 2 × dziennie) w terapii eradykacyjnej w Europie i Ameryce Północnej ze względu na przewagę osób intensywnie metabolizujących IPP w tych regionach [6]. Niestety w praktyce klinicznej te zalecenia nie zawsze są przestrzegane. Analiza 26 340 chorych z europejskiego rejestru terapii H. pylori (European Registry on H. pylori Management, Hp-EuReg) wykazała, że aż 48% pacjentów było leczonych niskimi dawkami IPP [20]. Na szczęście ten niekorzystny trend zmniejsza się w ostatnich latach. W 2013 r. niskie dawki IPP stosowano u 67% pacjentów, natomiast w 2019 r. ten odsetek zmniejszył się do 20% [20].
Być może problemy z nieadekwatnym hamowaniem kwasu żołądkowego zostaną rozwiązane wraz z wprowadzeniem na rynek nowych leków blokujących wydzielanie żołądkowe. Wonoprazan (zarejestrowany w Japonii, niedostępny w Europie), jest pierwszym lekiem, który w sposób kompetycyjny, zależny od potasu hamuje pompę ATP-H+/K+ w komórkach okładzinowych żołądka. W porównaniu z IPP wonoprazan działa szybciej, dłużej i silniej hamuje wydzielanie kwasu żołądkowego, niezależnie od przyjmowania posiłków oraz od polimorfizmu CYP2C19 [25, 26]. Zastąpienie IPP wonoprazanem w terapii potrójnej z klarytromycyną zwiększyło skuteczność eradykacji o 10–20%, a najsilniejszy efekt obserwowano w przypadku szczepów H. pylori opornych na klarytromycynę [27].
4 – Zbyt krótki czas stosowania terapii eradykacyjnej
W przypadku klasycznej terapii potrójnej 7-dniowy okres podawania leków był przez wiele lat standardem leczenia. Dopiero w wytycznych Maastricht IV/Florencja w 2012 r. znalazło się stwierdzenie, że wydłużenie terapii do 10–14 dni zwiększa skuteczność eradykacji o 5% [28]. Wyniki metaanalizy bazy danych Cochrane wskazują, że optymalny czas terapii potrójnej to 14 dni [29]. W celu poprawy efektywności leczenia wytyczne europejskie i kanadyjskie zalecają wydłużenie czasu potrójnej terapii eradykacyjnej z klarytromycyną do 14 dni, pod warunkiem oczywiście, że oporność na ten antybiotyk na danym obszarze nie przekracza 15% [6, 9]. W przypadku terapii potrójnej z amoksycyliną i metronidazolem wydłużenie czasu leczenia do 14 dni może przełamać istniejącą oporność na metronidazol [30]. Niestety dane z cytowanego wcześniej europejskiego rejestru Hp-EuReg pokazują, że wytyczne dotyczące długości trwania terapii eradykacyjnej nie są przestrzegane w codziennej praktyce klinicznej. Stwierdzono, że 69% pacjentów stosujących terapię potrójną otrzymywało ją przez zaledwie 7–10 dni, a skuteczność w tym przypadku wynosiła jedynie 81%, w porównaniu z 88% wyleczeń, gdy terapię przedłużono do 14 dni [20]. Jednocześnie w ostatnich latach obserwuje się korzystny trend wydłużenia czasu terapii potrójnej z 9,9 dnia w 2013 r. do 13,1 dnia w 2019 r. [20].
W przypadku terapii poczwórnej (z bizmutem lub bez bizmutu) czas leczenia również powinien wynosić 14 dni, chyba że na danym terenie wykazano skuteczność terapii 10-dniowej [6, 8, 9]. Dane dotyczące czasu trwania terapii poczwórnej raportowane przez lekarzy z Europy ponownie odbiegają od wytycznych. W analizie dotyczącej lat 2013–2019 terapia poczwórna bez bizmutu była stosowana przez 7–10 dni aż u 58% pacjentów, co przyczyniło się do istotnego pogorszenia skuteczności eradykacji (80%) w porównaniu z leczeniem 14-dniowym (90%) [20]. W przypadku terapii z lewofloksacyną wytyczne europejskie i kanadyjskie zalecają 14-dniowy okres leczenia, podczas gdy wytyczne amerykańskie dopuszczają terapię 10-dniową [6, 8, 9]. Terapia ratunkowa przy użyciu wysokich dawek amoksycyliny i IPP powinna być stosowana przez 14 dni, natomiast w schemacie z ryfabutyną ograniczona do 10 dni ze względu na jej potencjalne działanie mielotoksyczne [8, 9].
Podsumowując – przepisując terapię eradykacyjną lekarz powinien, oprócz właściwego wyboru schematu leczenia, zwrócić szczególną uwagę na okres, przez jaki te leki będą przyjmowane.
5 – Nieprzestrzeganie zaleceń lekarskich
Do najczęstszych przyczyn nieprzestrzegania zaleceń lekarskich zaliczamy złożoność schematów eradykacyjnych i związaną z tym dużą liczbę tabletek do przyjęcia, nietolerancję leków, utrudniony dostęp do lekarza POZ lub gastroenterologa, brak zrozumienia przez pacjenta, dlaczego wskazane jest leczenie. W warunkach polskich 14-dniowa terapia z bizmutem (4 × 120 mg), metronidazolem (4 × 500 mg), tetracykliną (4 × 500 mg) i IPP (2 × 20 mg) wiąże się z koniecznością przyjęcia aż 238 tabletek. W przypadku zastosowania preparatu złożonego (Pylera®) zawierającego 40 mg tlenku bizmutu, 125 mg metronidazolu oraz 125 mg chlorowodorku tetracykliny 10-dniowa terapia z IPP wymaga przyjęcia 140 tabletek. Dlatego przed przepisaniem terapii należy dokładnie omówić z pacjentem schemat leczenia, korzyści i możliwe działania niepożądane. Na podstawie przeprowadzonej analizy wykazano, że ok. 10% pacjentów przyjmuje < 60% leków przepisanych w terapii eradykacyjnej [31]. Zgodnie z danymi rejestru Hp-EuReg przestrzeganie zaleceń dotyczących leczenia H. pylori w Europie było na bardzo wysokim poziomie i wyniosło aż 97%, co miało bezpośrednie odzwierciedlenie w wysokim współczynniku eradykacji – 87%, podczas gdy u osób niestosujących się do zaleceń wskaźnik ten spadł do 56% [20]. Do zwiększenia przestrzegania zaleceń lekarskich może się przyczynić stosowanie nowoczesnych metod, w tym specjalnych aplikacji medycznych na telefonie komórkowym pomagających w prawidłowym przyjmowaniu leków [32].
Przepisując terapię eradykacyjną, lekarz powinien uprzedzić pacjenta o niekorzystnym wpływie palenia tytoniu na skuteczność leczenia. Palenie zwiększa wydzielanie kwasu żołądkowego, upośledza wydzielanie śluzu oraz redukuje podśluzówkowy przepływ krwi w żołądku, przez co zmniejsza miejscową penetrację antybiotyków. Niekorzystny wpływ palenia na wyniki leczenia potwierdzono w jednej z niedawno opublikowanych metaanaliz, w której wykazano, że pacjenci palący mieli istotnie wyższe ryzyko niepowodzenia terapii eradykacyjnej (OR = 1,70) w porównaniu z niepalącymi [33].
6 – Brak terapii uzupełniającej poprawiającej skuteczność leczenia eradykacyjnego i zmniejszającej częstość zdarzeń niepożądanych
W algorytmie leczenia infekcji H. pylori zawartym w wytycznych Kolegium Lekarzy Rodzinnych w Polsce oraz European Society for Primary Care Gastroenterology (ESPCG) probiotyki są istotnym elementem terapii eradykacyjnej [34]. Badania ostatnich lat wskazują, że probiotyki poprzez oddziaływanie przeciwdrobnoustrojowe i immunomodulujące mogą wspomagać leczenie infekcji H. pylori. Mechanizm działania przeciwdrobnoustrojowego probiotyków jest wielopłaszczyznowy i obejmuje wydzielanie substancji przeciwbakteryjnych, osłabienie aktywności ureazy, zwiększanie wytwarzania śluzu, hamowanie przylegania H. pylori do komórek nabłonkowych żołądka oraz wzmacnianie bariery śluzówkowej [35]. Modulacja odpowiedzi immunologicznej i zapalnej gospodarza odbywa się poprzez hamowanie produkcji interleukiny 8, zwiększanie wytwarzania IgA, stymulację przeciwzapalnej odpowiedzi Treg oraz hamowanie prozapalnych Th1 i Th17 [35]. W obowiązujących wytycznych europejskich znalazło się stwierdzenie, że niektóre probiotyki mogą mieć korzystny wpływ na eradykację H. pylori, jak również zmniejszać częstość występowania efektów ubocznych terapii eradykacyjnej [6]. W metaanalizie obejmującej 5792 pacjentów wykazano, że suplementacja probiotykami poprawiła wskaźnik eradykacji o ok. 10% w stosunku do grupy kontrolnej (OR = 1,94) oraz zmniejszyła częstość występowania działań niepożądanych związanych z antybiotykoterapią (OR = 0,56) [36]. Korzyści wynikające z przyjmowania probiotyków były istotnie większe przy ich dłuższym stosowaniu (> 10 dni).
Należy pamiętać, że skuteczność probiotyków zależy od gatunku mikroorganizmów, jaki zostanie zastosowany w określonej jednostce chorobowej, ich dawki, jak również czasu przyjmowania. Wybór określonych gatunków probiotyków powinien być oparty na ich udowodnionej skuteczności w badaniach klinicznych. Najwięcej dowodów naukowych dotyczących skuteczności probiotyków w eradykacji H. pylori dotyczy szczepów Lactobacillus i Saccharomyces boulardii [6]. Od niedawna na rynku polskim jest dostępny preparat probiotyczny łączący S. bou-lardii z Lactobacillus reuteri, który ze względu na synergistyczne działanie tych dwóch szczepów wydaje się ciekawą opcją w terapii eradykacyjnej. Szczep L. reuteri DSM17648 wykazuje wyjątkowy mechanizm działania. Ma on unikalną zdolność rozpoznawania i łączenia się ze strukturami powierzchniowymi H. pylori, co w istotny sposób upośledza ruchliwość bakterii, a powstałe w ten sposób agregaty bakteryjne (L. reuteri DSM17648 + H. pylori) są następnie eliminowane z żołądka [37]. Cytometria przepływowa wykazała, że w ciągu kilku sekund po kontakcie jedna komórka L. reuteri koagreguje z 2–3 komórkami H. pylori i w formie takiego koagregatu opuszcza przewód pokarmowy [37]. W badaniu 24 pacjentów z dyspepsją zakażonych H. pylori wykazano, że w porównaniu z placebo suplementacja L. reuteri DSM17648 (2 × 1010 komórek na dobę) przez 28 dni powodowała zmniejszenie populacji H. pylori w żołądku u 62,5% badanych oraz poprawę objawów dyspepsji u 66,7% [38]. W innym badaniu potwierdzono, że połączenie 28-dniowej suplementacji L. reuteri DSM17648 z klasyczną 10-dniową terapią potrójną zwiększyło o 10% odsetek eradykacji, wpłynęło korzystnie na redukcję bólów brzucha, charakteryzowało się dobrą tolerancją leczenia i wysokim profilem bezpieczeństwa [39]. Również w przypadku S. boulardii wyniki dwóch metaanaliz potwierdziły, że dołączenie tego probiotyku zwiększyło wskaźnik eradykacji H. pylori (RR 1,11–1,13) i istotnie zmniejszyło ryzyko wystąpienia działań niepożądanych terapii [40, 41].
Podsumowując – dostępne badania wykazały korzystne działanie probiotyków w skojarzeniu z antybiotykami w poprawie skuteczności eradykacji H. pylori i zmniejszaniu działań niepożądanych antybiotykoterapii. Pacjent nie tylko może być skuteczniej leczony, lecz także istnieje większa szansa, że nie zaniecha terapii ze względu na działania niepożądane antybiotyków.
7 – Brak oceny skuteczności eradykacji H. pylori
Rutynowe wykonywanie testów potwierdzających eradykację H. pylori pozwala na zebranie lokalnych wskaźników powodzenia leczenia dla każdego schematu wraz z danymi demograficznymi i klinicznymi dotyczącymi pacjentów. Takie informacje powinny być upubliczniane, aby pomóc lekarzom w wyborze najskuteczniejszego schematu eradykacyjnego. W badaniu ankietowym przeprowadzonym w kilku krajach wykazano, że odsetek pacjentów, u których potwierdzono eradykację H. pylori, był bardzo zróżnicowany i wahał się od 8% do 92% [20]. W analizie europejskiej skuteczność eradykacji nie została potwierdzona w mniej niż 10% przypadków, co jest bardzo korzystnym zjawiskiem [20]. Wobec ograniczonej dostępności informacji na temat wrażliwości H. pylori na poszczególne antybiotyki dane dotyczące odsetka skutecznych wyleczeń mogą pomóc w wyborze terapii lekarzom POZ.
Podsumowanie
Ze względu na duże rozpowszechnienie w populacji oraz możliwe istotne konsekwencje kliniczne infekcja H. pylori stanowi doniosły problem kliniczny i społeczny. Pomimo niemal 40 lat intensywnych badań klinicznych idealna terapia eradykacyjna nie istnieje. W obliczu rosnącej oporności na antybiotyki kluczowym zagadnieniem jest nie tylko znajomość, lecz także przestrzeganie aktualnych wytycznych, tak aby zrealizować przesłanie prof. Davida Grahama: The only good Helicobacter pylori is a dead Helicobacter pylori. Lekarze powinni wystrzegać się najczęstszych błędów popełnianych w leczeniu zakażenia tą bakterią. Do działań, które mogą zwiększyć skuteczność terapii eradykacyjnej, zaliczamy stosowanie schematów leczenia z uwzględnieniem danych o oporności na antybiotyki, unikanie powtórnego podawania tych samych leków przeciwdrobnoustrojowych, wydłużenie czasu trwania terapii, adekwatne hamowanie wydzielania kwasu żołądkowego, wytłumaczenie pacjentowi konieczności przestrzegania zaleceń lekarskich oraz (w świetle nowych doniesień i obowiązujących rekomendacji: wytyczne Kolegium Lekarzy Rodzinnych w Polsce, ESPCG) podawanie probiotyków, których dobór nie może być przypadkowy (ryc. 2).

Zgodnie z wytycznymi Maastricht V/Florencja powinny to być ściśle określone szczepy, przebadane w tym wskazaniu, np. S. boulardii i L. reuteri (najlepiej w jednym preparacie), które w połączeniu z antybiotykami zwiększają skuteczność leczenia i zmniejszają częstość występowania działań niepożądanych. Optymalizacja eradykacji H. pylori poprzez zastosowanie ściśle określonych probiotyków jest zasadna szczególnie u pacjentów, którzy:
• w przeszłości mieli objawy niepożądane w trakcie stosowania antybiotykoterapii (biegunki, bóle brzucha itp.),
• byli już poddawani terapii eradykacyjnej (nieskutecznie) – w celu zwiększenia szansy powodzenia ponownego leczenia,
• należą do grupy tzw. pacjentów wrażliwych (osoby starsze, dzieci), u których dysbioza poantybiotykowa może mieć negatywny wpływ na funkcjonowanie organizmu.
Chociaż nie jest to obligatoryjne, zalecana jest również ocena skuteczności przebytej terapii eradykacyjnej H. pylori. Pozwoli to nie tylko na wykazanie eliminacji tej bakterii, lecz także na ocenę skuteczności poszczególnych schematów leczenia i ewentualnej oporności na określone antybiotyki.
Piśmiennictwo
1. Saleem N, Howden CW. Update on the management of Helicobacter pylori infection. Curr Treat Options Gastroenterol 2020; 1-12.
2. Reshetnyak VI, Burmistrov AI, Maev IV. Helicobacter pylori: commensal, symbiont or pathogen? World
J Gastroenterol 2021; 27: 545-560.
3. Zamani M, Ebrahimtabar F, Zamani V i wsp. Systematic review with meta-analysis: the worldwide prevalence of Helicobacter pylori infection. Aliment Pharmacol Ther 2018; 47: 868-876.
4. McColl KE. Clinical practice. Helicobacter pylori infection. N Engl J Med 2010; 362: 1597-1604.
5. Balamtekin N, Artuk C, Arslan M i wsp. The effect of Helicobacter pylori on the presentation and clinical course of coronavirus disease 2019 infection. J Pediatr Gastroenterol Nutr 2021; 72: 511-513.
6. Malfertheiner P, Megraud F, O’Morain CA i wsp. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut 2017; 66: 6-30.
7. Shah SC, Iyer PG, Moss SF. AGA clinical practice update on the management of refractory Helicobacter pylori infection: expert review. Gastroenterology 2021; 160: 1831-1841.
8. Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG Clinical Guideline: treatment of Helicobacter pylori infection. Am J Gastroenterol 2017; 112: 212-239.
9. Fallone CA, Chiba N, van Zanten SV i wsp. The Toronto consensus for the treatment of Helicobacter pylori infection in adults. Gastroenterology 2016; 151: 51-69.e14.
10. Tacconelli E, Carrara E, Savoldi A i wsp. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. Lancet Infect Dis 2018; 18: 318-327.
11. Savoldi A, Carrara E, Graham DY i wsp. Prevalence of antibiotic resistance in Helicobacter pylori: a systematic review and meta-analysis in World Health Organization regions. Gastroenterology 2018; 155: 1372-1382.e17.
12. Dzierzanowska-Fangrat K, Rozynek E, Celińska-Cedro D i wsp. Antimicrobial resistance of Helicobacter pylori in Poland: a multicentre study. Int J Antimicrob Agents 2005; 26: 230-234.
13. Nyssen OP, Bordin D, Tepes B i wsp. European registry on Helicobacter pylori management (Hp-EuReg): patterns and trends in first-line empirical eradication prescription and outcomes of 5 years and 21 533 patients. Gut 2021; 70: 40-54.
14. Liu KS, Hung IF, Seto WK i wsp. Ten day sequential versus 10 day modified bismuth quadruple therapy as empirical firstline and secondline treatment for Helicobacter pylori in Chinese patients: an open label, randomised, crossover trial. Gut 2014; 63: 1410-1415.
15. Macías-García F, Bastón-Rey I, de la Iglesia-García D i wsp. Bismuth-containing quadruple therapy versus concomitant quadruple therapy as first-line treatment for Helicobacter pylori infection in an area of high resistance to clarithromycin: a prospective, cross-sectional, comparative, open trial. Helicobacter 2019; 24: e12546.
16. Molina-Infante J, Pazos-Pacheco C, Vinagre-Rodriguez G i wsp. Nonbismuth quadruple (concomitant) therapy: empirical and tailored efficacy versus standard triple therapy for clarithromycin-susceptible Helicobacter pylori and versus sequential therapy for clarithromycin-resistant strains. Helicobacter 2012; 17: 269-276.
17. Yang JC, Lin CJ, Wang HL i wsp. High-dose dual therapy is superior to standard first-line or rescue therapy for Helicobacter pylori infection. Clin Gastroenterol Hepatol 2015; 13: 895-905.e5.
18. Gisbert JP, Calvet X. Review article: rifabutin in the treatment of refractory Helicobacter pylori infection. Aliment Pharmacol Ther 2012; 35: 209-221.
19. Murakami TT, Scranton RA, Brown HE i wsp. Management of Helicobacter pylori in the United States: results from a national survey of gastroenterology physicians. Prev Med 2017; 100: 216-222.
20. Nyssen OP, Vaira D, Tepes B i wsp. Room for improvement in the treatment of Helicobacter pylori infection: lessons from the European registry on H. pylori management (Hp-EuReg). J Clin Gastroenterol 2021; doi: 10.1097/MCG.0000000000001482.
21. Erah PO, Goddard AF, Barrett DA i wsp. The stability of amoxycillin, clarithromycin and metronidazole in gastric juice: relevance to the treatment of Helicobacter pylori infection. J Antimicrob Chemother 1997; 39: 5-12.
22. Kuo CH, Lu CY, Shih HY i wsp. CYP2C19 polymorphism influences Helicobacter pylori eradication. World J Gastroenterol 2014; 20: 16029-16036.
23. Villoria A, Garcia P, Calvet X i wsp. Meta-analysis: high-dose proton pump inhibitors vs. standard dose in triple therapy for Helicobacter pylori eradication. Aliment Pharmacol Ther 2008; 28: 868-877.
24. Vallve M, Vergara M, Gisbert JP, Calvet X. Single vs. double dose of a proton pump inhibitor in triple therapy for Helicobacter pylori eradication: a meta-analysis. Aliment Pharmacol Ther 2002; 16: 1149-1156.
25. Fallone CA, Moss SF, Malfertheiner P. Reconciliation of recent Helicobacter pylori treatment guidelines in a time of increasing resistance to antibiotics. Gastroenterol 2019; 157: 44-53.
26. Jung YS, Kim EH, Park CH. Systematic review with meta-analysis: the efficacy of vonoprazan-based triple therapy on Helicobacter pylori eradication. Aliment Pharmacol Ther 2017; 46: 106-114.
27. Li M, Oshima T, Horikawa T i wsp. Systematic review with meta-analysis: vonoprazan, a potent acid blocker, is superior to proton-pump inhibitors for eradication of clarithromycin-resistant strains of Helicobacter pylori. Helicobacter 2018; 23: e12495.
28. Malfertheiner P, Megraud F, O’Morain CA i wsp. Management of Helicobacter pylori infection – the Maastricht IV/ Florence Consensus Report. Gut 2012; 61: 646-664.
29. Yuan Y, Ford AC, Khan KJ i wsp. Optimum duration of regimens for Helicobacter pylori eradication. Cochrane Database Syst Rev 2013; (12): CD008337.
30. Graham DY, Osato MS, Hoffman J i wsp. Metronidazole containing quadruple therapy for infection with metronidazole resistant Helicobacter pylori: a prospective study. Aliment Pharmacol Ther 2000; 14: 745-750.
31. Lee M, Kemp JA, Canning A i wsp. A randomized controlled trial of an enhanced patient compliance program for Helicobacter pylori therapy. Arch Intern Med 1999; 159: 2312-2316.
32. Luo M, Hao Y, Tang M i wsp. Application of a social media platform as a patient reminder in the treatment of Helicobacter pylori. Helicobacter 2020; 25: e12682.
33. Yu J, Yang P, Qin X i wsp. Impact of smoking on the eradication of Helicobacter pylori. Helicobacter 2021: e12860.
34. Mach T, Zwolińska-Wcisło M, Palka M i wsp. Zasady postępowania w dyspepsji, chorobie wrzodowej i infekcji Helicobacter pylori. Wytyczne Kolegium Lekarzy Rodzinnych w Polsce oraz European Society for Primary Care Gastroenterology (ESPCG), 2016. https://klrwp.pl/strona/174/wytyczne-h-pylori/pl.
35. Compare D, Sgamato C, Nardone OM i wsp. Probiotics in gastrointestinal diseases: all that glitters is not gold. Dig Dis 2021; doi: 10.1159/000516023.
36. Zhang M, Zhang C, Zhao J i wsp. Meta-analysis of the efficacy of probiotic-supplemented therapy on the eradication of H. pylori and incidence of therapy-associated side effects. Microb Pathog 2020; 147: 104403.
37. Holz C, Busjahn A, Mehling H i wsp. Significant reduction in Helicobacter pylori load in humans with non-viable Lactobacillus reuteri DSM17648: a pilot study. Probiotics Antimicrob Proteins 2015; 7: 91-100.
38. Buckley M, Lacey S, Doolan A i wsp. The effect of Lactobacillus reuteri supplementation in Helicobacter pylori infection: a placebo-controlled, single blind study. BMC Nutr 2018; 4: 48.
39. Uspienskiy YP, Fomin YА, Ivanov SV, Menaker IO. Evolution in eradication therapy of HP-associated diseases: beyond the standards? RMJ 2016; 17: 3 11.
40. Szajewska H, Horvath A, Piwowarczyk A. Meta-analysis: the effects of Saccharomyces boulardii supplementation on Helicobacter pylori eradication rates and side effects during treatment. Aliment Pharmacol Ther 2010; 32: 1069-1079.
41. Szajewska H, Horvath A, Kołodziej M. Systematic review with meta-analysis: Saccharomyces boulardii supplementation and eradication of Helicobacter pylori infection. Aliment Pharmacol Ther 2015; 41: 1237-1245.
Pełna treść artykułu: Jarosław Daniluk. Eradykacja Helicobacter pylori – siedem grzechów głównych. Lekarz POZ 2021; 7 (6): 411-420.
Źródło:
Lekarz POZ 2021; 7 (6): 411-420.
Lekarz POZ 2021; 7 (6): 411-420.



