Leczenie i profilaktyka nawracających zakażeń układu moczowego

Wszelkie działania mające na celu zmniejszenie podatności oraz zwiększenie odporności chorych mają dużo większe znaczenie niż szerokie, często niefrasobliwe stosowanie antybiotyków – niosące koszty zarówno dla indywidualnych pacjentek, jak i całej populacji i środowiska.
Autorka: Anna Bonder-Nowicka, II Klinika Urologii CMKP, Szpital Bielański, Warszawa
Zakażenia układu moczowego (ZUM) to najczęstszy problem skłaniający kobiety do poszukiwania pomocy lekarskiej. Co roku ok. 15% kobiet aktywnych seksualnie ma epizod ZUM, a nawet 60% kobiet zachoruje na ZUM w ciągu całego życia. Przynajmniej u jednej na cztery z nich rozwinie się nawracająca postać infekcji w ciągu roku [1]. O objawowym ZUM mówimy wtedy, gdy pacjentka odczuwa dyskomfort podczas oddawania moczu, ma częstomocz, parcia naglące oraz ból w podbrzuszu. Infekcję potwierdza uzyskanie w badaniu ogólnym moczu > 10 leukocytów w 1 mm3, a w posiewie moczu ze środkowego strumienia minimum 103 CFU (colony-forming units). Jeśli takie epizody występują częściej niż dwa razy w ciągu 6 miesięcy lub 3 razy w ciągu roku, określamy je jako nawracające ZUM (ryc. 1) [2].

Prawdziwa skala problemu widoczna jest jednak dopiero wtedy, gdy weźmiemy pod uwagę, że każdy epizod ZUM to średnio 6,1 dnia dotkliwych objawów, 2,4 dnia ograniczonej aktywności, 1,2 dnia zwolnienia z pracy lub szkoły oraz 0,4 dnia pozostawania w łóżku [3]. W odniesieniu do liczby pacjentek uwidacznia się wielkie zapotrzebowanie na powszechne i skuteczne interwencje profilaktyczne. Chodzi nie tylko o to, żeby poprawić komfort życia kobiet oraz umożliwić im aktywność społeczną, zawodową i seksualną, lecz także żeby zmniejszyć niekorzystne skutki społeczne ich nieobecności oraz potężne koszty leczenia.
U młodych kobiet najczęściej identyfikowane czynniki ryzyka to aktywność seksualna (w ogóle), używanie preparatów plemnikobójczych, nowy partner seksualny, wywiad nawracających ZUM u matki lub w dzieciństwie oraz niekorzystny status sekrecyjny związany z grupą krwi. W grupie kobiet po okresie menopauzy główną rolę odgrywa wcześniejszy wywiad nawracających ZUM oraz nietrzymanie moczu, atrofia śluzówek pochwy, obniżenie narządu rodnego, zaleganie moczu po mikcji, niekorzystny status sekrecyjny, ale największe ryzyko stwarza cewnikowanie pęcherza i zależność od instytucjonalnych form opieki [2].
Najczęstszą drogą zakażenia jest droga wstępująca, a dominującym czynnikiem etiologicznym Escherichia coli, która odpowiada za 70–95% ZUM. Pozostałe patogeny to inne Enterobacteriaceae (głównie Proteus mirabilis i Klebsiella spp.) oraz Staphylococcus saprophyticus (5–10% zakażeń).
Do rozpoznania ZUM konieczne jest występowanie objawów klinicznych. Jeśli pacjentka ich nie ma, a w badaniach moczu stwierdzamy bakterie (wzrost ≥ 105 CFU/ml w dwóch próbkach od kobiety, wzrost ≥ 105 CFU/ml w jednej od mężczyzny, 102 CFU/ml w moczu pobranym z cewnika), rozpoznajemy bezobjawową bakteriurię, która wymaga leczenia wyłącznie w bardzo wąskiej grupie pacjentów. Kolonizacja dolnych dróg moczowych może dotyczyć nawet 1–5% zdrowych, młodych kobiet. Po okresie menopauzy ten wskaźnik rośnie do 4–19%. Cukrzyca zwiększa to ryzyko do 0,7–27%, objęcie opieką instytucjonalną do 15–50%, a najbardziej narażeni są pacjenci z urazem rdzenia kręgowego – 23–89% [4]. Bezobjawowa bakteriuria nie powoduje pogorszenia funkcji nerek ani trwałych śladów w dolnych drogach moczowych, co więcej – działa protekcyjnie przed nawrotowym charakterem ZUM, a niepotrzebne jej leczenie nie tylko naraża pacjenta na działania niepożądane leków, lecz także na cięższy przebieg ZUM, jeśli ono wystąpi. Aktywne oznaczanie i leczenie bezobjawowej bakteriurii przynosi korzyści wyłącznie kobietom w ciąży, ponieważ zmniejsza ryzyko niskiej masy urodzeniowej i przedwczesnego porodu, oraz pacjentom przygotowywanym do planowych operacji urologicznych. Leczenie to nie odbiega od schematów leczenia niepowikłanych ZUM pod względem długości trwania ani rodzaju stosowanych antybiotyków, jednak powinno mieć charakter celowany, tj. zgodny z wynikiem antybiogramu z posiewu moczu [5].
W opiece nad pacjentkami z nawracającymi ZUM działania profilaktyczne należy rozpocząć od najmniej ryzykownych, tj. leczenia i modyfikacji czynników ryzyka, profilaktyki nieantybiotykowej, a dopiero po wyczerpaniu tych możliwości, w ostateczności wprowadzić leczenie antybiotykami. Łatwe do wdrożenia wydają się: zwiększenie podaży płynów, opróżnianie pęcherza po stosunku, mycie i wycieranie od przodu do tyłu oraz stosowanie przewiewnej bielizny, jednak badania wskazują, że wpływ tych interwencji jest niewielki [6]. Spośród metod profilaktyki nieantybiotykowej tylko kilka ma działanie udowodnione w badaniach. Najsilniej zalecaną interwencją w profilaktyce nawracających ZUM jest stosowanie immunomodulacji doustnej – Uro-Vaxom (OM-89).
Doustna immunizacja Uro-Vaxom (OM-89) jest rekomendowana zarówno przez Europejskie Towarzystwo Urologiczne (EAU) w niepowikłanych ZUM u kobiet (siła dowodów – strong, najwyższy poziom rekomendacji – 1a ) [2], jak i Polskie Towarzystwo Urologiczne w profilaktyce nawracających ZUM w celu zmniejszenia częstości nawrotów, zmniejszenia dolegliwości, ilości przepisywanych antybiotyków oraz ryzyka narastania wielooporności drobnoustrojów na leki [7].
Przeprowadzono szereg badań klinicznych III fazy z zastosowaniem leku Uro-Vaxom (OM-89) w profilaktyce nawracających ZUM, przede wszystkim u kobiet. Największą wartość mają badania z randomizacją, z podwójnie ślepą próbą z użyciem placebo [8–12]. Wielkość redukcji nawrotów w porównaniu z grupą kontrolną w obserwacji od 6 do 12 miesięcy wynosiła kilkadziesiąt procent (w różnych badaniach od 20% do 65%). Według najnowszej metaanalizy badań klinicznych z 2013 r. Uro-Vaxom (OM-89) zmniejsza częstość nawrotów ZUM o blisko połowę [13]. U ok. 2/3 badanych otrzymujących lek w okresie obserwacji nie rejestrowano ani jednego nawrotu ZUM [11]. W świetle jednoznacznych wyników badań klinicznych oraz zaleceń polskich i międzynarodowych wydaje się, że Uro-Vaxom (OM-89) powinien znaleźć szersze zastosowanie w praktyce nie tylko urologów, ginekologów czy nefrologów, lecz także lekarzy POZ i internistów jako użyteczna metoda terapeutyczna, która może zmniejszyć częstość nawrotów oraz poprawić jakość życia chorych z nawracającymi ZUM. Zaleca się wdrożenie immunomodulacji Uro-Vaxom (OM-89) jednocześnie z antybiotykiem pierwszego rzutu, jeżeli z wywiadu wiemy, że w ciągu ostatnich 6 miesięcy wystąpiły więcej niż dwa ZUM. Immunomodulację kontynuuje się przez pełne 90 dni.
Uro-Vaxom (OM-89) to ekstrakt z 18 uropatogennych szczepów E. coli, który zwiększa odpowiedź organizmu na kontakt z patogenem, a przez to wyraźnie zmniejsza częstość nawrotów ZUM. Działanie immunostymulujące preparatu Uro-Vaxom (OM-89) polega na wzmacnianiu zarówno odporności wrodzonej (aktywacja receptora TLR4, co prowadzi do uwalniania cytokin, które stymulują odpowiedź obronną i ekspresję białek adhezyjnych, wzrost aktywności fagocytarnej neutrofilów i makrofagów, wzrost aktywności cytotoksycznej komórek NK), jak i obu rodzajów odporności nabytej, tj. humoralnej i komórkowej (aktywowanie limfocytów B i T, co prowadzi do wzrostu poziomu swoistych przeciwciał klasy IgA oraz IgG, które wiążąc się z receptorami na powierzchni bakterii, zwiększają ich eliminację z dróg moczowych) [14]. Lek Uro-Vaxom (OM-89) indukuje silną odpowiedź immunologiczną, która nie jest ograniczona tylko do E. coli. Podobieństwo jej białek błonowych do białek innych bakterii Gram-ujemnych i Gram-dodatnich sprawia, że lek jest skuteczny również wobec innych uropatogenów (Enterococcus fecalis, Klebsiella pneumoniae, Proteus mirabilis, Providencia rettgeri), a także szczepów enterokrwotocznych (enterohemorrhagic E. coli – EHEC) [15]. Dzięki odporności na działanie proteaz jelitowych lek jest dostępny w postaci doustnej. W zapobieganiu nawracającym ZUM podaje się go raz dziennie na czczo (30 min przed posiłkiem) przez 90 dni. Nie obserwuje się istotnych działań niepożądanych. Uro-Vaxom (OM-89) nie wchodzi w interakcje z innymi lekami. Pozostałe metody profilaktyki nieantybiotykowej, które zostały uwzględnione w rekomendacjach EAU, charakteryzują się niższym poziomem dowodów naukowych [2]. U kobiet po menopauzie miejscowe (ale nie ogólne!) stosowanie estrogenów zmniejsza ryzyko wystąpienia nawracających ZUM [16]. Wyniki badań oceniających skuteczność preparatów Lactobacilli spp. są niejednoznaczne [17]. Legendarny wpływ preparatów żurawiny nie znajduje wystarczającego potwierdzenia w metaanalizach [18]. Budzące wielkie nadzieje wlewki dopęcherzowe z roztworu siarczanu chondroityny i kwasu hialuronowego, w zamyśle mające odbudowywać przerwaną warstwę glikozoaminoglikanów na powierzchni komórek urotelium, wciąż czekają na wiarygodną rekomendację [19].
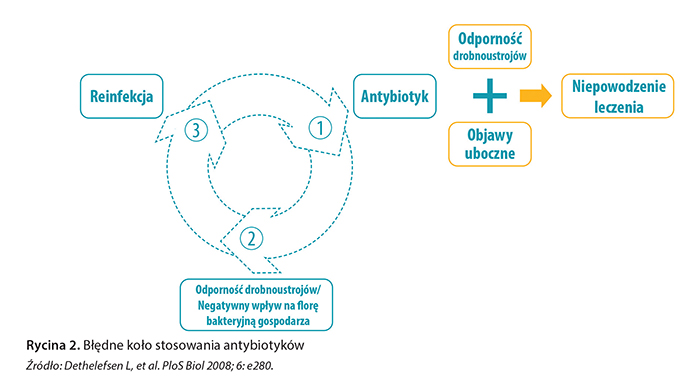
U pacjentek, u których zmiany stylu życia oraz profilaktyka nieantybiotykowa nie przyniosły rezultatu, możliwe jest stosowanie antybiotyków na dwa sposoby: poprzez ciągłe podawanie leków w małych dawkach przez 3–6 miesięcy albo doraźnie – bezpośrednio po stosunku. Proponowane leki to fosfomycyna 3 g co 10 dni, trimetoprim 100 mg raz dziennie, a podczas ciąży cefaleksyna 125 mg lub 250 mg oraz cefaklor 250 mg raz dziennie [6]. Profilaktyka postkoitalna ma zastosowanie tylko u kobiet, u których jest wyraźna korelacja pomiędzy epizodami ZUM a aktywnością seksualną, zwłaszcza w okresie ciąży [20]. Niestety długotrwałe podawanie leków przeciwbakteryjnych w suboptymalnych dawkach niesie ze sobą istotne ryzyko działań niepożądanych (właściwych dla poszczególnych leków, jak również uporczywej kandydozy pochwy lub uszczuplenia zasobów mikroflory jelitowej) i co nie mniej istotne – wyselekcjonowania szczepów wielolekoopornych (ryc. 2).
W ostatnich latach narastająca lawinowo oporność bakterii na kolejne antybiotyki ogranicza możliwości ich szerokiego stosowania. Na powstanie nowych substancji przeciwbakteryjnych współczesna farmakologia nie daje dużych nadziei. Nierzadkie – i niestety coraz częstsze – są przypadki zakażeń wywołanych przez patogeny oporne na doustne lub wszystkie dostępne antybiotyki. To sprawia, że wszelkie działania mające na celu zmniejszenie podatności oraz zwiększenie odporności chorych mają dużo większe znaczenie niż szerokie, często niefrasobliwe stosowanie antybiotyków – niosące koszty zarówno dla indywidualnych pacjentek, jak i całej populacji i środowiska. Wciąż oczekiwane są wyniki badań porównujących skuteczność profilaktyki nieantybiotykowej i profilaktyki z użyciem leków przeciwbakteryjnych. Układ moczowy ma wbudowane różnorodne i silne mechanizmy ochrony przed bakteriami – immunologiczne i komórkowe. Wspieranie ich w obecnym, szybko zmieniającym się świecie wydaje się rozsądnym kierunkiem.
Piśmiennictwo
1. Lindsay EN. Managing recurrent urinary tract infections in women. Womens Health 2005; 1: 39-50.
2. EAU Guidelines on Urological Infections 2020.
3. Naber KG, Bishop MC, Bjerklund-Johansen TE i wsp. Guidelines on the management of urinary and male genital tract infections. European Association of Urology 2006; 7–8. Appendices 12.1 [Criteria for the diagnosis of a UTI], p. 109.
4. Nicolle LE, Bradley S, Colgan R i wsp. Infectious diseases society of America guidelines for the diagnosis and treatment of asymptomatic bacteriuria in adults. Clin Infect Dis 2005; 40: 643-654.
5. Sousa R, Muñoz-Mahamud E, Quayle J i wsp. Is asymptomatic bacteriuria a risk factor for prosthetic joint infection? Clin Infect Dis 2014; 59: 41-47.
6. Hooton TM. Recurrent urinary tract infection in women. Int J Antimicrob Agents 2001; 17: 259-268.
7. Gołąbek T, Lipiński M, Drewa T i wsp. Zalecenia zespołu ekspertów dotyczące leczenia i profilaktyki zakażeń układu moczowego immunostymulatorem Uro-Vaxom (OM-89). Przegl Urol 2017; 2: 24-29.
8. Frey C, Obolensky W, Wyss H. Treatment of recurrent urinary tract infections: efficacy of an orally administered biological response modifier. Urol Int 1986; 41: 444-446.
9. Tammen H. The German Urinary Tract Infection Study Group. Immunobiotherapy with Uro-Vaxom in recurrent urinary tract infection. Br J Urol 1990; 65: 6-9.
10. Schulman CC, Corbusier A, Michiels H, Taenzer JH. Oral immunotherapy of recurrent urinary tract infections: a double-blind placebocontrolledmulticenter study. J Urol 1993; 150: 917-921.
11. Magasi P, Pánovics J, Illés A, Nagy M. Uro-Vaxom and the management of recurrent urinary tract infection in adults: a randomized multicenter double-blind trial. Eur Urol 1994; 26: 137-140.
12. Bauer HW, Alloussi S, Egger G i wsp. Multicenter UTI Study Group. A long-term, multicenter, double-blind study of an Escherichia coli extract (OM-89) in female patients with recurrent urinary tract infections. Eur Urol 2005; 47: 542-548.
13. Beerepoot MAJ, Geerlings SE, van Haarst EP i wsp. Nonantibiotic prophylaxis for recurrent urinary tract infections: a systematic review and meta-analysis of randomized controlled trials. J Urol 2013; 190: 1981-1989.
14. Huber M, Baier W, Serr A, Bessler WG. Immunogenicity of an E. coli extract after oral or intraperitoneal administration: induction of antibodies against pathogenic bacterial strains. Int J Immunopharmacol 2000; 22: 57-68.
15. Bauer HV, Rahlfs VW, Lauener PA, Blessmann GS. Prevention of recurrent urinary tract infections with immuno-active E. coli fractions: a meta-analysis of five placebo controlled double-blind studies. Int J Antimicrob Agents 2002; 19: 451-456.
16. Raz R, Estamm WE. A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections. N Engl J Med 1993; 329: 753-756.
17. Schwenger EM, Tejani AM, Loewen PS. Probiotics for preventing urinary tract infections in adults and children. Cochrane Database Syst Rev 2015: CD008772.
18. Jepson RG, Williams G, Craig JC. Cranberries for preventing urinary tract infections. Cochrane Database Syst Rev 2012; 10: Cd001321.
19. Madersbacher H, van Ophoven A, van Kerrebroeck P. GAG layer replenishment therapy for chronic forms of cystitis with intravesical glycosaminoglycans – a review. Neurourol Urodyn 2013; 32: 9-18.
20. Pfau A, Sacks TG. Effective prophylaxis for recurrent urinary tract infections during pregnancy. Clin Infect Dis 1992; 14: 810-814.
Zakażenia układu moczowego (ZUM) to najczęstszy problem skłaniający kobiety do poszukiwania pomocy lekarskiej. Co roku ok. 15% kobiet aktywnych seksualnie ma epizod ZUM, a nawet 60% kobiet zachoruje na ZUM w ciągu całego życia. Przynajmniej u jednej na cztery z nich rozwinie się nawracająca postać infekcji w ciągu roku [1]. O objawowym ZUM mówimy wtedy, gdy pacjentka odczuwa dyskomfort podczas oddawania moczu, ma częstomocz, parcia naglące oraz ból w podbrzuszu. Infekcję potwierdza uzyskanie w badaniu ogólnym moczu > 10 leukocytów w 1 mm3, a w posiewie moczu ze środkowego strumienia minimum 103 CFU (colony-forming units). Jeśli takie epizody występują częściej niż dwa razy w ciągu 6 miesięcy lub 3 razy w ciągu roku, określamy je jako nawracające ZUM (ryc. 1) [2].

Prawdziwa skala problemu widoczna jest jednak dopiero wtedy, gdy weźmiemy pod uwagę, że każdy epizod ZUM to średnio 6,1 dnia dotkliwych objawów, 2,4 dnia ograniczonej aktywności, 1,2 dnia zwolnienia z pracy lub szkoły oraz 0,4 dnia pozostawania w łóżku [3]. W odniesieniu do liczby pacjentek uwidacznia się wielkie zapotrzebowanie na powszechne i skuteczne interwencje profilaktyczne. Chodzi nie tylko o to, żeby poprawić komfort życia kobiet oraz umożliwić im aktywność społeczną, zawodową i seksualną, lecz także żeby zmniejszyć niekorzystne skutki społeczne ich nieobecności oraz potężne koszty leczenia.
U młodych kobiet najczęściej identyfikowane czynniki ryzyka to aktywność seksualna (w ogóle), używanie preparatów plemnikobójczych, nowy partner seksualny, wywiad nawracających ZUM u matki lub w dzieciństwie oraz niekorzystny status sekrecyjny związany z grupą krwi. W grupie kobiet po okresie menopauzy główną rolę odgrywa wcześniejszy wywiad nawracających ZUM oraz nietrzymanie moczu, atrofia śluzówek pochwy, obniżenie narządu rodnego, zaleganie moczu po mikcji, niekorzystny status sekrecyjny, ale największe ryzyko stwarza cewnikowanie pęcherza i zależność od instytucjonalnych form opieki [2].
Najczęstszą drogą zakażenia jest droga wstępująca, a dominującym czynnikiem etiologicznym Escherichia coli, która odpowiada za 70–95% ZUM. Pozostałe patogeny to inne Enterobacteriaceae (głównie Proteus mirabilis i Klebsiella spp.) oraz Staphylococcus saprophyticus (5–10% zakażeń).
Do rozpoznania ZUM konieczne jest występowanie objawów klinicznych. Jeśli pacjentka ich nie ma, a w badaniach moczu stwierdzamy bakterie (wzrost ≥ 105 CFU/ml w dwóch próbkach od kobiety, wzrost ≥ 105 CFU/ml w jednej od mężczyzny, 102 CFU/ml w moczu pobranym z cewnika), rozpoznajemy bezobjawową bakteriurię, która wymaga leczenia wyłącznie w bardzo wąskiej grupie pacjentów. Kolonizacja dolnych dróg moczowych może dotyczyć nawet 1–5% zdrowych, młodych kobiet. Po okresie menopauzy ten wskaźnik rośnie do 4–19%. Cukrzyca zwiększa to ryzyko do 0,7–27%, objęcie opieką instytucjonalną do 15–50%, a najbardziej narażeni są pacjenci z urazem rdzenia kręgowego – 23–89% [4]. Bezobjawowa bakteriuria nie powoduje pogorszenia funkcji nerek ani trwałych śladów w dolnych drogach moczowych, co więcej – działa protekcyjnie przed nawrotowym charakterem ZUM, a niepotrzebne jej leczenie nie tylko naraża pacjenta na działania niepożądane leków, lecz także na cięższy przebieg ZUM, jeśli ono wystąpi. Aktywne oznaczanie i leczenie bezobjawowej bakteriurii przynosi korzyści wyłącznie kobietom w ciąży, ponieważ zmniejsza ryzyko niskiej masy urodzeniowej i przedwczesnego porodu, oraz pacjentom przygotowywanym do planowych operacji urologicznych. Leczenie to nie odbiega od schematów leczenia niepowikłanych ZUM pod względem długości trwania ani rodzaju stosowanych antybiotyków, jednak powinno mieć charakter celowany, tj. zgodny z wynikiem antybiogramu z posiewu moczu [5].
W opiece nad pacjentkami z nawracającymi ZUM działania profilaktyczne należy rozpocząć od najmniej ryzykownych, tj. leczenia i modyfikacji czynników ryzyka, profilaktyki nieantybiotykowej, a dopiero po wyczerpaniu tych możliwości, w ostateczności wprowadzić leczenie antybiotykami. Łatwe do wdrożenia wydają się: zwiększenie podaży płynów, opróżnianie pęcherza po stosunku, mycie i wycieranie od przodu do tyłu oraz stosowanie przewiewnej bielizny, jednak badania wskazują, że wpływ tych interwencji jest niewielki [6]. Spośród metod profilaktyki nieantybiotykowej tylko kilka ma działanie udowodnione w badaniach. Najsilniej zalecaną interwencją w profilaktyce nawracających ZUM jest stosowanie immunomodulacji doustnej – Uro-Vaxom (OM-89).
Doustna immunizacja Uro-Vaxom (OM-89) jest rekomendowana zarówno przez Europejskie Towarzystwo Urologiczne (EAU) w niepowikłanych ZUM u kobiet (siła dowodów – strong, najwyższy poziom rekomendacji – 1a ) [2], jak i Polskie Towarzystwo Urologiczne w profilaktyce nawracających ZUM w celu zmniejszenia częstości nawrotów, zmniejszenia dolegliwości, ilości przepisywanych antybiotyków oraz ryzyka narastania wielooporności drobnoustrojów na leki [7].
Przeprowadzono szereg badań klinicznych III fazy z zastosowaniem leku Uro-Vaxom (OM-89) w profilaktyce nawracających ZUM, przede wszystkim u kobiet. Największą wartość mają badania z randomizacją, z podwójnie ślepą próbą z użyciem placebo [8–12]. Wielkość redukcji nawrotów w porównaniu z grupą kontrolną w obserwacji od 6 do 12 miesięcy wynosiła kilkadziesiąt procent (w różnych badaniach od 20% do 65%). Według najnowszej metaanalizy badań klinicznych z 2013 r. Uro-Vaxom (OM-89) zmniejsza częstość nawrotów ZUM o blisko połowę [13]. U ok. 2/3 badanych otrzymujących lek w okresie obserwacji nie rejestrowano ani jednego nawrotu ZUM [11]. W świetle jednoznacznych wyników badań klinicznych oraz zaleceń polskich i międzynarodowych wydaje się, że Uro-Vaxom (OM-89) powinien znaleźć szersze zastosowanie w praktyce nie tylko urologów, ginekologów czy nefrologów, lecz także lekarzy POZ i internistów jako użyteczna metoda terapeutyczna, która może zmniejszyć częstość nawrotów oraz poprawić jakość życia chorych z nawracającymi ZUM. Zaleca się wdrożenie immunomodulacji Uro-Vaxom (OM-89) jednocześnie z antybiotykiem pierwszego rzutu, jeżeli z wywiadu wiemy, że w ciągu ostatnich 6 miesięcy wystąpiły więcej niż dwa ZUM. Immunomodulację kontynuuje się przez pełne 90 dni.
Uro-Vaxom (OM-89) to ekstrakt z 18 uropatogennych szczepów E. coli, który zwiększa odpowiedź organizmu na kontakt z patogenem, a przez to wyraźnie zmniejsza częstość nawrotów ZUM. Działanie immunostymulujące preparatu Uro-Vaxom (OM-89) polega na wzmacnianiu zarówno odporności wrodzonej (aktywacja receptora TLR4, co prowadzi do uwalniania cytokin, które stymulują odpowiedź obronną i ekspresję białek adhezyjnych, wzrost aktywności fagocytarnej neutrofilów i makrofagów, wzrost aktywności cytotoksycznej komórek NK), jak i obu rodzajów odporności nabytej, tj. humoralnej i komórkowej (aktywowanie limfocytów B i T, co prowadzi do wzrostu poziomu swoistych przeciwciał klasy IgA oraz IgG, które wiążąc się z receptorami na powierzchni bakterii, zwiększają ich eliminację z dróg moczowych) [14]. Lek Uro-Vaxom (OM-89) indukuje silną odpowiedź immunologiczną, która nie jest ograniczona tylko do E. coli. Podobieństwo jej białek błonowych do białek innych bakterii Gram-ujemnych i Gram-dodatnich sprawia, że lek jest skuteczny również wobec innych uropatogenów (Enterococcus fecalis, Klebsiella pneumoniae, Proteus mirabilis, Providencia rettgeri), a także szczepów enterokrwotocznych (enterohemorrhagic E. coli – EHEC) [15]. Dzięki odporności na działanie proteaz jelitowych lek jest dostępny w postaci doustnej. W zapobieganiu nawracającym ZUM podaje się go raz dziennie na czczo (30 min przed posiłkiem) przez 90 dni. Nie obserwuje się istotnych działań niepożądanych. Uro-Vaxom (OM-89) nie wchodzi w interakcje z innymi lekami. Pozostałe metody profilaktyki nieantybiotykowej, które zostały uwzględnione w rekomendacjach EAU, charakteryzują się niższym poziomem dowodów naukowych [2]. U kobiet po menopauzie miejscowe (ale nie ogólne!) stosowanie estrogenów zmniejsza ryzyko wystąpienia nawracających ZUM [16]. Wyniki badań oceniających skuteczność preparatów Lactobacilli spp. są niejednoznaczne [17]. Legendarny wpływ preparatów żurawiny nie znajduje wystarczającego potwierdzenia w metaanalizach [18]. Budzące wielkie nadzieje wlewki dopęcherzowe z roztworu siarczanu chondroityny i kwasu hialuronowego, w zamyśle mające odbudowywać przerwaną warstwę glikozoaminoglikanów na powierzchni komórek urotelium, wciąż czekają na wiarygodną rekomendację [19].
U pacjentek, u których zmiany stylu życia oraz profilaktyka nieantybiotykowa nie przyniosły rezultatu, możliwe jest stosowanie antybiotyków na dwa sposoby: poprzez ciągłe podawanie leków w małych dawkach przez 3–6 miesięcy albo doraźnie – bezpośrednio po stosunku. Proponowane leki to fosfomycyna 3 g co 10 dni, trimetoprim 100 mg raz dziennie, a podczas ciąży cefaleksyna 125 mg lub 250 mg oraz cefaklor 250 mg raz dziennie [6]. Profilaktyka postkoitalna ma zastosowanie tylko u kobiet, u których jest wyraźna korelacja pomiędzy epizodami ZUM a aktywnością seksualną, zwłaszcza w okresie ciąży [20]. Niestety długotrwałe podawanie leków przeciwbakteryjnych w suboptymalnych dawkach niesie ze sobą istotne ryzyko działań niepożądanych (właściwych dla poszczególnych leków, jak również uporczywej kandydozy pochwy lub uszczuplenia zasobów mikroflory jelitowej) i co nie mniej istotne – wyselekcjonowania szczepów wielolekoopornych (ryc. 2).

W ostatnich latach narastająca lawinowo oporność bakterii na kolejne antybiotyki ogranicza możliwości ich szerokiego stosowania. Na powstanie nowych substancji przeciwbakteryjnych współczesna farmakologia nie daje dużych nadziei. Nierzadkie – i niestety coraz częstsze – są przypadki zakażeń wywołanych przez patogeny oporne na doustne lub wszystkie dostępne antybiotyki. To sprawia, że wszelkie działania mające na celu zmniejszenie podatności oraz zwiększenie odporności chorych mają dużo większe znaczenie niż szerokie, często niefrasobliwe stosowanie antybiotyków – niosące koszty zarówno dla indywidualnych pacjentek, jak i całej populacji i środowiska. Wciąż oczekiwane są wyniki badań porównujących skuteczność profilaktyki nieantybiotykowej i profilaktyki z użyciem leków przeciwbakteryjnych. Układ moczowy ma wbudowane różnorodne i silne mechanizmy ochrony przed bakteriami – immunologiczne i komórkowe. Wspieranie ich w obecnym, szybko zmieniającym się świecie wydaje się rozsądnym kierunkiem.
Piśmiennictwo
1. Lindsay EN. Managing recurrent urinary tract infections in women. Womens Health 2005; 1: 39-50.
2. EAU Guidelines on Urological Infections 2020.
3. Naber KG, Bishop MC, Bjerklund-Johansen TE i wsp. Guidelines on the management of urinary and male genital tract infections. European Association of Urology 2006; 7–8. Appendices 12.1 [Criteria for the diagnosis of a UTI], p. 109.
4. Nicolle LE, Bradley S, Colgan R i wsp. Infectious diseases society of America guidelines for the diagnosis and treatment of asymptomatic bacteriuria in adults. Clin Infect Dis 2005; 40: 643-654.
5. Sousa R, Muñoz-Mahamud E, Quayle J i wsp. Is asymptomatic bacteriuria a risk factor for prosthetic joint infection? Clin Infect Dis 2014; 59: 41-47.
6. Hooton TM. Recurrent urinary tract infection in women. Int J Antimicrob Agents 2001; 17: 259-268.
7. Gołąbek T, Lipiński M, Drewa T i wsp. Zalecenia zespołu ekspertów dotyczące leczenia i profilaktyki zakażeń układu moczowego immunostymulatorem Uro-Vaxom (OM-89). Przegl Urol 2017; 2: 24-29.
8. Frey C, Obolensky W, Wyss H. Treatment of recurrent urinary tract infections: efficacy of an orally administered biological response modifier. Urol Int 1986; 41: 444-446.
9. Tammen H. The German Urinary Tract Infection Study Group. Immunobiotherapy with Uro-Vaxom in recurrent urinary tract infection. Br J Urol 1990; 65: 6-9.
10. Schulman CC, Corbusier A, Michiels H, Taenzer JH. Oral immunotherapy of recurrent urinary tract infections: a double-blind placebocontrolledmulticenter study. J Urol 1993; 150: 917-921.
11. Magasi P, Pánovics J, Illés A, Nagy M. Uro-Vaxom and the management of recurrent urinary tract infection in adults: a randomized multicenter double-blind trial. Eur Urol 1994; 26: 137-140.
12. Bauer HW, Alloussi S, Egger G i wsp. Multicenter UTI Study Group. A long-term, multicenter, double-blind study of an Escherichia coli extract (OM-89) in female patients with recurrent urinary tract infections. Eur Urol 2005; 47: 542-548.
13. Beerepoot MAJ, Geerlings SE, van Haarst EP i wsp. Nonantibiotic prophylaxis for recurrent urinary tract infections: a systematic review and meta-analysis of randomized controlled trials. J Urol 2013; 190: 1981-1989.
14. Huber M, Baier W, Serr A, Bessler WG. Immunogenicity of an E. coli extract after oral or intraperitoneal administration: induction of antibodies against pathogenic bacterial strains. Int J Immunopharmacol 2000; 22: 57-68.
15. Bauer HV, Rahlfs VW, Lauener PA, Blessmann GS. Prevention of recurrent urinary tract infections with immuno-active E. coli fractions: a meta-analysis of five placebo controlled double-blind studies. Int J Antimicrob Agents 2002; 19: 451-456.
16. Raz R, Estamm WE. A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections. N Engl J Med 1993; 329: 753-756.
17. Schwenger EM, Tejani AM, Loewen PS. Probiotics for preventing urinary tract infections in adults and children. Cochrane Database Syst Rev 2015: CD008772.
18. Jepson RG, Williams G, Craig JC. Cranberries for preventing urinary tract infections. Cochrane Database Syst Rev 2012; 10: Cd001321.
19. Madersbacher H, van Ophoven A, van Kerrebroeck P. GAG layer replenishment therapy for chronic forms of cystitis with intravesical glycosaminoglycans – a review. Neurourol Urodyn 2013; 32: 9-18.
20. Pfau A, Sacks TG. Effective prophylaxis for recurrent urinary tract infections during pregnancy. Clin Infect Dis 1992; 14: 810-814.
Źródło:
Lekarz POZ 1/2021 vol. 7
Lekarz POZ 1/2021 vol. 7