Komisja Europejska zarejestrowała niwolumab w skojarzeniu z niską dawką ipilimumabu w leczeniu I linii zaawansowanego raka nerki
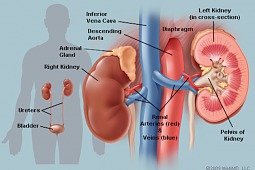
Komisja Europejska zarejestrowała terapię niwolumabem w dawce 3 mg/kg w skojarzeniu z ipilimumabem w dawce 1 mg/kg („mała dawka”) w leczeniu pierwszej linii zaawansowanego raka nerkowokomórkowego u pacjentów o pośrednim i złym rokowaniu. Jest to pierwsza w Unii Europejskiej rejestracja skojarzonej terapii lekami immunoonkologicznymi przeznaczonej dla pacjentów z rakiem nerkowokomórkowym.
- Obecnie mniej niż 50% pacjentów z przerzutowym rakiem nerkowokomórkowym przeżywa ponad dwa lata i praktycznie nie stwierdza się remisji całkowitych. Stąd pilna potrzeba opracowania nowych metod leczenia tej choroby” – stwierdził dr Bernard Escudier, były Przewodniczący Komitetu ds. Nowotworów Układu Moczowo-Płciowego w Instytucie Gustave Roussy. -Rejestracja zapewnia pacjentom w Unii Europejskiej dostęp do terapii pierwszej linii, w przypadku której wykazano niemal 10% odsetek odpowiedzi całkowitych i istotne wydłużenie przeżycia przy mniejszej liczbie działań niepożądanych w porównaniu z sunitynibem.
Terapię zarejestrowano w oparciu o wyniki badania klinicznego 3 fazy CheckMate -214, zatrzymanego przed czasem po zaplanowanej analizie okresowej, która wykazała, że leczenie niwolumabem w skojarzeniu z małą dawką ipilimumabu zapewnia istotne wydłużenie przeżycia całkowitego (OS), przy jednoczesnym zmniejszeniu o 37% ryzyka zgonu u pacjentów o pośrednim i złym rokowaniu w porównaniu z obecnym leczeniem standardowym z zastosowaniem sunitynibu (HR 0,63; 99,8% CI: 0,44 do 0,89; p<0,0001). Korzyści w zakresie OS obserwowano niezależnie od poziomu ekspresji PD-L1. Mediana przeżycia całkowitego u pacjentów leczonych niwolumabem w skojarzeniu z małą dawką ipilimumabu nie została jeszcze osiągnięta (95% CI: 28,2 do nieosiągniętej [NE]), wobec 25,9 miesiąca w przypadku pacjentów leczonych z zastosowaniem sunitynibu.
W terapii skojarzonej niwolumabem i małą dawką ipilimumabu uzyskano też wyższy odsetek odpowiedzi obiektywnych na poziomie 41,6% (95% CI: 36,9 do 46,5; p<0,0001; n=177/425) w porównaniu do 26,5% dla sunitynibu (95% CI: 22,4 do 31,0; n=112/422) oraz odsetek odpowiedzi całkowitych wynoszący 9,4% w grupie leczonej niwolumabem w skojarzeniu z małą dawką ipilimumabu wobec 1,2% w grupie pacjentów leczonych sunitynibem. Wśród pacjentów, u których wystąpiła odpowiedź, mediana trwania odpowiedzi w grupie leczonej niwolumabem skojarzonym z małą dawką ipilimumabu nie została jeszcze osiągnięta (95% CI: 21,8 do NE), wobec 18,2 miesiąca w przypadku sunitynibu (95% CI: 14.8 do NE). Terapia skojarzona niwolumabem z małą dawką ipilimumabu wiązała się ponadto z mniejszym łącznym odsetkiem działań niepożądanych stopnia 3 i 4 w porównaniu z sunitynibem (65% wobec 76%).
-Ogromnie cieszy nas fakt, że Komisja Europejska zarejestrowała leczenie niwolumabem w skojarzeniu z małą dawką ipilimumabu na podstawie znacznego wydłużenia przeżycia wykazanego w badaniu CheckMate -214 ” – powiedział Chris Boerner, Dyrektor ds. Handlowych spółki Bristol-Myers Squibb. „Dzisiejsza decyzja stanowi ważny krok na drodze do celu, którym jest przełom w sposobie leczenia raka i poprawa jakości życia i długoterminowego przeżycia pacjentów.
Informacje na temat badania klinicznego CheckMate -214
CheckMate -214 jest otwartym badaniem klinicznym 3 fazy z randomizacją, oceniającym skuteczność niwolumabu w dawce 3 mg/kg w skojarzeniu z ipilimumabem w dawce 1 mg/kg w porównaniu do sunitynibu u pacjentów z uprzednio nieleczonym, zaawansowanym rakiem nerkowokomórkowym. W populacji badanej o pośrednim i złym rokowaniu 425 pacjentów otrzymywało niwolumab w dawce 3 mg/kg oraz ipilimumab w dawce 1 mg/kg co trzy tygodnie przez cztery dawki, a następnie niwolumab w dawce 3 mg/kg co dwa tygodnie, a 422 pacjentów otrzymywało sunitynib w dawce 50 mg raz dziennie przez cztery tygodnie, a następnie przez dwa tygodnie mieli przerwę w leczeniu. Zalecane dawkowanie w terapii skojarzonej niwolumabem z małą dawką ipilimumabu wynosi 3 mg/kg niwolumabu, a następnie ipilimumab w dawce 1 mg/kg, podawane w kolejnych wlewach dożylnych po 30 minut tego samego dnia, co trzy tygodnie, przez cztery dawki. Po podaniu czterech dawek skojarzonych stosuje się niwolumab w dawce 240 mg co dwa tygodnie we wlewie dożylnym trwającym 30 minut lub w dawce 480 mg co cztery tygodnie we wlewie 60-minutowym, do momentu progresji choroby lub wystąpienia nieakcpetowalnych działań niepożądanych.
Skojarzone wskaźniki skuteczności w badaniu obejmowały przeżycie całkowite, odsetek odpowiedzi obiektywnych (odpowiedź całkowita + odpowiedź częściowa) oraz przeżycie wolne od progresji, wyznaczane przez niezależny komitet oceny radiograficznej (IRRC) u pacjentów o pośrednim i złym rokowaniu. Pacjenci byli włączani do badania niezależnie od statusu ekspresji PD-L1.
Informacje na temat raka nerkowokomórkowego
Rak nerkowokomórkowy (RCC) jest najczęstszym typem raka nerki u dorosłych, odpowiedzialnym za ponad 140 tys. zgonów rocznie na całym świecie. Rak jasnokomórkowy nerki jest najczęściej spotykanym podtypem RCC, który występuje u 80-90% chorych. RCC występuje niemal dwukrotnie częściej u mężczyzn niż u kobiet, przy czym najwyższe współczynniki obserwuje się w Ameryce Północnej i w Europie. Globalnie współczynnik przeżyć pięcioletnich w przypadku osób zdiagnozowanych w zaawansowanym lub przerzutowym stadium raka nerki wynosi 8%.
Informacje na temat niwolumabu
Niwolumab jest inhibitorem immunologicznego punktu kontrolnego PD-1 zaprojektowanym tak, aby wspomóc system immunologiczny organizmu w przywracaniu odpowiedzi immunologicznej. Wspomagając system immunologiczny organizmu w walce z rakiem, niwolumab stał się ważną opcją terapeutyczną w leczeniu wielu typów nowotworów.
Program badawczo-rozwojowy niwolumabu wyrasta z wiedzy naukowej i doświadczeń Bristol-Myers Squibb w dziedzinie immunoonkologii i obejmuje szeroką gamę badań klinicznych różnych faz, w tym fazy 3, a także różne typy nowotworów. Do chwili obecnej program badań klinicznych niwolumabu objął ponad 25 000 pacjentów. Dzięki badaniom z zastosowaniem niwolumabu lepiej rozumiemy znaczenie biomarkerów w leczeniu pacjentów, szczególnie w odniesieniu do tego, jakie korzyści z zastosowania leku odnoszą pacjenci w zależności od poziomu ekspresji PD-L1.
W lipcu 2014 r. niwolumab został pierwszym na świecie zarejestrowanym inhibitorem immunologicznego punktu kontrolnego PD-1. Obecnie jest zarejestrowany w ponad 65 krajach, w tym w Stanach Zjednoczonych, Unii Europejskiej, Japonii i Chinach. W październiku 2015 r. opracowana przez naszą firmę pierwsza terapia skojarzona niwolumabem + ipilimumabem została zarejestrowana do leczenia przerzutowego czerniaka i jest obecnie zarejestrowana w ponad 50 krajach, w tym w Stanach Zjednoczonych i Unii Europejskiej.
Terapię zarejestrowano w oparciu o wyniki badania klinicznego 3 fazy CheckMate -214, zatrzymanego przed czasem po zaplanowanej analizie okresowej, która wykazała, że leczenie niwolumabem w skojarzeniu z małą dawką ipilimumabu zapewnia istotne wydłużenie przeżycia całkowitego (OS), przy jednoczesnym zmniejszeniu o 37% ryzyka zgonu u pacjentów o pośrednim i złym rokowaniu w porównaniu z obecnym leczeniem standardowym z zastosowaniem sunitynibu (HR 0,63; 99,8% CI: 0,44 do 0,89; p<0,0001). Korzyści w zakresie OS obserwowano niezależnie od poziomu ekspresji PD-L1. Mediana przeżycia całkowitego u pacjentów leczonych niwolumabem w skojarzeniu z małą dawką ipilimumabu nie została jeszcze osiągnięta (95% CI: 28,2 do nieosiągniętej [NE]), wobec 25,9 miesiąca w przypadku pacjentów leczonych z zastosowaniem sunitynibu.
W terapii skojarzonej niwolumabem i małą dawką ipilimumabu uzyskano też wyższy odsetek odpowiedzi obiektywnych na poziomie 41,6% (95% CI: 36,9 do 46,5; p<0,0001; n=177/425) w porównaniu do 26,5% dla sunitynibu (95% CI: 22,4 do 31,0; n=112/422) oraz odsetek odpowiedzi całkowitych wynoszący 9,4% w grupie leczonej niwolumabem w skojarzeniu z małą dawką ipilimumabu wobec 1,2% w grupie pacjentów leczonych sunitynibem. Wśród pacjentów, u których wystąpiła odpowiedź, mediana trwania odpowiedzi w grupie leczonej niwolumabem skojarzonym z małą dawką ipilimumabu nie została jeszcze osiągnięta (95% CI: 21,8 do NE), wobec 18,2 miesiąca w przypadku sunitynibu (95% CI: 14.8 do NE). Terapia skojarzona niwolumabem z małą dawką ipilimumabu wiązała się ponadto z mniejszym łącznym odsetkiem działań niepożądanych stopnia 3 i 4 w porównaniu z sunitynibem (65% wobec 76%).
-Ogromnie cieszy nas fakt, że Komisja Europejska zarejestrowała leczenie niwolumabem w skojarzeniu z małą dawką ipilimumabu na podstawie znacznego wydłużenia przeżycia wykazanego w badaniu CheckMate -214 ” – powiedział Chris Boerner, Dyrektor ds. Handlowych spółki Bristol-Myers Squibb. „Dzisiejsza decyzja stanowi ważny krok na drodze do celu, którym jest przełom w sposobie leczenia raka i poprawa jakości życia i długoterminowego przeżycia pacjentów.
Informacje na temat badania klinicznego CheckMate -214
CheckMate -214 jest otwartym badaniem klinicznym 3 fazy z randomizacją, oceniającym skuteczność niwolumabu w dawce 3 mg/kg w skojarzeniu z ipilimumabem w dawce 1 mg/kg w porównaniu do sunitynibu u pacjentów z uprzednio nieleczonym, zaawansowanym rakiem nerkowokomórkowym. W populacji badanej o pośrednim i złym rokowaniu 425 pacjentów otrzymywało niwolumab w dawce 3 mg/kg oraz ipilimumab w dawce 1 mg/kg co trzy tygodnie przez cztery dawki, a następnie niwolumab w dawce 3 mg/kg co dwa tygodnie, a 422 pacjentów otrzymywało sunitynib w dawce 50 mg raz dziennie przez cztery tygodnie, a następnie przez dwa tygodnie mieli przerwę w leczeniu. Zalecane dawkowanie w terapii skojarzonej niwolumabem z małą dawką ipilimumabu wynosi 3 mg/kg niwolumabu, a następnie ipilimumab w dawce 1 mg/kg, podawane w kolejnych wlewach dożylnych po 30 minut tego samego dnia, co trzy tygodnie, przez cztery dawki. Po podaniu czterech dawek skojarzonych stosuje się niwolumab w dawce 240 mg co dwa tygodnie we wlewie dożylnym trwającym 30 minut lub w dawce 480 mg co cztery tygodnie we wlewie 60-minutowym, do momentu progresji choroby lub wystąpienia nieakcpetowalnych działań niepożądanych.
Skojarzone wskaźniki skuteczności w badaniu obejmowały przeżycie całkowite, odsetek odpowiedzi obiektywnych (odpowiedź całkowita + odpowiedź częściowa) oraz przeżycie wolne od progresji, wyznaczane przez niezależny komitet oceny radiograficznej (IRRC) u pacjentów o pośrednim i złym rokowaniu. Pacjenci byli włączani do badania niezależnie od statusu ekspresji PD-L1.
Informacje na temat raka nerkowokomórkowego
Rak nerkowokomórkowy (RCC) jest najczęstszym typem raka nerki u dorosłych, odpowiedzialnym za ponad 140 tys. zgonów rocznie na całym świecie. Rak jasnokomórkowy nerki jest najczęściej spotykanym podtypem RCC, który występuje u 80-90% chorych. RCC występuje niemal dwukrotnie częściej u mężczyzn niż u kobiet, przy czym najwyższe współczynniki obserwuje się w Ameryce Północnej i w Europie. Globalnie współczynnik przeżyć pięcioletnich w przypadku osób zdiagnozowanych w zaawansowanym lub przerzutowym stadium raka nerki wynosi 8%.
Informacje na temat niwolumabu
Niwolumab jest inhibitorem immunologicznego punktu kontrolnego PD-1 zaprojektowanym tak, aby wspomóc system immunologiczny organizmu w przywracaniu odpowiedzi immunologicznej. Wspomagając system immunologiczny organizmu w walce z rakiem, niwolumab stał się ważną opcją terapeutyczną w leczeniu wielu typów nowotworów.
Program badawczo-rozwojowy niwolumabu wyrasta z wiedzy naukowej i doświadczeń Bristol-Myers Squibb w dziedzinie immunoonkologii i obejmuje szeroką gamę badań klinicznych różnych faz, w tym fazy 3, a także różne typy nowotworów. Do chwili obecnej program badań klinicznych niwolumabu objął ponad 25 000 pacjentów. Dzięki badaniom z zastosowaniem niwolumabu lepiej rozumiemy znaczenie biomarkerów w leczeniu pacjentów, szczególnie w odniesieniu do tego, jakie korzyści z zastosowania leku odnoszą pacjenci w zależności od poziomu ekspresji PD-L1.
W lipcu 2014 r. niwolumab został pierwszym na świecie zarejestrowanym inhibitorem immunologicznego punktu kontrolnego PD-1. Obecnie jest zarejestrowany w ponad 65 krajach, w tym w Stanach Zjednoczonych, Unii Europejskiej, Japonii i Chinach. W październiku 2015 r. opracowana przez naszą firmę pierwsza terapia skojarzona niwolumabem + ipilimumabem została zarejestrowana do leczenia przerzutowego czerniaka i jest obecnie zarejestrowana w ponad 50 krajach, w tym w Stanach Zjednoczonych i Unii Europejskiej.
Źródło:
mat press/MK
mat press/MK
Kategorie:
Układ moczowo-płciowego