Zastosowanie leczenia skojarzonego lekami firmy Novartis Tafinlar® + Mekinist® przedłuża życie chorych na agresywną postać czerniaka
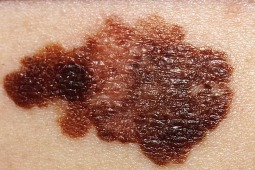
25. września 2015 roku firma Novartis ogłosiła, że uaktualnione wyniki badania klinicznego III fazy COMBI-v wykazały statystycznie istotna poprawę przeżycia u chorych na czerniaka z przerzutami z obecnością mutacji BRAF V600E/K, leczonych w sposób skojarzony lekami Tafinlar® (dabrafenib) + Mekinist® (trametinib) w porównaniu z monoterapią wemurafenibem.
Artykuł dostępny wyłącznie dla:
lekarz, lekarz dentysta, lekarz w trakcie specjalizacji .Zaloguj się, aby przeczytać pełną treść artykułu.
Zaloguj się
Nie pamiętasz hasła?
Skorzystaj z opcji przypominania hasła, aby odzyskać dostęp do swojego konta Termedia.
Źródło:
Novartis
Novartis
Kategorie:
Czerniak



