Szczepienia przeciw pneumokokom pacjentów dorosłych – nowe możliwości
Publikujemy szczegółową analizę przygotowaną przez wielodyscyplinarny zespół ekspertów – dotyczy nowych możliwości w przypadku szczepienia przeciw pneumokokom. To ważne, bo zakażenia pneumokokowe w populacji dorosłych pozostają istotnym problemem zdrowotnym.
Artykuł ekspertów – Jacka Wysockiego, Adama Antczaka, Joanny Chorostowskiej-Wynimko, Leszka Czupryniaka, Andrzeja Fala, Roberta Flisiaka, Ernesta Kuchara, Artura Mamcarza, Anety Nitch-Osuch, Marcina Stajszczyka, Michała Abendrota, Dominika Golickiego, Katarzyny Jaśkowiak i Anny Skoczyńskiej:
Bakterie Streptococcus pneumoniae (S. pneumoniae – dwoinka zapalenia płuc) są istotną przyczyną zachorowalności i umieralności osób dorosłych, w tym jedną z głównych przyczyn pozaszpitalnego zapalenia płuc (PZP) 1, 2. Inwazyjna choroba pneumokokowa (IChP) obejmuje ciężkie zakażenia pneumokokowe, w których dochodzi do przedostania się bakterii do pierwotnie jałowych miejsc, np. płynów ustrojowych. IChP może przebiegać pod postacią zapalenia płuc z bakteriemią, sepsy i zapalenia opon mózgowo-rdzeniowych, które wciąż stanowią poważny problem zdrowotny cechujący się wysoką śmiertelnością. Według danych Europejskiego Centrum ds. Zapobiegania i Kontroli Chorób (European Centre for Diseases Prevention and Control – ECDC) w 2019 r. (przed wybuchem pandemii COVID-19) odnotowano 23 tys. potwierdzonych przypadków IChP w krajach Unii Europejskiej/Europejskiego Obszaru Gospodarczego. Potwierdzone przypadki choroby najczęściej występowały wśród dzieci w wieku poniżej roku (13,5/100 tys.) i dorosłych w wieku powyżej 65 lat (16,7/100 tys.) 3.
Szacuje się, że pneumokokowe zapalenie płuc jest odpowiedzialne za mniej więcej 98 proc. obciążenia chorobami pneumokokowymi osób w wieku ≥ 50 lat 4. Zapalenie płuc jest niejednorodną jednostką chorobową o zmiennym obrazie klinicznym i etiologii. U osób dorosłych w większości przypadków (75 proc.) pneumokokowe PZP (pPZP) ma postać zakażenia nieinwazyjnego 5. Pozostałe 25 proc. przypadków stanowią zapalenia płuc z bakteriemią, które wiążą się z ciężkim przebiegiem, dłuższym czasem powrotu do zdrowia i większym ryzykiem zgonu 6. Pneumokokowe PZP jest także najczęstszym ciężkim powikłaniem zakażeń wirusowych. Zakażenie pneumokokami wykrywane jest u około 35 proc. chorych hospitalizowanych z powodu zapalenia płuc pierwotnie wywołanego przez wirusa grypy 7. Zapalenia płuc osób dorosłych stanowią istotne obciążenie systemów opieki zdrowotnej na całym świecie. Szacuje się, że odsetek dorosłych pacjentów z PZP wymagających hospitalizacji może wynosić od 20 proc. do 50 proc. w zależności od kraju 8. Według danych Narodowego Funduszu Zdrowia w 2019 r. w warunkach ambulatoryjnych leczono około 374,4 tys. dorosłych z powodu PZP, a 54,9 tys. hospitalizowano 9. Dokładne oszacowanie częstości przypadków PZP spowodowanych S. pneumoniae jest trudne. Zapalenie płuc leczone jest empirycznie zaraz po postawieniu diagnozy, najczęściej bez konieczności określenia etiologii zakażenia 10. Według badań obserwacyjnych przeprowadzonych w okresie ostatnich dwóch dekad (lata 1999–2020) odsetek przypadków PZP spowodowanych S. pneumoniae wynosi od 33 proc. do 48 proc. przypadków o znanej etiologii 1. Podana częstość pneumokokowych PZP nie uwzględnia jednak przypadków leczonych ambulatoryjnie. Obciążenie pneumokokowym PZP osób dorosłych jest więc z dużym prawdopodobieństwem niedoszacowane. Zapalenie płuc pociąga za sobą wiele następstw zdrowotnych, takich jak podwyższone ryzyko zgonu, zaostrzenie czy dekompensacja choroby podstawowej i pogorszenie ogólnej jakości życia 11, 12.
Grupy ryzyka zakażeń
Podstawowym czynnikiem ryzyka zakażenia S. pneumoniae jest zaawansowany wiek, który w zależności od źródła określany jest jako powyżej 50. lub 65. roku życia 13. Zmiany związane ze starzeniem się układu odpornościowego oraz istotnie częstsze występowanie chorób współistniejących wśród osób starszych przyczyniają się do zwiększonej podatności na zakażenia 14, 15. Częstość pneumokokowego zapalenia płuc wśród osób zdrowych w wieku ≥ 65 lat jest niemal 5-krotnie większa względem częstości obserwowanej u osób w wieku od 18 do 49 lat 13. Choroba przewlekła, bez względu na wiek pacjenta, zwiększa ryzyko wystąpienia zakażenia pneumokokami w porównaniu z osobami zdrowymi. Właśnie dlatego osoby dorosłe z przewlekłą chorobą serca, płuc, wątroby, cukrzycą są w tzw. grupie umiarkowanego ryzyka zakażenia pneumokokami 16 (tab. 1).
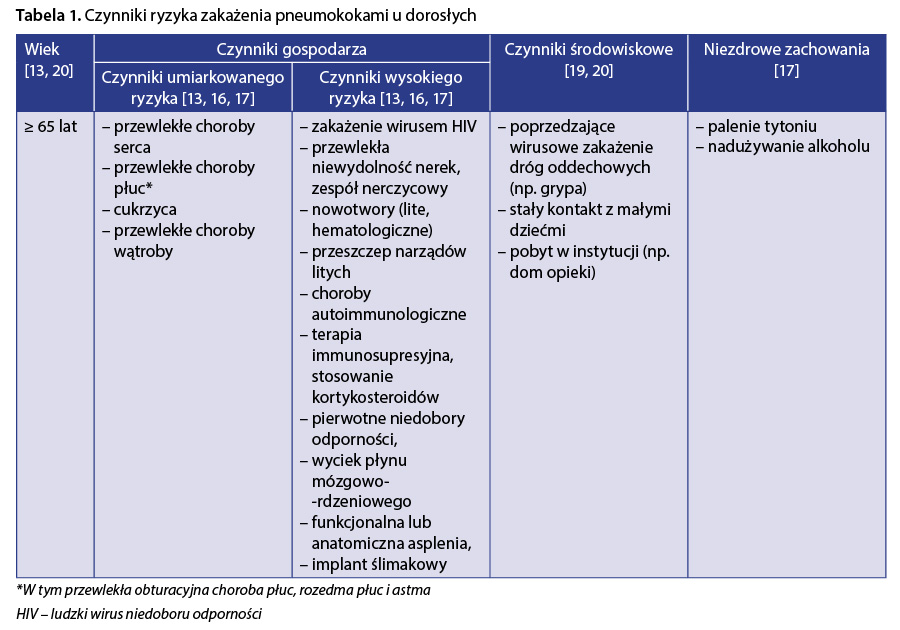
Trzeba jednak pamiętać, że współwystępowanie kilku czynników umiarkowanego ryzyka kilkukrotnie zwiększa ryzyko wystąpienia zakażenia S. pneumoniae względem osoby dorosłej w tym samym wieku 13. Niezdrowe zachowania – takie jak palenie papierosów oraz nadużywanie alkoholu – również zwiększają ryzyko zakażenia S. pneumoniae 17. Przykładowo, ryzyko wystąpienia IChP wśród palaczy w wieku od 18 do 64 lat jest ponad dwukrotnie większe niż wśród osób niepalących w tym samym wieku 18. Istotny wpływ na zwiększenie ryzyka zakażenia pneumokokami mają także czynniki środowiskowe, w tym wcześniejsze zakażenie wirusem grypy 19 lub przebywanie w placówkach opieki długoterminowej 20.
Najwyższe ryzyko zakażenia pneumokokami dotyczy osób z zaburzeniami układu odpornościowego, tj. osób dorosłych z immunosupresją spowodowaną wrodzonymi lub nabytymi niedoborami odporności, zakażeniem wirusem HIV, przewlekłą niewydolnością nerek, zespołem nerczycowym, białaczkami, chłoniakami, chorobą Hodgkina, uogólnionym nowotworem złośliwym oraz przeszczepem narządów litych 21. Osoby przyjmujące leczenie immunosupresyjne (tzw. jatrogenna immunosupresja) również są w grupie wysokiego ryzyka zakażenia 17. Leki immunosupresyjne stosowane są m.in. w schorzeniach reumatologicznych lub onkologicznych i stanowią bardzo zróżnicowaną grupę substancji, do której zaliczamy m.in. doustne kortykosteroidy czy rytuksymab 22. Wysokie ryzyko zakażenia pneumokokami związane jest również z wyciekiem płynu mózgowo-rdzeniowego i stanem po wszczepieniu implantu ślimakowego 16.
Szczepionka polisacharydowa a szczepionki skoniugowane przeciw pneumokokom
Obecnie dostępne są dwa rodzaje szczepionek przeciwko pneumokokom: szczepionka polisacharydowa (pneumococcal polysaccharide vaccine – PPSV lub PPV) 23 oraz szczepionki polisacharydowe skoniugowane (pneumococcal conjugate vaccine – PCV) 24–26. Ze względu na różną zawartość antygenów polisacharydowych szczepionek, w literaturze ich nazwy podaje się poprzez oznaczenie typu i walentności danej szczepionki. Na przykład PCV13 to szczepionka 13-walentna polisacharydowa skoniugowana (pneumococcal conjugate vaccine, 13-valent – PCV13).
Nieskoniugowana szczepionka polisacharydowa przeciw pneumokokom dostępna jest na rynku od około 40 lat 27. W kontekście szczepień dorosłych ma ona wiele ograniczeń w porównaniu ze szczepionkami skoniugowanymi, z których najważniejszymi są brak wzbudzania pamięci immunologicznej, względnie krótki czas trwania ochrony oraz konieczność powtarzania szczepienia (tab. 2).
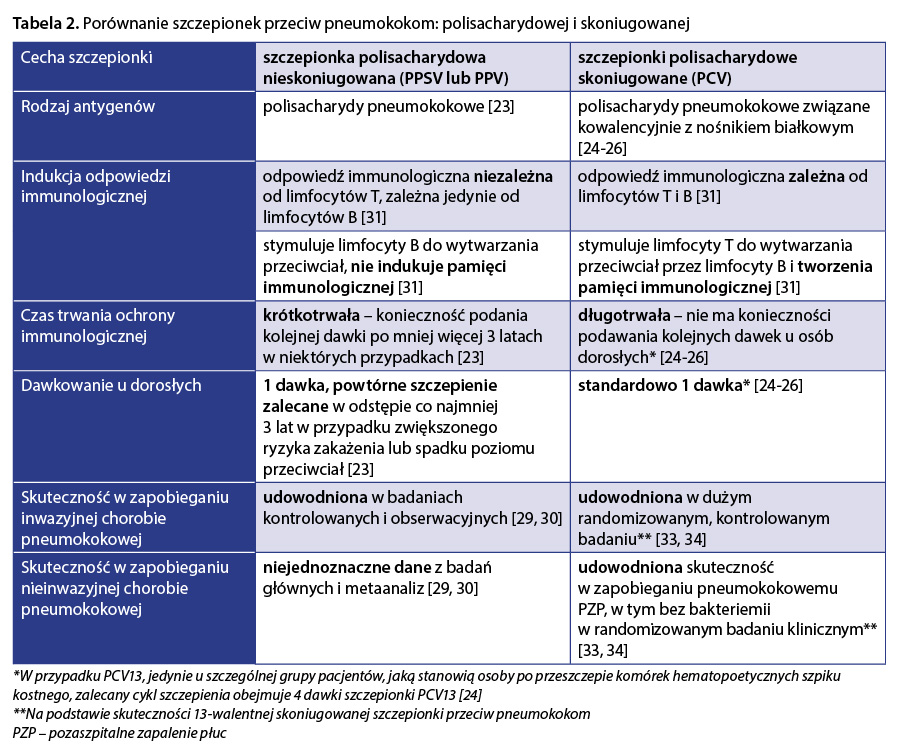
Odpowiedź immunologiczna na szczepionkę polisacharydową osób starszych, z określonymi chorobami przewlekłymi lub zaburzeniami odporności jest mniejsza niż osób zdrowych 28. O ile skuteczność szczepionki polisacharydowej u dorosłych w zapobieganiu inwazyjnym postaciom zakażenia pneumokokami została potwierdzona 29, to skuteczność w zapobieganiu zakażeniom nieinwazyjnym jest niejednoznaczna 30. Połączenie polisacharydu pneumokoka z białkiem nośnikowym w szczepionkach skoniugowanych (PCV) powoduje indukcję silnej odpowiedzi przez limfocyty B i T, a w rezultacie – wytworzenie długotrwałej pamięci immunologicznej 31. W konsekwencji szczepionka skoniugowana wykazuje porównywalną (najczęściej nie gorszą) immunogenność u dorosłych z dobrze kontrolowanymi farmakologicznie chorobami przewlekłymi, jak u osób zdrowych 32. Skuteczność szczepionki skoniugowanej 13-walentnej (PCV13) w zapobieganiu IChP i pPZP, w tym bez bakteriemii, u osób w wieku ≥ 65 lat potwierdzono w randomizowanym badaniu klinicznym 33, 34. Standardowo jedna dawka szczepionki skoniugowanej zapewnia skuteczną ochronę dorosłych przed zakażeniem pneumokokami, w tym osób z czynnikami podwyższonego ryzyka zakażeń. Podanie kolejnej dawki szczepionki skoniugowanej jest konieczne wyłącznie w bardzo szczególnych populacjach pacjentów, tj. po przeszczepieniu komórek hematopoetycznych szpiku 24.
Populacyjne szczepienia za pomocą szczepionki skoniugowanej mają pozytywny wpływ na zdrowie publiczne, natomiast nie potwierdzono efektywności w tym zakresie szczepionek nieskoniugowanych. W Stanach Zjednoczonych szczepionka polisacharydowa nieskoniugowana (PPSV) dostępna była dla dzieci powyżej 2. roku życia i dorosłych od lat 80. XX wieku. Co ciekawe, spadek zachorowań na IChP w populacji dorosłych zaobserwowano dopiero po rozpoczęciu szczepień za pomocą szczepionki skoniugowanej, początkowo w ramach powszechnego szczepienia dzieci szczepionką PCV7 (od 2000 r.) i po zaleceniu szczepień dorosłych z zastosowaniem PCV13 (od 2012 r.) 35. Efekt populacyjny wynika z udokumentowanego wpływu szczepionki skoniugowanej na zmniejszenie nosicielstwa pneumokoków w jamie nosowo-gardłowej osób zaszczepionych 36, 37. Wpływ szczepionki nieskoniugowanej na nosicielstwo pneumokoków jest niejasny 38.
Szczepionki skoniugowane przeciw pneumokokom dostępne w Polsce
Do końca 2021 jedyną dostępną skoniugowaną szczepionką stosowaną w profilaktyce zakażeń pneumokokowych u dorosłych była szczepionka PCV13. Początkowo szczepionka PCV13 została zarejestrowana wyłącznie do stosowania w populacji dziecięcej 39. W związku z ograniczeniami szczepionki polisacharydowej (m.in. z brakiem jednoznacznie potwierdzonej skuteczności w zapobieganiu PZP bez bakteriemii), rozpoczęto wiele badań klinicznych PCV13 w populacji dorosłych. Skuteczność szczepionki PCV13 oceniono w dużym randomizowanym, kontrolowanym badaniu klinicznym o akronimie CAPiTA (Community-Acquired Pneumonia immunization Trial in Adults), do którego włączono ponad 84 tys. osób w wieku ≥ 65 lat. Wykazano, że w badanej populacji skuteczność PCV13 w zapobieganiu IChP spowodowanej przez serotypy szczepionkowe wyniosła 75 proc., a w zapobieganiu pneumokokowemu PZP i pneumokokowemu PZP bez bakteriemii – odpowiednio 46 proc. i 45 proc.. Co więcej, dowiedziono, że skuteczność szczepionki nie zmniejsza się istotnie przez okres 4–5 lat 33. Szczepionka PCV13 była dobrze tolerowana, a najczęściej występującymi zdarzeniami niepożądanymi były reakcje w miejscu iniekcji szczepionki (zaczerwienienie, bol, ograniczony ruch ramienia) oraz uogólnione zdarzenia niepożądane (zmęczenie, bol mięśni, gorączka) 33. Skuteczność PCV13 była podobna w podgrupie osób z chorobami współistniejącymi, takimi jak: choroby serca, cukrzyca, choroba płuc 40. Wyniki badania klinicznego CAPiTA potwierdzono w badaniu przeprowadzonym w warunkach rzeczywistej praktyki klinicznej 41. Dowiedziono, że szczepienie dorosłych w wieku ≥ 65 lat za pomocą PCV13 zmniejszało ryzyko pneumokokowego PZP wymagającego hospitalizacji – wywołanego serotypami szczepionkowymi o 73 proc., a pneumokokowego PZP bez bakteriemii o 70 proc.. W badaniu tym 88 proc. pacjentów miało ≥ 1 chorobę współistniejącą, zwiększającą ryzyko zakażenia pneumokokami 41.
Od 2021 r. zarejestrowane zostały dwie nowe skoniugowane szczepionki przeciw pneumokokom, o większym pokryciu serotypowym niż PCV13: szczepionka 15-walentna (PCV15) oraz 20-walentna (PCV20). Szczepionka PCV15 pokrywa dwa dodatkowe serotypy względem PCV13 (22F i 33F), natomiast PCV20 – aż siedem dodatkowych (8, 10A, 11A, 12F, 15B, 22F, 33F). Do tej pory obie najnowsze szczepionki zarejestrowane zostały do czynnego uodparniania populacji osób dorosłych w celu zapobiegania chorobie inwazyjnej i zapaleniu płuc wywoływanym przez bakterie S. pneumoniae (tab. 3 i 4) 25, 26.


Szczepionka PCV20 a epidemiologia zakażeń pneumokokowych u dorosłych
Wprowadzenie powszechnych szczepień dzieci przeciwko pneumokokom prowadzi do obniżenia ogólnej zapadalności na IChP przy jednoczesnym stopniowym wzroście udziału zakażeń powodowanych przez serotypy, które nie znajdują pokrycia w stosowanych szczepionkach 42. Zjawisko zastępowania serotypów odnotowano już po wprowadzeniu szczepień dzieci za pomocą 7-walentnej skoniugowanej szczepionki przeciw pneumokokom (PCV7), a następnie szczepionki 13-walentnej lub 10-walentnej 43. Według danych ECDC w 2018 r. najczęściej identyfikowanymi serotypami powodującymi IChP we wszystkich grupach wiekowych były kolejno serotypy: 8, 3, 19A, 22F, 12F, 9N, 15A, 10A, 23B i 6C (ryc. 1).
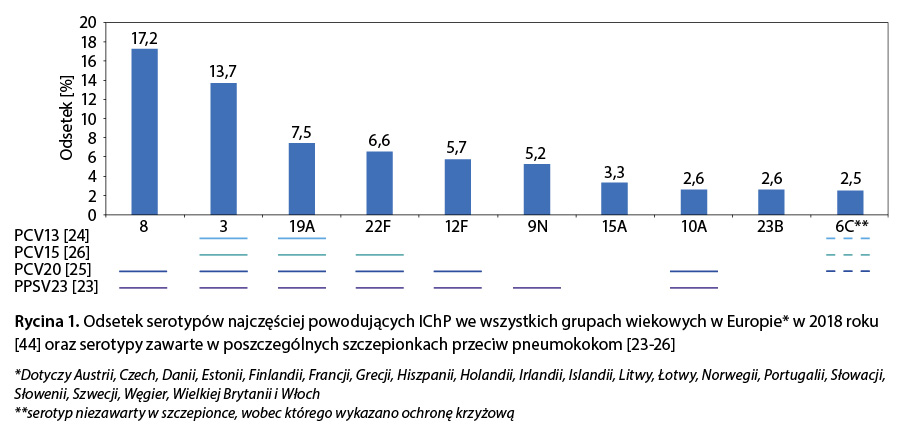
Serotypy te były przyczyną łącznie około 70 proc. przypadków IChP 44. Podobnych danych o epidemiologii zakażeń pneumokokowych w Polsce dostarcza Krajowy Ośrodek Referencyjny ds. Diagnostyki Bakteryjnych Zakażeń Ośrodkowego Układu Nerwowego (KOROUN). Według KOROUN w Polsce w 2021 r. najczęściej identyfikowanymi serotypami pneumokoków odpowiedzialnych za zakażenia inwazyjne osób w wieku > 20 lat były: 3, 4, 8, 9N, 19A, 22F, 6C, 14. Z kolei pięć serotypów najczęściej odpowiedzialnych za zgony to serotypy 3, 4, 14, 11A i 9N 45.
Zmieniająca się epidemiologia zakażeń pneumokokowych i wciąż aktualna potrzeba ochrony dorosłych przed tymi zakażeniami są bodźcem do ciągłego rozwoju skoniugowanych szczepionek przeciw pneumokokom. Siedem dodatkowych antygenów serotypów w PCV20 (8, 10A, 11A, 12F, 15B, 22F, 33F) zostało wybranych ze względu na ich stale rosnące znaczenie w epidemiologii IChP zarówno w Europie, jak i w perspektywie globalnej 44, 46. Jak przedstawiono w tabeli 4, szczepionka PCV20 ma obecnie najszersze pokrycie serotypowe spośród wszystkich dostępnych szczepionek skoniugowanych stosowanych u dorosłych. PCV20 jest jedyną szczepionką skoniugowaną wskazaną do czynnego uodparniania przed IChP i zapaleniem płuc spowodowanym serotypami 8, 12F i 10A – będącymi w pierwszej dziesiątce najczęściej identyfikowanych serotypów pneumokoków odpowiedzialnych za zakażenia inwazyjne w Europie (ryc. 1) 44. Na podstawie danych z 2018 r. z sieci Streptococcus pneumoniae Invasive Disease network (SpIDnet), finansowanej przez ECDC, oszacowano, że pokrycie serotypowe PCV20 w populacji osób w wieku ≥ 65 lat w Europie wynosi około 75 proc., podczas gdy PCV13 i PCV15, odpowiednio 45 proc. i 57 proc. 43. Z kolei na podstawie danych KOROUN z 2021 r. można oszacować, że teoretyczne pokrycie serotypowe PCV20 w populacji w wieku ≥ 20 lat w Polsce wynosi około 74 proc., a szczepionek PCV13 i PCV15 – 58 proc. i 62 proc. 45. Każdy z dodatkowych antygenów serotypowych w szczepionce PCV20 jest istotny, gdyż serotypy te są obecnie częstą przyczyną IChP w perspektywie globalnej. Dodatkowe serotypy PCV20 charakteryzują się: antybiotykoopornością (serotyp 11A, 15B, 22F, 33F) 47, 48, wywoływaniem zapalenia opon mózgowo-rdzeniowych (10A, 15B, 22F, 33F) 49, wyższym wskaźnikiem śmiertelności (wszystkie serotypy poza 12F) 21, 50 oraz wywoływaniem ognisk epidemicznych (8 i 12F) 51.
Charakterystyka szczepionki PCV20
20-walentna skoniugowana szczepionka przeciw pneumokokom (PCV20) jest szczepionką najnowszej generacji, pokrywa dodatkowe, istotne z epidemiologicznego punktu widzenia, serotypy w porównaniu z innymi szczepionkami skoniugowanymi. Poza dodatkowymi siedmioma pneumokokowymi antygenami polisacharydowymi skoniugowanymi z białkiem nośnikowym szczepionka PCV20 zawiera te same substancje pomocnicze, co szczepionka PCV13. Ponieważ skuteczność kliniczna PCV13 w populacji dorosłych została już potwierdzona, aktualnie prowadzone badania nad szczepionkami nowszej generacji dotyczą oceny bezpieczeństwa i immunogenności. Dotychczas przeprowadzone badania kliniczne PCV20 miały na celu porównanie immunogenności z PCV13 dla 13 antygenów wspólnych serotypów i z PPSV23 dla antygenów 7 dodatkowych serotypów (wspólnych z PPSV23, jednak niewystępujących w PCV13) 25.
Immunogenność szczepionki PCV20
Rejestrację PCV20 do stosowania w celu czynnej profilaktyki zakażeń pneumokokami u dorosłych poprzedziło przeprowadzenie m.in. trzech badań klinicznych, do których włączono około 6500 osób w ośrodkach w Stanach Zjednoczonych i Szwecji: badania 1007 52, 1006 53 i 1008 54. Kluczowe badanie kliniczne (1007) objęło osoby dorosłe w wieku ≥ 18 lat, które nie otrzymały w przeszłości żadnej szczepionki przeciw pneumokokom. Główną kohortę badania stanowiły osoby w wieku ≥ 60 lat, a dodatkowe dwie młodsze kohorty (18–49 lat i 50–59 lat) uwzględniono w celu oceny odpowiedzi na PCV20 w porównaniu z kohortą w wieku ≥ 60 lat. Odsetek pacjentów co najmniej z 1 czynnikiem ryzyka zakażenia pneumokokami w kohorcie w wieku ≥ 60 lat wyniósł 27 proc., a u włączonych osób najczęściej występującymi chorobami współistniejącymi były: cukrzyca typu 2, astma oraz przewlekła choroba sercowo-naczyniowa 55. W kohorcie pacjentów w wieku ≥ 60 lat zostało spełnione kryterium nie gorszego wyniku (non-inferiority) dla 19 z 20 serotypów zawartych w PCV20 ocenionej na podstawie porównania odpowiedzi immunologicznej mierzonej testem aktywności opsonofagocytarnej przeciwciał (opsonophagocytic assay – OPA). Jedynie odpowiedź immunologiczna na serotyp 8 po szczepieniu PCV20 była słabsza względem szczepionki PPSV23, jednak blisko granicy przyjętego kryterium non-inferiority – 0,49 – wobec granicy ustalonej na > 0,5 52. Znaczenie kliniczne tej obserwacji nie jest dotychczas znane. Odpowiedź na serotyp 8 była jednak silna, biorąc pod uwagę inne kryteria odpowiedzi immunologicznej 52. Ponadto, mając na uwadze cechy szczepionki skoniugowanej (zdolność do wywoływania długotrwałej pamięci immunologicznej i indukcję silniejszej odpowiedzi immunologicznej po ponownym kontakcie z danym serotypem 31), oczekuje się, że odpowiedź na serotyp 8 będzie wystarczająca do zapewnienia podobnej ochrony, takiej jak wobec pozostałych dziewiętnastu serotypów spełniających założone kryterium non-inferiority. W młodszych kohortach kryterium równoważności zostało spełnione dla wszystkich 20 serotypów w porównaniu z kohortą w wieku ≥ 60 lat. Profil bezpieczeństwa PCV20 był podobny do tego, jaki obserwowano w badaniach PCV13 z udziałem dorosłych 33, 52. Najczęściej szczepienie PCV20 wiązało się z reakcjami ogólnoustrojowymi (bólem mięśni) i reakcjami w miejscu podania szczepionki (bólem w miejscu wstrzyknięcia), które w znaczącej większości miały łagodny lub umiarkowany stopień nasilenia 52.
W badaniu 1006 wykazano silną immunogenność PCV20 u osób w wieku ≥ 65 lat, które wcześniej otrzymały szczepionkę PPSV23, PCV13 lub dwudawkowy schemat PCV13 i PPSV23 (1 dawka PCV13, 1 dawka PPSV23). Najsilniejszą odpowiedź immunologiczną na szczepienie PCV20 zaobserwowano u pacjentów wcześniej zaszczepionych PCV13 53. Z kolei w badaniu 1008 dowiedziono spójności odpowiedzi immunologicznej na szczepionkę PCV20 pochodzącą z trzech rożnych partii produkcyjnych u osób w wieku od 18 do 49 lat 54.
Najnowsze zalecenia szczepień przeciwko pneumokokom w populacji dorosłych
Szczepionka PCV20 została zarejestrowana w Stanach Zjednoczonych w połowie 2021 r. Na początku 2022 r. amerykański Komitet Doradczy ds. Szczepień (Advisory Committee on Immunization Practices – ACIP) zaktualizował rekomendacje dotyczące profilaktyki zakażeń pneumokokowych w populacji dorosłych 17. ACIP zaleca szczepienie osób w wieku ≥ 19 lat z przewlekłymi schorzeniami, uzależnionych od alkoholu lub tytoniu, z implantem ślimakowym, wyciekiem płynu mózgowo-rdzeniowego oraz osobom z obniżoną odpornością (tab. 5).
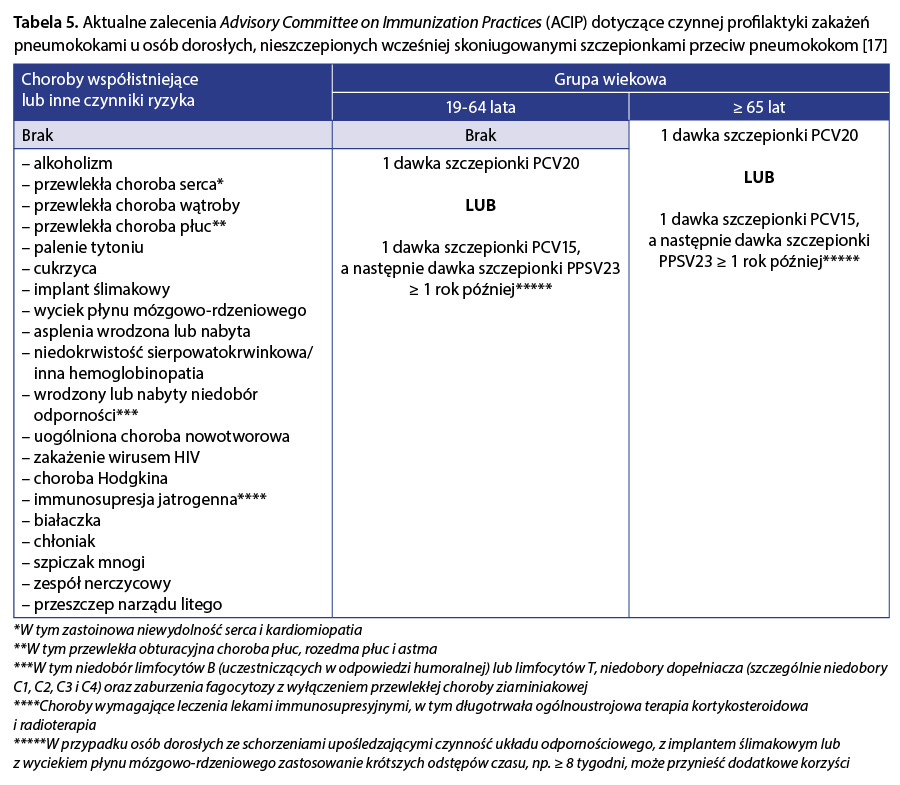
Jednocześnie zaleca się szczepienie wszystkich dorosłych w wieku ≥ 65 lat bez względu na występowanie dodatkowych czynników podwyższających ryzyko zakażenia S. pneumoniae. Po raz pierwszy ACIP rekomenduje stosowanie jednodawkowego schematu szczepień za pomocą wyłącznie szczepionki o obecnie największym pokryciu serotypowym wśród szczepionek polisacharydowych skoniugowanych – PCV20. Rutynowe podanie szczepionki PPSV23 po PCV20 nie jest wskazane, co wynika prawdopodobnie z niejasnej skuteczności PPSV23 w zapobieganiu pneumokokowemu zapaleniu płuc bez bakteriemii. Szacuje się, że dodanie szczepionki PPSV23 po szczepieniu PCV20 generowałoby wysokie koszty przy minimalnych korzyściach zdrowotnych 56, 57. Komitet rekomenduje alternatywne szczepienie sekwencyjne za pomocą 1 dawki szczepionki PCV15, po którym wymagane jest uzupełnienie 1 dawką szczepionki PPSV23 w odpowiednim odstępie czasowym (tab. 5). W przypadku osób z obniżoną odpornością, implantem ślimakowym lub wyciekiem płynu mózgowo-rdzeniowego zaleca się zachowanie krótszego odstępu czasu do podania PPSV23 (tj. co najmniej 8 tygodni), a w pozostałych przypadkach co najmniej 12 miesięcy. W ten sposób minimalizowane jest ryzyko zakażenia pneumokokami o serotypach, których antygeny występują wyłącznie w szczepionce PPSV23, osób obciążonych wysokim ryzykiem zakażenia. Dokument sporządzony przez ACIP wskazuje także zalecane schematy szczepień, w zależności od dotychczasowej historii szczepiennej pacjenta. Dorośli, którzy otrzymali w przeszłości tylko szczepienie PPSV23, mogą otrzymać szczepienie skoniugowaną szczepionką PCV (PCV20 lub PCV15) po upływie co najmniej roku od ostatniej dawki PPSV23. W przypadku osób dorosłych, które otrzymały PCV13, ale nie ukończyły zalecanej serii szczepień przeciwko pneumokokom z PPSV23, można zastosować jedną dawkę szczepionki PCV20, jeśli szczepionka PPSV23 nie jest dostępna 17. W ocenie ACIP, u pacjentów, którzy zakończyli cykl szczepienia z użyciem PCV13 i PPSV23, nie jest wymagane doszczepienie. Najnowsze wytyczne ACIP znacząco upraszczają zasady szczepień przeciw pneumokokom w populacji dorosłych. Oczekuje się, że dzięki temu zwiększy się wyszczepialność tej grupy wiekowej, co przełoży się na efektywne zapobieganie chorobom pneumokokowym 17.
Schemat podania sekwencyjnego (dwudawkowy) może nieść ryzyko zaniechania przez pacjenta zgłoszenia się na szczepienie uzupełniające, które powinno nastąpić po ściśle określonym czasie. Ponadto zastosowanie schematu dwudawkowego może nie być możliwe do zrealizowania w optymalnym czasie z uwagi na specyfikę schorzenia i stosowane lub planowane leczenie. Taka sytuacja ma miejsce np. w przypadku pacjentów z chorobami układowymi tkanki łącznej, jak reumatoidalne zapalenie stawów, toczeń rumieniowaty układowy lub układowe zapalenia naczyń, u których stosowane są leki immunosupresyjne. Zalecenia dotyczące szczepień w tej grupie chorych wskazują z jednej strony, żeby szczepienie optymalnie nie było wykonywane w czasie dużej aktywności choroby, z drugiej strony stosowane leczenie (jak glikokortykosteroidy, metotreksat lub – w największym stopniu – rytuksymab) może osłabić efektywność szczepienia 58. Dostępność szczepionki umożliwiającej jej zastosowanie w schemacie jednodawkowym zwiększa szansę tych pacjentów na skuteczną profilaktykę.
Profilaktyka chorób pneumokokowych u osób dorosłych w Polsce
Czynna profilaktyka zakażeń pneumokokami w populacji dorosłych jest zalecana w Programie Szczepień Ochronnych (PSO) na rok 2022. PSO zaleca szczepienia osób dorosłych, u których występują czynniki zwiększające ryzyko zakażenia S. pneumoniae 59. Szczepienia, które wymienione są w PSO jako zalecane, nie są jednak finansowane z budżetu Ministerstwa Zdrowia (MZ).
Od stycznia 2022 r. w ramach refundacji aptecznej dostępna jest szczepionka PCV13 z 50 proc. odpłatnością w populacji pacjentów w wieku ≥ 65. roku życia, u których występuje zwiększone (umiarkowane do wysokiego) ryzyko choroby pneumokokowej 60. Do refundacji szczepionki uprawnione są osoby, które spełniają kryterium wieku i u których występuje co najmniej jeden z następujących czynników ryzyka zakażenia: przewlekła choroba serca, przewlekła choroba wątroby, przewlekła choroba płuc, cukrzyca, implant ślimakowy, wyciek płynu mózgowo- rdzeniowego, wrodzona lub nabyta asplenia, niedokrwistość sierpowata i inne hemoglobinopatie, przewlekła niewydolność nerek, wrodzony lub nabyty niedobór odporności, uogólniona choroba nowotworowa, zakażenie wirusem HIV, choroba Hodgkina, jatrogenna immunosupresja, białaczka, szpiczak mnogi, przeszczep narządu litego 60. Refundacja szczepionki w tej populacji osób zwiększa jej dostępność dla pacjentów najbardziej narażonych na zakażenia S. pneumoniae.
Bezpłatne szczepienia przeciwko pneumokokom realizowane są także przez niektóre jednostki samorządów terytorialnych. Od 2016 do czerwca 2022 r. Agencja Oceny Technologii Medycznych i Taryfikacji poddała ocenie 36 programów polityki zdrowotnej, spośród których zdecydowana większość (82 proc.) poświęcona jest osobom z populacji ogólnej w wieku ≥ 55 lat. Pomimo wprowadzenia refundacji aptecznej szczepionki PCV13 w 2022 r. dwie gminy złożyły projekty programów profilaktyki zakażeń pneumokokowych w populacji ogólnej mieszkańców w wieku ≥ 65 lat. W przypadku dużego zainteresowania szczepionka będzie w pierwszej kolejności podawana osobom z czynnikami ryzyka zakażenia S. pneumoniae 61.
Rekomendacja profilaktyki zakażeń pneumokokowych w czasie pandemii COVID-19
W związku z wybuchem pandemii COVID-19 (coronavirus disease 2019) w marcu 2020 r., Światowa Organizacja Zdrowia (World Health Organization – WHO) wydała zalecenia dotyczące realizacji szczepień ochronnych. WHO podkreśla, że realizacja szczepień przeciwko pneumokokom i grypie sezonowej w grupach osób o zwiększonym ryzyku zarażenia powinna być realizowana priorytetowo. W zaleceniach WHO przekazuje jasny komunikat, że realizacja szczepień ochronnych jest kluczowym świadczeniem zdrowotnym w czasie pandemii COVID-19 62. Polskie Ministerstwo Zdrowia (MZ) wraz z Głównym Inspektoratem Sanitarnym (GIS), w ślad za WHO, wydały podobne rekomendacje, co przemawia za zasadnością szczepień. MZ wraz z GIS rekomendują upowszechnienie szczepień przeciw pneumokokom i grypie u osób z grup ryzyka, w tym osób w wieku ≥ 60 lat z chorobami przewlekłymi płuc, układu krążenia, nowotworami, cukrzycą, niewydolnością nerek i zaburzeniami odporności. Jak wskazywane jest w rekomendacji, osoby obciążone tymi schorzeniami są szczególnie narażone na zapalenie płuc 63. Holenderskie i hiszpańskie służby zdrowia dostrzegły potrzebę profilaktyki zakażeń pneumokokowych u osób, które w przeszłości były hospitalizowane z powodu COVID-19 64, 65.
Podsumowanie
Zakażenia pneumokokowe w populacji dorosłych pozostają istotnym problemem zdrowotnym. Ryzyko zakażenia S. pneumoniae osób dorosłych zwiększa się wraz z wiekiem lub występowaniem innych czynników sprzyjających zakażeniom, tj. chorób przewlekłych, stanów obniżających odporność oraz określonych czynników środowiskowych. W populacji dorosłych pneumokoki są przede wszystkim przyczyną zapaleń płuc, które stanowią znaczne obciążenie dla systemu opieki zdrowotnej i niosą poważne konsekwencje zdrowotne dla chorych. Zakażenia inwazyjne S. pneumoniae – chociaż nie tak częste jak zapalenia płuc bez bakteriemii – są stanami wiążącymi się z ciężkimi powikłaniami, w tym ze zgonem, szczególnie w grupie seniorów. Zmieniające się rozpowszechnienie serotypów pneumokokowych w populacji jest bodźcem do rozwoju następnych generacji szczepionek. Spośród dostępnych obecnie szczepionek skoniugowanych przeciwko pneumokokom szczepionka PCV20 zapewnia najszersze pokrycie serotypowe zarówno w Europie, jak i w Polsce. W przeprowadzonych badaniach klinicznych udokumentowano immunogenność PCV20 na poziomie porównywalnym z zarejestrowanymi dotychczas szczepionkami (PCV13 i PPSV23). Przewagą szczepionek skoniugowanych (w tym PCV20) w stosunku do nieskoniugowanych jest wytworzenie pamięci immunologicznej i silnej odpowiedzi po podaniu dawki przypominającej (tzw. efekt boosterowy). Jak opisano powyżej, szczepionka PCV20 zawiera antygeny ważnych epidemiologicznie serotypów, dlatego ocenia się, że stanowi ona dobrą odpowiedź na aktualną sytuację epidemiologiczną w Polsce oraz w ujęciu europejskim i globalnym. W najnowszych amerykańskich zaleceniach profilaktyki zakażeń pneumokokowych w populacji dorosłych rekomendowane jest podanie jednej dawki PCV20 albo zastosowanie schematu dwudawkowego (PCV15 + PPSV23). Wprowadzenie schematu jednodawkowego z użyciem PCV20 będzie dużym uproszczeniem realizacji szczepień w praktyce, co może pozytywnie wpłynąć na wyszczepialność.
Wprowadzenie w Polsce od 2022 r. refundacji aptecznej szczepionki PCV13 z 50 proc. odpłatnością dla osób w wieku ≥ 65 lat i co najmniej z umiarkowanymi czynnikami ryzyka zakażenia pneumokokami zwiększyło dostęp do szczepień najbardziej narażonej populacji. Jednocześnie w świetle obecnej epidemiologii zakażeń pneumokokowych i najnowszych zaleceń w Polsce wciąż istnieje potrzeba zwiększania dostępu do nowoczesnej profilaktyki zakażeń.
Autorzy tekstu to:
– Jacek Wysocki z Katedry i Zakład Profilaktyki Zdrowotnej, Wydział Nauk o Zdrowiu, Uniwersytet Medyczny w Poznaniu
– Adam Antczak z Kliniki Pulmonologii Ogólnej i Onkologicznej Uniwersytetu Medycznego w Łodzi,
– Joanna Chorostowska-Wynimko z Zakładu Genetyki i Immunologii Klinicznej Instytutu Gruźlicy i Chorób Płuc w Warszawie,
– Leszek Czupryniak z Kliniki Diabetologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego,
– Andrzej Fal z Kliniki Alergologii, Chorób Płuc i Chorób Wewnętrznych Centralnego Szpitala Klinicznego MSWiA w Warszawie i Wydziału Medycznego Collegium Medicum Uniwersytetu Kardynała Stefana Wyszyńskiego w Warszawie,
– Robert Flisiak z Kliniki Chorób Zakaźnych i Hepatologii Uniwersytetu Medycznego w Białymstoku,
– Ernest Kuchar z Kliniki Pediatrii z Oddziałem Obserwacyjnym Warszawskiego Uniwersytetu Medycznego,
– Artur Mamcarz z III Kliniki Chorób Wewnętrznych i Kardiologii Wydziału Lekarskiego Warszawskiego Uniwersytetu Medycznego,
– Aneta Nitch-Osuch z Zakładu Medycyny Społecznej i Zdrowia Publicznego Warszawskiego Uniwersytetu Medycznego,
– Marcin Stajszczyk z Oddziału Reumatologii i Chorób Autoimmunologicznych Śląskiego Centrum Reumatologii, Ortopedii i Rehabilitacji w Ustroniu,
– Michał Abendrot z Pfizer Polska Sp. z o.o.,
– Dominik Golicki z Katedry i Zakładu Farmakologii Doświadczalnej i Klinicznej Warszawskiego Uniwersytetu Medycznego i HealthQuest Sp. z o.o.,
– Katarzyna Jaśkowiak z HealthQuest Sp. z o.o.,
– Anna Skoczyńska z Krajowego Ośrodka Referencyjnego ds. Diagnostyki Bakteryjnych Zakażeń Ośrodkowego Układu Nerwowego (KOROUN) i Zakładu Epidemiologii i Mikrobiologii Klinicznej Narodowego Instytutu Leków w Warszawie.
Oświadczenie o potencjalnym konflikcie interesów: JW – brak konfliktu interesów; AA – brak konfliktu interesów; JCW – udział w radzie doradczej (Pfizer); LC – brak konfliktu interesów; AF – udział w radach doradczych (AstraZeneca, Chiesi, Meda, Novartis, Pfizer, Polpharma, PhytoPharm), honoraria za wykłady (Adamed, AstraZeneca, Boehringer Ingelheim, Chiesi, Klosterfrau, Meda, MSD, Novartis, Nycomed, Pfizer, PhytoPharm, Polpharmex, Sandoz, Schering Plough, TEVA); RF – udział w radach doradczych (Abbvie, Gilead, MSD, Roche, Pfizer), honoraria za wykłady (Abbvie, Gilead, MSD); EK – honoraria za wykłady (Pfizer, Sanofi Pasteur, GSK); AM – Pfizer; ANO – brak konfliktu interesów; MS – udział w radzie doradczej (Pfizer); MA – pracownik firmy Pfizer; AS – udział w radach doradczych (MSD, Pfizer, Sanofi Pasteur), honoraria za wykłady (Pfizer), granty dla instytucji, w której pracuje (MSD, Pfizer).
Opracowanie powstało przy wsparciu pisarzy medycznych, Katarzyny Jaśkowiak i Dominika Golickiego z firmy HealthQuest sp. z o.o., i zostało sfinansowane ze środków Pfizer Polska sp. z o.o.
Piśmiennictwo:
1. Shoar S, Musher DM. Etiology of community-acquired pneumonia in adults: a systematic review. Pneumonia (Nathan) 2020; 12: 11.
2. Welte T, Torres A, Nathwani D. Clinical and economic burden of community-acquired pneumonia among adults in Europe. Thorax 2012; 67: 71-79.
3. European Centre for Diseases Prevention and Control. Surveillance Atlas of Infectious Diseases: invasive pneumococcal diseases in 2020. https://atlas.ecdc.europa. eu/public/index.aspx. Dostęp: 24.05.2022.
4. Pallotta A, Rehm SJ. Navigating pneumococcal vaccination in adults. Cleve Clin J Med 2016; 83: 427-433.
5. Said MA, Johnson HL, Nonyane BA i wsp. Estimating the burden of pneumococcal pneumonia among adults: a systematic review and meta-analysis of diagnostic techniques. PLoS One 2013; 8: e60273.
6. Brandenburg JA, Marrie TJ, Coley CM i wsp. Clinical presentation, processes and outcomes of care for patients with pneumococcal pneumonia. J Gen Intern Med 2000; 15: 638-646.
7. Klein EY, Monteforte B, Gupta A i wsp. The frequency of influenza and bacterial coinfection: a systematic review and meta-analysis. Influenza Other Respir Viruses 2016; 10: 394-403.
8. European Respiratory Society. European Lung White Book. Chapter 18: Acute lower respiratory infections. https://www.erswhitebook.org/. Dostęp: 9.06.2022.
9. Jaśkowiak K, Dudzisz A, Golicki D. Zapalenia płuc u osob dorosłych w Polsce – pneumokokowe zapalenia płuc i ich profilaktyka. Lekarz POZ 2021; 7: 2.
10. Hryniewicz W, Albrecht P, Radzikowski A (red.). Rekomendacje postępowania w pozaszpitalnych zakażeniach układu oddechowego. Narodowy Instytut Lekow, Warszawa 2017.
11. Wyrwich KW, Yu H, Sato R i wsp. Observational longitudinal study of symptom burden and time for recovery from community-acquired pneumonia reported by older adults surveyed nationwide using the CAP. Burden of Illness Questionnaire. Patient Relat Outcome Meas 2015: 6: 215-223.
12. Ruiz LA, Serrano L, Espana PP i wsp. Factors influencing long-term survival after hospitalization with pneumococcal pneumonia. J Infect 2019; 79: 542-549.
13. Shea KM, Edelsberg J, Weycker D i wsp. Rates of pneumococcal disease in adults with chronic medical conditions. Open Forum Infect Dis 2014; 1: ofu024.
14. Krone CL, van de Groep K, Trzciński K i wsp. Immunosenescence and pneumococcal disease: an imbalance in host-pathogen interactions. Lancet Respir Med 2014; 2: 141-153.
15. Weiskopf D, Weinberger B, Grubeck-Loebenstein B. The aging of the immune system. Transpl Int 2009; 22: 1041-1050.
16. Steens A, Vestrheim DF, Aaberge IS i wsp. A review of the evidence to inform pneumococcal vaccine recommendations for risk groups aged 2 years and older. Epidemiol Infect 2014; 142: 2471-2482.
17. Kobayashi M, Farrar JL, Gierke R i wsp. Use of 15-Valent Pneumococcal Conjugate Vaccine and 20-Valent Pneumococcal Conjugate Vaccine Among U.S. Adults: Updated Recommendations of the Advisory Committee on Immunization Practices — United States, 2022. MMWR Morb Mortal Wkly Rep 2022; 71: 109–117.
18. Greene CM, Kyaw MH, Ray SM i wsp. Active Bacterial Core Surveillance Program of the Emerging Infections Program Network. Preventability of invasive pneumococcal disease and assessment of current polysaccharide vaccine recommendations for adults: United States, 2001-2003. Clin Infect Dis 2006; 43: 141-150.
19. Centers for Disease Control and Prevention. Prevention of pneumococcal infections secondary to seasonal and 2009 H1N1 influenza viruses infection. http://www.cdc. gov/h1n1flu/vaccination/provider/provider_pneumococcal. htm. Dostęp: 6.06.2022.
20. Kupronis BA, Richards CL, Whitney CG; Active Bacterial Core Surveillance Team. Invasive pneumococcal disease in older adults residing in long-term care facilities and in the community. J Am Geriatr Soc 2003; 51: 1520-1525.
21. van Hoek AJ, Andrews N, Waight PA i wsp. The effect of underlying clinical conditions on the risk of developing invasive pneumococcal disease in England. J Infect 2012; 65: 17-24.
22. Centers for Disease Control and Prevention. CDC Yellow Book 2020; Immunocompromised Travelers. https://wwwnc.cdc.gov/travel/yellowbook/2020/travelers- with-additional-considerations/immunocompromised- travelers. Dostęp: 17.06.2022.
23. Charakterystyka Produktu Leczniczego Pneumovax23R.
24. Charakterystyka Produktu Leczniczego Prevenar13R.
25. Charakterystyka Produktu Leczniczego ApexxnarR.
26. Charakterystyka Produktu Leczniczego VaxneuvanceR.
27. Matanock A, Lee G, Gierke R i wsp. Use of 13-Valent Pneumococcal Conjugate Vaccine and 23-Valent Pneumococcal Polysaccharide Vaccine Among Adults Aged ≥ 65 Years: Updated Recommendations of the Advisory Committee on Immunization Practices. MMWR Morb Mortal Wkly Rep 2019; 68: 1069-1075. Erratum in: MMWR Morb Mortal Wkly Rep 2020; 68: 1195.
28. Centers for Disease Control and Prevention. Types and Composition of Pneumococcal Vaccines. https://www. cdc.gov/vaccines/vpd/pneumo/hcp/about-vaccine. html. Dostęp: 24.05.2022.
29. Moberley S, Holden J, Tatham DP, Andrews RM. Vaccines for preventing pneumococcal infection in adults. Cochrane Database Syst Rev 2013: CD000422.
30. Niederman MS, Folaranmi T, Buchwald UK i wsp. Efficacy and effectiveness of a 23-valent polysaccharide vaccine against invasive and noninvasive pneumococcal disease and related outcomes: a review of available evidence. Expert Rev Vaccines; 20: 243-256.
31. Pollard AJ, Perrett KP, Beverley PC. Maintaining protection against invasive bacteria with protein-polysaccharide conjugate vaccines. Nat Rev Immunol 2009; 9: 213-220.
32. Schmoele-Thoma B, Jackson LA, Greenberg RN i wsp. Immunogenicity of 13-valent pneumococcal conjugate vaccine in immunocompetent older adults with stable underlying medical conditions. J Vaccines Immun 2015, 3: 7-12.
33. Bonten MJ, Huijts SM, Bolkenbaas M i wsp. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med 2015; 372: 1114-1125. 34. van Werkhoven CH, Huijts SM, Bolkenbaas M i wsp. The impact of age on the efficacy of 13-valent pneumococcal conjugate vaccine in elderly. Clin Infect Dis 2015; 61: 1835-1838.
35. Centers for Disease Control and Prevention. Pneumococcal Disease, Surveillance & Reporting. https://www. cdc.gov/pneumococcal/surveillance.html. Dostęp: 24.05.2022.
36. Desai AP, Sharma D, Crispell EK i wsp. Decline in pneumococcal nasopharyngeal carriage of vaccine serotypes after the introduction of the 13-valent pneumococcal conjugate vaccine in children in Atlanta, Georgia. Pediatr Infect Dis J 2015; 34: 1168–1174.
37. van Deursen AMM, van Houten MA, Webber C i wsp. The Impact of the 13-Valent Pneumococcal Conjugate Vaccine on Pneumococcal Carriage in the Community Acquired Pneumonia Immunization Trial in Adults (CAPiTA) Study. Clin Infect Dis 2018; 67: 42-49.
38. Herva E, Luotenen J, Timonen M i wsp. The effect of polyvalent pneumococcal polysaccharide vaccine on nasopharyngeal and nasal carriage of streptococcus pneumoniae. Scand J Inf Dis 1980; 12: 97–100.
39. European Medicines Agency. Summary of positive opinion for Prevenar 13. Londyn, 2009. https://www. ema.europa.eu/en/documents/smop-initial/chmp- -summary-positive-opinion-prevenar-13_en.pdf. Dostęp: 8.06.2022.
40. Suaya JA, Jiang Q, Scott DA i wsp. Post hoc analysis of the efficacy of the 13-valent pneumococcal conjugate vaccine against vaccine-type community-acquired pneumonia in at-risk older adults. Vaccine 2018; 36: 1477-1483.
41. McLaughlin JM, Jiang Q, Isturiz RE i wsp. Effectiveness of 13-Valent Pneumo-coccal Conjugate Vaccine Against Hospitalization for Community-Acquired Pneumonia in Older US Adults: A Test-Negative Design. Clin Infect Dis 2018; 67: 1498-1506.
42. Andrews N, Kent A, Amin-Chowdhury Z i wsp. Effectiveness of the seven-valent and thirteen-valent pneumococcal conjugate vaccines in England: the indirect cohort design, 2006-2018. Vaccine 2019; 37: 4491-4498.
43. Hanquet G, Krizova P, Dalby T i wsp. Serotype Replacement after Introduction of 10-Valent and 13-Valent Pneumococcal Conjugate Vaccines in 10 Countries, Europe. Emerg Infect Dis 2022; 28: 137-138.
44. European Centre for Diseases Prevention and Control. Annual epidemiological report for 2018. Stockholm: ECDC; 2020. https://www.ecdc.europa.eu/en/publications- data/invasive-pneumococcal-disease-annualepidemiological- report-2018. Dostęp: 24.05.2022.
45. Skoczyńska A, Wrobel-Pawelczyk I, Gołębiewska A i wsp. Inwazyjna choroba pneumokokowa w Polsce w 2021 roku (dane KOROUN), 2022. http://koroun.nil. gov.pl/dane-epidemiologiczne/. Dostęp: 26.05.2022.
46. Balsells E, Guillot L, Nair H i wsp. Serotype distribution of Streptococcus pneumoniae causing invasive disease in children in the post-PCV era: A systematic review and meta-analysis. PLoS One 2017; 12: e0177113.
47. Metcalf BJ, Gertz RE Jr, Gladstone RA i wsp. Active Bacterial Core surveillance team. Strain features and distributions in pneumococci from children with invasive disease before and after 13-valent conjugate vaccine implementation in the USA. Clin Microbiol Infect 2016; 22: 60.e9-60.e29.
48. Tomczyk S, Lynfield R, Schaffner W i wsp. Prevention of Antibiotic-Nonsusceptible Invasive Pneumococcal Disease With the 13-Valent Pneumococcal Conjugate Vaccine. Clin Infect Dis 2016; 62: 1119-1125.
49. Olarte L, Barson WJ, Barson RM i wsp. Impact of the 13-Valent Pneumococcal Conjugate Vaccine on Pneumococcal Meningitis in US Children. Clin Infect Dis 2015; 61: 767-775.
50. Oligbu G, Collins S, Sheppard CL i wsp. Childhood Deaths Attributable to Invasive Pneumococcal Disease in England and Wales, 2006-2014. Clin Infect Dis 2017; 65: 308-314.
51. Zivich PN, Grabenstein JD, Becker-Dreps SI i wsp. Streptococcus pneumoniae outbreaks and implications for transmission and control: a systematic review. Pneumonia (Nathan) 2018; 10: 11.
52. Essink B, Sabharwal C, Cannon K i wsp. Pivotal Phase 3 Randomized Clinical Trial of the Safety, Tolerability, and Immunogenicity of 20-Valent Pneumococcal Conjugate Vaccine in Adults 18 Years and Older. Clin Infect Dis 2021: ciab990.
53. Cannon K, Elder C, Young M i wsp. A trial to evaluate the safety and immunogenicity of a 20-valent pneumococcal conjugate vaccine in populations of adults ≥ 65 years of age with different prior pneumococcal vaccination. Vaccine 2021; 39: 7494-7502.
54. Klein NP, Peyrani P, Yacisin K i wsp. A phase 3, randomized, double-blind study to evaluate the immunogenicity and safety of 3 lots of 20-valent pneumococcal conjugate vaccine in pneumococcal vaccine-naive adults 18 through 49 years of age. Vaccine. 2021; 39: 5428-5435.
55. European Medicines Agency. Committee for Medicinal Products for Human Use (CHMP). Assessment report. Apexxnar. EMA/12384/2022. https://www.ema. europa.eu/en/documents/assessment-report/apexxnar- epar-public-assessment-report_en.pdf. Dostęp: 8.06.2022.
56. Stoecker C. Spotkanie Advisory Committee on Immunization Practices (ACIP), czerwiec 2021. https:// www.cdc.gov/vaccines/acip/meetings/downloads/ slides-2021-06/03-Pneumococcal-Stoecker-508.pdf. Dostęp: 8.06.2022.
57. Leidner AJ. Spotkanie Advisory Committee on Immunization Practices (ACIP), wrzesień 2021. https:// www.cdc.gov/vaccines/acip/meetings/downloads/ slides-2021-09-29/02-Pneumococcal-Leidner-508.pdf. Dostęp: 8.06.2022.
58. Furer V, Rondaan C, Heijstek MW i wsp. 2019 update of EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis 2020; 79: 39-52.
59. Główny Inspektorat Sanitarny. Program Szczepień Ochronnych na rok 2022. https://www.gov.pl/web/gis/ program-szczepien-ochronnych-na-rok-2022. Dostęp: 8.06.2022.
60. Obwieszczenie Ministra Zdrowia z dnia 20 grudnia 2021 r. w sprawie wykazu refundowanych lekow, środkow spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobow medycznych na 1 stycznia 2022 r. https://www.gov.pl/web/zdrowie/obwieszczeniaministra- zdrowia-lista-lekow-refundowanych. Dostęp: 8.06.2022.
61. Agencja Oceny Technologii Medycznych i Taryfikacji. Biuletyn informacji publicznej. Opinie do programow polityki zdrowotnej. https://bipold.aotm.gov.pl/index. php/repozytorium-ppz-2/opinie-o-projektachprogramow- zdrowotnych-realizowanych-przez-jst. Dostęp 8.06.2022.
62. Ministerstwo Zdrowia. Komunikat w sprawie wykonywania szczepień ochronnych w czasie pandemii COVID-19. https://www.gov.pl/web/zdrowie/komunikat- sprawie-wykonywania-szczepien-ochronnych-wczasie- pandemii-covid-19. Dostęp: 9.06.2022.
63. World Health Organization. Guidance on routine immunization services during COVID-19 pandemic in the WHO European Region. https://apps.who.int/iris/ handle/10665/334123. Dostęp: 9.06.2022.
64. Zorginstituut Nederland https://www.zorginstituutnederland. nl/publicaties/adviezen/2021/03/03/gvsadvies- 13-valent-pneumokokkenconjugaat-vaccinprevenar13. Dostęp: 9.06.2022.
65. Junta de Andalucia. https://www.juntadeandalucia.es/ export/drupaljda/instruccion_vacunacion_neumococica_ pacientes_post_covid_grave_26-11-2020-F.pdf. Dostęp: 9.06.2022.
Artykuł opublikowano w „Lekarzu POZ” 4/2022.
Przeczytaj także: „Ospa małpia – czy to nowa pandemia?”.

Bakterie Streptococcus pneumoniae (S. pneumoniae – dwoinka zapalenia płuc) są istotną przyczyną zachorowalności i umieralności osób dorosłych, w tym jedną z głównych przyczyn pozaszpitalnego zapalenia płuc (PZP) 1, 2. Inwazyjna choroba pneumokokowa (IChP) obejmuje ciężkie zakażenia pneumokokowe, w których dochodzi do przedostania się bakterii do pierwotnie jałowych miejsc, np. płynów ustrojowych. IChP może przebiegać pod postacią zapalenia płuc z bakteriemią, sepsy i zapalenia opon mózgowo-rdzeniowych, które wciąż stanowią poważny problem zdrowotny cechujący się wysoką śmiertelnością. Według danych Europejskiego Centrum ds. Zapobiegania i Kontroli Chorób (European Centre for Diseases Prevention and Control – ECDC) w 2019 r. (przed wybuchem pandemii COVID-19) odnotowano 23 tys. potwierdzonych przypadków IChP w krajach Unii Europejskiej/Europejskiego Obszaru Gospodarczego. Potwierdzone przypadki choroby najczęściej występowały wśród dzieci w wieku poniżej roku (13,5/100 tys.) i dorosłych w wieku powyżej 65 lat (16,7/100 tys.) 3.
Szacuje się, że pneumokokowe zapalenie płuc jest odpowiedzialne za mniej więcej 98 proc. obciążenia chorobami pneumokokowymi osób w wieku ≥ 50 lat 4. Zapalenie płuc jest niejednorodną jednostką chorobową o zmiennym obrazie klinicznym i etiologii. U osób dorosłych w większości przypadków (75 proc.) pneumokokowe PZP (pPZP) ma postać zakażenia nieinwazyjnego 5. Pozostałe 25 proc. przypadków stanowią zapalenia płuc z bakteriemią, które wiążą się z ciężkim przebiegiem, dłuższym czasem powrotu do zdrowia i większym ryzykiem zgonu 6. Pneumokokowe PZP jest także najczęstszym ciężkim powikłaniem zakażeń wirusowych. Zakażenie pneumokokami wykrywane jest u około 35 proc. chorych hospitalizowanych z powodu zapalenia płuc pierwotnie wywołanego przez wirusa grypy 7. Zapalenia płuc osób dorosłych stanowią istotne obciążenie systemów opieki zdrowotnej na całym świecie. Szacuje się, że odsetek dorosłych pacjentów z PZP wymagających hospitalizacji może wynosić od 20 proc. do 50 proc. w zależności od kraju 8. Według danych Narodowego Funduszu Zdrowia w 2019 r. w warunkach ambulatoryjnych leczono około 374,4 tys. dorosłych z powodu PZP, a 54,9 tys. hospitalizowano 9. Dokładne oszacowanie częstości przypadków PZP spowodowanych S. pneumoniae jest trudne. Zapalenie płuc leczone jest empirycznie zaraz po postawieniu diagnozy, najczęściej bez konieczności określenia etiologii zakażenia 10. Według badań obserwacyjnych przeprowadzonych w okresie ostatnich dwóch dekad (lata 1999–2020) odsetek przypadków PZP spowodowanych S. pneumoniae wynosi od 33 proc. do 48 proc. przypadków o znanej etiologii 1. Podana częstość pneumokokowych PZP nie uwzględnia jednak przypadków leczonych ambulatoryjnie. Obciążenie pneumokokowym PZP osób dorosłych jest więc z dużym prawdopodobieństwem niedoszacowane. Zapalenie płuc pociąga za sobą wiele następstw zdrowotnych, takich jak podwyższone ryzyko zgonu, zaostrzenie czy dekompensacja choroby podstawowej i pogorszenie ogólnej jakości życia 11, 12.
Grupy ryzyka zakażeń
Podstawowym czynnikiem ryzyka zakażenia S. pneumoniae jest zaawansowany wiek, który w zależności od źródła określany jest jako powyżej 50. lub 65. roku życia 13. Zmiany związane ze starzeniem się układu odpornościowego oraz istotnie częstsze występowanie chorób współistniejących wśród osób starszych przyczyniają się do zwiększonej podatności na zakażenia 14, 15. Częstość pneumokokowego zapalenia płuc wśród osób zdrowych w wieku ≥ 65 lat jest niemal 5-krotnie większa względem częstości obserwowanej u osób w wieku od 18 do 49 lat 13. Choroba przewlekła, bez względu na wiek pacjenta, zwiększa ryzyko wystąpienia zakażenia pneumokokami w porównaniu z osobami zdrowymi. Właśnie dlatego osoby dorosłe z przewlekłą chorobą serca, płuc, wątroby, cukrzycą są w tzw. grupie umiarkowanego ryzyka zakażenia pneumokokami 16 (tab. 1).

Trzeba jednak pamiętać, że współwystępowanie kilku czynników umiarkowanego ryzyka kilkukrotnie zwiększa ryzyko wystąpienia zakażenia S. pneumoniae względem osoby dorosłej w tym samym wieku 13. Niezdrowe zachowania – takie jak palenie papierosów oraz nadużywanie alkoholu – również zwiększają ryzyko zakażenia S. pneumoniae 17. Przykładowo, ryzyko wystąpienia IChP wśród palaczy w wieku od 18 do 64 lat jest ponad dwukrotnie większe niż wśród osób niepalących w tym samym wieku 18. Istotny wpływ na zwiększenie ryzyka zakażenia pneumokokami mają także czynniki środowiskowe, w tym wcześniejsze zakażenie wirusem grypy 19 lub przebywanie w placówkach opieki długoterminowej 20.
Najwyższe ryzyko zakażenia pneumokokami dotyczy osób z zaburzeniami układu odpornościowego, tj. osób dorosłych z immunosupresją spowodowaną wrodzonymi lub nabytymi niedoborami odporności, zakażeniem wirusem HIV, przewlekłą niewydolnością nerek, zespołem nerczycowym, białaczkami, chłoniakami, chorobą Hodgkina, uogólnionym nowotworem złośliwym oraz przeszczepem narządów litych 21. Osoby przyjmujące leczenie immunosupresyjne (tzw. jatrogenna immunosupresja) również są w grupie wysokiego ryzyka zakażenia 17. Leki immunosupresyjne stosowane są m.in. w schorzeniach reumatologicznych lub onkologicznych i stanowią bardzo zróżnicowaną grupę substancji, do której zaliczamy m.in. doustne kortykosteroidy czy rytuksymab 22. Wysokie ryzyko zakażenia pneumokokami związane jest również z wyciekiem płynu mózgowo-rdzeniowego i stanem po wszczepieniu implantu ślimakowego 16.
Szczepionka polisacharydowa a szczepionki skoniugowane przeciw pneumokokom
Obecnie dostępne są dwa rodzaje szczepionek przeciwko pneumokokom: szczepionka polisacharydowa (pneumococcal polysaccharide vaccine – PPSV lub PPV) 23 oraz szczepionki polisacharydowe skoniugowane (pneumococcal conjugate vaccine – PCV) 24–26. Ze względu na różną zawartość antygenów polisacharydowych szczepionek, w literaturze ich nazwy podaje się poprzez oznaczenie typu i walentności danej szczepionki. Na przykład PCV13 to szczepionka 13-walentna polisacharydowa skoniugowana (pneumococcal conjugate vaccine, 13-valent – PCV13).
Nieskoniugowana szczepionka polisacharydowa przeciw pneumokokom dostępna jest na rynku od około 40 lat 27. W kontekście szczepień dorosłych ma ona wiele ograniczeń w porównaniu ze szczepionkami skoniugowanymi, z których najważniejszymi są brak wzbudzania pamięci immunologicznej, względnie krótki czas trwania ochrony oraz konieczność powtarzania szczepienia (tab. 2).

Odpowiedź immunologiczna na szczepionkę polisacharydową osób starszych, z określonymi chorobami przewlekłymi lub zaburzeniami odporności jest mniejsza niż osób zdrowych 28. O ile skuteczność szczepionki polisacharydowej u dorosłych w zapobieganiu inwazyjnym postaciom zakażenia pneumokokami została potwierdzona 29, to skuteczność w zapobieganiu zakażeniom nieinwazyjnym jest niejednoznaczna 30. Połączenie polisacharydu pneumokoka z białkiem nośnikowym w szczepionkach skoniugowanych (PCV) powoduje indukcję silnej odpowiedzi przez limfocyty B i T, a w rezultacie – wytworzenie długotrwałej pamięci immunologicznej 31. W konsekwencji szczepionka skoniugowana wykazuje porównywalną (najczęściej nie gorszą) immunogenność u dorosłych z dobrze kontrolowanymi farmakologicznie chorobami przewlekłymi, jak u osób zdrowych 32. Skuteczność szczepionki skoniugowanej 13-walentnej (PCV13) w zapobieganiu IChP i pPZP, w tym bez bakteriemii, u osób w wieku ≥ 65 lat potwierdzono w randomizowanym badaniu klinicznym 33, 34. Standardowo jedna dawka szczepionki skoniugowanej zapewnia skuteczną ochronę dorosłych przed zakażeniem pneumokokami, w tym osób z czynnikami podwyższonego ryzyka zakażeń. Podanie kolejnej dawki szczepionki skoniugowanej jest konieczne wyłącznie w bardzo szczególnych populacjach pacjentów, tj. po przeszczepieniu komórek hematopoetycznych szpiku 24.
Populacyjne szczepienia za pomocą szczepionki skoniugowanej mają pozytywny wpływ na zdrowie publiczne, natomiast nie potwierdzono efektywności w tym zakresie szczepionek nieskoniugowanych. W Stanach Zjednoczonych szczepionka polisacharydowa nieskoniugowana (PPSV) dostępna była dla dzieci powyżej 2. roku życia i dorosłych od lat 80. XX wieku. Co ciekawe, spadek zachorowań na IChP w populacji dorosłych zaobserwowano dopiero po rozpoczęciu szczepień za pomocą szczepionki skoniugowanej, początkowo w ramach powszechnego szczepienia dzieci szczepionką PCV7 (od 2000 r.) i po zaleceniu szczepień dorosłych z zastosowaniem PCV13 (od 2012 r.) 35. Efekt populacyjny wynika z udokumentowanego wpływu szczepionki skoniugowanej na zmniejszenie nosicielstwa pneumokoków w jamie nosowo-gardłowej osób zaszczepionych 36, 37. Wpływ szczepionki nieskoniugowanej na nosicielstwo pneumokoków jest niejasny 38.
Szczepionki skoniugowane przeciw pneumokokom dostępne w Polsce
Do końca 2021 jedyną dostępną skoniugowaną szczepionką stosowaną w profilaktyce zakażeń pneumokokowych u dorosłych była szczepionka PCV13. Początkowo szczepionka PCV13 została zarejestrowana wyłącznie do stosowania w populacji dziecięcej 39. W związku z ograniczeniami szczepionki polisacharydowej (m.in. z brakiem jednoznacznie potwierdzonej skuteczności w zapobieganiu PZP bez bakteriemii), rozpoczęto wiele badań klinicznych PCV13 w populacji dorosłych. Skuteczność szczepionki PCV13 oceniono w dużym randomizowanym, kontrolowanym badaniu klinicznym o akronimie CAPiTA (Community-Acquired Pneumonia immunization Trial in Adults), do którego włączono ponad 84 tys. osób w wieku ≥ 65 lat. Wykazano, że w badanej populacji skuteczność PCV13 w zapobieganiu IChP spowodowanej przez serotypy szczepionkowe wyniosła 75 proc., a w zapobieganiu pneumokokowemu PZP i pneumokokowemu PZP bez bakteriemii – odpowiednio 46 proc. i 45 proc.. Co więcej, dowiedziono, że skuteczność szczepionki nie zmniejsza się istotnie przez okres 4–5 lat 33. Szczepionka PCV13 była dobrze tolerowana, a najczęściej występującymi zdarzeniami niepożądanymi były reakcje w miejscu iniekcji szczepionki (zaczerwienienie, bol, ograniczony ruch ramienia) oraz uogólnione zdarzenia niepożądane (zmęczenie, bol mięśni, gorączka) 33. Skuteczność PCV13 była podobna w podgrupie osób z chorobami współistniejącymi, takimi jak: choroby serca, cukrzyca, choroba płuc 40. Wyniki badania klinicznego CAPiTA potwierdzono w badaniu przeprowadzonym w warunkach rzeczywistej praktyki klinicznej 41. Dowiedziono, że szczepienie dorosłych w wieku ≥ 65 lat za pomocą PCV13 zmniejszało ryzyko pneumokokowego PZP wymagającego hospitalizacji – wywołanego serotypami szczepionkowymi o 73 proc., a pneumokokowego PZP bez bakteriemii o 70 proc.. W badaniu tym 88 proc. pacjentów miało ≥ 1 chorobę współistniejącą, zwiększającą ryzyko zakażenia pneumokokami 41.
Od 2021 r. zarejestrowane zostały dwie nowe skoniugowane szczepionki przeciw pneumokokom, o większym pokryciu serotypowym niż PCV13: szczepionka 15-walentna (PCV15) oraz 20-walentna (PCV20). Szczepionka PCV15 pokrywa dwa dodatkowe serotypy względem PCV13 (22F i 33F), natomiast PCV20 – aż siedem dodatkowych (8, 10A, 11A, 12F, 15B, 22F, 33F). Do tej pory obie najnowsze szczepionki zarejestrowane zostały do czynnego uodparniania populacji osób dorosłych w celu zapobiegania chorobie inwazyjnej i zapaleniu płuc wywoływanym przez bakterie S. pneumoniae (tab. 3 i 4) 25, 26.


Szczepionka PCV20 a epidemiologia zakażeń pneumokokowych u dorosłych
Wprowadzenie powszechnych szczepień dzieci przeciwko pneumokokom prowadzi do obniżenia ogólnej zapadalności na IChP przy jednoczesnym stopniowym wzroście udziału zakażeń powodowanych przez serotypy, które nie znajdują pokrycia w stosowanych szczepionkach 42. Zjawisko zastępowania serotypów odnotowano już po wprowadzeniu szczepień dzieci za pomocą 7-walentnej skoniugowanej szczepionki przeciw pneumokokom (PCV7), a następnie szczepionki 13-walentnej lub 10-walentnej 43. Według danych ECDC w 2018 r. najczęściej identyfikowanymi serotypami powodującymi IChP we wszystkich grupach wiekowych były kolejno serotypy: 8, 3, 19A, 22F, 12F, 9N, 15A, 10A, 23B i 6C (ryc. 1).

Serotypy te były przyczyną łącznie około 70 proc. przypadków IChP 44. Podobnych danych o epidemiologii zakażeń pneumokokowych w Polsce dostarcza Krajowy Ośrodek Referencyjny ds. Diagnostyki Bakteryjnych Zakażeń Ośrodkowego Układu Nerwowego (KOROUN). Według KOROUN w Polsce w 2021 r. najczęściej identyfikowanymi serotypami pneumokoków odpowiedzialnych za zakażenia inwazyjne osób w wieku > 20 lat były: 3, 4, 8, 9N, 19A, 22F, 6C, 14. Z kolei pięć serotypów najczęściej odpowiedzialnych za zgony to serotypy 3, 4, 14, 11A i 9N 45.
Zmieniająca się epidemiologia zakażeń pneumokokowych i wciąż aktualna potrzeba ochrony dorosłych przed tymi zakażeniami są bodźcem do ciągłego rozwoju skoniugowanych szczepionek przeciw pneumokokom. Siedem dodatkowych antygenów serotypów w PCV20 (8, 10A, 11A, 12F, 15B, 22F, 33F) zostało wybranych ze względu na ich stale rosnące znaczenie w epidemiologii IChP zarówno w Europie, jak i w perspektywie globalnej 44, 46. Jak przedstawiono w tabeli 4, szczepionka PCV20 ma obecnie najszersze pokrycie serotypowe spośród wszystkich dostępnych szczepionek skoniugowanych stosowanych u dorosłych. PCV20 jest jedyną szczepionką skoniugowaną wskazaną do czynnego uodparniania przed IChP i zapaleniem płuc spowodowanym serotypami 8, 12F i 10A – będącymi w pierwszej dziesiątce najczęściej identyfikowanych serotypów pneumokoków odpowiedzialnych za zakażenia inwazyjne w Europie (ryc. 1) 44. Na podstawie danych z 2018 r. z sieci Streptococcus pneumoniae Invasive Disease network (SpIDnet), finansowanej przez ECDC, oszacowano, że pokrycie serotypowe PCV20 w populacji osób w wieku ≥ 65 lat w Europie wynosi około 75 proc., podczas gdy PCV13 i PCV15, odpowiednio 45 proc. i 57 proc. 43. Z kolei na podstawie danych KOROUN z 2021 r. można oszacować, że teoretyczne pokrycie serotypowe PCV20 w populacji w wieku ≥ 20 lat w Polsce wynosi około 74 proc., a szczepionek PCV13 i PCV15 – 58 proc. i 62 proc. 45. Każdy z dodatkowych antygenów serotypowych w szczepionce PCV20 jest istotny, gdyż serotypy te są obecnie częstą przyczyną IChP w perspektywie globalnej. Dodatkowe serotypy PCV20 charakteryzują się: antybiotykoopornością (serotyp 11A, 15B, 22F, 33F) 47, 48, wywoływaniem zapalenia opon mózgowo-rdzeniowych (10A, 15B, 22F, 33F) 49, wyższym wskaźnikiem śmiertelności (wszystkie serotypy poza 12F) 21, 50 oraz wywoływaniem ognisk epidemicznych (8 i 12F) 51.
Charakterystyka szczepionki PCV20
20-walentna skoniugowana szczepionka przeciw pneumokokom (PCV20) jest szczepionką najnowszej generacji, pokrywa dodatkowe, istotne z epidemiologicznego punktu widzenia, serotypy w porównaniu z innymi szczepionkami skoniugowanymi. Poza dodatkowymi siedmioma pneumokokowymi antygenami polisacharydowymi skoniugowanymi z białkiem nośnikowym szczepionka PCV20 zawiera te same substancje pomocnicze, co szczepionka PCV13. Ponieważ skuteczność kliniczna PCV13 w populacji dorosłych została już potwierdzona, aktualnie prowadzone badania nad szczepionkami nowszej generacji dotyczą oceny bezpieczeństwa i immunogenności. Dotychczas przeprowadzone badania kliniczne PCV20 miały na celu porównanie immunogenności z PCV13 dla 13 antygenów wspólnych serotypów i z PPSV23 dla antygenów 7 dodatkowych serotypów (wspólnych z PPSV23, jednak niewystępujących w PCV13) 25.
Immunogenność szczepionki PCV20
Rejestrację PCV20 do stosowania w celu czynnej profilaktyki zakażeń pneumokokami u dorosłych poprzedziło przeprowadzenie m.in. trzech badań klinicznych, do których włączono około 6500 osób w ośrodkach w Stanach Zjednoczonych i Szwecji: badania 1007 52, 1006 53 i 1008 54. Kluczowe badanie kliniczne (1007) objęło osoby dorosłe w wieku ≥ 18 lat, które nie otrzymały w przeszłości żadnej szczepionki przeciw pneumokokom. Główną kohortę badania stanowiły osoby w wieku ≥ 60 lat, a dodatkowe dwie młodsze kohorty (18–49 lat i 50–59 lat) uwzględniono w celu oceny odpowiedzi na PCV20 w porównaniu z kohortą w wieku ≥ 60 lat. Odsetek pacjentów co najmniej z 1 czynnikiem ryzyka zakażenia pneumokokami w kohorcie w wieku ≥ 60 lat wyniósł 27 proc., a u włączonych osób najczęściej występującymi chorobami współistniejącymi były: cukrzyca typu 2, astma oraz przewlekła choroba sercowo-naczyniowa 55. W kohorcie pacjentów w wieku ≥ 60 lat zostało spełnione kryterium nie gorszego wyniku (non-inferiority) dla 19 z 20 serotypów zawartych w PCV20 ocenionej na podstawie porównania odpowiedzi immunologicznej mierzonej testem aktywności opsonofagocytarnej przeciwciał (opsonophagocytic assay – OPA). Jedynie odpowiedź immunologiczna na serotyp 8 po szczepieniu PCV20 była słabsza względem szczepionki PPSV23, jednak blisko granicy przyjętego kryterium non-inferiority – 0,49 – wobec granicy ustalonej na > 0,5 52. Znaczenie kliniczne tej obserwacji nie jest dotychczas znane. Odpowiedź na serotyp 8 była jednak silna, biorąc pod uwagę inne kryteria odpowiedzi immunologicznej 52. Ponadto, mając na uwadze cechy szczepionki skoniugowanej (zdolność do wywoływania długotrwałej pamięci immunologicznej i indukcję silniejszej odpowiedzi immunologicznej po ponownym kontakcie z danym serotypem 31), oczekuje się, że odpowiedź na serotyp 8 będzie wystarczająca do zapewnienia podobnej ochrony, takiej jak wobec pozostałych dziewiętnastu serotypów spełniających założone kryterium non-inferiority. W młodszych kohortach kryterium równoważności zostało spełnione dla wszystkich 20 serotypów w porównaniu z kohortą w wieku ≥ 60 lat. Profil bezpieczeństwa PCV20 był podobny do tego, jaki obserwowano w badaniach PCV13 z udziałem dorosłych 33, 52. Najczęściej szczepienie PCV20 wiązało się z reakcjami ogólnoustrojowymi (bólem mięśni) i reakcjami w miejscu podania szczepionki (bólem w miejscu wstrzyknięcia), które w znaczącej większości miały łagodny lub umiarkowany stopień nasilenia 52.
W badaniu 1006 wykazano silną immunogenność PCV20 u osób w wieku ≥ 65 lat, które wcześniej otrzymały szczepionkę PPSV23, PCV13 lub dwudawkowy schemat PCV13 i PPSV23 (1 dawka PCV13, 1 dawka PPSV23). Najsilniejszą odpowiedź immunologiczną na szczepienie PCV20 zaobserwowano u pacjentów wcześniej zaszczepionych PCV13 53. Z kolei w badaniu 1008 dowiedziono spójności odpowiedzi immunologicznej na szczepionkę PCV20 pochodzącą z trzech rożnych partii produkcyjnych u osób w wieku od 18 do 49 lat 54.
Najnowsze zalecenia szczepień przeciwko pneumokokom w populacji dorosłych
Szczepionka PCV20 została zarejestrowana w Stanach Zjednoczonych w połowie 2021 r. Na początku 2022 r. amerykański Komitet Doradczy ds. Szczepień (Advisory Committee on Immunization Practices – ACIP) zaktualizował rekomendacje dotyczące profilaktyki zakażeń pneumokokowych w populacji dorosłych 17. ACIP zaleca szczepienie osób w wieku ≥ 19 lat z przewlekłymi schorzeniami, uzależnionych od alkoholu lub tytoniu, z implantem ślimakowym, wyciekiem płynu mózgowo-rdzeniowego oraz osobom z obniżoną odpornością (tab. 5).

Jednocześnie zaleca się szczepienie wszystkich dorosłych w wieku ≥ 65 lat bez względu na występowanie dodatkowych czynników podwyższających ryzyko zakażenia S. pneumoniae. Po raz pierwszy ACIP rekomenduje stosowanie jednodawkowego schematu szczepień za pomocą wyłącznie szczepionki o obecnie największym pokryciu serotypowym wśród szczepionek polisacharydowych skoniugowanych – PCV20. Rutynowe podanie szczepionki PPSV23 po PCV20 nie jest wskazane, co wynika prawdopodobnie z niejasnej skuteczności PPSV23 w zapobieganiu pneumokokowemu zapaleniu płuc bez bakteriemii. Szacuje się, że dodanie szczepionki PPSV23 po szczepieniu PCV20 generowałoby wysokie koszty przy minimalnych korzyściach zdrowotnych 56, 57. Komitet rekomenduje alternatywne szczepienie sekwencyjne za pomocą 1 dawki szczepionki PCV15, po którym wymagane jest uzupełnienie 1 dawką szczepionki PPSV23 w odpowiednim odstępie czasowym (tab. 5). W przypadku osób z obniżoną odpornością, implantem ślimakowym lub wyciekiem płynu mózgowo-rdzeniowego zaleca się zachowanie krótszego odstępu czasu do podania PPSV23 (tj. co najmniej 8 tygodni), a w pozostałych przypadkach co najmniej 12 miesięcy. W ten sposób minimalizowane jest ryzyko zakażenia pneumokokami o serotypach, których antygeny występują wyłącznie w szczepionce PPSV23, osób obciążonych wysokim ryzykiem zakażenia. Dokument sporządzony przez ACIP wskazuje także zalecane schematy szczepień, w zależności od dotychczasowej historii szczepiennej pacjenta. Dorośli, którzy otrzymali w przeszłości tylko szczepienie PPSV23, mogą otrzymać szczepienie skoniugowaną szczepionką PCV (PCV20 lub PCV15) po upływie co najmniej roku od ostatniej dawki PPSV23. W przypadku osób dorosłych, które otrzymały PCV13, ale nie ukończyły zalecanej serii szczepień przeciwko pneumokokom z PPSV23, można zastosować jedną dawkę szczepionki PCV20, jeśli szczepionka PPSV23 nie jest dostępna 17. W ocenie ACIP, u pacjentów, którzy zakończyli cykl szczepienia z użyciem PCV13 i PPSV23, nie jest wymagane doszczepienie. Najnowsze wytyczne ACIP znacząco upraszczają zasady szczepień przeciw pneumokokom w populacji dorosłych. Oczekuje się, że dzięki temu zwiększy się wyszczepialność tej grupy wiekowej, co przełoży się na efektywne zapobieganie chorobom pneumokokowym 17.
Schemat podania sekwencyjnego (dwudawkowy) może nieść ryzyko zaniechania przez pacjenta zgłoszenia się na szczepienie uzupełniające, które powinno nastąpić po ściśle określonym czasie. Ponadto zastosowanie schematu dwudawkowego może nie być możliwe do zrealizowania w optymalnym czasie z uwagi na specyfikę schorzenia i stosowane lub planowane leczenie. Taka sytuacja ma miejsce np. w przypadku pacjentów z chorobami układowymi tkanki łącznej, jak reumatoidalne zapalenie stawów, toczeń rumieniowaty układowy lub układowe zapalenia naczyń, u których stosowane są leki immunosupresyjne. Zalecenia dotyczące szczepień w tej grupie chorych wskazują z jednej strony, żeby szczepienie optymalnie nie było wykonywane w czasie dużej aktywności choroby, z drugiej strony stosowane leczenie (jak glikokortykosteroidy, metotreksat lub – w największym stopniu – rytuksymab) może osłabić efektywność szczepienia 58. Dostępność szczepionki umożliwiającej jej zastosowanie w schemacie jednodawkowym zwiększa szansę tych pacjentów na skuteczną profilaktykę.
Profilaktyka chorób pneumokokowych u osób dorosłych w Polsce
Czynna profilaktyka zakażeń pneumokokami w populacji dorosłych jest zalecana w Programie Szczepień Ochronnych (PSO) na rok 2022. PSO zaleca szczepienia osób dorosłych, u których występują czynniki zwiększające ryzyko zakażenia S. pneumoniae 59. Szczepienia, które wymienione są w PSO jako zalecane, nie są jednak finansowane z budżetu Ministerstwa Zdrowia (MZ).
Od stycznia 2022 r. w ramach refundacji aptecznej dostępna jest szczepionka PCV13 z 50 proc. odpłatnością w populacji pacjentów w wieku ≥ 65. roku życia, u których występuje zwiększone (umiarkowane do wysokiego) ryzyko choroby pneumokokowej 60. Do refundacji szczepionki uprawnione są osoby, które spełniają kryterium wieku i u których występuje co najmniej jeden z następujących czynników ryzyka zakażenia: przewlekła choroba serca, przewlekła choroba wątroby, przewlekła choroba płuc, cukrzyca, implant ślimakowy, wyciek płynu mózgowo- rdzeniowego, wrodzona lub nabyta asplenia, niedokrwistość sierpowata i inne hemoglobinopatie, przewlekła niewydolność nerek, wrodzony lub nabyty niedobór odporności, uogólniona choroba nowotworowa, zakażenie wirusem HIV, choroba Hodgkina, jatrogenna immunosupresja, białaczka, szpiczak mnogi, przeszczep narządu litego 60. Refundacja szczepionki w tej populacji osób zwiększa jej dostępność dla pacjentów najbardziej narażonych na zakażenia S. pneumoniae.
Bezpłatne szczepienia przeciwko pneumokokom realizowane są także przez niektóre jednostki samorządów terytorialnych. Od 2016 do czerwca 2022 r. Agencja Oceny Technologii Medycznych i Taryfikacji poddała ocenie 36 programów polityki zdrowotnej, spośród których zdecydowana większość (82 proc.) poświęcona jest osobom z populacji ogólnej w wieku ≥ 55 lat. Pomimo wprowadzenia refundacji aptecznej szczepionki PCV13 w 2022 r. dwie gminy złożyły projekty programów profilaktyki zakażeń pneumokokowych w populacji ogólnej mieszkańców w wieku ≥ 65 lat. W przypadku dużego zainteresowania szczepionka będzie w pierwszej kolejności podawana osobom z czynnikami ryzyka zakażenia S. pneumoniae 61.
Rekomendacja profilaktyki zakażeń pneumokokowych w czasie pandemii COVID-19
W związku z wybuchem pandemii COVID-19 (coronavirus disease 2019) w marcu 2020 r., Światowa Organizacja Zdrowia (World Health Organization – WHO) wydała zalecenia dotyczące realizacji szczepień ochronnych. WHO podkreśla, że realizacja szczepień przeciwko pneumokokom i grypie sezonowej w grupach osób o zwiększonym ryzyku zarażenia powinna być realizowana priorytetowo. W zaleceniach WHO przekazuje jasny komunikat, że realizacja szczepień ochronnych jest kluczowym świadczeniem zdrowotnym w czasie pandemii COVID-19 62. Polskie Ministerstwo Zdrowia (MZ) wraz z Głównym Inspektoratem Sanitarnym (GIS), w ślad za WHO, wydały podobne rekomendacje, co przemawia za zasadnością szczepień. MZ wraz z GIS rekomendują upowszechnienie szczepień przeciw pneumokokom i grypie u osób z grup ryzyka, w tym osób w wieku ≥ 60 lat z chorobami przewlekłymi płuc, układu krążenia, nowotworami, cukrzycą, niewydolnością nerek i zaburzeniami odporności. Jak wskazywane jest w rekomendacji, osoby obciążone tymi schorzeniami są szczególnie narażone na zapalenie płuc 63. Holenderskie i hiszpańskie służby zdrowia dostrzegły potrzebę profilaktyki zakażeń pneumokokowych u osób, które w przeszłości były hospitalizowane z powodu COVID-19 64, 65.
Podsumowanie
Zakażenia pneumokokowe w populacji dorosłych pozostają istotnym problemem zdrowotnym. Ryzyko zakażenia S. pneumoniae osób dorosłych zwiększa się wraz z wiekiem lub występowaniem innych czynników sprzyjających zakażeniom, tj. chorób przewlekłych, stanów obniżających odporność oraz określonych czynników środowiskowych. W populacji dorosłych pneumokoki są przede wszystkim przyczyną zapaleń płuc, które stanowią znaczne obciążenie dla systemu opieki zdrowotnej i niosą poważne konsekwencje zdrowotne dla chorych. Zakażenia inwazyjne S. pneumoniae – chociaż nie tak częste jak zapalenia płuc bez bakteriemii – są stanami wiążącymi się z ciężkimi powikłaniami, w tym ze zgonem, szczególnie w grupie seniorów. Zmieniające się rozpowszechnienie serotypów pneumokokowych w populacji jest bodźcem do rozwoju następnych generacji szczepionek. Spośród dostępnych obecnie szczepionek skoniugowanych przeciwko pneumokokom szczepionka PCV20 zapewnia najszersze pokrycie serotypowe zarówno w Europie, jak i w Polsce. W przeprowadzonych badaniach klinicznych udokumentowano immunogenność PCV20 na poziomie porównywalnym z zarejestrowanymi dotychczas szczepionkami (PCV13 i PPSV23). Przewagą szczepionek skoniugowanych (w tym PCV20) w stosunku do nieskoniugowanych jest wytworzenie pamięci immunologicznej i silnej odpowiedzi po podaniu dawki przypominającej (tzw. efekt boosterowy). Jak opisano powyżej, szczepionka PCV20 zawiera antygeny ważnych epidemiologicznie serotypów, dlatego ocenia się, że stanowi ona dobrą odpowiedź na aktualną sytuację epidemiologiczną w Polsce oraz w ujęciu europejskim i globalnym. W najnowszych amerykańskich zaleceniach profilaktyki zakażeń pneumokokowych w populacji dorosłych rekomendowane jest podanie jednej dawki PCV20 albo zastosowanie schematu dwudawkowego (PCV15 + PPSV23). Wprowadzenie schematu jednodawkowego z użyciem PCV20 będzie dużym uproszczeniem realizacji szczepień w praktyce, co może pozytywnie wpłynąć na wyszczepialność.
Wprowadzenie w Polsce od 2022 r. refundacji aptecznej szczepionki PCV13 z 50 proc. odpłatnością dla osób w wieku ≥ 65 lat i co najmniej z umiarkowanymi czynnikami ryzyka zakażenia pneumokokami zwiększyło dostęp do szczepień najbardziej narażonej populacji. Jednocześnie w świetle obecnej epidemiologii zakażeń pneumokokowych i najnowszych zaleceń w Polsce wciąż istnieje potrzeba zwiększania dostępu do nowoczesnej profilaktyki zakażeń.
Autorzy tekstu to:
– Jacek Wysocki z Katedry i Zakład Profilaktyki Zdrowotnej, Wydział Nauk o Zdrowiu, Uniwersytet Medyczny w Poznaniu
– Adam Antczak z Kliniki Pulmonologii Ogólnej i Onkologicznej Uniwersytetu Medycznego w Łodzi,
– Joanna Chorostowska-Wynimko z Zakładu Genetyki i Immunologii Klinicznej Instytutu Gruźlicy i Chorób Płuc w Warszawie,
– Leszek Czupryniak z Kliniki Diabetologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego,
– Andrzej Fal z Kliniki Alergologii, Chorób Płuc i Chorób Wewnętrznych Centralnego Szpitala Klinicznego MSWiA w Warszawie i Wydziału Medycznego Collegium Medicum Uniwersytetu Kardynała Stefana Wyszyńskiego w Warszawie,
– Robert Flisiak z Kliniki Chorób Zakaźnych i Hepatologii Uniwersytetu Medycznego w Białymstoku,
– Ernest Kuchar z Kliniki Pediatrii z Oddziałem Obserwacyjnym Warszawskiego Uniwersytetu Medycznego,
– Artur Mamcarz z III Kliniki Chorób Wewnętrznych i Kardiologii Wydziału Lekarskiego Warszawskiego Uniwersytetu Medycznego,
– Aneta Nitch-Osuch z Zakładu Medycyny Społecznej i Zdrowia Publicznego Warszawskiego Uniwersytetu Medycznego,
– Marcin Stajszczyk z Oddziału Reumatologii i Chorób Autoimmunologicznych Śląskiego Centrum Reumatologii, Ortopedii i Rehabilitacji w Ustroniu,
– Michał Abendrot z Pfizer Polska Sp. z o.o.,
– Dominik Golicki z Katedry i Zakładu Farmakologii Doświadczalnej i Klinicznej Warszawskiego Uniwersytetu Medycznego i HealthQuest Sp. z o.o.,
– Katarzyna Jaśkowiak z HealthQuest Sp. z o.o.,
– Anna Skoczyńska z Krajowego Ośrodka Referencyjnego ds. Diagnostyki Bakteryjnych Zakażeń Ośrodkowego Układu Nerwowego (KOROUN) i Zakładu Epidemiologii i Mikrobiologii Klinicznej Narodowego Instytutu Leków w Warszawie.
Oświadczenie o potencjalnym konflikcie interesów: JW – brak konfliktu interesów; AA – brak konfliktu interesów; JCW – udział w radzie doradczej (Pfizer); LC – brak konfliktu interesów; AF – udział w radach doradczych (AstraZeneca, Chiesi, Meda, Novartis, Pfizer, Polpharma, PhytoPharm), honoraria za wykłady (Adamed, AstraZeneca, Boehringer Ingelheim, Chiesi, Klosterfrau, Meda, MSD, Novartis, Nycomed, Pfizer, PhytoPharm, Polpharmex, Sandoz, Schering Plough, TEVA); RF – udział w radach doradczych (Abbvie, Gilead, MSD, Roche, Pfizer), honoraria za wykłady (Abbvie, Gilead, MSD); EK – honoraria za wykłady (Pfizer, Sanofi Pasteur, GSK); AM – Pfizer; ANO – brak konfliktu interesów; MS – udział w radzie doradczej (Pfizer); MA – pracownik firmy Pfizer; AS – udział w radach doradczych (MSD, Pfizer, Sanofi Pasteur), honoraria za wykłady (Pfizer), granty dla instytucji, w której pracuje (MSD, Pfizer).
Opracowanie powstało przy wsparciu pisarzy medycznych, Katarzyny Jaśkowiak i Dominika Golickiego z firmy HealthQuest sp. z o.o., i zostało sfinansowane ze środków Pfizer Polska sp. z o.o.
Piśmiennictwo:
1. Shoar S, Musher DM. Etiology of community-acquired pneumonia in adults: a systematic review. Pneumonia (Nathan) 2020; 12: 11.
2. Welte T, Torres A, Nathwani D. Clinical and economic burden of community-acquired pneumonia among adults in Europe. Thorax 2012; 67: 71-79.
3. European Centre for Diseases Prevention and Control. Surveillance Atlas of Infectious Diseases: invasive pneumococcal diseases in 2020. https://atlas.ecdc.europa. eu/public/index.aspx. Dostęp: 24.05.2022.
4. Pallotta A, Rehm SJ. Navigating pneumococcal vaccination in adults. Cleve Clin J Med 2016; 83: 427-433.
5. Said MA, Johnson HL, Nonyane BA i wsp. Estimating the burden of pneumococcal pneumonia among adults: a systematic review and meta-analysis of diagnostic techniques. PLoS One 2013; 8: e60273.
6. Brandenburg JA, Marrie TJ, Coley CM i wsp. Clinical presentation, processes and outcomes of care for patients with pneumococcal pneumonia. J Gen Intern Med 2000; 15: 638-646.
7. Klein EY, Monteforte B, Gupta A i wsp. The frequency of influenza and bacterial coinfection: a systematic review and meta-analysis. Influenza Other Respir Viruses 2016; 10: 394-403.
8. European Respiratory Society. European Lung White Book. Chapter 18: Acute lower respiratory infections. https://www.erswhitebook.org/. Dostęp: 9.06.2022.
9. Jaśkowiak K, Dudzisz A, Golicki D. Zapalenia płuc u osob dorosłych w Polsce – pneumokokowe zapalenia płuc i ich profilaktyka. Lekarz POZ 2021; 7: 2.
10. Hryniewicz W, Albrecht P, Radzikowski A (red.). Rekomendacje postępowania w pozaszpitalnych zakażeniach układu oddechowego. Narodowy Instytut Lekow, Warszawa 2017.
11. Wyrwich KW, Yu H, Sato R i wsp. Observational longitudinal study of symptom burden and time for recovery from community-acquired pneumonia reported by older adults surveyed nationwide using the CAP. Burden of Illness Questionnaire. Patient Relat Outcome Meas 2015: 6: 215-223.
12. Ruiz LA, Serrano L, Espana PP i wsp. Factors influencing long-term survival after hospitalization with pneumococcal pneumonia. J Infect 2019; 79: 542-549.
13. Shea KM, Edelsberg J, Weycker D i wsp. Rates of pneumococcal disease in adults with chronic medical conditions. Open Forum Infect Dis 2014; 1: ofu024.
14. Krone CL, van de Groep K, Trzciński K i wsp. Immunosenescence and pneumococcal disease: an imbalance in host-pathogen interactions. Lancet Respir Med 2014; 2: 141-153.
15. Weiskopf D, Weinberger B, Grubeck-Loebenstein B. The aging of the immune system. Transpl Int 2009; 22: 1041-1050.
16. Steens A, Vestrheim DF, Aaberge IS i wsp. A review of the evidence to inform pneumococcal vaccine recommendations for risk groups aged 2 years and older. Epidemiol Infect 2014; 142: 2471-2482.
17. Kobayashi M, Farrar JL, Gierke R i wsp. Use of 15-Valent Pneumococcal Conjugate Vaccine and 20-Valent Pneumococcal Conjugate Vaccine Among U.S. Adults: Updated Recommendations of the Advisory Committee on Immunization Practices — United States, 2022. MMWR Morb Mortal Wkly Rep 2022; 71: 109–117.
18. Greene CM, Kyaw MH, Ray SM i wsp. Active Bacterial Core Surveillance Program of the Emerging Infections Program Network. Preventability of invasive pneumococcal disease and assessment of current polysaccharide vaccine recommendations for adults: United States, 2001-2003. Clin Infect Dis 2006; 43: 141-150.
19. Centers for Disease Control and Prevention. Prevention of pneumococcal infections secondary to seasonal and 2009 H1N1 influenza viruses infection. http://www.cdc. gov/h1n1flu/vaccination/provider/provider_pneumococcal. htm. Dostęp: 6.06.2022.
20. Kupronis BA, Richards CL, Whitney CG; Active Bacterial Core Surveillance Team. Invasive pneumococcal disease in older adults residing in long-term care facilities and in the community. J Am Geriatr Soc 2003; 51: 1520-1525.
21. van Hoek AJ, Andrews N, Waight PA i wsp. The effect of underlying clinical conditions on the risk of developing invasive pneumococcal disease in England. J Infect 2012; 65: 17-24.
22. Centers for Disease Control and Prevention. CDC Yellow Book 2020; Immunocompromised Travelers. https://wwwnc.cdc.gov/travel/yellowbook/2020/travelers- with-additional-considerations/immunocompromised- travelers. Dostęp: 17.06.2022.
23. Charakterystyka Produktu Leczniczego Pneumovax23R.
24. Charakterystyka Produktu Leczniczego Prevenar13R.
25. Charakterystyka Produktu Leczniczego ApexxnarR.
26. Charakterystyka Produktu Leczniczego VaxneuvanceR.
27. Matanock A, Lee G, Gierke R i wsp. Use of 13-Valent Pneumococcal Conjugate Vaccine and 23-Valent Pneumococcal Polysaccharide Vaccine Among Adults Aged ≥ 65 Years: Updated Recommendations of the Advisory Committee on Immunization Practices. MMWR Morb Mortal Wkly Rep 2019; 68: 1069-1075. Erratum in: MMWR Morb Mortal Wkly Rep 2020; 68: 1195.
28. Centers for Disease Control and Prevention. Types and Composition of Pneumococcal Vaccines. https://www. cdc.gov/vaccines/vpd/pneumo/hcp/about-vaccine. html. Dostęp: 24.05.2022.
29. Moberley S, Holden J, Tatham DP, Andrews RM. Vaccines for preventing pneumococcal infection in adults. Cochrane Database Syst Rev 2013: CD000422.
30. Niederman MS, Folaranmi T, Buchwald UK i wsp. Efficacy and effectiveness of a 23-valent polysaccharide vaccine against invasive and noninvasive pneumococcal disease and related outcomes: a review of available evidence. Expert Rev Vaccines; 20: 243-256.
31. Pollard AJ, Perrett KP, Beverley PC. Maintaining protection against invasive bacteria with protein-polysaccharide conjugate vaccines. Nat Rev Immunol 2009; 9: 213-220.
32. Schmoele-Thoma B, Jackson LA, Greenberg RN i wsp. Immunogenicity of 13-valent pneumococcal conjugate vaccine in immunocompetent older adults with stable underlying medical conditions. J Vaccines Immun 2015, 3: 7-12.
33. Bonten MJ, Huijts SM, Bolkenbaas M i wsp. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med 2015; 372: 1114-1125. 34. van Werkhoven CH, Huijts SM, Bolkenbaas M i wsp. The impact of age on the efficacy of 13-valent pneumococcal conjugate vaccine in elderly. Clin Infect Dis 2015; 61: 1835-1838.
35. Centers for Disease Control and Prevention. Pneumococcal Disease, Surveillance & Reporting. https://www. cdc.gov/pneumococcal/surveillance.html. Dostęp: 24.05.2022.
36. Desai AP, Sharma D, Crispell EK i wsp. Decline in pneumococcal nasopharyngeal carriage of vaccine serotypes after the introduction of the 13-valent pneumococcal conjugate vaccine in children in Atlanta, Georgia. Pediatr Infect Dis J 2015; 34: 1168–1174.
37. van Deursen AMM, van Houten MA, Webber C i wsp. The Impact of the 13-Valent Pneumococcal Conjugate Vaccine on Pneumococcal Carriage in the Community Acquired Pneumonia Immunization Trial in Adults (CAPiTA) Study. Clin Infect Dis 2018; 67: 42-49.
38. Herva E, Luotenen J, Timonen M i wsp. The effect of polyvalent pneumococcal polysaccharide vaccine on nasopharyngeal and nasal carriage of streptococcus pneumoniae. Scand J Inf Dis 1980; 12: 97–100.
39. European Medicines Agency. Summary of positive opinion for Prevenar 13. Londyn, 2009. https://www. ema.europa.eu/en/documents/smop-initial/chmp- -summary-positive-opinion-prevenar-13_en.pdf. Dostęp: 8.06.2022.
40. Suaya JA, Jiang Q, Scott DA i wsp. Post hoc analysis of the efficacy of the 13-valent pneumococcal conjugate vaccine against vaccine-type community-acquired pneumonia in at-risk older adults. Vaccine 2018; 36: 1477-1483.
41. McLaughlin JM, Jiang Q, Isturiz RE i wsp. Effectiveness of 13-Valent Pneumo-coccal Conjugate Vaccine Against Hospitalization for Community-Acquired Pneumonia in Older US Adults: A Test-Negative Design. Clin Infect Dis 2018; 67: 1498-1506.
42. Andrews N, Kent A, Amin-Chowdhury Z i wsp. Effectiveness of the seven-valent and thirteen-valent pneumococcal conjugate vaccines in England: the indirect cohort design, 2006-2018. Vaccine 2019; 37: 4491-4498.
43. Hanquet G, Krizova P, Dalby T i wsp. Serotype Replacement after Introduction of 10-Valent and 13-Valent Pneumococcal Conjugate Vaccines in 10 Countries, Europe. Emerg Infect Dis 2022; 28: 137-138.
44. European Centre for Diseases Prevention and Control. Annual epidemiological report for 2018. Stockholm: ECDC; 2020. https://www.ecdc.europa.eu/en/publications- data/invasive-pneumococcal-disease-annualepidemiological- report-2018. Dostęp: 24.05.2022.
45. Skoczyńska A, Wrobel-Pawelczyk I, Gołębiewska A i wsp. Inwazyjna choroba pneumokokowa w Polsce w 2021 roku (dane KOROUN), 2022. http://koroun.nil. gov.pl/dane-epidemiologiczne/. Dostęp: 26.05.2022.
46. Balsells E, Guillot L, Nair H i wsp. Serotype distribution of Streptococcus pneumoniae causing invasive disease in children in the post-PCV era: A systematic review and meta-analysis. PLoS One 2017; 12: e0177113.
47. Metcalf BJ, Gertz RE Jr, Gladstone RA i wsp. Active Bacterial Core surveillance team. Strain features and distributions in pneumococci from children with invasive disease before and after 13-valent conjugate vaccine implementation in the USA. Clin Microbiol Infect 2016; 22: 60.e9-60.e29.
48. Tomczyk S, Lynfield R, Schaffner W i wsp. Prevention of Antibiotic-Nonsusceptible Invasive Pneumococcal Disease With the 13-Valent Pneumococcal Conjugate Vaccine. Clin Infect Dis 2016; 62: 1119-1125.
49. Olarte L, Barson WJ, Barson RM i wsp. Impact of the 13-Valent Pneumococcal Conjugate Vaccine on Pneumococcal Meningitis in US Children. Clin Infect Dis 2015; 61: 767-775.
50. Oligbu G, Collins S, Sheppard CL i wsp. Childhood Deaths Attributable to Invasive Pneumococcal Disease in England and Wales, 2006-2014. Clin Infect Dis 2017; 65: 308-314.
51. Zivich PN, Grabenstein JD, Becker-Dreps SI i wsp. Streptococcus pneumoniae outbreaks and implications for transmission and control: a systematic review. Pneumonia (Nathan) 2018; 10: 11.
52. Essink B, Sabharwal C, Cannon K i wsp. Pivotal Phase 3 Randomized Clinical Trial of the Safety, Tolerability, and Immunogenicity of 20-Valent Pneumococcal Conjugate Vaccine in Adults 18 Years and Older. Clin Infect Dis 2021: ciab990.
53. Cannon K, Elder C, Young M i wsp. A trial to evaluate the safety and immunogenicity of a 20-valent pneumococcal conjugate vaccine in populations of adults ≥ 65 years of age with different prior pneumococcal vaccination. Vaccine 2021; 39: 7494-7502.
54. Klein NP, Peyrani P, Yacisin K i wsp. A phase 3, randomized, double-blind study to evaluate the immunogenicity and safety of 3 lots of 20-valent pneumococcal conjugate vaccine in pneumococcal vaccine-naive adults 18 through 49 years of age. Vaccine. 2021; 39: 5428-5435.
55. European Medicines Agency. Committee for Medicinal Products for Human Use (CHMP). Assessment report. Apexxnar. EMA/12384/2022. https://www.ema. europa.eu/en/documents/assessment-report/apexxnar- epar-public-assessment-report_en.pdf. Dostęp: 8.06.2022.
56. Stoecker C. Spotkanie Advisory Committee on Immunization Practices (ACIP), czerwiec 2021. https:// www.cdc.gov/vaccines/acip/meetings/downloads/ slides-2021-06/03-Pneumococcal-Stoecker-508.pdf. Dostęp: 8.06.2022.
57. Leidner AJ. Spotkanie Advisory Committee on Immunization Practices (ACIP), wrzesień 2021. https:// www.cdc.gov/vaccines/acip/meetings/downloads/ slides-2021-09-29/02-Pneumococcal-Leidner-508.pdf. Dostęp: 8.06.2022.
58. Furer V, Rondaan C, Heijstek MW i wsp. 2019 update of EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis 2020; 79: 39-52.
59. Główny Inspektorat Sanitarny. Program Szczepień Ochronnych na rok 2022. https://www.gov.pl/web/gis/ program-szczepien-ochronnych-na-rok-2022. Dostęp: 8.06.2022.
60. Obwieszczenie Ministra Zdrowia z dnia 20 grudnia 2021 r. w sprawie wykazu refundowanych lekow, środkow spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobow medycznych na 1 stycznia 2022 r. https://www.gov.pl/web/zdrowie/obwieszczeniaministra- zdrowia-lista-lekow-refundowanych. Dostęp: 8.06.2022.
61. Agencja Oceny Technologii Medycznych i Taryfikacji. Biuletyn informacji publicznej. Opinie do programow polityki zdrowotnej. https://bipold.aotm.gov.pl/index. php/repozytorium-ppz-2/opinie-o-projektachprogramow- zdrowotnych-realizowanych-przez-jst. Dostęp 8.06.2022.
62. Ministerstwo Zdrowia. Komunikat w sprawie wykonywania szczepień ochronnych w czasie pandemii COVID-19. https://www.gov.pl/web/zdrowie/komunikat- sprawie-wykonywania-szczepien-ochronnych-wczasie- pandemii-covid-19. Dostęp: 9.06.2022.
63. World Health Organization. Guidance on routine immunization services during COVID-19 pandemic in the WHO European Region. https://apps.who.int/iris/ handle/10665/334123. Dostęp: 9.06.2022.
64. Zorginstituut Nederland https://www.zorginstituutnederland. nl/publicaties/adviezen/2021/03/03/gvsadvies- 13-valent-pneumokokkenconjugaat-vaccinprevenar13. Dostęp: 9.06.2022.
65. Junta de Andalucia. https://www.juntadeandalucia.es/ export/drupaljda/instruccion_vacunacion_neumococica_ pacientes_post_covid_grave_26-11-2020-F.pdf. Dostęp: 9.06.2022.
Artykuł opublikowano w „Lekarzu POZ” 4/2022.
Przeczytaj także: „Ospa małpia – czy to nowa pandemia?”.

Źródło:
Lekarz POZ/Jacek Wysocki, Adam Antczak, Joanna Chorostowska-Wynimko, Leszek Czupryniak, Andrzej Fal, Robert Flisiak, Ernest Kuchar, Artur Mamcarz, Aneta Nitch-Osuch, Marcin Stajszczyk, Michał Abendrot i Dominik Golicki, Katarzyna Jaśkowiak i Anna Skoczyńska
Lekarz POZ/Jacek Wysocki, Adam Antczak, Joanna Chorostowska-Wynimko, Leszek Czupryniak, Andrzej Fal, Robert Flisiak, Ernest Kuchar, Artur Mamcarz, Aneta Nitch-Osuch, Marcin Stajszczyk, Michał Abendrot i Dominik Golicki, Katarzyna Jaśkowiak i Anna Skoczyńska




