Diagnostyka i leczenie pęcherzycy – konsensus Polskiego Towarzystwa Dermatologicznego
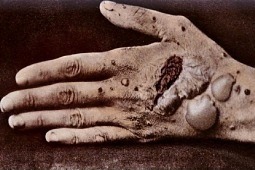
Pęcherzyca jest akantolityczną dermatozą pęcherzową o potencjalnie śmiertelnym przebiegu. Podstawą laboratoryjnego rozpoznania pęcherzycy jest badanie immunopatologiczne wycinka skórnego, w którym stwierdza się związane in vivo IgG, rzadziej Iga, w przestrzeniach międzykomórkowych naskórka. W celu ustalenia charakterystyki antygenu lub antygenów rozpoznawanych przez autoprzeciwciała i, co się z tym wiąże, określenia podtypu klinicznego pęcherzycy konieczne są badania surowicy metodami immunologicznymi. Leczenie pęcherzycy polegające na połączeniu prednizonu w początkowej dawce 1–1,5 mg/kg m.c. z azatiopryną jest uznane obecnie przez większość dermatologów i rekomendowane przez europejską grupę ekspercką jako leczenie z wyboru w typowych przypadkach, przy czym inne leki immunosupresyjne, leki biologiczne, dożylne immunoglobuliny znajdują zastosowanie w przypadkach opornych na klasyczne leczenie oraz w rzadkich odmianach pęcherzycy
Wprowadzenie
Pęcherzyca jest akantolityczną chorobą pęcherzową błon śluzowych i/lub skóry, wywołaną obecnością patogennych autoprzeciwciał w krążeniu oraz związanych in vivo w przestrzeniach międzykomórkowych naskórka, które są skierowane przeciwko rozmaitym cząsteczkom adhezyjnym desmosomów. Obraz i przebieg kliniczny poszczególnych odmian pęcherzycy zależy od rodzaju antygenu rozpoznawanego przez autoprzeciwciała oraz stopnia zaawansowania procesu chorobowego [1–3]. Diagnostyka pęcherzycy opiera się na stwierdzeniu obecności przeciwciał IgG, rzadko IgA, związanych w przestrzeniach międzykomórkowych wielowarstwowego nabłonka skóry i/lub błon śluzowych w bezpośrednim badaniu immunopatologicznym, które powinno być uzupełnione badaniami immunologicznymi surowicy pozwalającymi na określenie antygenu rozpoznawanego przez autoprzeciwciała, co umożliwia rozpoznanie odmiany klinicznej pęcherzycy [4]. Leczenie tej potencjalnie śmiertelnej choroby polega na stosowaniu glikokortykosteroidów skojarzonych z lekami immunosupresyjnymi, najczęściej azatiopryną, przy czym inne leki immunosupresyjne, leki biologiczne czy dożylnie podawane immunoglobuliny znajdują zastosowanie w przypadkach opornych na klasyczne leczenie oraz w rzadkich odmianach pęcherzycy [5–7].
Do tej pory nie stworzono ogólnoświatowego konsensusu dotyczącego diagnostyki i leczenia pęcherzycy, chociaż w niektórych krajach już powołano grupy eksperckie, które opracowały wytyczne dotyczące postępowania dla dermatologów w swoich krajach [8]. Poniżej przedstawiamy konsensus diagnostyki i leczenia pęcherzycy opracowany przez grupę ekspertów powołaną przez Zarząd Główny Polskiego Towarzystwa Dermatologicznego, oparty na wytycznych Europejskiego Towarzystwa Akademii Dermatologii i Wenerologii [9] oraz uwzględniający warunki i ograniczenia prawno-finansowe w Polsce.
Informacje kliniczne
Badanie podmiotowe Wywiad powinien obejmować informacje umożliwiające ustalenie:
a) początku i przebiegu choroby;
b) występowania objawów towarzyszących pęcherzycy, takich jak ból, świąd, zaburzenia połykania, utrata masy ciała, zmiany spojówkowe i laryngologiczne, zaburzenia w oddawaniu moczu, zmiany na narządach płciowych, zaburzenia neurologiczne;
c) występowania chorób i dolegliwości współistniejących, które wpływają na konieczność ograniczania dawek stosowanych glikokortykosteroidów i leków immunosupresyjnych; do takich chorób należą: cukrzyca, nadciśnienie, infekcje, nowotwory, choroby hematologiczne, endokrynologiczne i kardiologiczne;
d) czy pacjentka jest w ciąży lub czy stosuje skuteczną antykoncepcję, szczególnie gdy rozważane jest leczenie lekami immunosupresyjnymi u kobiety w wieku reprodukcyjnym;
e) przyjmowania w ciągu ostatnich 12 miesięcy przed wystąpieniem pęcherzycy leków uznanych za ją wywołujące i/lub podtrzymujące, tj.: d-penicylaminy, inhibitorów enzymu konwertującego angiotensynę, inhibitorów receptora dla angiotensyny, -adrenolityków, cefalosporyn, fenylobutazonu, pyritinolu, tioproniny, piroksykamu, ryfampicyny;
f) wpływu choroby na jakość życia (kwestionariusz jakości życia).
Badanie przedmiotowe
W badaniu przedmiotowym należy ustalić:
a) rozległość zmian skórnych lub śluzówkowych (skala PDAI – tab. 1.);
b) obecność zaburzeń funkcji narządów wewnętrznych, takich jak: utrudnione połykanie, utrata masy ciała, objawy dyzuryczne, osłabienie widzenia, opadanie powiek, diplopia, osłabienie siły mięśniowej;
c) nasilenie objawu Nikolskiego: typ 1 (dodatni w skórze zdrowej w okolicy zmian pęcherzowych), typ 2 (dodatni w skórze zdrowej oddalonej od zmian skórnych);
d) masę ciała, ciśnienie tętnicze, stan ogólny pacjenta (skala Karnowskiego).
Odmiany kliniczne pęcherzycy i jej przebieg
Pęcherzyca zwykła
Pęcherzyca zwykła (pemphigus vulgaris – PV) rozpoczyna się najczęściej podstępnie, niebolesnymi nadżerkami na błonach śluzowych policzków, podniebienia miękkiego oraz twardego i/lub nadżerkowym zapaleniem dziąseł. Początkowo sprawiające niewielkie dolegliwości nadżerki z czasem stają się bolesne i utrudniają przyjmowanie pokarmów. Rzadziej początek choroby jest nagły. Nadżerki mogą zajmować krtań, przełyk, spojówki, okolice narządów płciowych i odbyt [2, 9, 10].
Zmiany skórne występują po upływie kilku tygodni lub miesięcy i towarzyszą zmianom na błonach śluzowych. Mają charakter pęcherzy lub pęcherzyków o wiotkiej pokrywie, wypełnionych płynem surowiczym, które samoistnie pękają, tworząc sączące nadżerki, często są zlokalizowane na klatce piersiowej w okolicy łojotokowej, na twarzy, skórze owłosionej głowy, nierzadko rozpoczynają się w miejscach urażanych, w okolicach otworów naturalnych i fałdów skóry, okolicy pępka. Jeśli nie są leczone, mają tendencję do uogólniania się. Nadżerki powodują uczucie pieczenia, rzadziej świąd. W przypadkach pęcherzycy o ciężkim przebiegu mogą zajmować skórę owłosioną głowy i twarz. Innym objawem ciężkiej pęcherzycy jest spełzanie płytek paznokciowych.
Pęcherzyca bujająca
Pęcherzyca bujająca (pemphigus vegetans) jest bardzo rzadką odmianą pęcherzy zwykłej, która charakteryzuje się klinicznie obecnością zmian brodawkujących, bujających i krostkowych. W odmianie Neumana stwierdza się zmiany brodawkujące wokół ust, a w odmianie Hallopeau zmiany krostkowe i bujające występują w dołach pachowych i fałdach pachwinowych [2, 9, 10].
Pęcherzyca liściasta, łojotokowa i rumieniowa
Zmiany skórne o charakterze pęcherzy o wiotkiej pokrywie, szybko ulegających samoistnemu pękaniu, w przebiegu pęcherzycy liściastej, łojotokowej i rumieniowej (pemphigus foliaceus – PF) przekształcają się w miodowożółte strupy. Zmiany zlokalizowane są w górnej części klatki piersiowej i pleców, szczególnie w okolicach łojotokowych, a także na twarzy i skórze owłosionej głowy. W przypadkach nieleczonych może wystąpić erytrodermia. Błony śluzowe są wolne [2, 9, 10].
Pęcherzyca paraneoplastyczna
Pęcherzyca paraneoplastyczna (ang. paraneoplastic pemphigus/paraneoplastic multiorgan syndrome – PNP/PAMS) współistnieje z chorobami nowotworowymi, najczęściej z rozrostami limforetikularnymi, takimi jak nieziarnicze chłoniaki, przewlekła białaczka limfocytarna, a także z grasiczakiem i guzem Castlemana. U 1/3 chorych pęcherzyca jest wykrywana przed zdiagnozowaniem nowotworu, zwłaszcza że objawy PNP/PAMS mogą wyprzedzać chorobę nowotworową. Klinicznie ta odmiana pęcherzycy charakteryzuje się wybitną predylekcją do zajmowania błon śluzowych. Początkowo występuje zapalenie czerwieni warg, często krwotoczne, wrzodziejące zapalenie jamy ustnej, bolesne nadżerki prowadzące do zaburzeń połykania. Zmianom w jamie ustnej towarzyszy bliznowaciejące zapalenie spojówek i zapalenie rogówki, a także nadżerki na błonach śluzowych narządów płciowych. U części pacjentów nadżerki powstają w obrębie gardła, nosa oraz przełyku i powodują ból podczas połykania oraz refluks.
Zmiany skórne są wielopostaciowe – od przypominających liszaj płaski do zmian typu choroby przeszczep przeciw gospodarzowi (ang. graft versus host disease – GVHD), mogą przypominać także rumień wielopostaciowy lub pemfigoid, a najczęściej pęcherzycę zwykłą. Zmianom skórnym i śluzówkowym mogą towarzyszyć zagrażające życiu zmiany płucne o charakterze zapalenia pęcherzyków płucnych i/lub obturacyjnego zapalenia oskrzeli (bronchiolitis obliterans), które jest złym objawem rokowniczym [2, 9, 10].
Pęcherzyca opryszczkowata
Termin „pęcherzyca opryszczkowata” (pemphigus herpetiformis) został wprowadzony przez Jabłońską i wsp. w 1976 roku dla przypadków, w których obraz kliniczny przypomina dermatitis herpetiformis, a wyniki badań immunopatologicznych odpowiadają pęcherzycy [11]. U większości chorych objawy są ograniczone do skóry, a antygenem jest desmogleina 1, natomiast u około 20% stwierdza się zmiany śluzówkowe, a antygenem jest desmogleina 3. W ostatnich latach wykazano reaktywność surowic od chorych na pęcherzycę opryszczkowatą z desmokolinami. Ta odmiana pęcherzycy przebiega łagodnie w porównaniu z klasycznymi odmianami pemphigus i zwykle odpowiada na leczenie małymi dawkami prednizonu w połączeniu z dapsonem [12].
Pęcherzyca IgA
Znane są dwa warianty pęcherzycy mediowanej przeciwciałami IgA (pemphigus-IgA): subcorneal pustular dermatosis (SPD) oraz intra-epidermal neutrophilic type (IEN). Zmiany skórne mają charakter krost usadowionych na rumieniowej podstawie w SPD oraz krost o układzie obrączkowym na tułowiu w IEN [9, 10].
Diagnostyka laboratoryjna
Najważniejszym badaniem diagnostycznym dla rozpoznania pęcherzycy jest bezpośrednie badanie immunopatologiczne skóry lub błon śluzowych. Konieczne jest badanie surowicy metodami immunologicznymi, które umożliwia określenie antygenu rozpoznawanego przez autoprzeciwciała, co pozwala na ustalenie typu pęcherzycy.
Badanie histopatologiczne nie jest obligatoryjne, ale w szczególnych przypadkach może być pomocne.
Bezpośrednie badanie immunofluorescencyjne
Do bezpośredniego badania immunofluorescencyjnego (ang. direct immunofluorescence – DIF) należy pobrać wycinek ze skóry zdrowej w odległości nie większej niż 1 cm od zmiany. W przypadku zajęcia wyłącznie błon śluzowych wycinek pobiera się z otoczenia zmian w tej lokalizacji. Można też wykonać DIF włosów wyszarpniętych z owłosionej skóry głowy [13]. Pobrany wycinek powinien być przetransportowany do laboratorium w płynie Michela w temperaturze pokojowej lub zamrożony w ciekłym azocie i transportowany na suchym lodzie. Jeśli spodziewany czas transportu wycinka nie przekroczy 6 godzin, pobraną tkankę można przesyłać nawet w soli fizjologicznej w temperaturze otoczenia, natomiast idealnym rozwiązaniem jest skierowanie chorego do najbliższego ośrodka referencyjnego w celu konsultacji połączonej z pobraniem wycinka do badania immunopatologicznego.
W badaniu DIF stwierdza się związane in vivo linijne, rzadziej ziarniste złogi IgG, IgG4 i komplement (lub IgA w przypadkach pęcherzycy IgA) w przestrzeniach międzykomórkowych naskórka lub nabłonka. W przypadkach PNP/PAMS mogą być obecne ponadto linijne złogi IgG wzdłuż błony podstawnej [9, 10].
Pośrednie badanie immunofluorescencyjne
Badanie metodą immunofluorescencji pośredniej (ang. indirect immunofluorescence – IIF) przeprowadza się na kilku substratach. Przełyk małpy lub człowieka jest najlepszym substratem do wykrycia przeciwciał typowych dla pęcherzycy zwykłej, natomiast naskórek ludzki lub przełyk świnki morskiej okazuje się najlepszy do wykrywania przeciwciał typowych dla pęcherzycy liściastej. Płuco lub pęcherz moczowy szczura służą do wykrywania przeciwciał charakterystycznych dla PNP/PAMS. W badaniu IIF stwierdza się reakcję surowicy w przestrzeniach międzykomórkowych o układzie sieci rybackiej [10].
Do badań IIF można wykorzystać dostępne w handlu substraty scalone (Biochip), zawierające m.in. komórki transfekowane desmogleinami.
Badanie surowicy metodą ELISA
Dzięki badaniu metodą ELISA można stwierdzić reaktywność surowicy z desmogleiną 1 (Dsg1) w przypadku pęcherzycy liściastej lub z desmogleiną 3 (Dsg3) w przypadku pęcherzycy zwykłej ograniczonej do błon śluzowych, lub z Dsg3 i Dsg1 w przypadku pęcherzycy błon śluzowych i skóry [10]. Test ELISA jest dostępny komercyjnie. W Polsce badania te są wykonywane bezpłatnie u wszystkich chorych na pęcherzycę w wyznaczonych laboratoriach referencyjnych (Warszawa, Poznań).
Za pomocą testu ELISA możliwe jest wykrycie specyficznego IgG w 90% przypadków pęcherzycy badanych w aktywnej fazie choroby. Wyniki testu ELISA korelują z aktywnością choroby, rozległością zmian skórnych i mogą stanowić narzędzie do kontrolowania leczenia oraz oceny zagrożenia nawrotem choroby u osób będących w remisji klinicznej.
W przypadku podejrzenia PNP/PAMS test ELISA na desmogleiny może być pozytywny, dlatego diagnostyka immunologiczna tej odmiany pęcherzycy powinna być uzupełniona o metodę różnicującą z innymi odmianami pemphigus, np. test immunofluorescencyjny na pęcherzu moczowym szczura albo badanie techniką immunoblotu.
Immunoblot i immunoprecypitacja
Metody immunoblotu (IB) i immunoprecypitacji (IP) w przypadkach pęcherzycy zwykłej i liściastej mają charakter testów uzupełniających, natomiast są istotne w diagnostyce PNP/PAMS. Badania immunoblotu i immunoprecypitacji przeprowadza się na ekstrakcie z keratynocytów, co umożliwia ocenę reaktywności surowic z następującymi antygenami: enwoplakiną (210 kDa) i periplakiną (190 kDa) (obecnie dostępna komercyjnie również ELISA), desmogleiną 3 (130 kDa), desmogleiną 1 (160 kDa), desmokolinami, desmoplakinami, antygenem BP180 i BP230, plektyną (500 kDa) i 2-makroglobuliną (A2ML1, 170 kDa) [9].
Przeciwciała IgG przeciwko enwoplakinie i periplakinie i/lub A2ML1 są wysoce specyficzne dla PNP/PAMS. Przeciwciała IgG przeciwko desmoplakinom, antygenowi BP230 i plektynie mogą być obecne również w innych typach pęcherzycy [9].
Niemal 100-procentową czułość w diagnostyce PNP/PAMS uzyskuje się poprzez skojarzenie dwóch z trzech technik serologicznych (IIF/IB/IP) [9].
Badanie histopatologiczne
Wycinek wielkości 4 mm powinien być pobrany ze świeżego pęcherzyka (do 24 godzin), utrwalony w 4-procentowym roztworze formaliny i przesłany do rutynowego badania histopatologicznego. W przypadku pęcherzycy zwykłej i PNP/PAMS stwierdza się akantolizę ponad warstwą podstawną, a w przypadku pęcherzycy liściastej – podrogową. W przypadkach pęcherzyc IgA akantoliza może być nieobecna, a w obrazie mikroskopowym przeważają nacieki z granulocytów obojętnochłonnych (nacieki neutrofilowe). W przypadkach pęcherzycy IgA typu IEN nacieki neutrofilowe tworzą krosty śródnaskórkowe, a w przypadkach pęcherzycy IgA typu SPD nacieki neutrolifowe tworzą krosty podrogowe. W pęcherzycy opryszczkowej obraz histopatologiczny jest podobny do obrazu pęcherzycy IgA [10].
Badania niezbędne i zalecane przed leczeniem immunosupresyjnym
Przed rozpoczęciem leczenia ogólnego glikokortykosteroidami i lekami immunosupresyjnymi niezbędne jest wykonanie następujących badań:
a) morfologii z rozmazem,
b) kreatyniny i elektrolitów,
c) poziomu glikemii na czczo,
d) transaminaz, -glutamylotranspeptydazy, fosfatazy alkalicznej,
e) stężenia albumin i globulin,
f) ogólnego moczu,
g) rentgenografii klatki piersiowej.
Można zlecić badania i przeprowadzić następujące konsultacje:
a) HBV, HCV, HIV,
b) ultrasonografia jamy brzusznej,
c) Quantiferone lub PPD w przypadku ryzyka wystąpienia gruźlicy,
d) aktywność G6PD w surowicy, stężenie bilirubiny, retikulocyty, jeśli planowana jest terapia dapsonem,
e) -HCG w celu wykluczenia ciąży u kobiet w wieku reprodukcyjnym,
f) osteodensytometria przed leczeniem glikokortykosteroidami,
g) konsultacja okulistyczna w celu wykluczenia jaskry lub zaćmy,
h) konsultacja laryngologiczna, urologiczna, neurologiczna w przypadku obecności zmian na błonach śluzowych jamy ustnej i narządów płciowych oraz zaburzeń neurologicznych,
i) poziom (niedobór) IgA w surowicy, jeśli planowane jest leczenie IVIG.
Leczenie
Założenia
Celami leczenia są zagojenie zmian na skórze i błonach śluzowych, zapobieganie nawrotom choroby, ograniczenie działań ubocznych długotrwałej immunosupresji i/lub glikokortykosteroidoterapii i w efekcie poprawa jakości życia pacjentów.
Pacjenci z ciężką pęcherzycą błon śluzowych i skóry oraz pęcherzycą PNP/PAMS wymagają hospitalizacji. Z chwilą uzyskania konsolidacji zmian skórnych, co pozwala na obniżanie dawek leków, pacjenci mogą być leczeni ambulatoryjnie, podobnie jak większość chorych z ograniczonymi i łagodnymi odmianami pęcherzycy. Leczenie powinno być prowadzone przez dermatologa doświadczonego w terapii pęcherzycy w ścisłej współpracy z ośrodkiem klinicznym, co zapewnia możliwość diagnostyki laboratoryjnej i monitoringu leczenia. W przypadku pęcherzycy występującej u dzieci terapię powinien prowadzić zespół specjalistów na czele z dermatologiem doświadczonym w leczeniu dzieci w ścisłej współpracy z ośrodkiem klinicznym oraz pediatrą.
Leki pierwszego rzutu
Glikokortykosteroidy. W leczeniu pęcherzycy lekiem pierwszego rzutu jest prednizon lub prednizolon w dawce początkowej 1,0–1,5 mg/kg m.c. w pęcherzycy zwykłej błon śluzowych i skóry. W pęcherzycy ograniczonej do błon śluzowych lub w pęcherzycy liściastej dawka początkowa może być mniejsza (0,5–1,0 mg/kg m.c.). W przypadku nieuzyskania kontroli zmian skórnych w ciągu 2 tygodni leczenia dawka prednizonu lub prednizolonu powinna być zwiększona maksymalnie do 2 mg/kg m.c. Glikokortykosteroidy powinny być kojarzone z lekami immunosupresyjnymi od początku terapii w przypadkach ciężkiej pęcherzycy i/lub w przypadkach zwiększonego ryzyka wystąpienia działań ubocznych związanych z przewlekłą glikokortykosteroidoterapią [8, 9, 14–17]. Leki immunosupresyjne. Lekiem immunosupresyjnym pierwszego rzutu wg stanowiska grupy eksperckiej, który powinien być stosowany w połączeniu z prednizonem, jest azatiopryna (w dawce 1–3 mg/kg m.c./dobę). Leczenie należy rozpocząć od dawki 50 mg/dobę w celu sprawdzenia tolerancji leku, a następnie (po tygodniu) stopniowo zwiększać dawkę pod kontrolą morfologii (i ewentualnie badania aktywności metylotransferazy tiopurynowej, TPMT) [18].
Leki drugiego rzutu
Do leków drugiego wyboru stosowanych w leczeniu pęcherzycy zalicza się:
a) mykofenolan mofetylu w dawce 2 g/dobę (lub kwas mykofenolowy w dawce 1440 mg/dobę). Leki te należy rozważać w przypadkach nietolerancji azatiopryny. W terapii należy stopniowo zwiększać dawkę leku o jedną kapsułkę tygodniowo w celu zwiększenia tolerancji leku [15];
b) monoklonalne przeciwciała anty-CD20 (np. rytuksymab 2 × 1 γ i.v. w dwóch dawkach podzielonych, podawanych co 2 tygodnie lub 4 × 375 mg/m2 podawanych co tydzień) [19–22];
c) dożylne immunoglobuliny (IVIG) w dawce 2 g/kg m.c. przez 3–5 dni (pulsy podawane co miesiąc) [23];
d) cyklofosfamid doustnie w dawce 1–2 mg/kg m.c./dobę lub dożylnie w dawce 500 mg/miesiąc [24, 25];
e) w uzasadnionych przypadkach metyloprednizolon dożylnie w dawce 0,5–1 g/dobę przez 3 kolejne dni w miesiącu z następczym stosowaniem metyloprednizolonu doustnie w dawce początkowej odpowiadającej 0,5–0,75 mg prednizonu/kg m.c./dobę, stopniowo zmniejszanej [5, 26];
f) dapson w dawce 100 mg/dobę lub ≤ 1,5 mg/kg m.c./dobę [27].
Przeciwciała monoklonalne anty-CD20 (rytuksymab lub ofatumumab)
Rytuksymab lub ofatumumab są wskazane u pacjentów, u których nie można odstawić leczenia z powodu nawrotów, a dawka prednizonu kontrolująca chorobę jest wyższa niż 10 mg/dobę w połączeniu z lekiem immunosupresyjnym. Są to przypadki tzw. kortykosteroidozależne [22]. Ponadto podawanie rytuksymabu jest postępowaniem z wyboru w przypadkach pęcherzycy opornej na leczenie immunosupresyjne – przypadki tzw. kortykosteroidooporne. Za takie uważa się przypadki pęcherzycy leczonej pełną dawką prednizonu i azatiopryny, w których w ciągu 3 miesięcy leczenia nie można uzyskać kontroli zmian skórnych. Rytuksymab jest lekiem pierwszego rzutu w pęcherzycy paraneoplastycznej [22]. Rytuksymab podaje się w dawce 1000 mg w odstępie 2 tygodni albo 4 × 375 mg/m2 raz w tygodniu przez 4 kolejne tygodnie. Podawanie rytuksymabu powinno być skojarzone ze zmniejszeniem dawek glikokortykosteroidów i leków immunosupresyjnych. Podawanie rytuksymabu może być skojarzone z krótkotrwałym (do 4 miesięcy) podawaniem prednizonu oraz długoterminowym (powyżej 12 miesięcy) stosowaniem leków immunosupresyjnych. W przypadku nawrotu choroby należy rozważyć podanie pojedynczej dawki 500 mg, ale nie wcześniej niż po upływie 6 miesięcy od ostatniego podania leku [22]. Ciężkie powikłania związane ze stosowaniem rytuksymabu, takie jak postępująca wieloogniskowa encefalopatia oraz zagrażające życiu infekcje, występują rzadko i są trudne do precyzyjnego oszacowania. Znane są też doniesienia, że rytuksymab zastosowany jako terapia wyjściowa lub inicjująca umożliwia uzyskanie trwałej remisji choroby.
Ofatumumab jest lekiem dostępnym w Polsce jedynie w badaniach klinicznych.
Dożylne immunoglobuliny
Leczenie immunoglobulinami dożylnymi (IVIG) powinno być skojarzone z podawaniem glikokortykosteroidów na początku terapii. Leki te stosuje się w dawce 2 g/kg m.c./cykl, przy czym cykl trwa 2–5 dni, a cykle powtarza się początkowo co miesiąc [20]. Taki sposób podawania IVIG pozwala na uniknięcie bólów głowy i nudności. Ważnym, choć rzadkim powikłaniem leczenia IVIG jest zapalenie opon mózgowo-rdzeniowych, które występuje najczęściej u osób z napadami migreny. Przeciwwskazaniem do terapii IVIG jest niedobór IgA.
Immunoadsorpcja
Immunoadsorpcja jest metodą wykorzystywaną w Niemczech do leczenia chorych na pęcherzycę, którzy nie odpowiedzieli dostatecznie na standardowe leczenie immunosupresyjne (prednizon w połączeniu z azatiopryną lub mykofenolanem mofetylu). W Polsce metoda ta jest obecnie niedostępna [28].
Leczenie wspomagające
Leczenie pęcherzycy wspomagają:
a) żel z fluocynolonem na nadżerki na błonach śluzowych jamy ustnej [28, 29],
b) ostrzykiwanie nadżerek zlokalizowanych na błonach śluzowych acetonidem triamcinolonu,
c) propionian klobetazolu lub inhibitory kalcyneuryny na nadżerki na skórze,
d) środki antyseptyczne, np. roztwór oktenidyny do odkażania nadżerek,
e) opatrunki antyadhezyjne stosowane na rozległe nadżerki w okolicach urażanych,
f) środki przeciwbólowe, takie jak paracetamol lub opioidy, w razie potrzeby,
g) żele z miejscowymi analgetykami do stosowania na błony śluzowe,
h) kontrola laryngologiczna lub stomatologiczna,
i) ustalenie odpowiedniej diety z dietetykiem (u osób z utrudnionym połykaniem oraz powikłaniami glikokortykosteroidoterapii ogólnej).
Przewlekła glikokortykosteroidoterapia
W przypadku przewlekłej glikokortykosteroidoterapii stosuje się inhibitory pompy protonowej jako profilaktykę choroby wrzodowej, suplementację potasem, włącza profilaktykę osteoporozy, jeśli planowane leczenie jest dłuższe niż 6 miesięcy (suplementacja witaminą D i wapniem). Należy również przeprowadzić ocenę osteoporozy (densytometria na początku terapii oraz co 2 lata), kontrolę okulistyczną (zaćma, jaskra), włączyć profilaktykę przeciwgrzybiczą (flukonazol w dawce 200 mg/tydzień), ogólne leczenie przeciwgrzybicze, przeciwwirusowe i antybiotykoterapię w koniecznych przypadkach, leki przeciwkrzepliwe u chorych z ryzykiem wystąpienia zatorowości oraz zastosować wsparcie psychologiczne.
Monitorowanie leczenia
Pęcherzyca ma przewlekły i nawrotowy przebieg, który wymaga stałego kontrolowania zmian skórnych i śluzówkowych, parametrów immunologicznych choroby i potencjalnych działań ubocznych stosowanych leków. Monitorowanie umożliwia ocenę skuteczności i bezpieczeństwa leczenia, a także ustalenie planu systematycznej, powolnej redukcji dawek leków immunosupresyjnych, aż do ich odstawienia.
Definicje parametrów aktywności klinicznej pęcherzycy
Kontrola aktywności choroby to moment, w którym przestają pojawiać się nowe zmiany pęcherzowe, a nadżerki zaczynają się goić. Faza konsolidacji to okres minimum 2 tygodni, w którym minimum 80% zmian skórnych uległo wygojeniu, a nowe zmiany nie powstają. Od tego momentu można rozpocząć stopniowe redukowanie dawek leków immunosupresyjnych. Remisja całkowita podtrzymywana leczeniem definiowana jest jako brak zmian skórnych przy stosowaniu minimalnych dawek leków (prednizon w dawce ≤ 10 mg/dobę lub ekwiwalent przez minimum 2 miesiące). Remisja bez leczenia to stan braku zmian skórnych trwający co najmniej 2 miesiące od odstawienia terapii. Nawrót choroby oznacza pojawianie się 3 lub więcej nowych zmian w ciągu miesiąca obserwacji, które nie goją się samoistnie w ciągu tygodnia [31].
Postępowanie po uzyskaniu konsolidacji choroby
Czas do zagojenia się zmian skórnych wynosi zwykle 1–3 miesięcy, natomiast zmniejszanie dawki prednizonu należy rozpocząć z chwilą uzyskania fazy konsolidacji. Dawki prednizonu powinno się zmniejszać o 20% w odstępach 2-tygodniowych do uzyskania dawki 20 mg/dobę, a potem obniżać je wolniej. W razie pojawienia się pojedynczych zmian (1 lub 2) w czasie zmniejszania dawki glikokortykosteroidów wskazany jest powrót do leczenia poprzednią skuteczną dawką. W razie nawrotu choroby (pojawienie się 3 i więcej nowych zmian) dawka prednizonu powinna być zwiększona o dwa poziomy i stosowana do uzyskania kontroli zmian skórnych, a następnie ponownie zmniejszana co 2 tygodnie, natomiast w przypadku nieuzyskania kontroli zmian skórnych należy powrócić do dawki początkowej. W razie nawrotu pęcherzycy u osób leczonych wyłącznie prednizonem powinno się dołączyć lek immunosupresyjny. W przypadku nawrotu pęcherzycy u osób leczonych prednizonem w połączeniu z lekiem immunosupresyjnym należy zmienić lek immunosupresyjny albo jeśli jest to możliwe, rozważyć leczenie IVIG lub rytuksymabem [17–20]. Trzeba jednocześnie pamiętać, że zwiększenie dawki leków immunosupresyjnych podnosi ryzyko wystąpienia powikłań, dlatego pacjent wymaga szczególnej kontroli. Utrzymywanie się wysokiego poziomu przeciwciał skierowanych przeciwko Dsg1 w badaniu ELISA zwiastuje nawrót choroby, podczas gdy wysoki poziom przeciwciał anti-Dsg3 nie zawsze koreluje z nawrotem zmian na błonach śluzowych [9].
Schemat kontroli pacjenta
Skuteczność prowadzonego leczenia ocenia się głównie na podstawie badania klinicznego. Częstość wizyt lekarskich i ewentualnych badań zależy od stanu klinicznego pacjenta, ciężkości zmian skórnych w czasie leczenia (skala PDAI), rodzaju stosowanych leków pod kątem ich tolerancji i ewentualnych działań ubocznych. Początkowo wizyty powinny być planowane co 2 tygodnie do momentu kontroli choroby, następnie raz na miesiąc przez kolejne 3 miesiące, później co 2 miesiące [31].
W czasie wizyt kontrolnych należy zwracać uwagę, czy prowadzone leczenie kontroluje zmiany skórne i zmiany na błonach śluzowych, a także czy występują ewentualne działania niepożądane stosowanego leczenia, w szczególności:
• zależne od przewlekłej glikokortykosteroidoterapii, takie jak: cukrzyca, nadciśnienie tętnicze, niewydolność serca, choroby psychiczne, zaćma, jaskra, osteoporoza,
• zależne od stosowania glikokortykosteroidów z lekami immunosupresyjnymi; infekcje, szczególnie układu oddechowego, zapalenie wątroby,
• zależne od stosowania leków immunosupresyjnych – zaburzenia hematologiczne, np. leukopenia, i choroby układu oddechowego, a w przypadku stosowania dapsonu – niedokrwistość, zapalenie wątroby.
Informacje dla pacjentów i osób upoważnionych do informowania o stanie zdrowia
Pacjenci i osoby upoważnione do informowania o stanie zdrowia powinni być powiadomieni o:
a) przebiegu i rokowaniu choroby, występowaniu możliwych nawrotów,
b) możliwości jej leczenia i występowaniu ewentualnych działań ubocznych leków.
Należy pacjentów uprzedzić o istnieniu czynników zaostrzających pęcherzycę lub powodujących jej nawrót. Do takich czynników zalicza się opalanie, stosowanie niektórych leków (patrz wywiad, punkt e), dietę bogatą w składniki zawierające grupy tiolowe (por, cebula, czosnek).
W Polsce nie ma dotychczas grup wsparcia dla chorych na pęcherzycę i ich rodzin, ale pacjenci powinni być zachęcani do ich utworzenia w porozumieniu z takimi grupami działającymi w Europie Zachodniej i USA, jak: International Pemphigus and Pemphigoid Foundation (www.pemphigus.org), Pemphigus und Pemphigoid Selbsthilfe e. V. (www.pemphigus-pemphigoid-selbsthilfe.de), Pemphigus-Pemphigoid-France (www.pemphigus.asso.fr), Pemphigus Vulgaris Network (www.pemphigus.org.uk).
Piśmiennictwo
1. Joly P., Litrowski N.: Pemphigus group (vulgaris, vegetans, foliaceus, herpetiformis, brasiliensis). Clin Dermatol 2011, 29, 432-436.
2. Kneisel A., Hertl M.: Autoimmune bullous skin diseases. Part 1: clinical manifestations. J Dtsch Dermatol Ges 2011, 9,: 844-856.
3. Kneisel A., Hertl M.: Autoimmune bullous skin diseases. Part 2: diagnosis and therapy. J Dtsch Dermatol Ges 2011, 9, 927-947.
4. Amagai M., Klaus-Kovtun V., Stanley J.R.: Autoantibodies against a novel epithelial cadherin in pemphigus vulgaris, a disease of cell adhesion. Cell 1991, 67, 869-877.
5. Dańczak-Pazdrowska A., Pazdrowski J., Bowszyc-Dmochowska M., Dmochowski M.: Zmiany w krtani w pęcherzycy zwykłej z dominacją zmian na błonach śluzowych. Otolaryngol Pol 2007, 61, 509-512.
6. Martin L.K., Werth V., Villanueva E., Segall J., Murrell D.F.: Interventions for pemphigus vulgaris and pemphigus foliaceus. Cochrane Database Syst Rev 2009, 1, CD006263.
7. Martin L.K., Werth V.P., Villaneuva E.V., Murrell D.F.: A systematic review of randomized controlled trials for pemphigus vulgaris and pemphigus foliaceus. J Am Acad Dermatol 2011, 64, 903-908.
8. Joly P., Bernard P., Bedane C., Prost C., Ingen-Housz- Oro S.: Pemphigus. Guidelines for the diagnosis and treatment. Centres de reference des maladies bulleuses autoimmunes. Societe Francaise de Dermatologie. Ann Dermatol Venereol 2011, 138, 252-258.
9. Hertl M., Karpati S., Borradori L., Feliciani C., Joly P., Kowalewski C. i inni: Development of European Guideline Autoimmune Bullous Diseases guided by The European Academy od Dermatology and Veneorology (EADV). Pemphigus. S2 Guideline for diagnosis and treatment. JEADV 2014 (submitted).
10. Mihai S., Sitaru C.: Immunopathology and molecular diagnosis of autoimmune bullous diseases. J Cell Mol Med 2007, 11, 462-481.
11. Jablonska S., Chorzelski T.P., Beutner E.H., Jarząbek-Cho- rzelska M.: Herpetiform pemphigus, a variable pattern of pemphigus. Int J Dermatol 1975, 14, 353-359.
12. Kasperkiewicz M., Kowalewski C., Jabłońska S.: Pemphigus herpetiformis: from first description until now. J Am Acad Dermatol 2014, 70, 780-787.
13. Dańczak-Pazdrowska A., Bowszyc-Dmochowska M., Mariak I., Dmochowski M.: Pęcherzyca zwykła u dwóch braci. Pęcherzycowe złogi IgG4 w mieszkach włosowych. Postep Derm Alergol 2003, 20, 365-370.
14. Chams-Davatchi C., Mortazavizadeh A., Daneshpazhooh M., Davatchi F., Balighi K., Esmaili N. i inni: Randomized double blind trial of prednisolone and azathioprine, vs. prednisolone and placebo, in the treatment of pemphigus vulgaris. JEADV 2013, 27, 1285-1292.
15. Beissert S., Werfel T., Frieling U., Bohm M., Sticherling M., Stadler R. i inni: A comparison of oral methylprednisolone plus azathioprine or mycophenolate mofetil for the treatment of pemphigus. Arch Dermatol 2006, 142, 1447-1454.
16. Ioannides D., Apalla Z., Lazaridou E., Rigopoulos D.: Evaluation of mycophenolate mofetil as a steroid-sparing agent in pemphigus: a randomized, prospective study. JEADV 2012, 26, 855-860.
17. Chams-Davatchi C., Esmaili N., Daneshpazhooh M., Valikhani M., Balighi K., Hallaji Z. i inni: Randomized controlled open-label trial of four treatment regimens for pemphigus vulgaris. J Am Acad Dermatol 2007, 57, 622-628.
18. Jackson A.P., Hall A.G., McLelland J.: Thiopurine methyltransferase levels should be measured before commencing patients on azathioprine. Br J Dermatol 1997, 136, 133-134.
19. Kasperkiewicz M., Shimanovich I., Meier M., Schumacher N., Westermann L., Kramer J. i inni: Treatment of severe pemphigus with a combination of immunoadsorption, rituximab, pulsed dexamethasone and azathioprine/mycophenolate mofetil: a pilot study of 23 patients. Br J Dermatol 2012, 166, 154-160.
20. Ahmed A.R., Spigelman Z., Cavacini L.A., Posner M.R.: Treatment of pemphigus vulgaris with rituximab and intravenous immune globulin. N Engl J Med 2006, 355, 1772-1779.
21. Joly P., Mouquet H., Roujeau J.C., D’Incan M., Gilbert D., Jacquot S. i inni: A single cycle of rituximab for the treatment of severe pemphigus. N Engl J Med 2007, 357, 545-552.
22. Hertl M., Zillikens D., Borradori L., Bruckner-Tuderman L., Burckhard H., Eming R. i inni: Recommendations for the use of rituximab (anti-CD20 antibody) in the treatment of autoimmune bullous skin diseases. J Dtsch Dermatol Ges 2008, 6, 366-373.
23. Amagai M., Ikeda S., Shimizu H., Iizuka H., Hanada K., Aiba S. i inni: A randomized double-blind trial of intravenous immunoglobulin for pemphigus. J Am Acad Dermatol 2009, 60, 595-603.
24. Pasricha J.S., Khaitan B.K., Raman R.S., Chandra M.: Dexamethasone-cyclophosphamide pulse therapy for pemphigus. Int J Dermatol 1995, 34, 875-882.
25. Nousari C.H., Brodsky R., Anhalt G.J.: Evaluating the role of immunoablative high-dose cyclophosphamide therapy in pemphigus vulgaris. J Am Acad Dermatol 2003, 49, 148-150.
26. Jakubowicz O., Bowszyc-Dmochowska M., Gawęcki W., Gornowicz J., Dmochowski M.: Przypadek śluzówkowo-dominującej odmiany pęcherzycy zwykłej z wykwitami w krtani i złogami pęcherzycowymi we włosach wyszarpniętych z klinicznie niezmienionej skóry. Dermatol Klin 2010, 12, 256-260.
27. Werth V.P., Fivenson D., Pandya A.G., Chen D., Rico M.J., Albrecht J. i inni: Multicenter randomized, double-blind, placebo-controlled, clinical trial of dapsone as a glucocorticoid-sparing agent in maintenance-phase pemphigus vulgaris. Arch Dermatol 2008, 144, 25-32.
28. Zillikens D., Derfler K., Eming R., Fierlbeck G., Goebeler M., Hertl M. i inni: Recommendations for the use of immunoapheresis in the treatment of autoimmune bullous diseases. J Dtsch Dermatol Ges 2007, 5, 881-887.
29. Iraji F., Asilian A., Siadat A.H.: Pimecrolimus 1% cream in the treatment of cutaneous lesions of pemphigus vulgaris: a double-blind, placebo-controlled clinical trial. J Drugs Dermatol 2010, 9, 684-686.
30. Cohen S.N., Lim R.P., Paul C.J., Abdullah A.: Equal efficacy of topical tacrolimus and clobetasone butyrate in pemphigus foliaceus. Int J Dermatol 2006, 45, 1379.
31. Murrell D.F., Dick S., Ahmed A.R., Amagai M., Barnadas M.A., Borradori L. i inni: Consensus statement on definitions of disease, end points, and therapeutic response for pemphigus. J Am Acad Dermatol 2008, 58, 1043-1046.
Pęcherzyca jest akantolityczną chorobą pęcherzową błon śluzowych i/lub skóry, wywołaną obecnością patogennych autoprzeciwciał w krążeniu oraz związanych in vivo w przestrzeniach międzykomórkowych naskórka, które są skierowane przeciwko rozmaitym cząsteczkom adhezyjnym desmosomów. Obraz i przebieg kliniczny poszczególnych odmian pęcherzycy zależy od rodzaju antygenu rozpoznawanego przez autoprzeciwciała oraz stopnia zaawansowania procesu chorobowego [1–3]. Diagnostyka pęcherzycy opiera się na stwierdzeniu obecności przeciwciał IgG, rzadko IgA, związanych w przestrzeniach międzykomórkowych wielowarstwowego nabłonka skóry i/lub błon śluzowych w bezpośrednim badaniu immunopatologicznym, które powinno być uzupełnione badaniami immunologicznymi surowicy pozwalającymi na określenie antygenu rozpoznawanego przez autoprzeciwciała, co umożliwia rozpoznanie odmiany klinicznej pęcherzycy [4]. Leczenie tej potencjalnie śmiertelnej choroby polega na stosowaniu glikokortykosteroidów skojarzonych z lekami immunosupresyjnymi, najczęściej azatiopryną, przy czym inne leki immunosupresyjne, leki biologiczne czy dożylnie podawane immunoglobuliny znajdują zastosowanie w przypadkach opornych na klasyczne leczenie oraz w rzadkich odmianach pęcherzycy [5–7].
Do tej pory nie stworzono ogólnoświatowego konsensusu dotyczącego diagnostyki i leczenia pęcherzycy, chociaż w niektórych krajach już powołano grupy eksperckie, które opracowały wytyczne dotyczące postępowania dla dermatologów w swoich krajach [8]. Poniżej przedstawiamy konsensus diagnostyki i leczenia pęcherzycy opracowany przez grupę ekspertów powołaną przez Zarząd Główny Polskiego Towarzystwa Dermatologicznego, oparty na wytycznych Europejskiego Towarzystwa Akademii Dermatologii i Wenerologii [9] oraz uwzględniający warunki i ograniczenia prawno-finansowe w Polsce.
Informacje kliniczne
Badanie podmiotowe Wywiad powinien obejmować informacje umożliwiające ustalenie:
a) początku i przebiegu choroby;
b) występowania objawów towarzyszących pęcherzycy, takich jak ból, świąd, zaburzenia połykania, utrata masy ciała, zmiany spojówkowe i laryngologiczne, zaburzenia w oddawaniu moczu, zmiany na narządach płciowych, zaburzenia neurologiczne;
c) występowania chorób i dolegliwości współistniejących, które wpływają na konieczność ograniczania dawek stosowanych glikokortykosteroidów i leków immunosupresyjnych; do takich chorób należą: cukrzyca, nadciśnienie, infekcje, nowotwory, choroby hematologiczne, endokrynologiczne i kardiologiczne;
d) czy pacjentka jest w ciąży lub czy stosuje skuteczną antykoncepcję, szczególnie gdy rozważane jest leczenie lekami immunosupresyjnymi u kobiety w wieku reprodukcyjnym;
e) przyjmowania w ciągu ostatnich 12 miesięcy przed wystąpieniem pęcherzycy leków uznanych za ją wywołujące i/lub podtrzymujące, tj.: d-penicylaminy, inhibitorów enzymu konwertującego angiotensynę, inhibitorów receptora dla angiotensyny, -adrenolityków, cefalosporyn, fenylobutazonu, pyritinolu, tioproniny, piroksykamu, ryfampicyny;
f) wpływu choroby na jakość życia (kwestionariusz jakości życia).
Badanie przedmiotowe
W badaniu przedmiotowym należy ustalić:
a) rozległość zmian skórnych lub śluzówkowych (skala PDAI – tab. 1.);
b) obecność zaburzeń funkcji narządów wewnętrznych, takich jak: utrudnione połykanie, utrata masy ciała, objawy dyzuryczne, osłabienie widzenia, opadanie powiek, diplopia, osłabienie siły mięśniowej;
c) nasilenie objawu Nikolskiego: typ 1 (dodatni w skórze zdrowej w okolicy zmian pęcherzowych), typ 2 (dodatni w skórze zdrowej oddalonej od zmian skórnych);
d) masę ciała, ciśnienie tętnicze, stan ogólny pacjenta (skala Karnowskiego).
Odmiany kliniczne pęcherzycy i jej przebieg
Pęcherzyca zwykła
Pęcherzyca zwykła (pemphigus vulgaris – PV) rozpoczyna się najczęściej podstępnie, niebolesnymi nadżerkami na błonach śluzowych policzków, podniebienia miękkiego oraz twardego i/lub nadżerkowym zapaleniem dziąseł. Początkowo sprawiające niewielkie dolegliwości nadżerki z czasem stają się bolesne i utrudniają przyjmowanie pokarmów. Rzadziej początek choroby jest nagły. Nadżerki mogą zajmować krtań, przełyk, spojówki, okolice narządów płciowych i odbyt [2, 9, 10].
Zmiany skórne występują po upływie kilku tygodni lub miesięcy i towarzyszą zmianom na błonach śluzowych. Mają charakter pęcherzy lub pęcherzyków o wiotkiej pokrywie, wypełnionych płynem surowiczym, które samoistnie pękają, tworząc sączące nadżerki, często są zlokalizowane na klatce piersiowej w okolicy łojotokowej, na twarzy, skórze owłosionej głowy, nierzadko rozpoczynają się w miejscach urażanych, w okolicach otworów naturalnych i fałdów skóry, okolicy pępka. Jeśli nie są leczone, mają tendencję do uogólniania się. Nadżerki powodują uczucie pieczenia, rzadziej świąd. W przypadkach pęcherzycy o ciężkim przebiegu mogą zajmować skórę owłosioną głowy i twarz. Innym objawem ciężkiej pęcherzycy jest spełzanie płytek paznokciowych.
Pęcherzyca bujająca
Pęcherzyca bujająca (pemphigus vegetans) jest bardzo rzadką odmianą pęcherzy zwykłej, która charakteryzuje się klinicznie obecnością zmian brodawkujących, bujających i krostkowych. W odmianie Neumana stwierdza się zmiany brodawkujące wokół ust, a w odmianie Hallopeau zmiany krostkowe i bujające występują w dołach pachowych i fałdach pachwinowych [2, 9, 10].
Pęcherzyca liściasta, łojotokowa i rumieniowa
Zmiany skórne o charakterze pęcherzy o wiotkiej pokrywie, szybko ulegających samoistnemu pękaniu, w przebiegu pęcherzycy liściastej, łojotokowej i rumieniowej (pemphigus foliaceus – PF) przekształcają się w miodowożółte strupy. Zmiany zlokalizowane są w górnej części klatki piersiowej i pleców, szczególnie w okolicach łojotokowych, a także na twarzy i skórze owłosionej głowy. W przypadkach nieleczonych może wystąpić erytrodermia. Błony śluzowe są wolne [2, 9, 10].
Pęcherzyca paraneoplastyczna
Pęcherzyca paraneoplastyczna (ang. paraneoplastic pemphigus/paraneoplastic multiorgan syndrome – PNP/PAMS) współistnieje z chorobami nowotworowymi, najczęściej z rozrostami limforetikularnymi, takimi jak nieziarnicze chłoniaki, przewlekła białaczka limfocytarna, a także z grasiczakiem i guzem Castlemana. U 1/3 chorych pęcherzyca jest wykrywana przed zdiagnozowaniem nowotworu, zwłaszcza że objawy PNP/PAMS mogą wyprzedzać chorobę nowotworową. Klinicznie ta odmiana pęcherzycy charakteryzuje się wybitną predylekcją do zajmowania błon śluzowych. Początkowo występuje zapalenie czerwieni warg, często krwotoczne, wrzodziejące zapalenie jamy ustnej, bolesne nadżerki prowadzące do zaburzeń połykania. Zmianom w jamie ustnej towarzyszy bliznowaciejące zapalenie spojówek i zapalenie rogówki, a także nadżerki na błonach śluzowych narządów płciowych. U części pacjentów nadżerki powstają w obrębie gardła, nosa oraz przełyku i powodują ból podczas połykania oraz refluks.
Zmiany skórne są wielopostaciowe – od przypominających liszaj płaski do zmian typu choroby przeszczep przeciw gospodarzowi (ang. graft versus host disease – GVHD), mogą przypominać także rumień wielopostaciowy lub pemfigoid, a najczęściej pęcherzycę zwykłą. Zmianom skórnym i śluzówkowym mogą towarzyszyć zagrażające życiu zmiany płucne o charakterze zapalenia pęcherzyków płucnych i/lub obturacyjnego zapalenia oskrzeli (bronchiolitis obliterans), które jest złym objawem rokowniczym [2, 9, 10].
Pęcherzyca opryszczkowata
Termin „pęcherzyca opryszczkowata” (pemphigus herpetiformis) został wprowadzony przez Jabłońską i wsp. w 1976 roku dla przypadków, w których obraz kliniczny przypomina dermatitis herpetiformis, a wyniki badań immunopatologicznych odpowiadają pęcherzycy [11]. U większości chorych objawy są ograniczone do skóry, a antygenem jest desmogleina 1, natomiast u około 20% stwierdza się zmiany śluzówkowe, a antygenem jest desmogleina 3. W ostatnich latach wykazano reaktywność surowic od chorych na pęcherzycę opryszczkowatą z desmokolinami. Ta odmiana pęcherzycy przebiega łagodnie w porównaniu z klasycznymi odmianami pemphigus i zwykle odpowiada na leczenie małymi dawkami prednizonu w połączeniu z dapsonem [12].
Pęcherzyca IgA
Znane są dwa warianty pęcherzycy mediowanej przeciwciałami IgA (pemphigus-IgA): subcorneal pustular dermatosis (SPD) oraz intra-epidermal neutrophilic type (IEN). Zmiany skórne mają charakter krost usadowionych na rumieniowej podstawie w SPD oraz krost o układzie obrączkowym na tułowiu w IEN [9, 10].
Diagnostyka laboratoryjna
Najważniejszym badaniem diagnostycznym dla rozpoznania pęcherzycy jest bezpośrednie badanie immunopatologiczne skóry lub błon śluzowych. Konieczne jest badanie surowicy metodami immunologicznymi, które umożliwia określenie antygenu rozpoznawanego przez autoprzeciwciała, co pozwala na ustalenie typu pęcherzycy.
Badanie histopatologiczne nie jest obligatoryjne, ale w szczególnych przypadkach może być pomocne.
Bezpośrednie badanie immunofluorescencyjne
Do bezpośredniego badania immunofluorescencyjnego (ang. direct immunofluorescence – DIF) należy pobrać wycinek ze skóry zdrowej w odległości nie większej niż 1 cm od zmiany. W przypadku zajęcia wyłącznie błon śluzowych wycinek pobiera się z otoczenia zmian w tej lokalizacji. Można też wykonać DIF włosów wyszarpniętych z owłosionej skóry głowy [13]. Pobrany wycinek powinien być przetransportowany do laboratorium w płynie Michela w temperaturze pokojowej lub zamrożony w ciekłym azocie i transportowany na suchym lodzie. Jeśli spodziewany czas transportu wycinka nie przekroczy 6 godzin, pobraną tkankę można przesyłać nawet w soli fizjologicznej w temperaturze otoczenia, natomiast idealnym rozwiązaniem jest skierowanie chorego do najbliższego ośrodka referencyjnego w celu konsultacji połączonej z pobraniem wycinka do badania immunopatologicznego.
W badaniu DIF stwierdza się związane in vivo linijne, rzadziej ziarniste złogi IgG, IgG4 i komplement (lub IgA w przypadkach pęcherzycy IgA) w przestrzeniach międzykomórkowych naskórka lub nabłonka. W przypadkach PNP/PAMS mogą być obecne ponadto linijne złogi IgG wzdłuż błony podstawnej [9, 10].
Pośrednie badanie immunofluorescencyjne
Badanie metodą immunofluorescencji pośredniej (ang. indirect immunofluorescence – IIF) przeprowadza się na kilku substratach. Przełyk małpy lub człowieka jest najlepszym substratem do wykrycia przeciwciał typowych dla pęcherzycy zwykłej, natomiast naskórek ludzki lub przełyk świnki morskiej okazuje się najlepszy do wykrywania przeciwciał typowych dla pęcherzycy liściastej. Płuco lub pęcherz moczowy szczura służą do wykrywania przeciwciał charakterystycznych dla PNP/PAMS. W badaniu IIF stwierdza się reakcję surowicy w przestrzeniach międzykomórkowych o układzie sieci rybackiej [10].
Do badań IIF można wykorzystać dostępne w handlu substraty scalone (Biochip), zawierające m.in. komórki transfekowane desmogleinami.
Badanie surowicy metodą ELISA
Dzięki badaniu metodą ELISA można stwierdzić reaktywność surowicy z desmogleiną 1 (Dsg1) w przypadku pęcherzycy liściastej lub z desmogleiną 3 (Dsg3) w przypadku pęcherzycy zwykłej ograniczonej do błon śluzowych, lub z Dsg3 i Dsg1 w przypadku pęcherzycy błon śluzowych i skóry [10]. Test ELISA jest dostępny komercyjnie. W Polsce badania te są wykonywane bezpłatnie u wszystkich chorych na pęcherzycę w wyznaczonych laboratoriach referencyjnych (Warszawa, Poznań).
Za pomocą testu ELISA możliwe jest wykrycie specyficznego IgG w 90% przypadków pęcherzycy badanych w aktywnej fazie choroby. Wyniki testu ELISA korelują z aktywnością choroby, rozległością zmian skórnych i mogą stanowić narzędzie do kontrolowania leczenia oraz oceny zagrożenia nawrotem choroby u osób będących w remisji klinicznej.
W przypadku podejrzenia PNP/PAMS test ELISA na desmogleiny może być pozytywny, dlatego diagnostyka immunologiczna tej odmiany pęcherzycy powinna być uzupełniona o metodę różnicującą z innymi odmianami pemphigus, np. test immunofluorescencyjny na pęcherzu moczowym szczura albo badanie techniką immunoblotu.
Immunoblot i immunoprecypitacja
Metody immunoblotu (IB) i immunoprecypitacji (IP) w przypadkach pęcherzycy zwykłej i liściastej mają charakter testów uzupełniających, natomiast są istotne w diagnostyce PNP/PAMS. Badania immunoblotu i immunoprecypitacji przeprowadza się na ekstrakcie z keratynocytów, co umożliwia ocenę reaktywności surowic z następującymi antygenami: enwoplakiną (210 kDa) i periplakiną (190 kDa) (obecnie dostępna komercyjnie również ELISA), desmogleiną 3 (130 kDa), desmogleiną 1 (160 kDa), desmokolinami, desmoplakinami, antygenem BP180 i BP230, plektyną (500 kDa) i 2-makroglobuliną (A2ML1, 170 kDa) [9].
Przeciwciała IgG przeciwko enwoplakinie i periplakinie i/lub A2ML1 są wysoce specyficzne dla PNP/PAMS. Przeciwciała IgG przeciwko desmoplakinom, antygenowi BP230 i plektynie mogą być obecne również w innych typach pęcherzycy [9].
Niemal 100-procentową czułość w diagnostyce PNP/PAMS uzyskuje się poprzez skojarzenie dwóch z trzech technik serologicznych (IIF/IB/IP) [9].
Badanie histopatologiczne
Wycinek wielkości 4 mm powinien być pobrany ze świeżego pęcherzyka (do 24 godzin), utrwalony w 4-procentowym roztworze formaliny i przesłany do rutynowego badania histopatologicznego. W przypadku pęcherzycy zwykłej i PNP/PAMS stwierdza się akantolizę ponad warstwą podstawną, a w przypadku pęcherzycy liściastej – podrogową. W przypadkach pęcherzyc IgA akantoliza może być nieobecna, a w obrazie mikroskopowym przeważają nacieki z granulocytów obojętnochłonnych (nacieki neutrofilowe). W przypadkach pęcherzycy IgA typu IEN nacieki neutrofilowe tworzą krosty śródnaskórkowe, a w przypadkach pęcherzycy IgA typu SPD nacieki neutrolifowe tworzą krosty podrogowe. W pęcherzycy opryszczkowej obraz histopatologiczny jest podobny do obrazu pęcherzycy IgA [10].
Badania niezbędne i zalecane przed leczeniem immunosupresyjnym
Przed rozpoczęciem leczenia ogólnego glikokortykosteroidami i lekami immunosupresyjnymi niezbędne jest wykonanie następujących badań:
a) morfologii z rozmazem,
b) kreatyniny i elektrolitów,
c) poziomu glikemii na czczo,
d) transaminaz, -glutamylotranspeptydazy, fosfatazy alkalicznej,
e) stężenia albumin i globulin,
f) ogólnego moczu,
g) rentgenografii klatki piersiowej.
Można zlecić badania i przeprowadzić następujące konsultacje:
a) HBV, HCV, HIV,
b) ultrasonografia jamy brzusznej,
c) Quantiferone lub PPD w przypadku ryzyka wystąpienia gruźlicy,
d) aktywność G6PD w surowicy, stężenie bilirubiny, retikulocyty, jeśli planowana jest terapia dapsonem,
e) -HCG w celu wykluczenia ciąży u kobiet w wieku reprodukcyjnym,
f) osteodensytometria przed leczeniem glikokortykosteroidami,
g) konsultacja okulistyczna w celu wykluczenia jaskry lub zaćmy,
h) konsultacja laryngologiczna, urologiczna, neurologiczna w przypadku obecności zmian na błonach śluzowych jamy ustnej i narządów płciowych oraz zaburzeń neurologicznych,
i) poziom (niedobór) IgA w surowicy, jeśli planowane jest leczenie IVIG.
Leczenie
Założenia
Celami leczenia są zagojenie zmian na skórze i błonach śluzowych, zapobieganie nawrotom choroby, ograniczenie działań ubocznych długotrwałej immunosupresji i/lub glikokortykosteroidoterapii i w efekcie poprawa jakości życia pacjentów.
Pacjenci z ciężką pęcherzycą błon śluzowych i skóry oraz pęcherzycą PNP/PAMS wymagają hospitalizacji. Z chwilą uzyskania konsolidacji zmian skórnych, co pozwala na obniżanie dawek leków, pacjenci mogą być leczeni ambulatoryjnie, podobnie jak większość chorych z ograniczonymi i łagodnymi odmianami pęcherzycy. Leczenie powinno być prowadzone przez dermatologa doświadczonego w terapii pęcherzycy w ścisłej współpracy z ośrodkiem klinicznym, co zapewnia możliwość diagnostyki laboratoryjnej i monitoringu leczenia. W przypadku pęcherzycy występującej u dzieci terapię powinien prowadzić zespół specjalistów na czele z dermatologiem doświadczonym w leczeniu dzieci w ścisłej współpracy z ośrodkiem klinicznym oraz pediatrą.
Leki pierwszego rzutu
Glikokortykosteroidy. W leczeniu pęcherzycy lekiem pierwszego rzutu jest prednizon lub prednizolon w dawce początkowej 1,0–1,5 mg/kg m.c. w pęcherzycy zwykłej błon śluzowych i skóry. W pęcherzycy ograniczonej do błon śluzowych lub w pęcherzycy liściastej dawka początkowa może być mniejsza (0,5–1,0 mg/kg m.c.). W przypadku nieuzyskania kontroli zmian skórnych w ciągu 2 tygodni leczenia dawka prednizonu lub prednizolonu powinna być zwiększona maksymalnie do 2 mg/kg m.c. Glikokortykosteroidy powinny być kojarzone z lekami immunosupresyjnymi od początku terapii w przypadkach ciężkiej pęcherzycy i/lub w przypadkach zwiększonego ryzyka wystąpienia działań ubocznych związanych z przewlekłą glikokortykosteroidoterapią [8, 9, 14–17]. Leki immunosupresyjne. Lekiem immunosupresyjnym pierwszego rzutu wg stanowiska grupy eksperckiej, który powinien być stosowany w połączeniu z prednizonem, jest azatiopryna (w dawce 1–3 mg/kg m.c./dobę). Leczenie należy rozpocząć od dawki 50 mg/dobę w celu sprawdzenia tolerancji leku, a następnie (po tygodniu) stopniowo zwiększać dawkę pod kontrolą morfologii (i ewentualnie badania aktywności metylotransferazy tiopurynowej, TPMT) [18].
Leki drugiego rzutu
Do leków drugiego wyboru stosowanych w leczeniu pęcherzycy zalicza się:
a) mykofenolan mofetylu w dawce 2 g/dobę (lub kwas mykofenolowy w dawce 1440 mg/dobę). Leki te należy rozważać w przypadkach nietolerancji azatiopryny. W terapii należy stopniowo zwiększać dawkę leku o jedną kapsułkę tygodniowo w celu zwiększenia tolerancji leku [15];
b) monoklonalne przeciwciała anty-CD20 (np. rytuksymab 2 × 1 γ i.v. w dwóch dawkach podzielonych, podawanych co 2 tygodnie lub 4 × 375 mg/m2 podawanych co tydzień) [19–22];
c) dożylne immunoglobuliny (IVIG) w dawce 2 g/kg m.c. przez 3–5 dni (pulsy podawane co miesiąc) [23];
d) cyklofosfamid doustnie w dawce 1–2 mg/kg m.c./dobę lub dożylnie w dawce 500 mg/miesiąc [24, 25];
e) w uzasadnionych przypadkach metyloprednizolon dożylnie w dawce 0,5–1 g/dobę przez 3 kolejne dni w miesiącu z następczym stosowaniem metyloprednizolonu doustnie w dawce początkowej odpowiadającej 0,5–0,75 mg prednizonu/kg m.c./dobę, stopniowo zmniejszanej [5, 26];
f) dapson w dawce 100 mg/dobę lub ≤ 1,5 mg/kg m.c./dobę [27].
Przeciwciała monoklonalne anty-CD20 (rytuksymab lub ofatumumab)
Rytuksymab lub ofatumumab są wskazane u pacjentów, u których nie można odstawić leczenia z powodu nawrotów, a dawka prednizonu kontrolująca chorobę jest wyższa niż 10 mg/dobę w połączeniu z lekiem immunosupresyjnym. Są to przypadki tzw. kortykosteroidozależne [22]. Ponadto podawanie rytuksymabu jest postępowaniem z wyboru w przypadkach pęcherzycy opornej na leczenie immunosupresyjne – przypadki tzw. kortykosteroidooporne. Za takie uważa się przypadki pęcherzycy leczonej pełną dawką prednizonu i azatiopryny, w których w ciągu 3 miesięcy leczenia nie można uzyskać kontroli zmian skórnych. Rytuksymab jest lekiem pierwszego rzutu w pęcherzycy paraneoplastycznej [22]. Rytuksymab podaje się w dawce 1000 mg w odstępie 2 tygodni albo 4 × 375 mg/m2 raz w tygodniu przez 4 kolejne tygodnie. Podawanie rytuksymabu powinno być skojarzone ze zmniejszeniem dawek glikokortykosteroidów i leków immunosupresyjnych. Podawanie rytuksymabu może być skojarzone z krótkotrwałym (do 4 miesięcy) podawaniem prednizonu oraz długoterminowym (powyżej 12 miesięcy) stosowaniem leków immunosupresyjnych. W przypadku nawrotu choroby należy rozważyć podanie pojedynczej dawki 500 mg, ale nie wcześniej niż po upływie 6 miesięcy od ostatniego podania leku [22]. Ciężkie powikłania związane ze stosowaniem rytuksymabu, takie jak postępująca wieloogniskowa encefalopatia oraz zagrażające życiu infekcje, występują rzadko i są trudne do precyzyjnego oszacowania. Znane są też doniesienia, że rytuksymab zastosowany jako terapia wyjściowa lub inicjująca umożliwia uzyskanie trwałej remisji choroby.
Ofatumumab jest lekiem dostępnym w Polsce jedynie w badaniach klinicznych.
Dożylne immunoglobuliny
Leczenie immunoglobulinami dożylnymi (IVIG) powinno być skojarzone z podawaniem glikokortykosteroidów na początku terapii. Leki te stosuje się w dawce 2 g/kg m.c./cykl, przy czym cykl trwa 2–5 dni, a cykle powtarza się początkowo co miesiąc [20]. Taki sposób podawania IVIG pozwala na uniknięcie bólów głowy i nudności. Ważnym, choć rzadkim powikłaniem leczenia IVIG jest zapalenie opon mózgowo-rdzeniowych, które występuje najczęściej u osób z napadami migreny. Przeciwwskazaniem do terapii IVIG jest niedobór IgA.
Immunoadsorpcja
Immunoadsorpcja jest metodą wykorzystywaną w Niemczech do leczenia chorych na pęcherzycę, którzy nie odpowiedzieli dostatecznie na standardowe leczenie immunosupresyjne (prednizon w połączeniu z azatiopryną lub mykofenolanem mofetylu). W Polsce metoda ta jest obecnie niedostępna [28].
Leczenie wspomagające
Leczenie pęcherzycy wspomagają:
a) żel z fluocynolonem na nadżerki na błonach śluzowych jamy ustnej [28, 29],
b) ostrzykiwanie nadżerek zlokalizowanych na błonach śluzowych acetonidem triamcinolonu,
c) propionian klobetazolu lub inhibitory kalcyneuryny na nadżerki na skórze,
d) środki antyseptyczne, np. roztwór oktenidyny do odkażania nadżerek,
e) opatrunki antyadhezyjne stosowane na rozległe nadżerki w okolicach urażanych,
f) środki przeciwbólowe, takie jak paracetamol lub opioidy, w razie potrzeby,
g) żele z miejscowymi analgetykami do stosowania na błony śluzowe,
h) kontrola laryngologiczna lub stomatologiczna,
i) ustalenie odpowiedniej diety z dietetykiem (u osób z utrudnionym połykaniem oraz powikłaniami glikokortykosteroidoterapii ogólnej).
Przewlekła glikokortykosteroidoterapia
W przypadku przewlekłej glikokortykosteroidoterapii stosuje się inhibitory pompy protonowej jako profilaktykę choroby wrzodowej, suplementację potasem, włącza profilaktykę osteoporozy, jeśli planowane leczenie jest dłuższe niż 6 miesięcy (suplementacja witaminą D i wapniem). Należy również przeprowadzić ocenę osteoporozy (densytometria na początku terapii oraz co 2 lata), kontrolę okulistyczną (zaćma, jaskra), włączyć profilaktykę przeciwgrzybiczą (flukonazol w dawce 200 mg/tydzień), ogólne leczenie przeciwgrzybicze, przeciwwirusowe i antybiotykoterapię w koniecznych przypadkach, leki przeciwkrzepliwe u chorych z ryzykiem wystąpienia zatorowości oraz zastosować wsparcie psychologiczne.
Monitorowanie leczenia
Pęcherzyca ma przewlekły i nawrotowy przebieg, który wymaga stałego kontrolowania zmian skórnych i śluzówkowych, parametrów immunologicznych choroby i potencjalnych działań ubocznych stosowanych leków. Monitorowanie umożliwia ocenę skuteczności i bezpieczeństwa leczenia, a także ustalenie planu systematycznej, powolnej redukcji dawek leków immunosupresyjnych, aż do ich odstawienia.
Definicje parametrów aktywności klinicznej pęcherzycy
Kontrola aktywności choroby to moment, w którym przestają pojawiać się nowe zmiany pęcherzowe, a nadżerki zaczynają się goić. Faza konsolidacji to okres minimum 2 tygodni, w którym minimum 80% zmian skórnych uległo wygojeniu, a nowe zmiany nie powstają. Od tego momentu można rozpocząć stopniowe redukowanie dawek leków immunosupresyjnych. Remisja całkowita podtrzymywana leczeniem definiowana jest jako brak zmian skórnych przy stosowaniu minimalnych dawek leków (prednizon w dawce ≤ 10 mg/dobę lub ekwiwalent przez minimum 2 miesiące). Remisja bez leczenia to stan braku zmian skórnych trwający co najmniej 2 miesiące od odstawienia terapii. Nawrót choroby oznacza pojawianie się 3 lub więcej nowych zmian w ciągu miesiąca obserwacji, które nie goją się samoistnie w ciągu tygodnia [31].
Postępowanie po uzyskaniu konsolidacji choroby
Czas do zagojenia się zmian skórnych wynosi zwykle 1–3 miesięcy, natomiast zmniejszanie dawki prednizonu należy rozpocząć z chwilą uzyskania fazy konsolidacji. Dawki prednizonu powinno się zmniejszać o 20% w odstępach 2-tygodniowych do uzyskania dawki 20 mg/dobę, a potem obniżać je wolniej. W razie pojawienia się pojedynczych zmian (1 lub 2) w czasie zmniejszania dawki glikokortykosteroidów wskazany jest powrót do leczenia poprzednią skuteczną dawką. W razie nawrotu choroby (pojawienie się 3 i więcej nowych zmian) dawka prednizonu powinna być zwiększona o dwa poziomy i stosowana do uzyskania kontroli zmian skórnych, a następnie ponownie zmniejszana co 2 tygodnie, natomiast w przypadku nieuzyskania kontroli zmian skórnych należy powrócić do dawki początkowej. W razie nawrotu pęcherzycy u osób leczonych wyłącznie prednizonem powinno się dołączyć lek immunosupresyjny. W przypadku nawrotu pęcherzycy u osób leczonych prednizonem w połączeniu z lekiem immunosupresyjnym należy zmienić lek immunosupresyjny albo jeśli jest to możliwe, rozważyć leczenie IVIG lub rytuksymabem [17–20]. Trzeba jednocześnie pamiętać, że zwiększenie dawki leków immunosupresyjnych podnosi ryzyko wystąpienia powikłań, dlatego pacjent wymaga szczególnej kontroli. Utrzymywanie się wysokiego poziomu przeciwciał skierowanych przeciwko Dsg1 w badaniu ELISA zwiastuje nawrót choroby, podczas gdy wysoki poziom przeciwciał anti-Dsg3 nie zawsze koreluje z nawrotem zmian na błonach śluzowych [9].
Schemat kontroli pacjenta
Skuteczność prowadzonego leczenia ocenia się głównie na podstawie badania klinicznego. Częstość wizyt lekarskich i ewentualnych badań zależy od stanu klinicznego pacjenta, ciężkości zmian skórnych w czasie leczenia (skala PDAI), rodzaju stosowanych leków pod kątem ich tolerancji i ewentualnych działań ubocznych. Początkowo wizyty powinny być planowane co 2 tygodnie do momentu kontroli choroby, następnie raz na miesiąc przez kolejne 3 miesiące, później co 2 miesiące [31].
W czasie wizyt kontrolnych należy zwracać uwagę, czy prowadzone leczenie kontroluje zmiany skórne i zmiany na błonach śluzowych, a także czy występują ewentualne działania niepożądane stosowanego leczenia, w szczególności:
• zależne od przewlekłej glikokortykosteroidoterapii, takie jak: cukrzyca, nadciśnienie tętnicze, niewydolność serca, choroby psychiczne, zaćma, jaskra, osteoporoza,
• zależne od stosowania glikokortykosteroidów z lekami immunosupresyjnymi; infekcje, szczególnie układu oddechowego, zapalenie wątroby,
• zależne od stosowania leków immunosupresyjnych – zaburzenia hematologiczne, np. leukopenia, i choroby układu oddechowego, a w przypadku stosowania dapsonu – niedokrwistość, zapalenie wątroby.
Informacje dla pacjentów i osób upoważnionych do informowania o stanie zdrowia
Pacjenci i osoby upoważnione do informowania o stanie zdrowia powinni być powiadomieni o:
a) przebiegu i rokowaniu choroby, występowaniu możliwych nawrotów,
b) możliwości jej leczenia i występowaniu ewentualnych działań ubocznych leków.
Należy pacjentów uprzedzić o istnieniu czynników zaostrzających pęcherzycę lub powodujących jej nawrót. Do takich czynników zalicza się opalanie, stosowanie niektórych leków (patrz wywiad, punkt e), dietę bogatą w składniki zawierające grupy tiolowe (por, cebula, czosnek).
W Polsce nie ma dotychczas grup wsparcia dla chorych na pęcherzycę i ich rodzin, ale pacjenci powinni być zachęcani do ich utworzenia w porozumieniu z takimi grupami działającymi w Europie Zachodniej i USA, jak: International Pemphigus and Pemphigoid Foundation (www.pemphigus.org), Pemphigus und Pemphigoid Selbsthilfe e. V. (www.pemphigus-pemphigoid-selbsthilfe.de), Pemphigus-Pemphigoid-France (www.pemphigus.asso.fr), Pemphigus Vulgaris Network (www.pemphigus.org.uk).
Piśmiennictwo
1. Joly P., Litrowski N.: Pemphigus group (vulgaris, vegetans, foliaceus, herpetiformis, brasiliensis). Clin Dermatol 2011, 29, 432-436.
2. Kneisel A., Hertl M.: Autoimmune bullous skin diseases. Part 1: clinical manifestations. J Dtsch Dermatol Ges 2011, 9,: 844-856.
3. Kneisel A., Hertl M.: Autoimmune bullous skin diseases. Part 2: diagnosis and therapy. J Dtsch Dermatol Ges 2011, 9, 927-947.
4. Amagai M., Klaus-Kovtun V., Stanley J.R.: Autoantibodies against a novel epithelial cadherin in pemphigus vulgaris, a disease of cell adhesion. Cell 1991, 67, 869-877.
5. Dańczak-Pazdrowska A., Pazdrowski J., Bowszyc-Dmochowska M., Dmochowski M.: Zmiany w krtani w pęcherzycy zwykłej z dominacją zmian na błonach śluzowych. Otolaryngol Pol 2007, 61, 509-512.
6. Martin L.K., Werth V., Villanueva E., Segall J., Murrell D.F.: Interventions for pemphigus vulgaris and pemphigus foliaceus. Cochrane Database Syst Rev 2009, 1, CD006263.
7. Martin L.K., Werth V.P., Villaneuva E.V., Murrell D.F.: A systematic review of randomized controlled trials for pemphigus vulgaris and pemphigus foliaceus. J Am Acad Dermatol 2011, 64, 903-908.
8. Joly P., Bernard P., Bedane C., Prost C., Ingen-Housz- Oro S.: Pemphigus. Guidelines for the diagnosis and treatment. Centres de reference des maladies bulleuses autoimmunes. Societe Francaise de Dermatologie. Ann Dermatol Venereol 2011, 138, 252-258.
9. Hertl M., Karpati S., Borradori L., Feliciani C., Joly P., Kowalewski C. i inni: Development of European Guideline Autoimmune Bullous Diseases guided by The European Academy od Dermatology and Veneorology (EADV). Pemphigus. S2 Guideline for diagnosis and treatment. JEADV 2014 (submitted).
10. Mihai S., Sitaru C.: Immunopathology and molecular diagnosis of autoimmune bullous diseases. J Cell Mol Med 2007, 11, 462-481.
11. Jablonska S., Chorzelski T.P., Beutner E.H., Jarząbek-Cho- rzelska M.: Herpetiform pemphigus, a variable pattern of pemphigus. Int J Dermatol 1975, 14, 353-359.
12. Kasperkiewicz M., Kowalewski C., Jabłońska S.: Pemphigus herpetiformis: from first description until now. J Am Acad Dermatol 2014, 70, 780-787.
13. Dańczak-Pazdrowska A., Bowszyc-Dmochowska M., Mariak I., Dmochowski M.: Pęcherzyca zwykła u dwóch braci. Pęcherzycowe złogi IgG4 w mieszkach włosowych. Postep Derm Alergol 2003, 20, 365-370.
14. Chams-Davatchi C., Mortazavizadeh A., Daneshpazhooh M., Davatchi F., Balighi K., Esmaili N. i inni: Randomized double blind trial of prednisolone and azathioprine, vs. prednisolone and placebo, in the treatment of pemphigus vulgaris. JEADV 2013, 27, 1285-1292.
15. Beissert S., Werfel T., Frieling U., Bohm M., Sticherling M., Stadler R. i inni: A comparison of oral methylprednisolone plus azathioprine or mycophenolate mofetil for the treatment of pemphigus. Arch Dermatol 2006, 142, 1447-1454.
16. Ioannides D., Apalla Z., Lazaridou E., Rigopoulos D.: Evaluation of mycophenolate mofetil as a steroid-sparing agent in pemphigus: a randomized, prospective study. JEADV 2012, 26, 855-860.
17. Chams-Davatchi C., Esmaili N., Daneshpazhooh M., Valikhani M., Balighi K., Hallaji Z. i inni: Randomized controlled open-label trial of four treatment regimens for pemphigus vulgaris. J Am Acad Dermatol 2007, 57, 622-628.
18. Jackson A.P., Hall A.G., McLelland J.: Thiopurine methyltransferase levels should be measured before commencing patients on azathioprine. Br J Dermatol 1997, 136, 133-134.
19. Kasperkiewicz M., Shimanovich I., Meier M., Schumacher N., Westermann L., Kramer J. i inni: Treatment of severe pemphigus with a combination of immunoadsorption, rituximab, pulsed dexamethasone and azathioprine/mycophenolate mofetil: a pilot study of 23 patients. Br J Dermatol 2012, 166, 154-160.
20. Ahmed A.R., Spigelman Z., Cavacini L.A., Posner M.R.: Treatment of pemphigus vulgaris with rituximab and intravenous immune globulin. N Engl J Med 2006, 355, 1772-1779.
21. Joly P., Mouquet H., Roujeau J.C., D’Incan M., Gilbert D., Jacquot S. i inni: A single cycle of rituximab for the treatment of severe pemphigus. N Engl J Med 2007, 357, 545-552.
22. Hertl M., Zillikens D., Borradori L., Bruckner-Tuderman L., Burckhard H., Eming R. i inni: Recommendations for the use of rituximab (anti-CD20 antibody) in the treatment of autoimmune bullous skin diseases. J Dtsch Dermatol Ges 2008, 6, 366-373.
23. Amagai M., Ikeda S., Shimizu H., Iizuka H., Hanada K., Aiba S. i inni: A randomized double-blind trial of intravenous immunoglobulin for pemphigus. J Am Acad Dermatol 2009, 60, 595-603.
24. Pasricha J.S., Khaitan B.K., Raman R.S., Chandra M.: Dexamethasone-cyclophosphamide pulse therapy for pemphigus. Int J Dermatol 1995, 34, 875-882.
25. Nousari C.H., Brodsky R., Anhalt G.J.: Evaluating the role of immunoablative high-dose cyclophosphamide therapy in pemphigus vulgaris. J Am Acad Dermatol 2003, 49, 148-150.
26. Jakubowicz O., Bowszyc-Dmochowska M., Gawęcki W., Gornowicz J., Dmochowski M.: Przypadek śluzówkowo-dominującej odmiany pęcherzycy zwykłej z wykwitami w krtani i złogami pęcherzycowymi we włosach wyszarpniętych z klinicznie niezmienionej skóry. Dermatol Klin 2010, 12, 256-260.
27. Werth V.P., Fivenson D., Pandya A.G., Chen D., Rico M.J., Albrecht J. i inni: Multicenter randomized, double-blind, placebo-controlled, clinical trial of dapsone as a glucocorticoid-sparing agent in maintenance-phase pemphigus vulgaris. Arch Dermatol 2008, 144, 25-32.
28. Zillikens D., Derfler K., Eming R., Fierlbeck G., Goebeler M., Hertl M. i inni: Recommendations for the use of immunoapheresis in the treatment of autoimmune bullous diseases. J Dtsch Dermatol Ges 2007, 5, 881-887.
29. Iraji F., Asilian A., Siadat A.H.: Pimecrolimus 1% cream in the treatment of cutaneous lesions of pemphigus vulgaris: a double-blind, placebo-controlled clinical trial. J Drugs Dermatol 2010, 9, 684-686.
30. Cohen S.N., Lim R.P., Paul C.J., Abdullah A.: Equal efficacy of topical tacrolimus and clobetasone butyrate in pemphigus foliaceus. Int J Dermatol 2006, 45, 1379.
31. Murrell D.F., Dick S., Ahmed A.R., Amagai M., Barnadas M.A., Borradori L. i inni: Consensus statement on definitions of disease, end points, and therapeutic response for pemphigus. J Am Acad Dermatol 2008, 58, 1043-1046.
Źródło:
Cezary Kowalewski, Marian Dmochowski, Waldemar Placek, Elżbieta Waszczykowska, Roman Nowicki, Iwona Flisiak, Rafał Czajkowski, Ligia Brzezińska-Wcisło, Jacek Szepietowski, Andrzej Kaszuba, Katarzyna Woźniak Przegl Dermatol 2014, 101, 147–155 DOI (digital
Cezary Kowalewski, Marian Dmochowski, Waldemar Placek, Elżbieta Waszczykowska, Roman Nowicki, Iwona Flisiak, Rafał Czajkowski, Ligia Brzezińska-Wcisło, Jacek Szepietowski, Andrzej Kaszuba, Katarzyna Woźniak Przegl Dermatol 2014, 101, 147–155 DOI (digital




