Nadmierna potliwość – przyczyny i możliwości terapeutyczne

Nadpotliwość to wstydliwa dolegliwość, z którą pacjent często próbuje walczyć samodzielnie. Może obniżać jakość funkcjonowania, a nawet prowadzić do wycofania się z życia społecznego. W diagnostyce hiperhydrozy należy pamiętać o wykluczeniu jej wtórnych przyczyn i zaproponować optymalną formę terapii. Zalecane jest rozpoczynanie leczenia od preparatów miejscowych, następnie leczenie ogólne lub zabiegowe, a w ostateczności metody chirurgiczne.
Artykuł Olgi Jabłonowskiej, Anny Woźniackiej i Bożeny Dziankowskiej-Bartkowiak z Kliniki Dermatologii i Wenerologii Uniwersytetu Medycznego w Łodzi:
– Gruczoły potowe odgrywają ważną rolę w termoregulacji organizmu i mają ścisły związek z autonomicznym układem nerwowym. W stanie spoczynku pot wydzielany jest stale w niewielkich ilościach, jednak w wyniku zadziałania bodźca termicznego lub emocjonalnego jego produkcja się nasila1. Organizm człowieka ma cztery miliony gruczołów potowych, z czego ok. 75 proc. stanowią gruczoły ekrynowe, natomiast pozostałe to gruczoły apokrynowe. W hiperhydrozie pierwotnej główną funkcję pełni wzmożona aktywność gruczołów ekrynowych.
Gruczoły ekrynowe występują na powierzchni całej skóry, w największej ilości na dłoniach, czole, podeszwach stóp oraz w dołach pachowych. Czynność gruczołów ekrynowych zależy od układu cholinergicznego. Aktywność części wydzielniczej pobudzana jest przez bodźce termiczne, emocjonalne i smakowe. Główną funkcję gruczołów stanowi termoregulacja organizmu. Pot ekrynowy jest bezwonnym, hipotonicznym roztworem zawierającym sód, potas, chlorki, mocznik, kwas moczowy, mleczany, aminy biogenne, śladowe ilości aminokwasów i witaminy2. U osób dializowanych z powodu niewydolności nerek występuje wyższe stężenie toksyn mocznicowych w pocie3. Wraz z potem wydalane są również toksyny, takie jak alkohol etylowy, fenazon, kwas benzoesowy, kwas salicylowy, ołów, rtęć i żelazo4.
Gruczoły apokrynowe rozwijają się wraz z zawiązkami włosów między czwartym a piątym miesiącem życia płodowego, jednak dopiero w okresie dojrzewania powiększają się i uczynniają. U dorosłego człowieka zlokalizowane są głównie w okolicy pachowej, genitalnej, odbytu, wokół pępka, na brodawkach sutkowych, a także sporadycznie na tułowiu i głowie. Ich unerwienie jest adrenergiczne. Pot apokrynowy jest pierwotnie bezwonny, jasny, mętny, lepki, zawiera cholesterol, triglicerydy oraz kwasy tłuszczowe. Charakterystyczny zapach powstający po jego wydzieleniu wynika z rozkładu produktów przemiany zachodzącej pod wpływem skórnej flory bakteryjnej2.
Nadmierna, przekraczająca fizjologiczne potrzeby organizmu produkcja potu określana jest terminem hiperhydrozy. Dotyczy zarówno kobiet, jak i mężczyzn w różnym wieku5. Ostatnio przeprowadzone badanie w Stanach Zjednoczonych wykazało, że aż 17 proc. nastolatków zgłasza problem nadmiernego wydzielania potu6. Wyróżniono dwie postacie hiperhydrozy: pierwotną i wtórną.
Postacie – hiperhydroza pierwotna
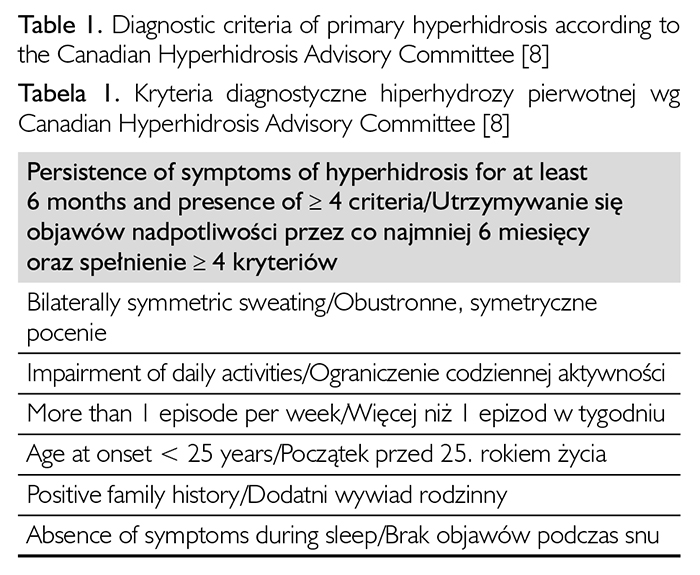
Analizując przyczyny hiperhydrozy, stwierdzono, że w 90proc. ma ona charakter pierwotny7. Pozostałe przypadki uznaje się za nadpotliwość wtórną. W etiopatologii postaci pierwotnej upatruje się przyczyn genetycznych, emocjonalnych oraz środowiskowych. Według Canadian Hyperhidrosis Advisory Committee, aby rozpoznać hiperhydrozę pierwotną, należy potwierdzić utrzymywanie się objawów przez co najmniej 6 miesięcy oraz stwierdzić cztery z sześciu wymienionych kryteriów: obustronna i symetryczna lokalizacja, wpływ na codzienną aktywność, więcej niż 1 epizod w tygodniu, początek przed 25. rokiem życia, dodatni wywiad rodzinny, brak objawów podczas snu8 (tabela 1).
Hiperhydroza pierwotna w większości przypadków obejmuje ograniczony obszar skóry. Najczęściej dotyczy rąk, stóp, pach oraz twarzy. Zwykle lokalizuje się jednocześnie w kilku obszarach anatomicznych [9]. Częstość występowania hiperhydrozy pierwotnej różni się w zależności od regionu świata. W badaniach przeprowadzonych w Stanach Zjednoczonych występuje u 2,8–4,8 proc. , Szwecji 5,5 proc., Niemczech 4,6 proc., Japonii 12,8 proc., Kanadzie (Vancouver) 12,3 proc. , Chinach (Szanghaju) 14,5 proc. osób w populacji10–14.
Postacie – hiperhydroza wtórna
Hiperhydroza wtórna współistnieje z innymi chorobami lub jest spowodowana przyjmowaniem leków. Może pojawić się między innymi w przebiegu nadczynności tarczycy, cukrzycy, otyłości, gruźlicy, zapalenia wsierdzia, choroby Parkinsona, guzów chromochłonnych oraz chłoniaków Hodgkina. Wśród przyczyn nadpotliwości wymieniane są również leki, takie jak neuroleptyki, leki przeciwdepresyjne, leki hipoglikemizujące, tryptany, opioidy, antybiotyki (ciprofloksacyna), leki przeciwwirusowe (acyklowir), leki przeciwwymiotne, przeciwgorączkowe, niesteroidowe leki przeciwzapalne, substancje o działaniu adrenergicznym oraz cholinergicznym7. W stanie fizjologii hiperhydroza wtórna często występuje w okresie ciąży, menopauzy oraz podczas ekspozycji na wysokie temperatury. W jej przebiegu nadpotliwość zwykle dotyczy całego ciała, przybierając postać uogólnioną5.
Hiperhydroza może również towarzyszyć rzadkim zespołom chorobowym, takim jak zespół Frey, zespół Rileya-Daya, zespół paznokieć–rzepka15-17. Inny podział uwzględnia lokalizację i wyróżnia hiperhydrozę uogólnioną, obejmującą praktycznie całą skórę, oraz ograniczoną, dotyczącą w szczególności pewnych obszarów, najczęściej pach, stóp, rąk lub twarzy (tab. 2, 3).


Diagnostyka
W procesie diagnozowania nadmiernej potliwości kluczowe znaczenie mają badania podmiotowe i przedmiotowe oraz badania laboratoryjne wykonane w celu wykluczenia hiperhydrozy wtórnej. Nadpotliwość może być pierwszym objawem umożliwiającym rozpoznanie zaburzeń endokrynologicznych, chorób układu sercowo-naczyniowego, a nawet nowotworów. U chorych zgłaszających nadmierne pocenie w nocy należy wykluczyć gruźlicę oraz choroby rozrostowe układu krwiotwórczego. W takich przypadkach priorytetem jest leczenie choroby podstawowej. Pierwotny charakter hiperhydrozy rozpoznawany jest po wykluczeniu innych przyczyn (choroby współistniejące, leki, stres). Postać ta dotyczy zwykle osób przed 30. rokiem życia i w 35–56 proc. przypadków charakteryzuje się rodzinnym występowaniem1. W celu potwierdzenia nadmiernej ilości wydzielanego potu w danym obszarze ciała zaleca się wykonanie próby Minora18. Polega ona na aplikacji wodnego roztworu jodyny i skrobi w miejscu zgłaszanego nadmiernego wydzielania potu (okolica dołów pachowych, dłoni, stóp). Badany obszar skóry zabarwia się na granatowo. Podczas rutynowych wizyt wskazane jest wykonanie fotodokumentacji w celu porównywania stopnia nasilenia dolegliwości w czasie. Innymi, trudniejszymi do zastosowania w praktyce klinicznej metodami obiektywnej oceny hiperhydrozy są: grawimetria, dynamiczna sudometria, termoregulacyjny test pocenia i pomiar przewodnictwa skóry7. Do subiektywnej oceny nasilenia hiperhydrozy wykorzystuje się czterostopniową skalę nasilenia hiperhydrozy – Hyperhidrosis Disease Severity Scale (HDSS). Zbadano, że zmniejszenie o 1 pkt w skali HDSS koreluje z 50-procentową, a o 2 pkt z 80-procentową redukcją wydzielania potu zmierzoną za pomocą grawimetrii19. Wpływ nadmiernej potliwości na jakość życia pacjentów można również oceniać za pomocą kwestionariuszy: The Hyperhydrosis Impact Questionnaire, Dermatology Life Quality Index oraz The Medical Outcomes Trust Short Form 12 Health Survey7. Zbadano, że u osób z hiperhydrozą częściej niż u osób bez tego objawu występują depresja oraz zaburzenia lękowe. Ponadto nadmierne wydzielanie potu sprzyja infekcjom bakteryjnym, wirusowym i grzybiczym, może prowadzić do powstania wyprysku potnicowego, powodować dyskomfort psychiczny związany z wydzielaniem przykrego zapachu i tendencję do przyjmowania nienaturalnej postawy ciała w celu ukrycia miejsc objętych nadpotliwością7.
Leczenie hiperhydrozy pierwotnej
Preparatami pierwszego wyboru w terapii nadpotliwości są preparaty miejscowe, których działanie opiera się na mechanicznym blokowaniu ujść gruczołów potowych. Zalecane są produkty zawierające sole glinu w formie kremów, płynów i zasypek19. W wyniku aplikacji tworzy się czop z polimerycznego żelu wodorotlenkowego, usuwany wraz ze złuszczaniem się warstwy rogowej naskórka. Niestety często zgłaszanym objawem niepożądanym jest podrażnienie skóry. Preparaty należy stosować wieczorem, na umytą i dokładnie osuszoną skórę, początkowo codziennie lub co drugi dzień, a następnie w celu podtrzymania efektu terapeutycznego 1–3 razy w tygodniu.
Ostatnio, zwłaszcza w literaturze popularnonaukowej, pojawiły się doniesienia wskazujące na możliwość istnienia związku między stosowaniem antyperspirantów a zwiększonym ryzykiem rozwoju nowotworu sutka. W piśmiennictwie zwraca się uwagę, że nadmierna ekspozycja na glin może wywoływać niestabilność genomu w komórkach nabłonka gruczołów sutkowych, powodować nieprawidłową proliferację, jak również przyczyniać się do zwiększonej migracji i inwazji komórek nowotworowych. Ponadto glin jako metaloestrogen może mieć działanie podobne do estrogenów, którym przypisywany jest udział w powstawaniu nowotworów piersi20.
Wyniki dwóch badań epidemiologicznych nie potwierdzają jednak pozytywnej korelacji między stosowaniem antyperspirantów a zwiększonym ryzykiem raka piersi21, 22. W jednej z analiz dotyczącej grupy 437 kobiet z nowotworem piersi w wywiadzie wykazano, że u pacjentek, które wcześniej rozpoczęły i częściej stosowały dezodoranty lub antyperspiranty oraz przeprowadzały depilację dołów pachowych, diagnozę nowotworu ustalono we wcześniejszym wieku. Autorzy badania rozważają, czy przyczyną obserwowanej korelacji mogłaby być zwiększona absorpcja soli glinu, wzmożona wskutek przerwania bariery naskórkowej depilacją23. Dlatego też określenie związku między korzystaniem z antyperspirantów a ryzykiem rozwoju nowotworu sutka wymaga dalszych badań.
Podobne podejrzenia nie potwierdziły się w przypadku choroby Alzheimera. Wczesne badania na zwierzętach sugerowały możliwy wpływ ekspozycji na aluminium na powstawanie zwyrodnień neurowłókienkowych, czego jednak nie potwierdziły późniejsze badania. Aktualnie eksperci zajmujący się chorobą Alzheimera stoją na stanowisku, że związek między codziennymi źródłami aluminium (takimi jak antyperspiranty) a chorobą Alzheimera jest wątpliwy24.
Glikopirolan w postaci 2proc. kremu, aplikowany 2 razy dziennie jest rekomendowany do leczenia nadpotliwości twarzy oraz w poceniu smakowym. W 2018 r. amerykańska Agencja Żywności i Leków dopuściła do leczenia nadpotliwości pach u osób od 9. roku życia chusteczki nawilżone 2,4proc. roztworem glikopirolanu. W dotychczas przeprowadzonych badaniach wykazano bezpieczeństwo miejscowej aplikacji glikopirolanu, a działania niepożądane, takie jak suchość skóry i błon śluzowych, ból głowy, nieostre widzenie, problemy z wypróżnianiem i oddawaniem moczu, zgłaszane u 2–25proc. użytkowników miały nasilenie łagodne do umiarkowanego25.
Powszechnym składnikiem dezodorantów jest również ałun – naturalny minerał stosowany już w starożytności. Przypisuje mu się działanie antybakteryjne, ściągające oraz zwężające ujścia gruczołów potowych. W jednym z badań testowano skuteczność i bezpieczeństwo ałunu amonowego aplikowanego na skórę twarzy u 23 osób z zespołem Frey. Opisano poprawę w zakresie nadmiernego wydzielania potu bez towarzyszącego podrażnienia skóry26.
W terapii ogólnej hiperhydrozy stosowane są leki antycholinergiczne, zwłaszcza glikopirolan oraz oksybutynina. Jednak działania niepożądane, takie jak suchość jamy ustnej, spojówek, zaburzenia czynności przewodu pokarmowego, trudności w oddawaniu moczu, tachykardia, często ograniczają ich przewlekłe przyjmowanie. Oksybutynina jest kompetytywnym antagonistą acetylocholinowych receptorów muskarynowych M1, M2, M3, M4 i M5, zarejestrowaną w leczeniu nietrzymania moczu. Stosowana jest również w nadpotliwości, zwłaszcza dotyczącej wielu obszarów ciała, przy niezadowalających efektach terapii miejscowej, w dawkach 2,5–5 mg 2 razy dziennie. Wyniki badań wykazują poprawę w zakresie odczuwanych dolegliwości u ok. 70–80 proc. pacjentów. Zwykle zalecana jest najmniejsza skuteczna dawka leku, aby ryzyko wystąpienia działań niepożądanych było niewielkie27. Badacze zwracają uwagę na możliwość zmniejszenia dawki oksybutyniny w czasie miesięcy zimowych, gdy problem nadpotliwości jest mniej nasilony. Oksybutynina jest bezwzględnie przeciwwskazana u osób z jaskrą z wąskim kątem przesączania, miastenią oraz zaburzeniami układu pokarmowego28. Zaletą glikopirolanu jest fakt, że substancja ta nie przekracza bariery krew–mózg, co zmniejsza ryzyko rozwoju działań niepożądanych. Lek podaje się 2 razy dziennie w dawce 1–2 mg24.
Innym lekiem, który może być pomocny w terapii hiperhydrozy, jest propranolol – nieselektywny β-adrenolityk, rekomendowany zwłaszcza w nadpotliwości, której towarzyszy lęk i stres29.
W leczeniu zlokalizowanej hiperhydrozy, szczególnie dotyczącej rąk i stóp, zastosowanie terapeutyczne znalazły zabiegi jontoforezy. Jontoforeza polega na wprowadzaniu do tkanek jonów za pomocą prądu stałego lub pulsującego30. Zabiegom jontoforezy przypisywane jest działanie przeciwzapalne, bakteriostatyczne, znieczulające, pobudzające krążenie w naczyniach krwionośnych. Ta forma elektroterapii jest stosowana w zwyrodnieniowych i zapalnych schorzeniach narządów ruchu, uszkodzeniach nerwów, zaburzeniach miejscowego ukrwienia tkanek. Może okazać się pomocna przy rozszerzonych naczyniach włosowatych, zwiotczeniu skóry, bliznach, trądziku różowatym oraz trądziku pospolitym. Mechanizm działania jontoforezy w leczeniu nadpotliwości nie został dokładnie poznany. Korzystny efekt kliniczny uzyskiwany jest prawdopodobnie poprzez zamknięcie przewodów wyprowadzających gruczołów ekrynowych, hamowanie przewodnictwa nerwowego i zmianę pH ograniczającą aktywność gruczołów31–33. Przeciwwskazaniami do jontoforezy są: wszczepione urządzenia stymulujące pracę serca, endoprotezy, metalowe implanty zlokalizowane w pobliżu miejsca leczenia, arytmia serca, padaczka oraz ciąża34. Ustąpienie dolegliwości uzyskuje się po ok. 1–4 tygodniach regularnych zabiegów. Dla utrzymania pożądanych efektów zwykle konieczna jest terapia podtrzymująca, stosowana co kilka miesięcy. Zabiegi jontoforezy mogą być stosowane również w populacji pediatrycznej, a ich zaletą jest mała inwazyjność [35]. Dostępne są również urządzenia przeznaczone do stosowania domowego, co sprzyja systematycznemu poddawaniu się zabiegom jontoforezy. Dobre efekty terapii potwierdzają dotychczasowe doświadczenia łódzkiej Kliniki Dermatologii (badania w toku).
Inną możliwością terapeutyczną, zarejestrowaną w Polsce do leczenia opornej na preparaty miejscowe nadmiernej potliwości pach, są iniekcje toksyny botulinowej typu A36. Metoda ta stosowana jest również alternatywnie w hiperhydrozie rąk i stóp. Objawem niepożądanym wstrzyknięcia do skóry jest ryzyko przejściowego porażenia okolicznych mięśni, co może być szczególnie uciążliwe dla osób wykonujących precyzyjne prace manualne. W piśmiennictwie dostępne są dane dotyczące stosowania również toksyny botulinowej typu B37, 38. W Polsce ma ona rejestrację jedynie w leczeniu dystonii szyjnej u osób dorosłych. Mechanizm działania toksyny botulinowej polega na hamowaniu wydzielania acetylocholiny z pęcherzyków presynaptycznych, a także blokowaniu przekaźnictwa cholinergicznego w płytce motorycznej mięśni szkieletowych oraz we włóknach autonomicznych unerwiających gruczoły potowe, łzowe, ślinowe lub mięśnie gładkie. Toksyna botulinowa typu A jest powszechnie wykorzystywana w neurologii, urologii (w leczeniu nadreaktywności pęcherza moczowego) oraz medycynie estetycznej 39, 40. Przeciwwskazaniami do jej stosowania są: miastenia, zespół Lamberta-Eatona, czynne zakażenia w obszarze aplikacji oraz znana nadwrażliwość na którykolwiek składnik preparatu. U osób przyjmujących doustne leki przeciwkrzepliwe należy zachować szczególną ostrożność, ponieważ zwiększa się ryzyko wystąpienia krwiaków podskórnych w miejscach iniekcji. Zaletą tej metody jest szybki, satysfakcjonujący, trwający średnio 6–9 miesięcy efekt terapeutyczny41.
Wśród innych metod leczenia hiperhydrozy mają zastosowanie: laseroterapia, radiofrekwencja mikroigłowa, technologie z wykorzystaniem ultradźwięków oraz mikrofal, szczególnie zalecane w nadpotliwości ograniczonej do dołów pachowych24.
Jeżeli dolegliwości związane z hiperhydrozą są bardzo nasilone, a mniej inwazyjne metody leczenia zawodzą, możliwe jest również poddanie się zabiegowi chirurgicznemu – sympatektomii, sympatetomii, miejscowemu wycięciu gruczołów potowych lub podskórnemu łyżeczkowaniu dołu pachowego z zastosowaniem urządzeń do liposukcji.
Najczęściej stosowaną metodą chirurgiczną jest sympatektomia, obecnie wykonywana głównie techniką endoskopową. Polega ona na przerwaniu ciągłości pnia współczulnego. W efekcie tego zabiegu dochodzi do rozszerzenia naczyń krwionośnych w odnerwionym obszarze ciała oraz zmniejszenia wydzielania potu. Sympatektomia znalazła również zastosowanie w leczeniu choroby Raynauda oraz choroby Buergera obejmującej kończyny górne. Skuteczność leczenia nadpotliwości tą metodą jest bardzo wysoka, jednak u części osób może wystąpić nadpotliwość kompensacyjna. Wśród innych powikłań sympatektomii opisywano wystąpienie krwawienia z miejsca operowanego, odmy opłucnowej lub podskórnej, zespołu Hornera, neuralgii współczulnej, nadpotliwości fantomowej, a także suchości skóry42.
Podsumowanie
Nadpotliwość to wstydliwa, często ukrywana dolegliwość, z którą pacjent nierzadko próbuje walczyć samodzielnie. Może znacznie obniżać jakość codziennego funkcjonowania, a nawet prowadzić do wycofania się z życia społecznego. W diagnostyce hiperhydrozy należy pamiętać o wykluczeniu jej wtórnych przyczyn, a następnie zaproponować optymalną formę terapii z uwzględnieniem rodzaju, nasilenia objawów oraz oczekiwań pacjenta. Zalecane jest jednak rozpoczynanie leczenia od preparatów miejscowych w późniejszych etapach leczenie ogólne lub zabiegowe, a w ostateczności metody chirurgiczne.
Piśmiennictwo:
1. Solish N., Bertucci V., Dansereau A., Hong HC., Lynde C., Lupin M., et al.: A comprehensive approach to the recognition, diagnosis, and severity-based treatment of focal hyperhidrosis: recommendations of the Canadian Hyperhidrosis Advisory Committee. Dermatol Surg 2007, 33, 908-923.
2. Adamski Z., Kaszuba A.: Dermatologia dla kosmetologów. Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu, Poznań, 2008.
3. Murota H.: Sweating in systemic abnormalities: uremia and diabetes mellitus. Curr Probl Dermatol 2016, 51, 57-61.
4. Nadlewska A., Ładny J., Wojewódzka-Żelezniakowicz M., Czaban S., Kosierkiewicz W., Szymańska A., et al.: Trucizny – definicja, rodzaje, mechanizm działania. Post Nauk Med 2010, 9, 704-708.
5. Haider A., Solish N.: Focal hyperhidrosis: diagnosis and management. CMAJ 2005, 172, 69-75.
6. Hebert A., Glaser D., Ballard A.: Prevalence of primary focal hyperhidrosis (PFHh) among teens 12-17 in US Population. 75th Annual Meeting of the American Academy of Dermatology. Orlando, 2017. Abstract (5192) presented at American Academy of Dermatology March 2017, Late-Breaking Research: Clinical Studies/Pediatric (F072).
7. Nawrocki S., Cha J.: The etiology, diagnosis and management of hyperhidrosis: a comprehensive review. Part I. Etiology and clinical work-up. J Am Acad Dermatol 2019, 81, 657-666.
8. Hornberger J., Grimes K., Naumann M., Glaser D., Lowe N., Naver H., et al.: Multi-specialty working group on the recognition, diagnosis, and treatment of primary focal hyperhidrosis. Recognition, diagnosis, and treatment of primary focal hyperhidrosis. J Am Acad Dermatol 2004, 51, 274-286.
9. Estevan F., Wolosker M., Wolosker N., Puech-Leão P.: Epidemiologic analysis of prevalence of the hyperhidrosis. An Bras Dermatol 2017, 92, 630-634.
10. Strutton D., Kowalski J., Glaser D., Stang P.: US prevalence of hyperhidrosis and impact on individuals with axillary hyperhidrosis: results from a national survey. J Am Acad Dermatol 2004, 51, 241-248.
11. Doolittle J., Walker P., Mills T., Thurston J.: Hyperhidrosis: an update on prevalence and severity in the United States. Arch Dermatol Res 2016, 308, 743-749.
12. Shayesteh A., Janlert U., Brulin C., Boman J., Nylander E.: Prevalence and characteristics of hyperhidrosis in Sweden: a cross- -sectional study in the general population. Dermatology 2016, 232, 586-591.
13. Fujimoto T., Kawahara K., Yokozeki H.: Epidemiological study and considerations of primary focal hyperhidrosis in Japan: from questionnaire analysis. J Dermatol 2013, 40, 886-890.
14. Liu Y., Bahar R., Kalia S., Huang R., Phillips A., Su M., et al.: Hyperhidrosis prevalence and demographical characteristics in dermatology outpatients in Shanghai and Vancouver. PLoS One 2016, 11, e0153719.
15. Ohshima Y., Tamada Y.: Classification of systemic and localized sweating disorders. Curr Probl Dermatol 2016, 51, 7-10.
16. Shetty A., Parikh P., Khubchandani R.: Familial dysautonomia (Riley-Day syndrome). Indian J Pediatr 1995, 62, 367-369.
17. Pechman K., Bergfeld W.: Palmar-plantar hyperhidrosis occurring in a kindred with nail-patella syndrome. J Am Acad Dermatol 1980, 3, 627-632.
18. Muller S., Kierland R.: The use of a modified starch-iodine test for investigating local sweating responses to intradermal injection of methacholine. J Invest Dermatol 1959, 32, 126-128.
19. Grabell D., Hebert A.: Current and emerging medical therapies for primary hyperhidrosis. Dermatol Ther 2017, 7, 25-36.
20. Darbre P.: Aluminium and the human breast. Morphologie 2016, 100, 65-74.
21. Mirick D., Davis S., Thomas D.: Antiperspirant use and the risk of breast cancer. J Natl Cancer Inst 2002, 94, 1578-1580.
22. Fakri S., Al-Azzawi A., Al-Tawil N.: Antiperspirant use as a risk factor for breast cancer in Iraq. East Mediterr Health J 2006, 12, 478-482.
23. McGrath K.: An earlier age of breast cancer diagnosis related to more frequent use of antiperspirants/deodorants and underarm shaving. Eur J Cancer Prev 2003, 12, 479-485.
24. Nawrocki S., Cha J.: The etiology, diagnosis and management of hyperhidrosis: a comprehensive review. Part II. Therapeutic options. J Am Acad Dermatol 2019, 81, 669-680.
25. Chabicovsky M., Winkler S., Soeberdt M., Kilic A., Masur C., Abels C.: Pharmacology, toxicology and clinical safety of glycopyrrolate. Toxicol Appl Pharmacol 2019, 370, 154-169.
26. Chueasupparobon N., Rawangban W., Tangjaturonrasme N.: Treatment of Frey’s syndrome with topical ammonium alum: first report with twenty-two cases. Clin Otolaryngol 2016, 41, 593-596.
27. Jarrett J., Moss D.: PURLs: oral agent offers relief from generalized hyperhidrosis. J Fam Pract 2017, 66, 392-394.
28. Delort S., Marchi E., Corrêa M.: Oxybutynin as an alternative treatment for hyperhidrosis. An Bras Dermatol 2017, 92, 217- 220.
29. Glaser D.: Oral medications. Dermatol Clin 2014, 32, 527-532.
30. Krueger E., Claudino J., Scheeren E., Neves E., Mulinari E., Nohama P.: Iontophoresis: principles and applications. Fisioter Mov 2014, 27, 469-481.
31. Hill A., Baker G., Jansen G.: Mechanism of action of iontophoresis in the treatment of palmar hyperhidrosis. Cutis 1981, 28, 69-72.
32. Anliker M., Kreyden O.: Tap water iontophoresis. Curr Probl Dermatol 2002, 30, 48-56.
33. Wang L., Hilliges M., Gajecki M., Marcusson J., Johansson O.: No change in skin innervation in patients with palmar hyperhidrosis treated with tap-water iontophoresis. Br J Dermatol 1994, 131, 742-743.
34. Pariser D., Ballard A.: Iontophoresis for palmar and plantar hyperhidrosis. Dermatol Clin 2014, 32, 491-494.
35. DogrukKacar S., Ozuguz P., Eroglu S., Polat S., Karaca S.: Treatment of primary hyperhidrosis with tap water iontophoresis in paediatric patients: a retrospective analysis. Cutan Ocul Toxicol 2014, 33, 313-316.
36. De Almeida A., Montagner S.: Botulinum toxin for axillary hyperhidrosis. Dermatol Clin 2014, 22, 495-504.
37. Basciani M., Di Rienzo F., Bizzarrini M., Zanchi M., Copetti M., Intiso D.: Efficacy of botulinum toxin type B for the treatment of primary palmar hyperhidrosis: a prospective, open, single-blind, multi-centre study. Arch Dermatol Res 2014, 306, 497-503.
38. Rosell K., Hymnelius K., Swartling C.: Botulinum toxin type A and B improve quality of life in patients with axillary and palmar hyperhidrosis. Acta Derm Venereol 2013, 93, 335-339.
39. Hsieh P., Chiu H., Chen K., Chang C., Chou E.: Botulinum toxin A for the treatment of overactive bladder. Toxins 2016, 8, 59.
40. Satriyasa B.: Botulinum toxin A for reducing the appearance of facial wrinkles: a literature review of clinical use and pharmacological aspect. Clin Cosmet Investig Dermatol 2019, 12, 223-228.
41. Doft M., Hardy K., Ascherman J: Treatment of hyperhidrosis with botulinum toxin. Aesthet Surg J 2012, 32, 238-244.
42. Krasna M.: The role of surgical treatment of hyperhidrosis. Mayo Clin Proc 2011, 86, 717-718.
Artykuł opublikowano w „Przeglądzie Dermatologicznym” 3/2020.

– Gruczoły potowe odgrywają ważną rolę w termoregulacji organizmu i mają ścisły związek z autonomicznym układem nerwowym. W stanie spoczynku pot wydzielany jest stale w niewielkich ilościach, jednak w wyniku zadziałania bodźca termicznego lub emocjonalnego jego produkcja się nasila1. Organizm człowieka ma cztery miliony gruczołów potowych, z czego ok. 75 proc. stanowią gruczoły ekrynowe, natomiast pozostałe to gruczoły apokrynowe. W hiperhydrozie pierwotnej główną funkcję pełni wzmożona aktywność gruczołów ekrynowych.
Gruczoły ekrynowe występują na powierzchni całej skóry, w największej ilości na dłoniach, czole, podeszwach stóp oraz w dołach pachowych. Czynność gruczołów ekrynowych zależy od układu cholinergicznego. Aktywność części wydzielniczej pobudzana jest przez bodźce termiczne, emocjonalne i smakowe. Główną funkcję gruczołów stanowi termoregulacja organizmu. Pot ekrynowy jest bezwonnym, hipotonicznym roztworem zawierającym sód, potas, chlorki, mocznik, kwas moczowy, mleczany, aminy biogenne, śladowe ilości aminokwasów i witaminy2. U osób dializowanych z powodu niewydolności nerek występuje wyższe stężenie toksyn mocznicowych w pocie3. Wraz z potem wydalane są również toksyny, takie jak alkohol etylowy, fenazon, kwas benzoesowy, kwas salicylowy, ołów, rtęć i żelazo4.
Gruczoły apokrynowe rozwijają się wraz z zawiązkami włosów między czwartym a piątym miesiącem życia płodowego, jednak dopiero w okresie dojrzewania powiększają się i uczynniają. U dorosłego człowieka zlokalizowane są głównie w okolicy pachowej, genitalnej, odbytu, wokół pępka, na brodawkach sutkowych, a także sporadycznie na tułowiu i głowie. Ich unerwienie jest adrenergiczne. Pot apokrynowy jest pierwotnie bezwonny, jasny, mętny, lepki, zawiera cholesterol, triglicerydy oraz kwasy tłuszczowe. Charakterystyczny zapach powstający po jego wydzieleniu wynika z rozkładu produktów przemiany zachodzącej pod wpływem skórnej flory bakteryjnej2.
Nadmierna, przekraczająca fizjologiczne potrzeby organizmu produkcja potu określana jest terminem hiperhydrozy. Dotyczy zarówno kobiet, jak i mężczyzn w różnym wieku5. Ostatnio przeprowadzone badanie w Stanach Zjednoczonych wykazało, że aż 17 proc. nastolatków zgłasza problem nadmiernego wydzielania potu6. Wyróżniono dwie postacie hiperhydrozy: pierwotną i wtórną.
Postacie – hiperhydroza pierwotna
Analizując przyczyny hiperhydrozy, stwierdzono, że w 90proc. ma ona charakter pierwotny7. Pozostałe przypadki uznaje się za nadpotliwość wtórną. W etiopatologii postaci pierwotnej upatruje się przyczyn genetycznych, emocjonalnych oraz środowiskowych. Według Canadian Hyperhidrosis Advisory Committee, aby rozpoznać hiperhydrozę pierwotną, należy potwierdzić utrzymywanie się objawów przez co najmniej 6 miesięcy oraz stwierdzić cztery z sześciu wymienionych kryteriów: obustronna i symetryczna lokalizacja, wpływ na codzienną aktywność, więcej niż 1 epizod w tygodniu, początek przed 25. rokiem życia, dodatni wywiad rodzinny, brak objawów podczas snu8 (tabela 1).

Hiperhydroza pierwotna w większości przypadków obejmuje ograniczony obszar skóry. Najczęściej dotyczy rąk, stóp, pach oraz twarzy. Zwykle lokalizuje się jednocześnie w kilku obszarach anatomicznych [9]. Częstość występowania hiperhydrozy pierwotnej różni się w zależności od regionu świata. W badaniach przeprowadzonych w Stanach Zjednoczonych występuje u 2,8–4,8 proc. , Szwecji 5,5 proc., Niemczech 4,6 proc., Japonii 12,8 proc., Kanadzie (Vancouver) 12,3 proc. , Chinach (Szanghaju) 14,5 proc. osób w populacji10–14.
Postacie – hiperhydroza wtórna
Hiperhydroza wtórna współistnieje z innymi chorobami lub jest spowodowana przyjmowaniem leków. Może pojawić się między innymi w przebiegu nadczynności tarczycy, cukrzycy, otyłości, gruźlicy, zapalenia wsierdzia, choroby Parkinsona, guzów chromochłonnych oraz chłoniaków Hodgkina. Wśród przyczyn nadpotliwości wymieniane są również leki, takie jak neuroleptyki, leki przeciwdepresyjne, leki hipoglikemizujące, tryptany, opioidy, antybiotyki (ciprofloksacyna), leki przeciwwirusowe (acyklowir), leki przeciwwymiotne, przeciwgorączkowe, niesteroidowe leki przeciwzapalne, substancje o działaniu adrenergicznym oraz cholinergicznym7. W stanie fizjologii hiperhydroza wtórna często występuje w okresie ciąży, menopauzy oraz podczas ekspozycji na wysokie temperatury. W jej przebiegu nadpotliwość zwykle dotyczy całego ciała, przybierając postać uogólnioną5.
Hiperhydroza może również towarzyszyć rzadkim zespołom chorobowym, takim jak zespół Frey, zespół Rileya-Daya, zespół paznokieć–rzepka15-17. Inny podział uwzględnia lokalizację i wyróżnia hiperhydrozę uogólnioną, obejmującą praktycznie całą skórę, oraz ograniczoną, dotyczącą w szczególności pewnych obszarów, najczęściej pach, stóp, rąk lub twarzy (tab. 2, 3).


Diagnostyka
W procesie diagnozowania nadmiernej potliwości kluczowe znaczenie mają badania podmiotowe i przedmiotowe oraz badania laboratoryjne wykonane w celu wykluczenia hiperhydrozy wtórnej. Nadpotliwość może być pierwszym objawem umożliwiającym rozpoznanie zaburzeń endokrynologicznych, chorób układu sercowo-naczyniowego, a nawet nowotworów. U chorych zgłaszających nadmierne pocenie w nocy należy wykluczyć gruźlicę oraz choroby rozrostowe układu krwiotwórczego. W takich przypadkach priorytetem jest leczenie choroby podstawowej. Pierwotny charakter hiperhydrozy rozpoznawany jest po wykluczeniu innych przyczyn (choroby współistniejące, leki, stres). Postać ta dotyczy zwykle osób przed 30. rokiem życia i w 35–56 proc. przypadków charakteryzuje się rodzinnym występowaniem1. W celu potwierdzenia nadmiernej ilości wydzielanego potu w danym obszarze ciała zaleca się wykonanie próby Minora18. Polega ona na aplikacji wodnego roztworu jodyny i skrobi w miejscu zgłaszanego nadmiernego wydzielania potu (okolica dołów pachowych, dłoni, stóp). Badany obszar skóry zabarwia się na granatowo. Podczas rutynowych wizyt wskazane jest wykonanie fotodokumentacji w celu porównywania stopnia nasilenia dolegliwości w czasie. Innymi, trudniejszymi do zastosowania w praktyce klinicznej metodami obiektywnej oceny hiperhydrozy są: grawimetria, dynamiczna sudometria, termoregulacyjny test pocenia i pomiar przewodnictwa skóry7. Do subiektywnej oceny nasilenia hiperhydrozy wykorzystuje się czterostopniową skalę nasilenia hiperhydrozy – Hyperhidrosis Disease Severity Scale (HDSS). Zbadano, że zmniejszenie o 1 pkt w skali HDSS koreluje z 50-procentową, a o 2 pkt z 80-procentową redukcją wydzielania potu zmierzoną za pomocą grawimetrii19. Wpływ nadmiernej potliwości na jakość życia pacjentów można również oceniać za pomocą kwestionariuszy: The Hyperhydrosis Impact Questionnaire, Dermatology Life Quality Index oraz The Medical Outcomes Trust Short Form 12 Health Survey7. Zbadano, że u osób z hiperhydrozą częściej niż u osób bez tego objawu występują depresja oraz zaburzenia lękowe. Ponadto nadmierne wydzielanie potu sprzyja infekcjom bakteryjnym, wirusowym i grzybiczym, może prowadzić do powstania wyprysku potnicowego, powodować dyskomfort psychiczny związany z wydzielaniem przykrego zapachu i tendencję do przyjmowania nienaturalnej postawy ciała w celu ukrycia miejsc objętych nadpotliwością7.
Leczenie hiperhydrozy pierwotnej
Preparatami pierwszego wyboru w terapii nadpotliwości są preparaty miejscowe, których działanie opiera się na mechanicznym blokowaniu ujść gruczołów potowych. Zalecane są produkty zawierające sole glinu w formie kremów, płynów i zasypek19. W wyniku aplikacji tworzy się czop z polimerycznego żelu wodorotlenkowego, usuwany wraz ze złuszczaniem się warstwy rogowej naskórka. Niestety często zgłaszanym objawem niepożądanym jest podrażnienie skóry. Preparaty należy stosować wieczorem, na umytą i dokładnie osuszoną skórę, początkowo codziennie lub co drugi dzień, a następnie w celu podtrzymania efektu terapeutycznego 1–3 razy w tygodniu.
Ostatnio, zwłaszcza w literaturze popularnonaukowej, pojawiły się doniesienia wskazujące na możliwość istnienia związku między stosowaniem antyperspirantów a zwiększonym ryzykiem rozwoju nowotworu sutka. W piśmiennictwie zwraca się uwagę, że nadmierna ekspozycja na glin może wywoływać niestabilność genomu w komórkach nabłonka gruczołów sutkowych, powodować nieprawidłową proliferację, jak również przyczyniać się do zwiększonej migracji i inwazji komórek nowotworowych. Ponadto glin jako metaloestrogen może mieć działanie podobne do estrogenów, którym przypisywany jest udział w powstawaniu nowotworów piersi20.
Wyniki dwóch badań epidemiologicznych nie potwierdzają jednak pozytywnej korelacji między stosowaniem antyperspirantów a zwiększonym ryzykiem raka piersi21, 22. W jednej z analiz dotyczącej grupy 437 kobiet z nowotworem piersi w wywiadzie wykazano, że u pacjentek, które wcześniej rozpoczęły i częściej stosowały dezodoranty lub antyperspiranty oraz przeprowadzały depilację dołów pachowych, diagnozę nowotworu ustalono we wcześniejszym wieku. Autorzy badania rozważają, czy przyczyną obserwowanej korelacji mogłaby być zwiększona absorpcja soli glinu, wzmożona wskutek przerwania bariery naskórkowej depilacją23. Dlatego też określenie związku między korzystaniem z antyperspirantów a ryzykiem rozwoju nowotworu sutka wymaga dalszych badań.
Podobne podejrzenia nie potwierdziły się w przypadku choroby Alzheimera. Wczesne badania na zwierzętach sugerowały możliwy wpływ ekspozycji na aluminium na powstawanie zwyrodnień neurowłókienkowych, czego jednak nie potwierdziły późniejsze badania. Aktualnie eksperci zajmujący się chorobą Alzheimera stoją na stanowisku, że związek między codziennymi źródłami aluminium (takimi jak antyperspiranty) a chorobą Alzheimera jest wątpliwy24.
Glikopirolan w postaci 2proc. kremu, aplikowany 2 razy dziennie jest rekomendowany do leczenia nadpotliwości twarzy oraz w poceniu smakowym. W 2018 r. amerykańska Agencja Żywności i Leków dopuściła do leczenia nadpotliwości pach u osób od 9. roku życia chusteczki nawilżone 2,4proc. roztworem glikopirolanu. W dotychczas przeprowadzonych badaniach wykazano bezpieczeństwo miejscowej aplikacji glikopirolanu, a działania niepożądane, takie jak suchość skóry i błon śluzowych, ból głowy, nieostre widzenie, problemy z wypróżnianiem i oddawaniem moczu, zgłaszane u 2–25proc. użytkowników miały nasilenie łagodne do umiarkowanego25.
Powszechnym składnikiem dezodorantów jest również ałun – naturalny minerał stosowany już w starożytności. Przypisuje mu się działanie antybakteryjne, ściągające oraz zwężające ujścia gruczołów potowych. W jednym z badań testowano skuteczność i bezpieczeństwo ałunu amonowego aplikowanego na skórę twarzy u 23 osób z zespołem Frey. Opisano poprawę w zakresie nadmiernego wydzielania potu bez towarzyszącego podrażnienia skóry26.
W terapii ogólnej hiperhydrozy stosowane są leki antycholinergiczne, zwłaszcza glikopirolan oraz oksybutynina. Jednak działania niepożądane, takie jak suchość jamy ustnej, spojówek, zaburzenia czynności przewodu pokarmowego, trudności w oddawaniu moczu, tachykardia, często ograniczają ich przewlekłe przyjmowanie. Oksybutynina jest kompetytywnym antagonistą acetylocholinowych receptorów muskarynowych M1, M2, M3, M4 i M5, zarejestrowaną w leczeniu nietrzymania moczu. Stosowana jest również w nadpotliwości, zwłaszcza dotyczącej wielu obszarów ciała, przy niezadowalających efektach terapii miejscowej, w dawkach 2,5–5 mg 2 razy dziennie. Wyniki badań wykazują poprawę w zakresie odczuwanych dolegliwości u ok. 70–80 proc. pacjentów. Zwykle zalecana jest najmniejsza skuteczna dawka leku, aby ryzyko wystąpienia działań niepożądanych było niewielkie27. Badacze zwracają uwagę na możliwość zmniejszenia dawki oksybutyniny w czasie miesięcy zimowych, gdy problem nadpotliwości jest mniej nasilony. Oksybutynina jest bezwzględnie przeciwwskazana u osób z jaskrą z wąskim kątem przesączania, miastenią oraz zaburzeniami układu pokarmowego28. Zaletą glikopirolanu jest fakt, że substancja ta nie przekracza bariery krew–mózg, co zmniejsza ryzyko rozwoju działań niepożądanych. Lek podaje się 2 razy dziennie w dawce 1–2 mg24.
Innym lekiem, który może być pomocny w terapii hiperhydrozy, jest propranolol – nieselektywny β-adrenolityk, rekomendowany zwłaszcza w nadpotliwości, której towarzyszy lęk i stres29.
W leczeniu zlokalizowanej hiperhydrozy, szczególnie dotyczącej rąk i stóp, zastosowanie terapeutyczne znalazły zabiegi jontoforezy. Jontoforeza polega na wprowadzaniu do tkanek jonów za pomocą prądu stałego lub pulsującego30. Zabiegom jontoforezy przypisywane jest działanie przeciwzapalne, bakteriostatyczne, znieczulające, pobudzające krążenie w naczyniach krwionośnych. Ta forma elektroterapii jest stosowana w zwyrodnieniowych i zapalnych schorzeniach narządów ruchu, uszkodzeniach nerwów, zaburzeniach miejscowego ukrwienia tkanek. Może okazać się pomocna przy rozszerzonych naczyniach włosowatych, zwiotczeniu skóry, bliznach, trądziku różowatym oraz trądziku pospolitym. Mechanizm działania jontoforezy w leczeniu nadpotliwości nie został dokładnie poznany. Korzystny efekt kliniczny uzyskiwany jest prawdopodobnie poprzez zamknięcie przewodów wyprowadzających gruczołów ekrynowych, hamowanie przewodnictwa nerwowego i zmianę pH ograniczającą aktywność gruczołów31–33. Przeciwwskazaniami do jontoforezy są: wszczepione urządzenia stymulujące pracę serca, endoprotezy, metalowe implanty zlokalizowane w pobliżu miejsca leczenia, arytmia serca, padaczka oraz ciąża34. Ustąpienie dolegliwości uzyskuje się po ok. 1–4 tygodniach regularnych zabiegów. Dla utrzymania pożądanych efektów zwykle konieczna jest terapia podtrzymująca, stosowana co kilka miesięcy. Zabiegi jontoforezy mogą być stosowane również w populacji pediatrycznej, a ich zaletą jest mała inwazyjność [35]. Dostępne są również urządzenia przeznaczone do stosowania domowego, co sprzyja systematycznemu poddawaniu się zabiegom jontoforezy. Dobre efekty terapii potwierdzają dotychczasowe doświadczenia łódzkiej Kliniki Dermatologii (badania w toku).
Inną możliwością terapeutyczną, zarejestrowaną w Polsce do leczenia opornej na preparaty miejscowe nadmiernej potliwości pach, są iniekcje toksyny botulinowej typu A36. Metoda ta stosowana jest również alternatywnie w hiperhydrozie rąk i stóp. Objawem niepożądanym wstrzyknięcia do skóry jest ryzyko przejściowego porażenia okolicznych mięśni, co może być szczególnie uciążliwe dla osób wykonujących precyzyjne prace manualne. W piśmiennictwie dostępne są dane dotyczące stosowania również toksyny botulinowej typu B37, 38. W Polsce ma ona rejestrację jedynie w leczeniu dystonii szyjnej u osób dorosłych. Mechanizm działania toksyny botulinowej polega na hamowaniu wydzielania acetylocholiny z pęcherzyków presynaptycznych, a także blokowaniu przekaźnictwa cholinergicznego w płytce motorycznej mięśni szkieletowych oraz we włóknach autonomicznych unerwiających gruczoły potowe, łzowe, ślinowe lub mięśnie gładkie. Toksyna botulinowa typu A jest powszechnie wykorzystywana w neurologii, urologii (w leczeniu nadreaktywności pęcherza moczowego) oraz medycynie estetycznej 39, 40. Przeciwwskazaniami do jej stosowania są: miastenia, zespół Lamberta-Eatona, czynne zakażenia w obszarze aplikacji oraz znana nadwrażliwość na którykolwiek składnik preparatu. U osób przyjmujących doustne leki przeciwkrzepliwe należy zachować szczególną ostrożność, ponieważ zwiększa się ryzyko wystąpienia krwiaków podskórnych w miejscach iniekcji. Zaletą tej metody jest szybki, satysfakcjonujący, trwający średnio 6–9 miesięcy efekt terapeutyczny41.
Wśród innych metod leczenia hiperhydrozy mają zastosowanie: laseroterapia, radiofrekwencja mikroigłowa, technologie z wykorzystaniem ultradźwięków oraz mikrofal, szczególnie zalecane w nadpotliwości ograniczonej do dołów pachowych24.
Jeżeli dolegliwości związane z hiperhydrozą są bardzo nasilone, a mniej inwazyjne metody leczenia zawodzą, możliwe jest również poddanie się zabiegowi chirurgicznemu – sympatektomii, sympatetomii, miejscowemu wycięciu gruczołów potowych lub podskórnemu łyżeczkowaniu dołu pachowego z zastosowaniem urządzeń do liposukcji.
Najczęściej stosowaną metodą chirurgiczną jest sympatektomia, obecnie wykonywana głównie techniką endoskopową. Polega ona na przerwaniu ciągłości pnia współczulnego. W efekcie tego zabiegu dochodzi do rozszerzenia naczyń krwionośnych w odnerwionym obszarze ciała oraz zmniejszenia wydzielania potu. Sympatektomia znalazła również zastosowanie w leczeniu choroby Raynauda oraz choroby Buergera obejmującej kończyny górne. Skuteczność leczenia nadpotliwości tą metodą jest bardzo wysoka, jednak u części osób może wystąpić nadpotliwość kompensacyjna. Wśród innych powikłań sympatektomii opisywano wystąpienie krwawienia z miejsca operowanego, odmy opłucnowej lub podskórnej, zespołu Hornera, neuralgii współczulnej, nadpotliwości fantomowej, a także suchości skóry42.
Podsumowanie
Nadpotliwość to wstydliwa, często ukrywana dolegliwość, z którą pacjent nierzadko próbuje walczyć samodzielnie. Może znacznie obniżać jakość codziennego funkcjonowania, a nawet prowadzić do wycofania się z życia społecznego. W diagnostyce hiperhydrozy należy pamiętać o wykluczeniu jej wtórnych przyczyn, a następnie zaproponować optymalną formę terapii z uwzględnieniem rodzaju, nasilenia objawów oraz oczekiwań pacjenta. Zalecane jest jednak rozpoczynanie leczenia od preparatów miejscowych w późniejszych etapach leczenie ogólne lub zabiegowe, a w ostateczności metody chirurgiczne.
Piśmiennictwo:
1. Solish N., Bertucci V., Dansereau A., Hong HC., Lynde C., Lupin M., et al.: A comprehensive approach to the recognition, diagnosis, and severity-based treatment of focal hyperhidrosis: recommendations of the Canadian Hyperhidrosis Advisory Committee. Dermatol Surg 2007, 33, 908-923.
2. Adamski Z., Kaszuba A.: Dermatologia dla kosmetologów. Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu, Poznań, 2008.
3. Murota H.: Sweating in systemic abnormalities: uremia and diabetes mellitus. Curr Probl Dermatol 2016, 51, 57-61.
4. Nadlewska A., Ładny J., Wojewódzka-Żelezniakowicz M., Czaban S., Kosierkiewicz W., Szymańska A., et al.: Trucizny – definicja, rodzaje, mechanizm działania. Post Nauk Med 2010, 9, 704-708.
5. Haider A., Solish N.: Focal hyperhidrosis: diagnosis and management. CMAJ 2005, 172, 69-75.
6. Hebert A., Glaser D., Ballard A.: Prevalence of primary focal hyperhidrosis (PFHh) among teens 12-17 in US Population. 75th Annual Meeting of the American Academy of Dermatology. Orlando, 2017. Abstract (5192) presented at American Academy of Dermatology March 2017, Late-Breaking Research: Clinical Studies/Pediatric (F072).
7. Nawrocki S., Cha J.: The etiology, diagnosis and management of hyperhidrosis: a comprehensive review. Part I. Etiology and clinical work-up. J Am Acad Dermatol 2019, 81, 657-666.
8. Hornberger J., Grimes K., Naumann M., Glaser D., Lowe N., Naver H., et al.: Multi-specialty working group on the recognition, diagnosis, and treatment of primary focal hyperhidrosis. Recognition, diagnosis, and treatment of primary focal hyperhidrosis. J Am Acad Dermatol 2004, 51, 274-286.
9. Estevan F., Wolosker M., Wolosker N., Puech-Leão P.: Epidemiologic analysis of prevalence of the hyperhidrosis. An Bras Dermatol 2017, 92, 630-634.
10. Strutton D., Kowalski J., Glaser D., Stang P.: US prevalence of hyperhidrosis and impact on individuals with axillary hyperhidrosis: results from a national survey. J Am Acad Dermatol 2004, 51, 241-248.
11. Doolittle J., Walker P., Mills T., Thurston J.: Hyperhidrosis: an update on prevalence and severity in the United States. Arch Dermatol Res 2016, 308, 743-749.
12. Shayesteh A., Janlert U., Brulin C., Boman J., Nylander E.: Prevalence and characteristics of hyperhidrosis in Sweden: a cross- -sectional study in the general population. Dermatology 2016, 232, 586-591.
13. Fujimoto T., Kawahara K., Yokozeki H.: Epidemiological study and considerations of primary focal hyperhidrosis in Japan: from questionnaire analysis. J Dermatol 2013, 40, 886-890.
14. Liu Y., Bahar R., Kalia S., Huang R., Phillips A., Su M., et al.: Hyperhidrosis prevalence and demographical characteristics in dermatology outpatients in Shanghai and Vancouver. PLoS One 2016, 11, e0153719.
15. Ohshima Y., Tamada Y.: Classification of systemic and localized sweating disorders. Curr Probl Dermatol 2016, 51, 7-10.
16. Shetty A., Parikh P., Khubchandani R.: Familial dysautonomia (Riley-Day syndrome). Indian J Pediatr 1995, 62, 367-369.
17. Pechman K., Bergfeld W.: Palmar-plantar hyperhidrosis occurring in a kindred with nail-patella syndrome. J Am Acad Dermatol 1980, 3, 627-632.
18. Muller S., Kierland R.: The use of a modified starch-iodine test for investigating local sweating responses to intradermal injection of methacholine. J Invest Dermatol 1959, 32, 126-128.
19. Grabell D., Hebert A.: Current and emerging medical therapies for primary hyperhidrosis. Dermatol Ther 2017, 7, 25-36.
20. Darbre P.: Aluminium and the human breast. Morphologie 2016, 100, 65-74.
21. Mirick D., Davis S., Thomas D.: Antiperspirant use and the risk of breast cancer. J Natl Cancer Inst 2002, 94, 1578-1580.
22. Fakri S., Al-Azzawi A., Al-Tawil N.: Antiperspirant use as a risk factor for breast cancer in Iraq. East Mediterr Health J 2006, 12, 478-482.
23. McGrath K.: An earlier age of breast cancer diagnosis related to more frequent use of antiperspirants/deodorants and underarm shaving. Eur J Cancer Prev 2003, 12, 479-485.
24. Nawrocki S., Cha J.: The etiology, diagnosis and management of hyperhidrosis: a comprehensive review. Part II. Therapeutic options. J Am Acad Dermatol 2019, 81, 669-680.
25. Chabicovsky M., Winkler S., Soeberdt M., Kilic A., Masur C., Abels C.: Pharmacology, toxicology and clinical safety of glycopyrrolate. Toxicol Appl Pharmacol 2019, 370, 154-169.
26. Chueasupparobon N., Rawangban W., Tangjaturonrasme N.: Treatment of Frey’s syndrome with topical ammonium alum: first report with twenty-two cases. Clin Otolaryngol 2016, 41, 593-596.
27. Jarrett J., Moss D.: PURLs: oral agent offers relief from generalized hyperhidrosis. J Fam Pract 2017, 66, 392-394.
28. Delort S., Marchi E., Corrêa M.: Oxybutynin as an alternative treatment for hyperhidrosis. An Bras Dermatol 2017, 92, 217- 220.
29. Glaser D.: Oral medications. Dermatol Clin 2014, 32, 527-532.
30. Krueger E., Claudino J., Scheeren E., Neves E., Mulinari E., Nohama P.: Iontophoresis: principles and applications. Fisioter Mov 2014, 27, 469-481.
31. Hill A., Baker G., Jansen G.: Mechanism of action of iontophoresis in the treatment of palmar hyperhidrosis. Cutis 1981, 28, 69-72.
32. Anliker M., Kreyden O.: Tap water iontophoresis. Curr Probl Dermatol 2002, 30, 48-56.
33. Wang L., Hilliges M., Gajecki M., Marcusson J., Johansson O.: No change in skin innervation in patients with palmar hyperhidrosis treated with tap-water iontophoresis. Br J Dermatol 1994, 131, 742-743.
34. Pariser D., Ballard A.: Iontophoresis for palmar and plantar hyperhidrosis. Dermatol Clin 2014, 32, 491-494.
35. DogrukKacar S., Ozuguz P., Eroglu S., Polat S., Karaca S.: Treatment of primary hyperhidrosis with tap water iontophoresis in paediatric patients: a retrospective analysis. Cutan Ocul Toxicol 2014, 33, 313-316.
36. De Almeida A., Montagner S.: Botulinum toxin for axillary hyperhidrosis. Dermatol Clin 2014, 22, 495-504.
37. Basciani M., Di Rienzo F., Bizzarrini M., Zanchi M., Copetti M., Intiso D.: Efficacy of botulinum toxin type B for the treatment of primary palmar hyperhidrosis: a prospective, open, single-blind, multi-centre study. Arch Dermatol Res 2014, 306, 497-503.
38. Rosell K., Hymnelius K., Swartling C.: Botulinum toxin type A and B improve quality of life in patients with axillary and palmar hyperhidrosis. Acta Derm Venereol 2013, 93, 335-339.
39. Hsieh P., Chiu H., Chen K., Chang C., Chou E.: Botulinum toxin A for the treatment of overactive bladder. Toxins 2016, 8, 59.
40. Satriyasa B.: Botulinum toxin A for reducing the appearance of facial wrinkles: a literature review of clinical use and pharmacological aspect. Clin Cosmet Investig Dermatol 2019, 12, 223-228.
41. Doft M., Hardy K., Ascherman J: Treatment of hyperhidrosis with botulinum toxin. Aesthet Surg J 2012, 32, 238-244.
42. Krasna M.: The role of surgical treatment of hyperhidrosis. Mayo Clin Proc 2011, 86, 717-718.
Artykuł opublikowano w „Przeglądzie Dermatologicznym” 3/2020.

Źródło:
Przegląd Dermatologiczny/Olga Jabłonowska, Anna Woźniacka, Bożena Dziankowska-Bartkowiak
Przegląd Dermatologiczny/Olga Jabłonowska, Anna Woźniacka, Bożena Dziankowska-Bartkowiak



















