Zakażenia szpitalne – jak rozwiązać ten problem

W latach 2018–2021 liczba pacjentów z zakażeniami bakteriami o skrajnej oporności na antybiotyki, tzw. CPE (Carbapenemase-producing Enterobacterales), zwiększyła się o ponad 400 proc. Bezrefleksyjne opisanie tego faktu można uznać za przejaw nieodpowiedzialności – proponujemy zatem rozwiązanie.
Skrajna oporność bakterii na wszystkie dostępne antybiotyki staje się zjawiskiem coraz częściej stwierdzanym u hospitalizowanych. Im większy szpital, im ciężej chorzy – im bardziej wyspecjalizowane procedury, tym częściej lekarze otrzymują wyniki badań mikrobiologicznych, gdzie dobór antybiotyku jest bardzo zawężony lub wręcz niemożliwy. Przyczyny napędzające narastanie tej oporności zdecydowanie wykraczają poza proste nadużywanie antybiotyków w ochronie zdrowia, ale mają bardziej związek z nieskuteczną kontrolą zakażeń w szpitalu, transferem genów oporności między zwierzętami i ludźmi.
Kłopoty wynikają też z coraz lepiej rozpoznawanych przyczyn ekologicznych.
Raport Głównej Inspekcji Sanitarnej „Stan sanitarny kraju za rok 2021” dobitnie potwierdza opisany problem, wskazując, że w latach 2018–2021 liczba pacjentów z zakażeniami bakteriami o skrajnej oporności na antybiotyki, tzw. CPE (Carbapenemase-producing Enterobacterales), zwiększyła się o ponad 400 proc. Bezrefleksyjne opisanie tego faktu, bez przedstawienia propozycji działań naprawczych, można uznać za przejaw nieodpowiedzialności.
CPE, czyli pałeczki jelitowe produkujące karbapenemazy (głównie Klebsiella pneumoniae New Delhi, OXA-48, KPC) oprócz skrajnej antybiotykooporności mają olbrzymi potencjał do rozprzestrzeniania się w warunkach szpitalnych. Na podstawie wielu symulacji epidemiologicznych można ocenić, że w chwili przekroczenia pewnej progowej zapadalności na zakażenia o etiologii CPE pojawia się efekt kuli śnieżnej prowadzący do niekontrolowanego i nieodwracalnego rozprzestrzeniania. Dla upraszczającego porównania, tą właśnie perspektywą różni się CPE od drobnoustroju, który rozbił polską ochronę zdrowia na prawie dwa lata, czyli SARS-CoV-2. Bakterie uznawane za kluczowe dla epidemiologii szpitalnej to CPE oraz Acinetobacter baumanii (tabela 1).

W latach w 2013–2016 w Polsce wystąpiła pierwsza fala zakażeń o etiologii Klebsiella pneumoniae New Delhi. Objęła ponad 10 tys. udokumentowanych w badaniach genetycznych transmisji tego samego ustroju w szpitalach głównie Wielkopolski, Mazowsza i Podlasia. Spektakularny, absolutnie unikatowy w światowej literaturze opis rozprzestrzeniania jednego drobnoustroju przygotował zespół prof. Marka Gniadkowskiego z Narodowego Instytutu Leków. Mimo twardych dowodów na szybką transmisję tej bakterii, zmieniającą oblicze sytuacji epidemiologicznej polskich szpitali, Ministerstwo Zdrowia nie uznało problemu za wystarczająco istotny, aby wdrożyć skoordynowany program zapobiegania rozprzestrzenianiu CPE. Zrozumienie przez osoby zarządzające systemem ochrony zdrowia perspektyw rozwoju CPE i jego wpływu na zdrowie leczonych w szpitalu pacjentów było powodem głębokich zmian w systemie kontroli zakażeń szpitalnych m.in. w Izraelu oraz Irlandii.
Skuteczne zapobieganie CPE odbywa się na trzech płaszczyznach: ogólnokrajowej, regionalnej i szpitalnej. Dzięki współpracy ekspertów Narodowego Programu Ochrony Antybiotyków, kierowanego przez prof. Walerię Hryniewicz, z wojewódzkimi stacjami sanitarno-epidemiologicznymi, w kilku województwach wdrożono skutecznie regionalne programy ograniczania CPE, które działały i spowodowały jedynie minimalne zachorowania aż do pandemii SARS-CoV-2. W 2023 r. sytuacja jest zdecydowanie trudniejsza, gdyż liczba pacjentów z zakażeniami CPE wzrosła na tyle, że powstrzymanie tej fali wymaga zdecydowanie szerszych działań i musi być przesłanką do szybkich, ale przemyślanych zmian systemu kontroli zakażeń szpitalnych. Należy użyć słowa „musi”, gdyż w innym wypadku perspektywa jest zbyt ponura, aby zakładać jej zaistnienie. Kontrola oporności na antybiotyki, w szczególności CPE, odbywa się na opisanych poniżej trzech płaszczyznach.
Płaszczyzna ogólnokrajowa
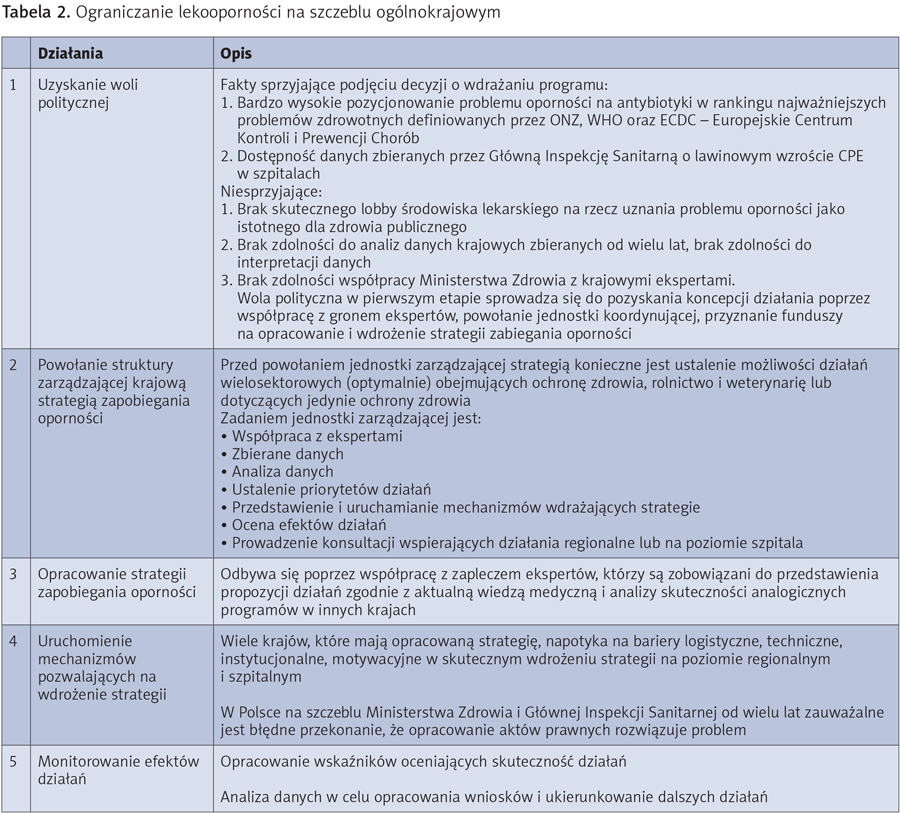
Analiza dotychczasowych działań pozwala na stwierdzenie, że na tej płaszczyźnie najtrudniej wdrożyć skuteczne działania, ponieważ wymaga to rzeczowej dyskusji miedzy przedstawicielami Ministerstwa Zdrowia, Głównej Inspekcji Sanitarnej i ekspertami, aby ocenić bieżącą sytuację, rzetelnie prognozować skutki zaniechania i przedstawiać propozycje działań. W Polsce zaplecze eksperckie, w tym wiele towarzystw naukowych, nie zbudowało lobbingu na rzecz wdrażania skutecznych działań zapobiegających oporności na antybiotyki. Polski system kontroli zakażeń w szpitalach jest w dużej mierze nastawiony na realizację działań biurokratycznych, tzn. pozorowanych (wymaganych polskim prawem), prowadzone są niewiarygodne monitorowania zakażeń, szpitalne programy kontroli zakażeń prowadzone są przez osoby (przewodniczący zespołu kontroli zakażeń szpitalnych), których przygotowanie sprowadza się w większości placówek do ukończenia zaledwie kilkudniowego szkolenia. Szczegółowo problem został poruszony w opracowaniu „System kontroli zakażeń szpitalnych” z 2016 r. dostępny m.in. na stronach internetowych Stowarzyszenia Epidemiologii Szpitalnej i Polskiego Stowarzyszenia Pielęgniarek Epidemiologicznych. Istnieje wystarczająco dużo przykładów z krajów UE oraz wytycznych, m.in. WHO, aby program ogólnokrajowy mógł być rzetelnie opracowany i wdrożony. Pierwszym, jednakże niezbędnym krokiem, jest pozyskanie woli politycznej, której podstawę stanowi rzetelne rozpoznanie problemu i uczciwa deklaracja rzeczywistego jego rozwiązania. Działania na tym poziomie sprowadzają się do opracowania ogólnokrajowej strategii zapobiegania oporności na antybiotyki oraz uruchomieniu mechanizmów, które zapewnią jego realizację. Szczegółowe propozycje zawarte są w tabeli 2.
Działania regionalne
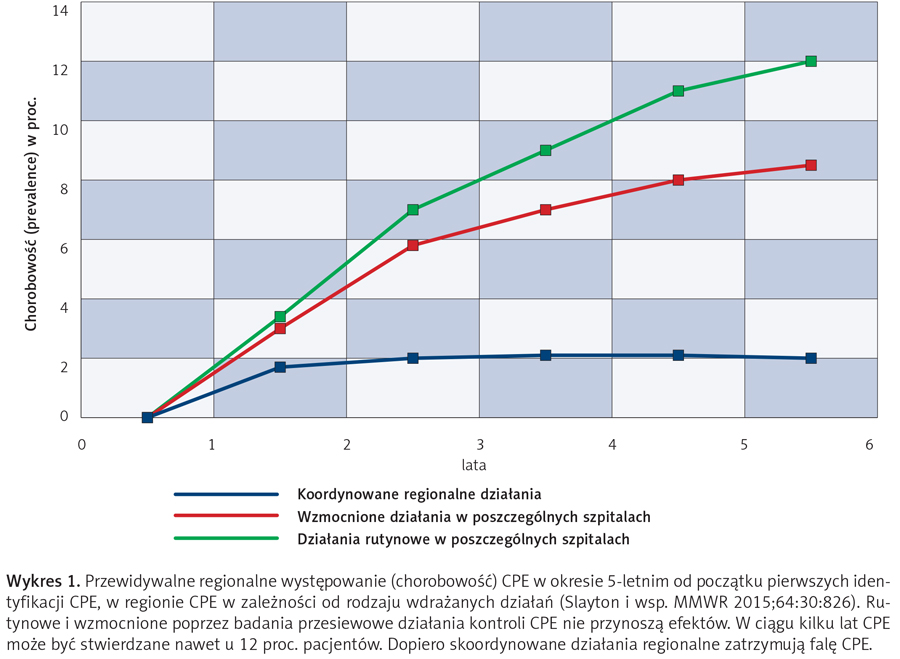
Znaczenie działań na poziomie województwa wynika z badań wskazujących na to, że szpitale stanowią system powiązanych epidemiologicznie jednostek i lekooporne drobnoustroje wraz z pacjentami przenoszą się między nimi. Niechęć jednej placówki do wdrażania programów zapobiegania oporności rzutuje na sytuację epidemiologiczną innych w danym województwie. Symulacje epidemiologiczne przedstawiane przez wiarygodne ośrodki naukowe wskazują, że jedynie skoordynowane regionalne działania mogą zatrzymać falę CPE (wykres 1).
Działania regionalne powinny być koordynowane przez wojewódzkie stacje sanitarno-epidemiologiczne przy udziale ekspertów z zakresu epidemiologii szpitalnej. Rozprzestrzenianie CPE odbywa się głównie na zatłoczonych oddziałach, w których hospitalizowani są obłożnie chorzy. Na tych oddziałach rzadko dochodzi do wykrywania inwazyjnych zakażeń, a więc ogromna większość transmisji jest niezauważalna, jeżeli nie są prowadzone badania przesiewowe (wymazy z odbytu). Takie oddziały stanowią rezerwuar CPE dla całego regionu i powinny być brane szczególnie pod uwagę w trakcie prowadzenia działań regionalnych. Konsekwencje transmisji CPE na tych oddziałach, pod postacią inwazyjnych, bardzo trudnych do wyleczenia zakażeń, ponoszą oddziały intensywnej terapii i poddające pacjentów inwazyjnym procedurom. Działania regionalne opierają się między innymi na:
- rozpoznaniu i monitorowaniu aktualnej sytuacji dotyczącej występowania CPE w regionie,
- ocenie ryzyka rozprzestrzenia CPE w regionie, identyfikacji szpitali/oddziałów stanowiących rezerwuar CPE,
- podejmowaniu interwencji weryfikujących stosowanie zaleceń ograniczania rozprzestrzenia CPE w szpitalach,
- konsultacje i doradztwo dla jednostek ochrony zdrowia,
- mobilizacji kadry zarządzającej szpitalami do wdrażania skutecznych działań.
Działania szpitala
Szpital wdraża działania uniwersalne oraz ukierunkowane na ograniczenie rozprzestrzeniania wybranej grupy drobnoustrojów. Uniwersalne, stosowane we wszystkich obszarach klinicznych, polegają na:
- zapobieganiu transmisji drobnoustrojów poprzez personel medyczny: wdrożenie programu higieny rąk zgodnie z wytycznymi WHO, dekontaminację przedmiotów podręcznych (telefony, pieczątki, stetoskopy) poprzez właściwą politykę ubraniową, utrzymując zasadę „nic poniżej łokci”, wdrożenie właściwej techniki prowadzenia toalet obłożnie chorych,
- likwidacji rezerwuarów w środowisku szpitala: na oddziale głównym rezerwuarem CPE są krany i spływy wody, z którymi mają kontakt pacjenci, a w przypadku Acinetobacter baumanii na oddziałach intensywnej terapii, najczęściej dochodzi do skażenia całego oddziału,
- wdrażaniu programu racjonalnej antybiotykoterapii.
Działania ukierunkowane na CPE lub Acinetobacter baumanii polegają przede wszystkim na identyfikacji nosicieli poprzez badania przesiewowe oraz wdrażaniu skutecznej izolacji. Prowadzenie badań przesiewowych (wymazy z odbytu) jest nadal przedmiotem licznych kontrowersji, gdyż w wielu szpitalach nie odbywa się różnicowanie między oddziałami wysokiego i niskiego ryzyka oraz szuka się zbyt wielu drobnoustrojów (np. enterokoki oporne na wankomycynę, pałeczki jelitowe ESBL), co zwiększa koszty i wydłuża czas oczekiwania na wyniki. Badania przesiewowe powinny być prowadzone przede wszystkim na oddziałach wysokiego ryzyka, np. wewnętrznych, chirurgicznych, neurologicznych, a mogą być ograniczane w oddziałach niskiego ryzyka, do których należą okulistyka, oddziały pediatryczne, najczęściej laryngologia i położnictwo. Na oddziałach wysokiego ryzyka, w których identyfikowane są przypadki CPE, należy badania przesiewowe również prowadzić w trakcie hospitalizacji.
Tekst dr. med. Tomasza Ozorowskiego, kierownika Działu Epidemiologii Uniwersyteckiego Szpitala Klinicznego w Poznaniu, wielkopolskiego konsultanta wojewódzkiego w dziedzinie mikrobiologii lekarskiej opublikowano w „Menedżerze Zdrowia” 5–6/2023.
Przeczytaj także: „Zakażenia szpitalne – jak zapewnić bezpieczeństwo pacjentom i personelowi medycznemu?”, „Bakterie oporne na działanie antybiotyku atakują”, „Bakterie grozy – dużo zakażeń, bo mało strategii” i „Bakterie grozy – to pacjent musi dowieść, że poniósł uszczerbek na zdrowiu”.
Menedżer Zdrowia/Tomasz Ozorowski




















