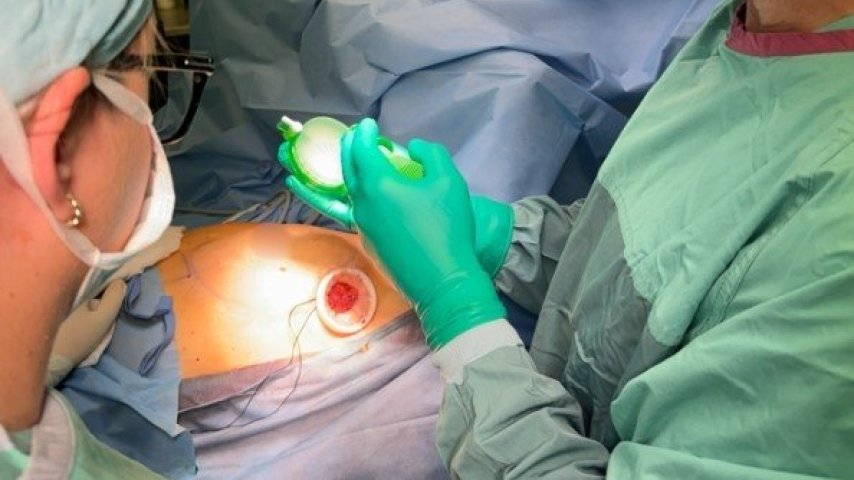
Wiedza o czerniaku może przynieść korzyści w leczeniu wszystkich nowotworów
Projekt MEL-Interaction, finansowany ze środków Unii Europejskiej, zademonstrował nowe narzędzia i modele eksperymentalne, aby odkryć interakcje genetyczne białek i limfocytów T odpowiadające za czerniaki. Te odkrycia przyczyniają się do rozwoju spersonalizowanych metod leczenia raka.
Artykuł dostępny wyłącznie dla:
lekarz, lekarz dentysta, lekarz w trakcie specjalizacji .Zaloguj się, aby przeczytać pełną treść artykułu.
Zaloguj się
Nie pamiętasz hasła?
Skorzystaj z opcji przypominania hasła, aby odzyskać dostęp do swojego konta Termedia.
Źródło:
cordis.europa.eu
cordis.europa.eu