Choroby pemfigoidowe w okresie niemowlęcym i dziecięcym

Celem pracy jest przegląd przypadków zachorowań na pemfigoid u niemowląt i dzieci na przestrzeni ostatnich 20 lat.
Autorki: Magdalena Jałowska1, Julia Jałowska2, Marian Dmochowski1
1Pracownia Autoimmunizacyjnych Dermatoz Pęcherzowych, Katedra i Klinika Dermatologii, Uniwersytet Medyczny w Poznaniu,
2Uniwersytet SWPS w Poznaniu.
Wprowadzenie
Autoimmunologiczne choroby pęcherzowe u dorosłych i dzieci to dermatozy charakteryzujące się powstawaniem pęcherzy na skórze i/lub błonach śluzowych, rozpoznawane na podstawie obrazu klinicznego, badania immunofluorescencji bezpośredniej skóry zdrowej pobranej z otoczenia zmiany skórnej oraz badania surowicy na obecność krążących autoprzeciwciał [1–4]. Pemfigoid pęcherzowy (bullous pemphigoid – BP) to autoimmunologiczna podnaskórkowa choroba pęcherzowa mediowana przeciwciałami przeciwko hemidesmosomalnym białkom skóry połączenia skórno-naskórkowego, mianowicie BP180 i/lub BP230 [5]. Jest najczęstszym autoimmunologicznym schorzeniem pęcherzowym u osób starszych, występującym średnio w wieku > 70 lat. Średni wiek pacjentów w momencie rozpoznania w Europie wynosi około 80 lat [5]. Niemowlęce i dziecięce odmiany pemfigoidu pęcherzowego (określane jako pemfigoid niemowlęcy i pemfigoid dziecięcy) należą do chorób niezwykle rzadkich [6]. Pierwszy przypadek pemfigoidu pęcherzowego u dziecka opisano w 1970 roku na podstawie bezpośredniej diagnostyki immunofluorescencyjnej [7], a pierwszy przypadek u niemowlęcia – w 1977 roku [7].
Celem pracy jest przegląd przypadków zachorowań na pemfigoid u niemowląt i dzieci na przestrzeni ostatnich 20 lat. W celu wyselekcjonowania literatury fachowej przeszukano bazę Wiley Online Library pod kątem frazy „pemfigoid niemowlęcy” w tytule (uzyskano 11 rekordów), „pemfigoid dziecięcy” w tytule (pobrano 46 rekordów, po zawężeniu puli rekordów do prac opublikowanych po 2011 roku uzyskano 7 rekordów). Ponieważ terminologia w piśmiennictwie znacznie się różni, aby uniknąć nieporozumień, w tytule i w tabeli 1 podsumowującej opublikowane przypadki używamy terminu „choroby pemfigoidowe”. Co ważne, po krytycznej ocenie piśmiennictwa proponujemy tutaj, aby unikać akronimu „BP”, jeśli nie przeprowadzono identyfikacji molekularnej autoantygenów. W związku z tym należy zauważyć, że istnieją postulaty o usprawnienie nomenklatury autoimmunologicznych chorób pęcherzowych poprzez włączenie danych dotyczących molekularnej natury autoantygenów [3]. Dlatego w dalszej części tekstu posługujemy się akronimem „BP” dla ogólnego opisu zagadnienia lub opisu poszczególnych przypadków, w których wykonano diagnostykę molekularną.
Lokalizacja zmian skórnych
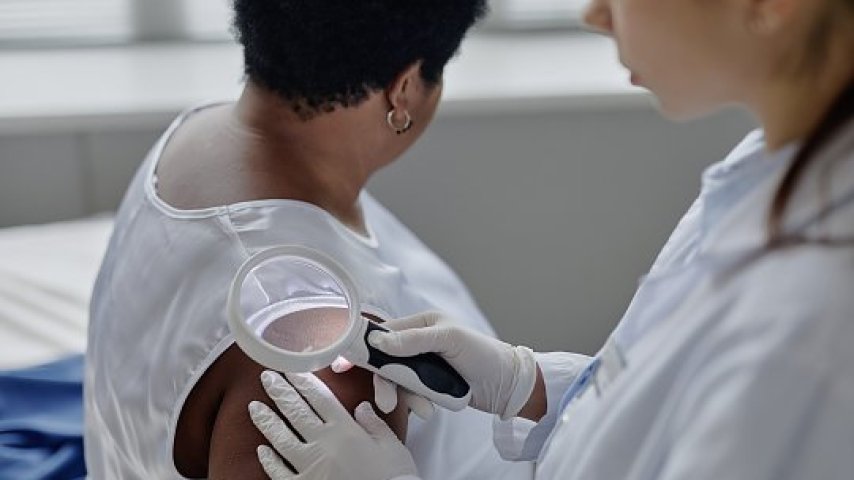
U dzieci występują 2 szczyty zachorowań na BP: pierwszy rok życia z kulminacją zachorowań około 3.–4. miesiąca i drugi, około 8. roku życia [7, 8]. Różnice w obrazie klinicznym BP zależą od wieku dzieci. U dzieci poniżej 12. miesiąca życia zmiany występują w okolicach akralnych (dłoniowo-podeszwowych) i na twarzy, oszczędzając śluzówki i okolice narządów płciowych, z uogólnionymi zmianami pęcherzowymi (obserwowanymi tylko w mniej więcej 5 proc. przypadków) lub bez pęcherzy [9, 10]. Zmiany pokrzywkowe zostały powiązane z niemowlęcym BP (ryc. 1) po szczepieniach lub infekcjach wirusowych [11, 12]. Dystrybucja zmian w późniejszym dzieciństwie była znacznie mniej jednoznaczna i obejmowała podgrupę dzieci z BP zlokalizowanym w okolicy narządów płciowych i innych lokalizacjach błony śluzowej, czyli w lokalizacjach niewystępujących u niemowląt. Zajęcie błony śluzowej jest powszechne w populacji pediatrycznej [13]. Zmiany uogólnione są rzadsze w BP u dzieci [11]. Niektórzy pacjenci mogą skarżyć się na świąd. Te różnice kliniczne doprowadziły do rozróżnienia BP niemowlęcego (infantile BP – IBP) i dziecięcego.
Pemfigoid błony śluzowej (mucous membrane pemphigoid – MMP) zwykle występuje u pacjentów w wieku podeszłym, z bardzo nielicznymi przypadkami zachorowań u dzieci [14]. Do 2021 roku zgłoszono tylko 24 przypadki dziecięcego MMP [14].
Czynniki wywołujące
Etiologia niemowlęcego i dziecięcego BP nie jest znana. Możliwe przyczyny to związek z nieswoistymi przeciwciałami matczynymi, choroby autoimmunologiczne w okresie niemowlęcym, niektóre leki i szczepionki, takie jak szczepionki przeciw błonicy, tężcowi, polio, wirusowemu zapaleniu wątroby typu B, meningokokom typu C [9]. Jednak związek patogenetyczny między BP i szczepionkami jest trudny do ustalenia ze względu na to, że dzieci otrzymają wiele szczepień w pierwszych kilku latach życia, a BP występuje bardzo rzadko w tej samej populacji [15].
Należy zidentyfikować potencjalne czynniki wywołujące BP w okresie niemowlęcym, między innymi chorobę koronawirusową 2019 (COVID-19), i odpowiednio leczyć [12].
Kryteria diagnostyczne
Kryteria diagnostyczne BP wieku dziecięcego (opublikowane w 2012 r., nie obejmują identyfikacji molekularnej autoantygenów):
1. Pacjenci w wieku poniżej 18 lat z klinicznym wyglądem napiętych pęcherzy na skórze rumieniowej lub normalnej, z zajęciem błony śluzowej lub bez, oraz z pęcherzami podnaskórkowymi z eozynofilami.
2. Linijne złogi IgG lub C3 w strefie błony podstawnej naskórka w immunofluorescencji bezpośredniej (direct immunofluorescence – DIF) lub krążące autoprzeciwciała IgG przeciw antygenom błony podstawnej w pośredniej immunofluorescencji (indirect immunofluorescence – IIF) [16].
Leczenie
W leczeniu dziecięcego i młodzieńczego BP terapią pierwszego wyboru jest zazwyczaj miejscowe lub ogólnoustrojowe stosowanie glikokortykosteroidów [7]. Nie ma jednak rygorystycznych kryteriów terapeutycznych i niewiele dyskutowano na temat różnych opcji leczniczych drugiego wyboru [7], dodając w razie potrzeby leki uzupełniające terapię glikokortykosteroidami [17]. W mniej rozległych przypadkach (< 10 proc. BSA) mogą być wystarczające glikokortykosteroidy stosowane miejscowo [7]. W cięższych przypadkach leczeniem z wyboru jest schemat polegający na powolnym obniżaniu dawki prednizonu od 2 do 1 mg/kg m.c./dobę [7].
Niemowlęcy i młodzieńczy BP zwykle cechuje się szybką odpowiedzią na ogólnoustrojowe glikokortykosteroidy, ulega remisji w czasie kilku miesięcy [8] i generalnie ma dobre rokowanie [8]. Nawroty są zgłaszane u 12 proc. niemowląt, zwłaszcza po szybkim zmniejszeniu dawki glikokortykosteroidów [17]. Wznowy są rzadkie, chociaż zdarzają się przypadki oporne na leczenie. Choroba może zagrażać życiu, zwłaszcza gdy zmiany są uogólnione [8]. Fuertes i wsp. opisują przypadek niemowlęcia z ciężkim BP opornym na wielokrotne leczenie, z wrodzoną limfopenią limfocytów T, która mogła mieć wpływ na niezwykle agresywny przebieg choroby pęcherzowej [8]. Rytuksymab doprowadził do pełnej odpowiedzi klinicznej, ale dziecko zmarło niespodziewanie 3 miesiące po ostatnim wlewie rytuksymabu [8]. Flores-Climente i wsp. opisują niemowlę z ocznym MMP, u którego z powodzeniem zastosowano rytuksymab [18].
Jedną z proponowanych opcji leczenia IBP jest połączenie silnego miejscowego glikokortykosteroidu i erytromycyny stosowanej doustnie [19]. W piśmiennictwie dostępne są opisy przypadków IBP skutecznie leczonych dożylną terapią immunoglobulinami (intravenous immunoglobulin – IVIG). Leczenie to można rozważyć jako możliwą opcję terapeutyczną pacjentów opornych na konwencjonalną terapię glikokortykosteroidami [20]. Opisywano przypadki IBP leczone IVIG w różnych dawkach (200–1000 mg/kg m.c./dobę), liczbie (1–7), czasie trwania kursów wlewów (1–5 dni) i różnych odstępach między kursami (2–5 tygodni). Najczęściej podawane dawki odpowiadały schematowi IVIG u dorosłych (400 mg/kg m.c./dobę, 5 dni) w autoimmunologicznych chorobach pęcherzowych obejmujących BP [21].
Bardziej oporne przypadki mogą wymagać leczenia uzupełniającego w postaci dapsonu, azatiopryny, mykofenolanu mofetylu (MMF), cyklosporyny, sulfasalazyny lub IVIG oddzielnie lub w połączeniu z glikokortykosteroidami.
Diagnoza różnicowa
Diagnostyka różnicowa powinna obejmować linijną IgA chorobę pęcherzową, pęcherzowy toczeń rumieniowaty układowy, opryszczkowe zapalenie skóry, nabyte pęcherzowe oddzielanie się naskórka, pęcherzową osutkę polekową [10, 18], infekcja HSV typu 1 i 2, choroby zakaźne wieku dziecięcego przebiegające z pęcherzami. W diagnostyce różnicowej przewlekłych nadżerek powierzchownych sromu objawiających się w dzieciństwie uwzględnia się różne jednostki chorobowe: liszaj twardzinowy, liszaj płaski nadżerkowy, kontaktowe zapalenie skóry z podrażnienia, ciężkie nietrzymanie moczu, pieluszkowe nadżerkowe zapalenie skóry Jacqueta, przewlekłe zakażenie HSV oraz wykorzystywanie seksualne [10] (tab. 1).
Wnioski
Przeanalizowaliśmy 18 publikacji z lat 2012–2023 dotyczących chorób pemfigoidowych u dzieci i niemowląt. Niektóre publikacje, pomimo wzmianki o pemfigoidzie dziecięcym w tytule, w rzeczywistości opisywały pemfigoid u niemowląt. Remisję uzyskano u 17 leczonych pacjentów, zgon odnotowano tylko u 1 niemowlęcia, u którego wcześniej rozpoznano niedobór odporności. Większość chorych była leczona ogólnoustrojowo glikokortykosteroidami, u 8 niemowląt dodatkowo wprowadzono dożylne immunoglobuliny, u 1 cyklosporynę (MMP), u 3 mykofenolan mofetylu, u 3 dapson, u 2 erytromycynę, u 2 rytuksymab i u 1 azatioprynę. Objawy pemfigoidu po szczepieniu stwierdzono u 14 niemowląt. Po uzyskaniu remisji szczepienia wznowiono i nie stwierdzono reakcji na immunizację.
U wszystkich dzieci poniżej 1. roku życia zmiany skórne były zlokalizowane na rękach i stopach (dłonie i podeszwy stóp) bez zajęcia błony śluzowej. U dzieci powyżej 1. roku życia obecne były pęcherze zlokalizowane głównie na błonie śluzowej. W dzieciństwie zmiany pemfigoidowe mają tendencję do lokalizowania się wokół naturalnych otworów ciała, podobnie jak w pęcherzycy [29].
Konfilikt interesów
Autorzy nie zgłaszają konfliktu interesów.
Pełna wersja pracy dostępna jest
Piśmiennictwo
1. Chia-Sui C., Chien-Lun H., Ming-Luen L., Chun-Jen C., Ding-Dar L., Keh-Gong W.: Childhood bullous pemphigoid: a case report and literature review. J Clin Exp Dermatol Res 2013, S6. DOI:10.4172/2155-9554.S6-010.
2. Jałowska M., Gornowicz-Porowska J., Seraszek-Jaros A., Bowszyc-Dmochowska M., Kaczmarek E., Dmochowski M.: Clinical significance of umbilical region involvement in pemphigus vulgaris in a series of 81 ethnic Poles: a comparative analysis of the distribution of lesions in two infrequent locations. Adv Dermatol Allergol 2022, 29, 281-285.
3. Dmochowski M., Jałowska M., Bowszyc-Dmochowska M.: Issues occupying our minds: nomenclature of autoimmune blistering diseases requires updating, pemphigus vulgaris propensity to affect areas adjacent to natural body orifices unifies seemingly diverse clinical features of this disease. Front Immunol 2022, 13, 1103375.
4. Jałowska M.D., Gornowicz-Porowska J., Seraszek-Jaros A., Bowszyc-Dmochowska M., Kaczmarek E., Dmochowski M.: Conceptualization and validation of an innovative direct immunofluorescence technique utilizing fluorescein conjugate against IgG + IgG4 for routinely diagnosing autoimmune bullous dermatoses. Cent Eur J Immunol 2021, 46, 183-190.
5. Borradori L., Van Beek N., Feliciani C., Tedbirt B., Antiga E., Bergman R., et al.: Updated S2 K guidelines for the management of bullous pemphigoid initiated by the European Academy of Dermatology and Venereology (EADV). J Eur Acad Dermatol Venereol 2022, 36, 1689-1704.
6. Wawrzycki B., Krasowska D., Pietrzak A., Szumilo J., Blazowski L., Pietraszek-Mamcarz J., et al.: Infantile bullous pemphigoid successfully treated with combined pulse corticosteroids and high-dose IVIG. Dermatol Ther 2018, 31, e12635.
7. Schwieger-Briel A., Moellmann C., Mattulat B., Schauer F., Kiritsi D., Schmidt E., et al.: Bullous pemphigoid in infants: characteristics, diagnosis and treatment. Orphanet J Rare Dis 2014, 9, 185.
8. Fuertes I., Luelmo J., Leal L., Romaní J., Sánchez S., Mascaró J.M. Jr.: Refractory childhood pemphigoid successfully treated with rituximab. Pediatr Dermatol 2012, 30, e96-7.
9. de la Fuente S., Hernandez-Martın A., de Lucas R., González-Enseñat M.A., Vicente A., Colmenero I.: Postvaccination bullous pemphigoid in infancy: report of three new cases and literature review. Pediatr Dermatol 2013, 30, 741-744.
10. Belzile E., Funaro D., Powell J.: Localized vulvar bullous pemphigoid of childhood: a rare cause of persistent vulvar erosions in children, Pediatr Dermatol 2019, 36, 349-351.
11. Neri I., Greco A., Bassi A., Orgaz-Molina J., Balestri R., Oranges T.: Bullous pemphigoid in infant postvaccination: myth or reality? Int J Immunopathol Pharmacol 2016, 29, 295-299.
12. Rosińska-Więckowicz A., Jałowska M., Bowszyc-Dmochowska M., Dmochowski M.: Case report: infantile bullous pemphigoid: triggering by COVID-19 is speculative. Front Med 2021, 8, 760823.
13. Das D., Bandyopadhyay D.: Juvenile pemphigoid nodularis: report of a rare case. Indian Dermatol Online J 2014, 5, 189-192.
14. Rodriguez Baisi K., Wentworth A., Chattha A.J., DiCaudo D.J., Mangold A., Nelson S.A.: A rare case of childhood mucous membrane pemphigoid involving the oral and genital mucosa. Pediatr Dermatol 2021, 38, 904-907.
15. Baoqi Y., Mei W., Xiaoxiao Y., Fangfang B., Zhenhua Y., Zhenhuan P., et al.: Childhood bullous pemphigoid: a report of three cases in China. Int J Dermatol 2015, 55, 691-694.
16. Sansaricq F., Stein S.L., Petronic-Rosic V.: Autoimmune bullous diseases in childhood. Clin Dermatol 2012, 30, 114-127.
17. Viglizzo G., Herzum A., Cozzani E., Occella C., Parodi A.: Intravenous immunoglobulins in infantile dyshidrosiform bullous pemphigoid refractory to steroids and dapsone. Dermatol Ther 2022, 35, e15826.
18. Flores-Climente V., Rozas-Muñoz E., Martínez-Grau A., Aucouturier F., Luna S., Baselga E.: Childhood ocular mucous membrane pemphigoid successfully treated with rituximab. Pediatr Dermatol 2019, 36, 984-985.
19. Farrugia M.E., Ball S.L., Tidman M.J.: Infantile pemphigoid treated without oral corticosteroids. Clin Exp Dermatol 2019, 44, 832-833.
20. Watanabe T., Hara S., Muto J., Watanabe D., Akiyama M.: Infantile bullous pemphigoid successfully treated with intravenous immunoglobulin therapy. Clin Exp Dermatol 2017, 42, 576-578.
21. Tekin B., Yücelten A.D.: Infantile bullous pemphigoid treated using intra-venous immunoglobulin: case report and review of the literature. Pediatr Dermatol 2015, 32, 723-726.
22. Ramos L., Tellechea O., Moreno A., Martins L., Neves N., Januário G., et al.: Childhood bullous pemphigoid: report of 2 cases. J Eur Acad Dermatol Venereol 2016, 30, 330-332.
23. Taquin H., Chiaverini C., Lacour J.P.: Spectrum of clinical responses to therapies in infantile bullous pemphigoid. Pediatr Dermatol 2016, 33, e77-e81.
24. Okada K., Kakeda M., Yamamoto S., Yokoyama T., Habe K., Nakato D.: Infantile bullous pemphigoid successfully treated with i.v. immunoglobulin and cyclosporin. J Dermatol 2019, 46, e213-e214.
25. Wang Y., Xiao Y., Li Y., Fu L., Yu F., Ma L., et al.: Bullous pemphigoid associated with ulcerative colitis in a young child: a case report. Dermatol Ther 2020, 33, e14325.
26. Navarro-Navarro I., Jiménez-Gallo D., Valenzuela-Ubiña S., Domínguez-Gomez M., Linares-Barrios M.: Infantile bullous pemphigoid following serogroup B meningococcal vaccination. Br J Dermatol 2021, 184, e53.
27. Xu K., Wei Y., Wang T., Ding L., Li W., Wang L.: A case of infantile bullous pemphigoid successfully treated with compound glycyrrhizin tablets. Dermatol Ther 2020, 33, e13550.
28. Pérez-Feal P., Pita da Veiga G., Sánchez-Aguilar D., Aliste C., Vázquez-Veiga H., Vázquez-Osorio I.: Infantile bullous pemphigoid after meningococcal B vaccine. Int J Dermatol 2021, 60, 1172-1173.
29. Jałowska M., Gornowicz-Porowska J., Bowszyc-Dmochowska M., Dmochowski M.: Sacral dimple, conjunctiva, and nipple as less obvious pemphigus vulgaris locations around natural body orifices: a report of three cases. J Clin Med 2022, 11, 2855.
1Pracownia Autoimmunizacyjnych Dermatoz Pęcherzowych, Katedra i Klinika Dermatologii, Uniwersytet Medyczny w Poznaniu,
2Uniwersytet SWPS w Poznaniu.
Wprowadzenie
Autoimmunologiczne choroby pęcherzowe u dorosłych i dzieci to dermatozy charakteryzujące się powstawaniem pęcherzy na skórze i/lub błonach śluzowych, rozpoznawane na podstawie obrazu klinicznego, badania immunofluorescencji bezpośredniej skóry zdrowej pobranej z otoczenia zmiany skórnej oraz badania surowicy na obecność krążących autoprzeciwciał [1–4]. Pemfigoid pęcherzowy (bullous pemphigoid – BP) to autoimmunologiczna podnaskórkowa choroba pęcherzowa mediowana przeciwciałami przeciwko hemidesmosomalnym białkom skóry połączenia skórno-naskórkowego, mianowicie BP180 i/lub BP230 [5]. Jest najczęstszym autoimmunologicznym schorzeniem pęcherzowym u osób starszych, występującym średnio w wieku > 70 lat. Średni wiek pacjentów w momencie rozpoznania w Europie wynosi około 80 lat [5]. Niemowlęce i dziecięce odmiany pemfigoidu pęcherzowego (określane jako pemfigoid niemowlęcy i pemfigoid dziecięcy) należą do chorób niezwykle rzadkich [6]. Pierwszy przypadek pemfigoidu pęcherzowego u dziecka opisano w 1970 roku na podstawie bezpośredniej diagnostyki immunofluorescencyjnej [7], a pierwszy przypadek u niemowlęcia – w 1977 roku [7].
Celem pracy jest przegląd przypadków zachorowań na pemfigoid u niemowląt i dzieci na przestrzeni ostatnich 20 lat. W celu wyselekcjonowania literatury fachowej przeszukano bazę Wiley Online Library pod kątem frazy „pemfigoid niemowlęcy” w tytule (uzyskano 11 rekordów), „pemfigoid dziecięcy” w tytule (pobrano 46 rekordów, po zawężeniu puli rekordów do prac opublikowanych po 2011 roku uzyskano 7 rekordów). Ponieważ terminologia w piśmiennictwie znacznie się różni, aby uniknąć nieporozumień, w tytule i w tabeli 1 podsumowującej opublikowane przypadki używamy terminu „choroby pemfigoidowe”. Co ważne, po krytycznej ocenie piśmiennictwa proponujemy tutaj, aby unikać akronimu „BP”, jeśli nie przeprowadzono identyfikacji molekularnej autoantygenów. W związku z tym należy zauważyć, że istnieją postulaty o usprawnienie nomenklatury autoimmunologicznych chorób pęcherzowych poprzez włączenie danych dotyczących molekularnej natury autoantygenów [3]. Dlatego w dalszej części tekstu posługujemy się akronimem „BP” dla ogólnego opisu zagadnienia lub opisu poszczególnych przypadków, w których wykonano diagnostykę molekularną.
Lokalizacja zmian skórnych
U dzieci występują 2 szczyty zachorowań na BP: pierwszy rok życia z kulminacją zachorowań około 3.–4. miesiąca i drugi, około 8. roku życia [7, 8]. Różnice w obrazie klinicznym BP zależą od wieku dzieci. U dzieci poniżej 12. miesiąca życia zmiany występują w okolicach akralnych (dłoniowo-podeszwowych) i na twarzy, oszczędzając śluzówki i okolice narządów płciowych, z uogólnionymi zmianami pęcherzowymi (obserwowanymi tylko w mniej więcej 5 proc. przypadków) lub bez pęcherzy [9, 10]. Zmiany pokrzywkowe zostały powiązane z niemowlęcym BP (ryc. 1) po szczepieniach lub infekcjach wirusowych [11, 12]. Dystrybucja zmian w późniejszym dzieciństwie była znacznie mniej jednoznaczna i obejmowała podgrupę dzieci z BP zlokalizowanym w okolicy narządów płciowych i innych lokalizacjach błony śluzowej, czyli w lokalizacjach niewystępujących u niemowląt. Zajęcie błony śluzowej jest powszechne w populacji pediatrycznej [13]. Zmiany uogólnione są rzadsze w BP u dzieci [11]. Niektórzy pacjenci mogą skarżyć się na świąd. Te różnice kliniczne doprowadziły do rozróżnienia BP niemowlęcego (infantile BP – IBP) i dziecięcego.
Pemfigoid błony śluzowej (mucous membrane pemphigoid – MMP) zwykle występuje u pacjentów w wieku podeszłym, z bardzo nielicznymi przypadkami zachorowań u dzieci [14]. Do 2021 roku zgłoszono tylko 24 przypadki dziecięcego MMP [14].
Czynniki wywołujące
Etiologia niemowlęcego i dziecięcego BP nie jest znana. Możliwe przyczyny to związek z nieswoistymi przeciwciałami matczynymi, choroby autoimmunologiczne w okresie niemowlęcym, niektóre leki i szczepionki, takie jak szczepionki przeciw błonicy, tężcowi, polio, wirusowemu zapaleniu wątroby typu B, meningokokom typu C [9]. Jednak związek patogenetyczny między BP i szczepionkami jest trudny do ustalenia ze względu na to, że dzieci otrzymają wiele szczepień w pierwszych kilku latach życia, a BP występuje bardzo rzadko w tej samej populacji [15].
Należy zidentyfikować potencjalne czynniki wywołujące BP w okresie niemowlęcym, między innymi chorobę koronawirusową 2019 (COVID-19), i odpowiednio leczyć [12].
Kryteria diagnostyczne
Kryteria diagnostyczne BP wieku dziecięcego (opublikowane w 2012 r., nie obejmują identyfikacji molekularnej autoantygenów):
1. Pacjenci w wieku poniżej 18 lat z klinicznym wyglądem napiętych pęcherzy na skórze rumieniowej lub normalnej, z zajęciem błony śluzowej lub bez, oraz z pęcherzami podnaskórkowymi z eozynofilami.
2. Linijne złogi IgG lub C3 w strefie błony podstawnej naskórka w immunofluorescencji bezpośredniej (direct immunofluorescence – DIF) lub krążące autoprzeciwciała IgG przeciw antygenom błony podstawnej w pośredniej immunofluorescencji (indirect immunofluorescence – IIF) [16].
Leczenie
W leczeniu dziecięcego i młodzieńczego BP terapią pierwszego wyboru jest zazwyczaj miejscowe lub ogólnoustrojowe stosowanie glikokortykosteroidów [7]. Nie ma jednak rygorystycznych kryteriów terapeutycznych i niewiele dyskutowano na temat różnych opcji leczniczych drugiego wyboru [7], dodając w razie potrzeby leki uzupełniające terapię glikokortykosteroidami [17]. W mniej rozległych przypadkach (< 10 proc. BSA) mogą być wystarczające glikokortykosteroidy stosowane miejscowo [7]. W cięższych przypadkach leczeniem z wyboru jest schemat polegający na powolnym obniżaniu dawki prednizonu od 2 do 1 mg/kg m.c./dobę [7].
Niemowlęcy i młodzieńczy BP zwykle cechuje się szybką odpowiedzią na ogólnoustrojowe glikokortykosteroidy, ulega remisji w czasie kilku miesięcy [8] i generalnie ma dobre rokowanie [8]. Nawroty są zgłaszane u 12 proc. niemowląt, zwłaszcza po szybkim zmniejszeniu dawki glikokortykosteroidów [17]. Wznowy są rzadkie, chociaż zdarzają się przypadki oporne na leczenie. Choroba może zagrażać życiu, zwłaszcza gdy zmiany są uogólnione [8]. Fuertes i wsp. opisują przypadek niemowlęcia z ciężkim BP opornym na wielokrotne leczenie, z wrodzoną limfopenią limfocytów T, która mogła mieć wpływ na niezwykle agresywny przebieg choroby pęcherzowej [8]. Rytuksymab doprowadził do pełnej odpowiedzi klinicznej, ale dziecko zmarło niespodziewanie 3 miesiące po ostatnim wlewie rytuksymabu [8]. Flores-Climente i wsp. opisują niemowlę z ocznym MMP, u którego z powodzeniem zastosowano rytuksymab [18].
Jedną z proponowanych opcji leczenia IBP jest połączenie silnego miejscowego glikokortykosteroidu i erytromycyny stosowanej doustnie [19]. W piśmiennictwie dostępne są opisy przypadków IBP skutecznie leczonych dożylną terapią immunoglobulinami (intravenous immunoglobulin – IVIG). Leczenie to można rozważyć jako możliwą opcję terapeutyczną pacjentów opornych na konwencjonalną terapię glikokortykosteroidami [20]. Opisywano przypadki IBP leczone IVIG w różnych dawkach (200–1000 mg/kg m.c./dobę), liczbie (1–7), czasie trwania kursów wlewów (1–5 dni) i różnych odstępach między kursami (2–5 tygodni). Najczęściej podawane dawki odpowiadały schematowi IVIG u dorosłych (400 mg/kg m.c./dobę, 5 dni) w autoimmunologicznych chorobach pęcherzowych obejmujących BP [21].
Bardziej oporne przypadki mogą wymagać leczenia uzupełniającego w postaci dapsonu, azatiopryny, mykofenolanu mofetylu (MMF), cyklosporyny, sulfasalazyny lub IVIG oddzielnie lub w połączeniu z glikokortykosteroidami.
Diagnoza różnicowa
Diagnostyka różnicowa powinna obejmować linijną IgA chorobę pęcherzową, pęcherzowy toczeń rumieniowaty układowy, opryszczkowe zapalenie skóry, nabyte pęcherzowe oddzielanie się naskórka, pęcherzową osutkę polekową [10, 18], infekcja HSV typu 1 i 2, choroby zakaźne wieku dziecięcego przebiegające z pęcherzami. W diagnostyce różnicowej przewlekłych nadżerek powierzchownych sromu objawiających się w dzieciństwie uwzględnia się różne jednostki chorobowe: liszaj twardzinowy, liszaj płaski nadżerkowy, kontaktowe zapalenie skóry z podrażnienia, ciężkie nietrzymanie moczu, pieluszkowe nadżerkowe zapalenie skóry Jacqueta, przewlekłe zakażenie HSV oraz wykorzystywanie seksualne [10] (tab. 1).
Wnioski
Przeanalizowaliśmy 18 publikacji z lat 2012–2023 dotyczących chorób pemfigoidowych u dzieci i niemowląt. Niektóre publikacje, pomimo wzmianki o pemfigoidzie dziecięcym w tytule, w rzeczywistości opisywały pemfigoid u niemowląt. Remisję uzyskano u 17 leczonych pacjentów, zgon odnotowano tylko u 1 niemowlęcia, u którego wcześniej rozpoznano niedobór odporności. Większość chorych była leczona ogólnoustrojowo glikokortykosteroidami, u 8 niemowląt dodatkowo wprowadzono dożylne immunoglobuliny, u 1 cyklosporynę (MMP), u 3 mykofenolan mofetylu, u 3 dapson, u 2 erytromycynę, u 2 rytuksymab i u 1 azatioprynę. Objawy pemfigoidu po szczepieniu stwierdzono u 14 niemowląt. Po uzyskaniu remisji szczepienia wznowiono i nie stwierdzono reakcji na immunizację.
U wszystkich dzieci poniżej 1. roku życia zmiany skórne były zlokalizowane na rękach i stopach (dłonie i podeszwy stóp) bez zajęcia błony śluzowej. U dzieci powyżej 1. roku życia obecne były pęcherze zlokalizowane głównie na błonie śluzowej. W dzieciństwie zmiany pemfigoidowe mają tendencję do lokalizowania się wokół naturalnych otworów ciała, podobnie jak w pęcherzycy [29].
Konfilikt interesów
Autorzy nie zgłaszają konfliktu interesów.
Pełna wersja pracy dostępna jest
| TUTAJ |  |
Piśmiennictwo
1. Chia-Sui C., Chien-Lun H., Ming-Luen L., Chun-Jen C., Ding-Dar L., Keh-Gong W.: Childhood bullous pemphigoid: a case report and literature review. J Clin Exp Dermatol Res 2013, S6. DOI:10.4172/2155-9554.S6-010.
2. Jałowska M., Gornowicz-Porowska J., Seraszek-Jaros A., Bowszyc-Dmochowska M., Kaczmarek E., Dmochowski M.: Clinical significance of umbilical region involvement in pemphigus vulgaris in a series of 81 ethnic Poles: a comparative analysis of the distribution of lesions in two infrequent locations. Adv Dermatol Allergol 2022, 29, 281-285.
3. Dmochowski M., Jałowska M., Bowszyc-Dmochowska M.: Issues occupying our minds: nomenclature of autoimmune blistering diseases requires updating, pemphigus vulgaris propensity to affect areas adjacent to natural body orifices unifies seemingly diverse clinical features of this disease. Front Immunol 2022, 13, 1103375.
4. Jałowska M.D., Gornowicz-Porowska J., Seraszek-Jaros A., Bowszyc-Dmochowska M., Kaczmarek E., Dmochowski M.: Conceptualization and validation of an innovative direct immunofluorescence technique utilizing fluorescein conjugate against IgG + IgG4 for routinely diagnosing autoimmune bullous dermatoses. Cent Eur J Immunol 2021, 46, 183-190.
5. Borradori L., Van Beek N., Feliciani C., Tedbirt B., Antiga E., Bergman R., et al.: Updated S2 K guidelines for the management of bullous pemphigoid initiated by the European Academy of Dermatology and Venereology (EADV). J Eur Acad Dermatol Venereol 2022, 36, 1689-1704.
6. Wawrzycki B., Krasowska D., Pietrzak A., Szumilo J., Blazowski L., Pietraszek-Mamcarz J., et al.: Infantile bullous pemphigoid successfully treated with combined pulse corticosteroids and high-dose IVIG. Dermatol Ther 2018, 31, e12635.
7. Schwieger-Briel A., Moellmann C., Mattulat B., Schauer F., Kiritsi D., Schmidt E., et al.: Bullous pemphigoid in infants: characteristics, diagnosis and treatment. Orphanet J Rare Dis 2014, 9, 185.
8. Fuertes I., Luelmo J., Leal L., Romaní J., Sánchez S., Mascaró J.M. Jr.: Refractory childhood pemphigoid successfully treated with rituximab. Pediatr Dermatol 2012, 30, e96-7.
9. de la Fuente S., Hernandez-Martın A., de Lucas R., González-Enseñat M.A., Vicente A., Colmenero I.: Postvaccination bullous pemphigoid in infancy: report of three new cases and literature review. Pediatr Dermatol 2013, 30, 741-744.
10. Belzile E., Funaro D., Powell J.: Localized vulvar bullous pemphigoid of childhood: a rare cause of persistent vulvar erosions in children, Pediatr Dermatol 2019, 36, 349-351.
11. Neri I., Greco A., Bassi A., Orgaz-Molina J., Balestri R., Oranges T.: Bullous pemphigoid in infant postvaccination: myth or reality? Int J Immunopathol Pharmacol 2016, 29, 295-299.
12. Rosińska-Więckowicz A., Jałowska M., Bowszyc-Dmochowska M., Dmochowski M.: Case report: infantile bullous pemphigoid: triggering by COVID-19 is speculative. Front Med 2021, 8, 760823.
13. Das D., Bandyopadhyay D.: Juvenile pemphigoid nodularis: report of a rare case. Indian Dermatol Online J 2014, 5, 189-192.
14. Rodriguez Baisi K., Wentworth A., Chattha A.J., DiCaudo D.J., Mangold A., Nelson S.A.: A rare case of childhood mucous membrane pemphigoid involving the oral and genital mucosa. Pediatr Dermatol 2021, 38, 904-907.
15. Baoqi Y., Mei W., Xiaoxiao Y., Fangfang B., Zhenhua Y., Zhenhuan P., et al.: Childhood bullous pemphigoid: a report of three cases in China. Int J Dermatol 2015, 55, 691-694.
16. Sansaricq F., Stein S.L., Petronic-Rosic V.: Autoimmune bullous diseases in childhood. Clin Dermatol 2012, 30, 114-127.
17. Viglizzo G., Herzum A., Cozzani E., Occella C., Parodi A.: Intravenous immunoglobulins in infantile dyshidrosiform bullous pemphigoid refractory to steroids and dapsone. Dermatol Ther 2022, 35, e15826.
18. Flores-Climente V., Rozas-Muñoz E., Martínez-Grau A., Aucouturier F., Luna S., Baselga E.: Childhood ocular mucous membrane pemphigoid successfully treated with rituximab. Pediatr Dermatol 2019, 36, 984-985.
19. Farrugia M.E., Ball S.L., Tidman M.J.: Infantile pemphigoid treated without oral corticosteroids. Clin Exp Dermatol 2019, 44, 832-833.
20. Watanabe T., Hara S., Muto J., Watanabe D., Akiyama M.: Infantile bullous pemphigoid successfully treated with intravenous immunoglobulin therapy. Clin Exp Dermatol 2017, 42, 576-578.
21. Tekin B., Yücelten A.D.: Infantile bullous pemphigoid treated using intra-venous immunoglobulin: case report and review of the literature. Pediatr Dermatol 2015, 32, 723-726.
22. Ramos L., Tellechea O., Moreno A., Martins L., Neves N., Januário G., et al.: Childhood bullous pemphigoid: report of 2 cases. J Eur Acad Dermatol Venereol 2016, 30, 330-332.
23. Taquin H., Chiaverini C., Lacour J.P.: Spectrum of clinical responses to therapies in infantile bullous pemphigoid. Pediatr Dermatol 2016, 33, e77-e81.
24. Okada K., Kakeda M., Yamamoto S., Yokoyama T., Habe K., Nakato D.: Infantile bullous pemphigoid successfully treated with i.v. immunoglobulin and cyclosporin. J Dermatol 2019, 46, e213-e214.
25. Wang Y., Xiao Y., Li Y., Fu L., Yu F., Ma L., et al.: Bullous pemphigoid associated with ulcerative colitis in a young child: a case report. Dermatol Ther 2020, 33, e14325.
26. Navarro-Navarro I., Jiménez-Gallo D., Valenzuela-Ubiña S., Domínguez-Gomez M., Linares-Barrios M.: Infantile bullous pemphigoid following serogroup B meningococcal vaccination. Br J Dermatol 2021, 184, e53.
27. Xu K., Wei Y., Wang T., Ding L., Li W., Wang L.: A case of infantile bullous pemphigoid successfully treated with compound glycyrrhizin tablets. Dermatol Ther 2020, 33, e13550.
28. Pérez-Feal P., Pita da Veiga G., Sánchez-Aguilar D., Aliste C., Vázquez-Veiga H., Vázquez-Osorio I.: Infantile bullous pemphigoid after meningococcal B vaccine. Int J Dermatol 2021, 60, 1172-1173.
29. Jałowska M., Gornowicz-Porowska J., Bowszyc-Dmochowska M., Dmochowski M.: Sacral dimple, conjunctiva, and nipple as less obvious pemphigus vulgaris locations around natural body orifices: a report of three cases. J Clin Med 2022, 11, 2855.
Źródło:
Dermatol Rev/Przegl Dermatol 2023, 110, 12–22
Dermatol Rev/Przegl Dermatol 2023, 110, 12–22