Niwolumab został zarejestrowany do leczenia niektórych postaci raka jelita grubego z przerzutami
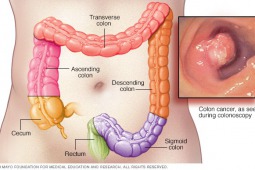
Amerykańska Agencja Żywności i Leków (Food and Drug Administration, FDA) zarejestrowała przyspieszonej procedurze niwolumab (Opdivo) doleczenia dorosłych oraz nastoletnich chorych na raka jelita grubego z przerzutami, ze znaczną niestabilnością mikrosatelitarną (microsatellite instability, MSI-H) oraz zaburzeniem mechanizmów naprawczych (mismatch repair deficient, dMMR), u których doszło do progresji choroby po leczeniu schematem zawierającym fluoropirymidynę, oksaliplatynę i irynotekan.
Rejestrację oparto na wynikach badania klinicznego CheckMate 142, do którego włączono 53 chorych na raka jelita grubego z przerzutami z miejscową MSI-H lub dMMR, u których doszło do progresji choroby po wcześniejszym leczeniu. Chorych przydzielano do grupy otrzymującej niwolumab 3 mg/kg co 2 tygodnie do progresji choroby lub nieakceptowalnej toksyczności.
U 28% chorych odnotowano obiektywna odpowiedź na leczenie, w tym 1 odpowiedź całkowita i 14 odpowiedzi częściowych.
Informacja prasowa FDA podkreśla, że nie badano niwolumabu u dzieci, a w odniesieniu do nastolatków w weku 12 lat i starszych z rakiem jelita grubego z przerzutami z MSI-H lub dMMR zastosowano wyniki uzyskane u dorosłych.
Wyniki badania CheckMate 142 przedstawiono na American Society of Clinical Oncology (ASCO) Gastrointestinal Cancers Symposium w styczniu 2017 roku. Jak podkreślili badacze, niwolumab w monoterapii pozwala na uzyskanie trwałych odpowiedzi, kontroli choroby oraz długotrwałego przeżycia u chorych na raka jelita grubego z MSI-H. Odpowiedzi odnotowano niezależnie od ekspresji PD-L1 na komórkach guza lub komórkach immunologicznych, od stanu mutacji w genie BRAF lub KRAS oraz od rozpoznania zespołu Lyncha w wywiadzie.
Najczęstsze działania niepożądane odnotowane w trakcie leczenia niwolumabem obejmowały zmęczenie, wysypkę, bole mięśni i kości, pokrzywkę, biegunkę, nudności, osłabienie, kaszel, duszność, zaparcie, zmniejszenie apetytu, bole pleców, bole stawów, zakażenia górnych dróg oddechowych oraz gorączkę.
Lek zarejestrowano w zalecanej dawce 240 mg we wlewie dożylnym w ciągu 60 minut co 2 tygodnie. W maju w podobnym wskazaniu zarejestrowano inny lek immunologiczny, pembrolizumab.
U 28% chorych odnotowano obiektywna odpowiedź na leczenie, w tym 1 odpowiedź całkowita i 14 odpowiedzi częściowych.
Informacja prasowa FDA podkreśla, że nie badano niwolumabu u dzieci, a w odniesieniu do nastolatków w weku 12 lat i starszych z rakiem jelita grubego z przerzutami z MSI-H lub dMMR zastosowano wyniki uzyskane u dorosłych.
Wyniki badania CheckMate 142 przedstawiono na American Society of Clinical Oncology (ASCO) Gastrointestinal Cancers Symposium w styczniu 2017 roku. Jak podkreślili badacze, niwolumab w monoterapii pozwala na uzyskanie trwałych odpowiedzi, kontroli choroby oraz długotrwałego przeżycia u chorych na raka jelita grubego z MSI-H. Odpowiedzi odnotowano niezależnie od ekspresji PD-L1 na komórkach guza lub komórkach immunologicznych, od stanu mutacji w genie BRAF lub KRAS oraz od rozpoznania zespołu Lyncha w wywiadzie.
Najczęstsze działania niepożądane odnotowane w trakcie leczenia niwolumabem obejmowały zmęczenie, wysypkę, bole mięśni i kości, pokrzywkę, biegunkę, nudności, osłabienie, kaszel, duszność, zaparcie, zmniejszenie apetytu, bole pleców, bole stawów, zakażenia górnych dróg oddechowych oraz gorączkę.
Lek zarejestrowano w zalecanej dawce 240 mg we wlewie dożylnym w ciągu 60 minut co 2 tygodnie. W maju w podobnym wskazaniu zarejestrowano inny lek immunologiczny, pembrolizumab.
Źródło:
FDA/KS
FDA/KS
Kategorie:
Przewód pokarmowy



