Zjawisko znamion nawrotowych – seria przypadków

Mimo że znamiona nawrotowe (recurrent nevus – RN) są zmianami łagodnymi, mogą sprawiać trudności diagnostyczne ze względu na podobieństwo obrazu klinicznego, dermoskopowego i histopatologicznego do czerniaka.
Autorzy:
Beata Zagórska1, Martyna Sławińska2, Roman J. Nowicki2, Michał Sobjanek2
1Dermatologiczne Studenckie Koło Naukowe przy Klinice Dermatologii, Wenerologii i Alergologii, Wydział Lekarski, Gdański Uniwersytet Medyczny
2Katedra i Klinika Dermatologii, Wydział Lekarski, Wenerologii i Alergologii, Gdański Uniwersytet Medyczny
Wprowadzenie
Znamię nawrotowe (recurrent nevus – RN) to łagodna proliferacja melanocytów, która powstaje w miejscu uprzednio nieradykalnie usuniętego znamienia melanocytarnego [1]. Częstość występowania nawrotów mieści się w granicach od 0,3 proc. do 28 proc.. Najczęściej nawrót następuje od 6 tygodni do 6 miesięcy po usunięciu zmiany [2, 3]. Przypadki RN są opisywane przede wszystkim u młodych kobiet w wieku 20–30 lat. Najczęstszą lokalizacją jest tułów (szczególnie grzbiet), a następnie okolica kończyn i twarzy [1, 4, 5]. W obrazie klinicznym RN widoczne są nieregularne brzegi, nierównomierna pigmentacja z obszarami hipo- i hiperpigmentacji w obrębie blizny oraz asymetryczny rozkład struktur barwnikowych [6, 7]. Pod względem histopatologicznym około 50–60 proc. wszystkich RN to znamiona złożone. Rzadziej spotykane są znamiona śródskórne i łączące [1, 5]. Najczęstszymi zmianami nawrotowymi są znamiona nabyte, rzadziej wrodzone, atypowe, wrzecionowate, błękitne lub znamiona Spitz [1]. Rozpoznanie RN może przysparzać trudności. Kornberg i wsp. [7] w artykule opublikowanym w 1975 roku określili RN jako „pseudomelanoma Ackermana” ze względu na podobieństwo obrazu klinicznego, histopatologicznego i dermoskopowego do czerniaka szerzącego się powierzchownie (superficial spreading melanoma – SSM). Obecnie określenie to jest rzadko używane, jednak przypomina o konieczności przeprowadzania starannej oceny u takich pacjentów.
Cel pracy
W artykule przedstawiono serię przypadków pacjentów, u których doszło do nawrotu znamion melanocytarnych po wcześniejszym nieradykalnym laserowym usunięciu zmian.
Opis przypadków
Pacjent 1.
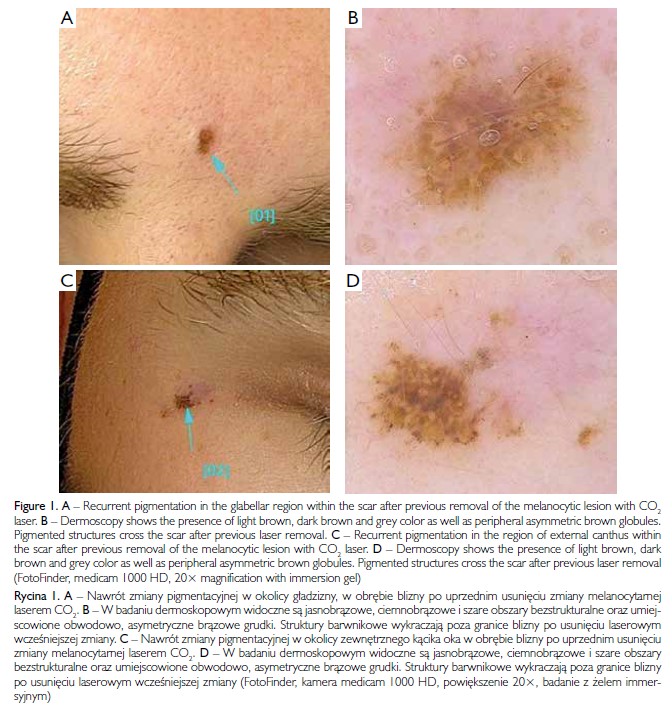
Mężczyzna w wieku 26 lat zgłosił się do poradni dermatologicznej z powodu nawrotu pigmentacji w obrębie blizn po uprzednim usunięciu dwóch znamion z wykorzystaniem lasera CO2 (ryc. 1 A, C). Pacjent był ogólnie zdrowy, ale w wywiadzie rodzinnym stwierdzono przypadek czerniaka (u babci pacjenta). W badaniu dermoskopowym uwidoczniono wzorzec bezstrukturalny z obecnością obszarów w kolorze jasnobrązowym, ciemnobrązowym i szarym oraz umiejscowionych obwodowo, asymetrycznych brązowych grudek. W obu przypadkach struktury barwnikowe wykraczały poza obszar blizny pozostałej po wcześniejszym laserowym usunięciu znamienia (ryc. 1 B, D). Zmiany usunięto chirurgicznie, a na podstawie wyniku badania histopatologicznego rozpoznano skórne znamiona nawrotowe.
Pacjent 2.
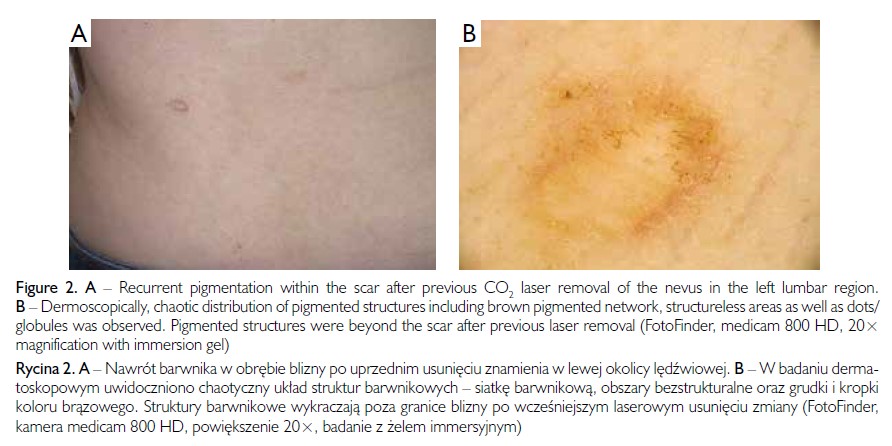
Kobieta w wieku 30 lat zgłosiła się do poradni dermatologicznej z powodu nawrotu pigmentacji w obrębie blizny po usunięciu znamienia umiejscowionego w lewej okolicy lędźwiowej. Znamię zostało usunięte za pomocą lasera CO2 (ryc. 2 A, C). Pacjentka była ogólnie zdrowa, a wywiad rodzinny w kierunku czerniaka był ujemny. W badaniu dermoskopowym uwidoczniono chaotyczny układ struktur obejmujących siatkę barwnikową, obszary bezstrukturalne oraz kropki i grudki koloru brązowego. Struktury barwnikowe wykraczały poza obszar blizny pozostałej po wcześniejszym laserowym usunięciu zmiany (ryc. 2 B). Zmianę usunięto chirurgicznie, a na podstawie wyniku badania histopatologicznego rozpoznano znamię złożone (combined nevus).
Pacjent 3.
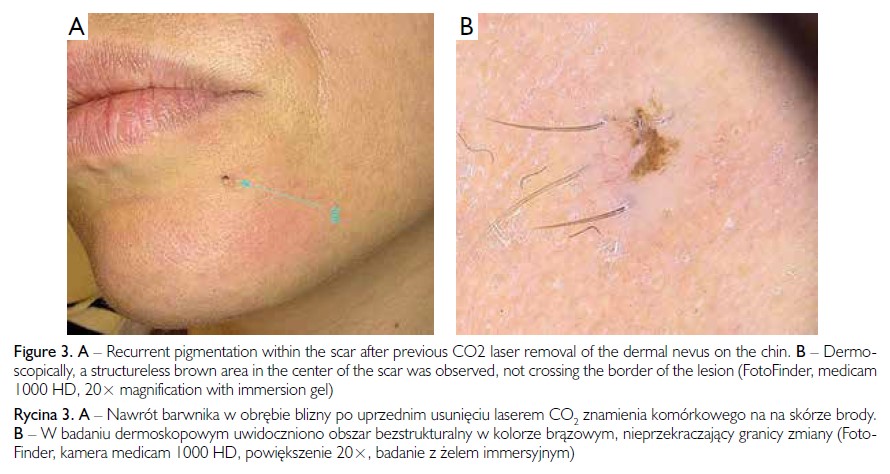
Kobieta w wieku 39 lat zgłosiła się do poradni dermatologicznej z powodu nawrotu pigmentacji w obrębie blizny po usunięciu znamienia komórkowego skóry brody. Znamię zostało usunięte za pomocą lasera CO2 (ryc. 3 A). Pacjentka była ogólnie zdrowa, a wywiad rodzinny w kierunku czerniaka był ujemny. W badaniu dermoskopowym stwierdzono centralnie umiejscowiony obszar bezstrukturalny w kolorze brązowym, nieprzekraczający granicy blizny. Ze względu na niepokój onkologiczny pacjentki zdecydowano o diagnostycznym wycięciu zmiany (ryc. 3 B).
Omówienie
W większości przypadków nawrotowa proliferacja melanocytów w bliźnie jest skutkiem wcześniejszego niepełnego usunięcia łagodnej zmiany barwnikowej. Poza wycięciem wrzecionowatym stosowano także wiele innych, alternatywnych metod leczenia zmian melanocytarnych, m.in. wycięcie styczne, krioterapię, elektrokoagulację i usuwanie laserowe [1, 8]. Dane dostępne w piśmiennictwie wskazują, że RN może również występować wskutek wcześniejszego leczenia 5-fluorouracylem z kwasem salicylowym, zabiegu dermabrazji, radioterapii lub urazu związanego z przewlekłym drażnieniem lub wcześniejszym oparzeniem [9, 10]. Mechanizm nawrotu znamion nie został dokładnie poznany. Przedstawiono wiele teorii, ale wydaje się, że najbardziej prawdopodobna z nich opiera się na wynikach badań prowadzonych na modelu zwierzęcym [11]. Wskazuje na proces przemieszczania się komórek macierzystych melanocytów z dolnej części mieszków włosowych i ich ponowne gromadzenie się w miejscu uprzednio usuniętego znamienia [1, 11].
W wielu przypadkach nawrót zmiany melanocytarnej charakteryzuje się asymetrią i nierównomierną pigmentacją. Wymaga wówczas różnicowania z czerniakiem. W badaniu Bluma i wsp. [8] do najistotniejszych przesłanek klinicznych wskazujących na możliwość rozpoznania czerniaka zaliczono wiek powyżej 30 lat, dłuższy okres do wystąpienia nawrotu, umiejscowienie zmiany w obrębie głowy lub szyi oraz obecność pigmentacji wykraczającej poza obszar blizny. W obrazie dermoskopowym nawracającego czerniaka stwierdzono ekscentrycznie umiejscowione obszary hiperpigmentacyjne, chaotyczny rozkład struktur oraz obecność kół (szczególnie na twarzy) [8]. Natomiast do cech wskazujących na rozpoznanie RN zaliczono: wiek poniżej 30 lat, krótszy czas do nawrotu, a także symetrię, odśrodkowy wzorzec wzrostu i linie promieniste widoczne w badaniu dermoskopowym [8]. W pracy Guida i wsp. [12], w której analizowano RN oraz przypadki nawrotu czerniaka po wcześniejszym leczeniu laserowym jako cechy związane w sposób znamienny z rozpoznaniem zmiany złośliwej, wskazano asymetrię, wykraczanie zmiany poza obręb blizny i ekscentryczne rozmieszczenie barwnika.
Cechy histopatologiczne, które mogą wskazywać na zmianę złośliwą (oprócz barwnika wykraczającego poza granice blizny), obejmują wysoki stopień atypii komórkowej wraz z obecnością atypowych melanocytów w naskórku i atypią cytologiczną w skórze właściwej. Dodatkowo może wystąpić zajęcie struktur przydatkowych oraz lentiginalne szerzenie się atypowych melanocytów [13]. Warto także zauważyć, że regresji czerniaka może towarzyszyć wzmożone włóknienie i utrata melanocytów, naśladujące zjawisko RN [1]. Badanie immunohistochemiczne, określające wzorzec dojrzewania z białkiem gp100 (z HMB-45) i antytyrozynazą, a także niski wskaźnik proliferacji (Ki-67), wskazuje na rozpoznanie znamienia nawrotowego [14]. Innym badaniem, które może być przydatne w diagnostyce różnicowej RN i czerniaka, jest refleksyjna mikroskopia konfokalna (reflectance confocal microscopy – RCM) in vivo [15, 16]. RCM może również ułatwiać określenie prawidłowego marginesu wycięcia, co pozwala ograniczyć wielkość kolejnej blizny. Jest to szczególnie ważne w przypadku zmian umiejscowionych na twarzy [17].
Wnioski
Mimo że RN są zmianami łagodnymi, mogą sprawiać trudności diagnostyczne ze względu na podobieństwo obrazu klinicznego, dermoskopowego i histopatologicznego do czerniaka.
Przy ocenie znamion nawrotowych przydatna jest dermatoskopia, jednak ostateczne rozpoznanie powinno być oparte na danych klinicznych oraz wynikach badania histopatologicznego usuniętej zmiany pierwotnej, jeśli są one dostępne [8]. W przypadkach budzących wątpliwości niezbędne jest wycięcie blizny wraz z obszarem nawrotu barwnika oraz badanie histopatologiczne. Jeżeli uprzednio usunięta zmiana została zdiagnozowana jako zwykłe znamię melanocytarne, alternatywą jest okresowa kontrola kliniczna i dermoskopowa.
Konflikt interesów
Autorzy nie zgłaszają konfliktu interesów.
Piśmiennictwo
1. King R., Hayzen B.A., Page R.N., Googe P.B., Zeagler D., Mihmjr M.C.: Recurrent nevus phenomenon: a clinicopathologic study of 357 cases and histologic comparison with melanoma with regression. Mod Pathol 2009, 22, 611-617.
2. Bompy L., Levasseur J., Hallier A., Fraitag S., Aubriot-Lorton M.H., Bonniaud B., et al.: Recurrent nevus: case-report about a pagetoid form occurring from a congenital nevus in infancy. Ann Chir Plast Esthetique 2018, 63, 349-352.
3. Botella-Estrada R., Nagore E., Sopena J., Cremades A., Alfaro A., Sanmartin O., et al.: Clinical, dermoscopy and histological correlation study of melanotic pigmentations in excision scars of melanocytic tumours. Br J Dermatol 2006, 154, 478-484.
4. Walton R.G., Cox A.J.: Electrodesiccation of pigmented nevi. Arch Dermatol 1963, 87, 342-349.
5. Park H.K., Leonard D.D., Arrington III J.H., Lund H.Z.: Recurrent melanocytic nevi: clinical and histologic review of 175 cases. J Am Acad Dermatol 1987, 17, 285-292.
6. Rhodes A.R., Harrist T.J., Day C.L., Mihmjr M.C., Fitzpatrick T.B., Sober A.J.: Dysplastic melanocytic nevi in histologic association with 234 primary cutaneous melanomas. J Am Acad Dermatol 1983, 9, 563-574.
7. Kornberg R., Ackerman A.B.: Pseudomelanoma: recurrent melanocytic nevus following partial surgical removal. Arch Dermatol 1975, 111, 1588-1590.
8. Blum A., Hofmann-Wellenhof R., Marghoob A.A., Argenziano G., Cabo H., Carrera C., et al.: Recurrent melanocytic nevi and melanomas in dermoscopy: results of a Multicenter Study of the International Dermoscopy Society. JAMA Dermatol 2014, 150, 138-145.
9. Fox J.C., Reed J.A., Shea C.R.: The recurrent nevus phenomenon: a history of challenge, controversy, and discovery. Arch Pathol Lab Med 2011, 135, 842-846.
10. De Araujo R.N., de Araújo M.K., Piñeiro-Maceira J., Barcaui C.B.: Recurrent nevus after burn injury. Dermatol Pract Concept 2019, 9, 165-167.
11. Nishimura E.K., Jordan S.A., Oshima H., Yoshida H., Osawa M., Moriyama M., et al.: Dominant role of the niche in melanocyte stem-cell fate determination. Nature 2002, 416, 854-860.
12. Guida S., Bencini P.L., Manganoni A.M., Gianotti R., Lospalluti L., Greco P., et al.: Recurrence of melanocytic lesions after laser treatment: benign vs. malignant upon dermoscopy. J Eur Acad Dermatol Venereol 2017, 12, 526–528.
13. Brenn T.: Pitfalls in the evaluation of melanocytic lesions. Histopathology 2012, 60, 690-705.
14. Hoang M.P., Prieto V.G., Burchette J.L., Shea C.R.: Recurrent melanocytic nevus: a histologic and immunohistochemical evaluation. J Cutaneous Pathol 2001, 28, 400-406.
15. Schwartz R.J., Vera K., Navarrete N., Lobos P.: In vivo reflectance confocal microscopy of halo nevus. J Cutan Med Surg 2013, 17, 33-38.
16. Larre Borges A., Zalaudek I., Longo C.: Melanocytic nevi with special features: clinical-dermoscopic and reflectance confocal microscopic-findings. J Eur Acad Dermatol Venereol 2014, 28, 833-845.
17. Serban E.D., Farnetani F., Pellacani G., Constantin M.M.: Role of in vivo reflectance confocal microscopy in the analysis of melanocytic lesions. Acta Dermatovenerol Croatica 2018, 26, 64-67.

Beata Zagórska1, Martyna Sławińska2, Roman J. Nowicki2, Michał Sobjanek2
1Dermatologiczne Studenckie Koło Naukowe przy Klinice Dermatologii, Wenerologii i Alergologii, Wydział Lekarski, Gdański Uniwersytet Medyczny
2Katedra i Klinika Dermatologii, Wydział Lekarski, Wenerologii i Alergologii, Gdański Uniwersytet Medyczny
Wprowadzenie
Znamię nawrotowe (recurrent nevus – RN) to łagodna proliferacja melanocytów, która powstaje w miejscu uprzednio nieradykalnie usuniętego znamienia melanocytarnego [1]. Częstość występowania nawrotów mieści się w granicach od 0,3 proc. do 28 proc.. Najczęściej nawrót następuje od 6 tygodni do 6 miesięcy po usunięciu zmiany [2, 3]. Przypadki RN są opisywane przede wszystkim u młodych kobiet w wieku 20–30 lat. Najczęstszą lokalizacją jest tułów (szczególnie grzbiet), a następnie okolica kończyn i twarzy [1, 4, 5]. W obrazie klinicznym RN widoczne są nieregularne brzegi, nierównomierna pigmentacja z obszarami hipo- i hiperpigmentacji w obrębie blizny oraz asymetryczny rozkład struktur barwnikowych [6, 7]. Pod względem histopatologicznym około 50–60 proc. wszystkich RN to znamiona złożone. Rzadziej spotykane są znamiona śródskórne i łączące [1, 5]. Najczęstszymi zmianami nawrotowymi są znamiona nabyte, rzadziej wrodzone, atypowe, wrzecionowate, błękitne lub znamiona Spitz [1]. Rozpoznanie RN może przysparzać trudności. Kornberg i wsp. [7] w artykule opublikowanym w 1975 roku określili RN jako „pseudomelanoma Ackermana” ze względu na podobieństwo obrazu klinicznego, histopatologicznego i dermoskopowego do czerniaka szerzącego się powierzchownie (superficial spreading melanoma – SSM). Obecnie określenie to jest rzadko używane, jednak przypomina o konieczności przeprowadzania starannej oceny u takich pacjentów.
Cel pracy
W artykule przedstawiono serię przypadków pacjentów, u których doszło do nawrotu znamion melanocytarnych po wcześniejszym nieradykalnym laserowym usunięciu zmian.
Opis przypadków
Pacjent 1.
Mężczyzna w wieku 26 lat zgłosił się do poradni dermatologicznej z powodu nawrotu pigmentacji w obrębie blizn po uprzednim usunięciu dwóch znamion z wykorzystaniem lasera CO2 (ryc. 1 A, C). Pacjent był ogólnie zdrowy, ale w wywiadzie rodzinnym stwierdzono przypadek czerniaka (u babci pacjenta). W badaniu dermoskopowym uwidoczniono wzorzec bezstrukturalny z obecnością obszarów w kolorze jasnobrązowym, ciemnobrązowym i szarym oraz umiejscowionych obwodowo, asymetrycznych brązowych grudek. W obu przypadkach struktury barwnikowe wykraczały poza obszar blizny pozostałej po wcześniejszym laserowym usunięciu znamienia (ryc. 1 B, D). Zmiany usunięto chirurgicznie, a na podstawie wyniku badania histopatologicznego rozpoznano skórne znamiona nawrotowe.

Pacjent 2.
Kobieta w wieku 30 lat zgłosiła się do poradni dermatologicznej z powodu nawrotu pigmentacji w obrębie blizny po usunięciu znamienia umiejscowionego w lewej okolicy lędźwiowej. Znamię zostało usunięte za pomocą lasera CO2 (ryc. 2 A, C). Pacjentka była ogólnie zdrowa, a wywiad rodzinny w kierunku czerniaka był ujemny. W badaniu dermoskopowym uwidoczniono chaotyczny układ struktur obejmujących siatkę barwnikową, obszary bezstrukturalne oraz kropki i grudki koloru brązowego. Struktury barwnikowe wykraczały poza obszar blizny pozostałej po wcześniejszym laserowym usunięciu zmiany (ryc. 2 B). Zmianę usunięto chirurgicznie, a na podstawie wyniku badania histopatologicznego rozpoznano znamię złożone (combined nevus).

Pacjent 3.
Kobieta w wieku 39 lat zgłosiła się do poradni dermatologicznej z powodu nawrotu pigmentacji w obrębie blizny po usunięciu znamienia komórkowego skóry brody. Znamię zostało usunięte za pomocą lasera CO2 (ryc. 3 A). Pacjentka była ogólnie zdrowa, a wywiad rodzinny w kierunku czerniaka był ujemny. W badaniu dermoskopowym stwierdzono centralnie umiejscowiony obszar bezstrukturalny w kolorze brązowym, nieprzekraczający granicy blizny. Ze względu na niepokój onkologiczny pacjentki zdecydowano o diagnostycznym wycięciu zmiany (ryc. 3 B).

Omówienie
W większości przypadków nawrotowa proliferacja melanocytów w bliźnie jest skutkiem wcześniejszego niepełnego usunięcia łagodnej zmiany barwnikowej. Poza wycięciem wrzecionowatym stosowano także wiele innych, alternatywnych metod leczenia zmian melanocytarnych, m.in. wycięcie styczne, krioterapię, elektrokoagulację i usuwanie laserowe [1, 8]. Dane dostępne w piśmiennictwie wskazują, że RN może również występować wskutek wcześniejszego leczenia 5-fluorouracylem z kwasem salicylowym, zabiegu dermabrazji, radioterapii lub urazu związanego z przewlekłym drażnieniem lub wcześniejszym oparzeniem [9, 10]. Mechanizm nawrotu znamion nie został dokładnie poznany. Przedstawiono wiele teorii, ale wydaje się, że najbardziej prawdopodobna z nich opiera się na wynikach badań prowadzonych na modelu zwierzęcym [11]. Wskazuje na proces przemieszczania się komórek macierzystych melanocytów z dolnej części mieszków włosowych i ich ponowne gromadzenie się w miejscu uprzednio usuniętego znamienia [1, 11].
W wielu przypadkach nawrót zmiany melanocytarnej charakteryzuje się asymetrią i nierównomierną pigmentacją. Wymaga wówczas różnicowania z czerniakiem. W badaniu Bluma i wsp. [8] do najistotniejszych przesłanek klinicznych wskazujących na możliwość rozpoznania czerniaka zaliczono wiek powyżej 30 lat, dłuższy okres do wystąpienia nawrotu, umiejscowienie zmiany w obrębie głowy lub szyi oraz obecność pigmentacji wykraczającej poza obszar blizny. W obrazie dermoskopowym nawracającego czerniaka stwierdzono ekscentrycznie umiejscowione obszary hiperpigmentacyjne, chaotyczny rozkład struktur oraz obecność kół (szczególnie na twarzy) [8]. Natomiast do cech wskazujących na rozpoznanie RN zaliczono: wiek poniżej 30 lat, krótszy czas do nawrotu, a także symetrię, odśrodkowy wzorzec wzrostu i linie promieniste widoczne w badaniu dermoskopowym [8]. W pracy Guida i wsp. [12], w której analizowano RN oraz przypadki nawrotu czerniaka po wcześniejszym leczeniu laserowym jako cechy związane w sposób znamienny z rozpoznaniem zmiany złośliwej, wskazano asymetrię, wykraczanie zmiany poza obręb blizny i ekscentryczne rozmieszczenie barwnika.
Cechy histopatologiczne, które mogą wskazywać na zmianę złośliwą (oprócz barwnika wykraczającego poza granice blizny), obejmują wysoki stopień atypii komórkowej wraz z obecnością atypowych melanocytów w naskórku i atypią cytologiczną w skórze właściwej. Dodatkowo może wystąpić zajęcie struktur przydatkowych oraz lentiginalne szerzenie się atypowych melanocytów [13]. Warto także zauważyć, że regresji czerniaka może towarzyszyć wzmożone włóknienie i utrata melanocytów, naśladujące zjawisko RN [1]. Badanie immunohistochemiczne, określające wzorzec dojrzewania z białkiem gp100 (z HMB-45) i antytyrozynazą, a także niski wskaźnik proliferacji (Ki-67), wskazuje na rozpoznanie znamienia nawrotowego [14]. Innym badaniem, które może być przydatne w diagnostyce różnicowej RN i czerniaka, jest refleksyjna mikroskopia konfokalna (reflectance confocal microscopy – RCM) in vivo [15, 16]. RCM może również ułatwiać określenie prawidłowego marginesu wycięcia, co pozwala ograniczyć wielkość kolejnej blizny. Jest to szczególnie ważne w przypadku zmian umiejscowionych na twarzy [17].
Wnioski
Mimo że RN są zmianami łagodnymi, mogą sprawiać trudności diagnostyczne ze względu na podobieństwo obrazu klinicznego, dermoskopowego i histopatologicznego do czerniaka.
Przy ocenie znamion nawrotowych przydatna jest dermatoskopia, jednak ostateczne rozpoznanie powinno być oparte na danych klinicznych oraz wynikach badania histopatologicznego usuniętej zmiany pierwotnej, jeśli są one dostępne [8]. W przypadkach budzących wątpliwości niezbędne jest wycięcie blizny wraz z obszarem nawrotu barwnika oraz badanie histopatologiczne. Jeżeli uprzednio usunięta zmiana została zdiagnozowana jako zwykłe znamię melanocytarne, alternatywą jest okresowa kontrola kliniczna i dermoskopowa.
Konflikt interesów
Autorzy nie zgłaszają konfliktu interesów.
Piśmiennictwo
1. King R., Hayzen B.A., Page R.N., Googe P.B., Zeagler D., Mihmjr M.C.: Recurrent nevus phenomenon: a clinicopathologic study of 357 cases and histologic comparison with melanoma with regression. Mod Pathol 2009, 22, 611-617.
2. Bompy L., Levasseur J., Hallier A., Fraitag S., Aubriot-Lorton M.H., Bonniaud B., et al.: Recurrent nevus: case-report about a pagetoid form occurring from a congenital nevus in infancy. Ann Chir Plast Esthetique 2018, 63, 349-352.
3. Botella-Estrada R., Nagore E., Sopena J., Cremades A., Alfaro A., Sanmartin O., et al.: Clinical, dermoscopy and histological correlation study of melanotic pigmentations in excision scars of melanocytic tumours. Br J Dermatol 2006, 154, 478-484.
4. Walton R.G., Cox A.J.: Electrodesiccation of pigmented nevi. Arch Dermatol 1963, 87, 342-349.
5. Park H.K., Leonard D.D., Arrington III J.H., Lund H.Z.: Recurrent melanocytic nevi: clinical and histologic review of 175 cases. J Am Acad Dermatol 1987, 17, 285-292.
6. Rhodes A.R., Harrist T.J., Day C.L., Mihmjr M.C., Fitzpatrick T.B., Sober A.J.: Dysplastic melanocytic nevi in histologic association with 234 primary cutaneous melanomas. J Am Acad Dermatol 1983, 9, 563-574.
7. Kornberg R., Ackerman A.B.: Pseudomelanoma: recurrent melanocytic nevus following partial surgical removal. Arch Dermatol 1975, 111, 1588-1590.
8. Blum A., Hofmann-Wellenhof R., Marghoob A.A., Argenziano G., Cabo H., Carrera C., et al.: Recurrent melanocytic nevi and melanomas in dermoscopy: results of a Multicenter Study of the International Dermoscopy Society. JAMA Dermatol 2014, 150, 138-145.
9. Fox J.C., Reed J.A., Shea C.R.: The recurrent nevus phenomenon: a history of challenge, controversy, and discovery. Arch Pathol Lab Med 2011, 135, 842-846.
10. De Araujo R.N., de Araújo M.K., Piñeiro-Maceira J., Barcaui C.B.: Recurrent nevus after burn injury. Dermatol Pract Concept 2019, 9, 165-167.
11. Nishimura E.K., Jordan S.A., Oshima H., Yoshida H., Osawa M., Moriyama M., et al.: Dominant role of the niche in melanocyte stem-cell fate determination. Nature 2002, 416, 854-860.
12. Guida S., Bencini P.L., Manganoni A.M., Gianotti R., Lospalluti L., Greco P., et al.: Recurrence of melanocytic lesions after laser treatment: benign vs. malignant upon dermoscopy. J Eur Acad Dermatol Venereol 2017, 12, 526–528.
13. Brenn T.: Pitfalls in the evaluation of melanocytic lesions. Histopathology 2012, 60, 690-705.
14. Hoang M.P., Prieto V.G., Burchette J.L., Shea C.R.: Recurrent melanocytic nevus: a histologic and immunohistochemical evaluation. J Cutaneous Pathol 2001, 28, 400-406.
15. Schwartz R.J., Vera K., Navarrete N., Lobos P.: In vivo reflectance confocal microscopy of halo nevus. J Cutan Med Surg 2013, 17, 33-38.
16. Larre Borges A., Zalaudek I., Longo C.: Melanocytic nevi with special features: clinical-dermoscopic and reflectance confocal microscopic-findings. J Eur Acad Dermatol Venereol 2014, 28, 833-845.
17. Serban E.D., Farnetani F., Pellacani G., Constantin M.M.: Role of in vivo reflectance confocal microscopy in the analysis of melanocytic lesions. Acta Dermatovenerol Croatica 2018, 26, 64-67.

Źródło:
Dermatol Rev/Przegl Dermatol 2022, 109, 244–250
Dermatol Rev/Przegl Dermatol 2022, 109, 244–250