Tajne dokumenty refundacyjne

Wciąż nie mamy dostępu do dokumentacji dotyczącej refundacji leków. - Od 2018 r. AOTMiT odchodzi od zasad przejrzystości. 95 proc. postępowań refundacyjnych zainicjowanych w 2019 r. ma utajniony wynik Budget Impact Analysis w wariancie nieuwzględniającym instrumentów dzielenia ryzyka, co oznacza brak informacji, w jakim stopniu wnioskowana do refundacji terapia wpłynie na obciążenie budżetu płatnika – podkreśla Sabina Wierzganowska, niezależny ekspert do spraw refundacji.
Artykuł Sabiny Wierzganowskiej:
- W postępowaniu dotyczącym finansowania ze środków publicznych produktu leczniczego bez refundowanego odpowiednika wymagane jest złożenie wraz z wnioskiem analiz HTA, które przekazywane są Agencji Oceny Technologii Medycznych i Taryfikacji w celu przygotowania analizy weryfikacyjnej, a następnie stanowiska Rady Przejrzystości i rekomendacji prezesa agencji. Przepisy obligują agencję do publikacji wymienionych analiz w "Biuletynie Informacji Publicznej" i wyznaczają termin siedmiu dni na zgłaszanie ewentualnych uwag.
Zakres publikowanych informacji podlega jednak ograniczeniu ze względu na ochronę tajemnicy przedsiębiorcy. Utajnienie odbywa się poprzez zakreślenie wybranych fragmentów opublikowanych dokumentów. Kwestią interpretacji jest, jaka treść powinna zostać zakreślona, by skutecznie chronić tajemnicę przedsiębiorstwa przy jednoczesnym zachowaniu przejrzystości procesu refundacyjnego i realizacji zasady jawności dokumentacji.
Sprawdziłam, jak w praktyce AOTMiT radzi sobie z pogodzeniem tych dwóch wartości prawnych. Zbadałam stan jawności informacji publikowanych przez agencję w BIP w latach 2012-2019.
Analizą objęte zostały wszystkie (ponad 600) postępowania refundacyjne dla technologii leczniczych bez refundowanego odpowiednika. Jawność informacji analizowaliśmy w czterech kategoriach:
- dostępność wyników analizy wpływu na budżet płatnika BIA w wariancie bez RSS,
- dostępność wyników analizy kosztów użyteczności ICUR w wariancie bez RSS (o ile zastosowano tę technikę analityczną),
- dostępność opisu wskazania, to jest wnioskowanych kryteriów włączenia do programu lekowego (w postępowaniach dotyczących tego trybu refundacji),
- czytelność rekomendacji refundacyjnych prezesa AOTMiT (ile z nich posiada zakreślony fragment treści rekomendacji lub uzasadnienia oraz w jakim stopniu).
Wyniki?
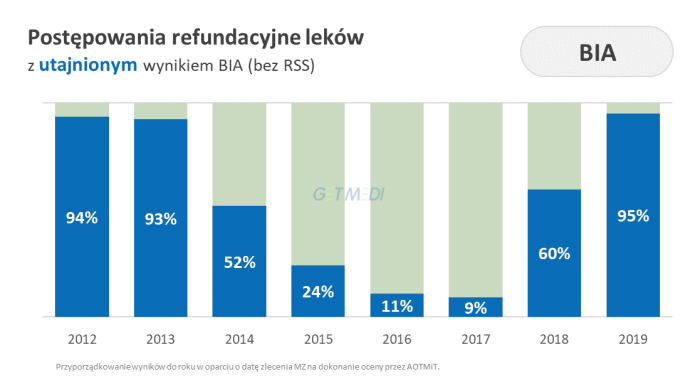
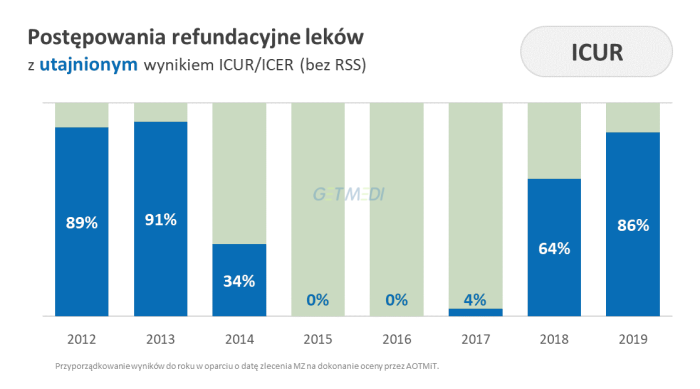
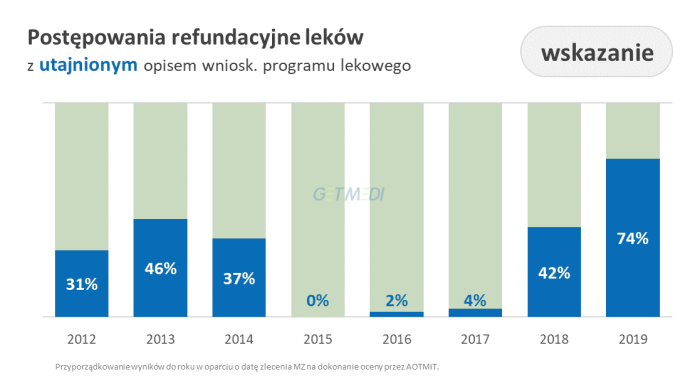
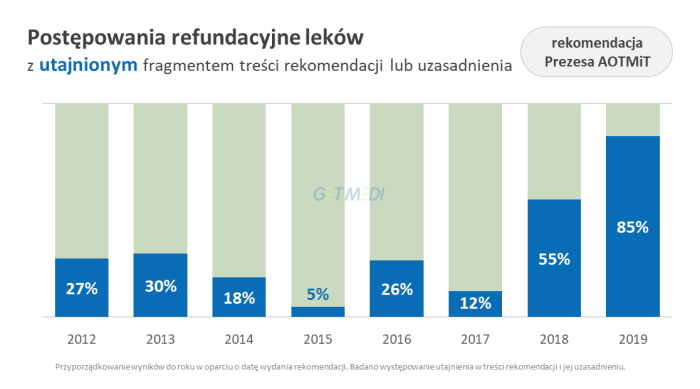
Przeprowadzona analiza ukazuje dużą zmienność podejścia agencji do kwestii zakreślania informacji na przestrzeni lat.
Początkowo agencja zakreślała informacje zgodnie z propozycją wnioskodawcy. Skutkowało to wysokim stopniem utajnienia treści, w szczególności wskaźników ekonomicznych. Zdarzały się też postępowania, w których utajniano niemal pełną treść opublikowanych analiz.
Podejście agencji do jawności zaczęło zmieniać się w połowie 2014 roku. Agencja opublikowała wtedy komunikat, w którym zaanonsowała nową interpretację dotyczącą zakresu informacji podlegających utajnieniu ze względu na tajemnicę przedsiębiorstwa. Zakres ten został następnie rozszerzony komunikatem agencji opublikowanym w sierpniu 2015 roku.
- Agencja utajniać będzie w dokumentach opracowywanych na podstawie zleceń dotyczących wniosków refundacyjnych (tj. w analizach weryfikacyjnych Agencji, stanowiskach Rady Przejrzystości, rekomendacjach prezesa Agencji) tylko i wyłącznie fragmenty dotyczące bezpośrednio instrumentów dzielenia ryzyka oraz bezpośrednio cen niezależnie od tego, co wskaże wnioskodawca jako tajemnicę przedsiębiorstwa. W szczególności jawne będą dane na temat bezpieczeństwa stosowania leku, informacje o refundacji w innych krajach, wyniki badań klinicznych, wskaźniki ICUR, ICER, informacje o skuteczności klinicznej i praktycznej, o uzyskiwanych efektach zdrowotnych, o działaniach niepożądanych, dostępne dowody naukowe, wpływ na budżet płatnika publicznego i wyniki badań nigdzie niepublikowanych – czytamy w komunikacie.
Agencja przyjęła zatem podejście ograniczenia ochrony tajemnicy przedsiębiorstwa poprzez zakreślanie minimum informacji - danych o wnioskowanej cenie oraz o instrumentach dzielenia ryzyka (RSS) obniżających rzeczywiste ceny leków względem cen widocznych na liście leków refundowanych.
Od 2018 roku obserwowane jest odejście agencji od praktykowanych przez kilka lat zasad przejrzystości. Analiza postępowań refundacyjnych zainicjowanych w 2019 roku, dla których opublikowano analizy (według stanu BIP na 31 lipca 2019 r.) wskazuje, że:
- 95 proc. postępowań ma utajniony wynik BIA w wariancie bez RSS, co oznacza brak informacji o tym, w jakim stopniu wnioskowana do refundacji terapia wpłynie na obciążenie budżetu płatnika,
- 86 proc. postępowań ma utajniony wyniki ICUR w wariancie bez RSS, na podstawie którego można stwierdzić czy wnioskowana terapia jest kosztowo użyteczna w porównaniu z innymi,
- 74 proc. postępowań ma utajniony opis wnioskowanego programu lekowego, co w praktyce uniemożliwia ocenę prawidłowości opublikowanej dokumentacji klinicznej osobom niebędącym stronom postępowania,
- 85 proc. postępowań ma utajniony fragment rekomendacji lub jej uzasadnienia (zwykle tylko uzasadnienia), a zakres zakreśleń obejmuje średnio 13 proc. treści uzasadnienia (2,8 proc. w 2018 roku, 0,1 proc. w 2017 roku). Coraz częściej zakreślane są pełne akapity, a stopień zakreśleń w indywidualnych przypadkach przekracza nawet 50 proc.
Podejście agencji do zakresu informacji uznawanych za tajemnicę przedsiębiorstwa wprowadzone w 2014 roku, opracowane na podstawie polecenia ministra zdrowia, argumentowane było potrzebą przedstawiania do publicznej wiadomości rzeczowych dowodów i wyjaśnień, które uwiarygadniają wydawane na ich podstawie decyzje refundacyjne.
- Utajnienie określonych pól ma znaczenie dla ochrony interesów wynikających z działalności gospodarczej, ale nie może stać w sprzeczności z demokratyczną zasadą kontroli społecznej władczych decyzji administracji publicznej. Szczególnie w tak wrażliwym społecznie obszarze, jakim jest alokacja środków publicznych na refundację leków, niezwykle ważne jest, by – przy zachowaniu tajemnicy przedsiębiorstwa (w praktyce oznacza to treść porozumień podziału ryzyka i proponowane ceny) – udostępnić wszystkie dane, które konieczne są do prowadzenia szerokiej debaty publicznej na temat sposobu realizacji przez ministra zdrowia zasady równego dostępu obywateli do świadczeń zdrowotnych, sprawiedliwości społecznej i przejrzystości procesu decyzyjnego.
W tej perspektywie jako informację publiczną należy bezwzględnie traktować kluczowe dane z analiz weryfikacyjnych, takie jak wyniki badań klinicznych, skuteczność kliniczna i praktyczna, uzyskiwane efekty zdrowotne, działania niepożądane, a także relacje kosztu uzyskiwanego dodatkowego efektu zdrowotnego w zestawieniu z alternatywnymi technologiami medycznymi – wskazywano.
Wyniki przeprowadzonej analizy wskazują, że mamy do czynienia z najniższym w historii stanem transparentności dowodów stojących za decyzjami refundacyjnymi, a co za tym idzie - utrudnianiem lub wręcz blokowaniem kontroli społecznej, czyli wartości, do której wcześniej się odwoływano.
- W postępowaniu dotyczącym finansowania ze środków publicznych produktu leczniczego bez refundowanego odpowiednika wymagane jest złożenie wraz z wnioskiem analiz HTA, które przekazywane są Agencji Oceny Technologii Medycznych i Taryfikacji w celu przygotowania analizy weryfikacyjnej, a następnie stanowiska Rady Przejrzystości i rekomendacji prezesa agencji. Przepisy obligują agencję do publikacji wymienionych analiz w "Biuletynie Informacji Publicznej" i wyznaczają termin siedmiu dni na zgłaszanie ewentualnych uwag.
Zakres publikowanych informacji podlega jednak ograniczeniu ze względu na ochronę tajemnicy przedsiębiorcy. Utajnienie odbywa się poprzez zakreślenie wybranych fragmentów opublikowanych dokumentów. Kwestią interpretacji jest, jaka treść powinna zostać zakreślona, by skutecznie chronić tajemnicę przedsiębiorstwa przy jednoczesnym zachowaniu przejrzystości procesu refundacyjnego i realizacji zasady jawności dokumentacji.
Sprawdziłam, jak w praktyce AOTMiT radzi sobie z pogodzeniem tych dwóch wartości prawnych. Zbadałam stan jawności informacji publikowanych przez agencję w BIP w latach 2012-2019.
Analizą objęte zostały wszystkie (ponad 600) postępowania refundacyjne dla technologii leczniczych bez refundowanego odpowiednika. Jawność informacji analizowaliśmy w czterech kategoriach:
- dostępność wyników analizy wpływu na budżet płatnika BIA w wariancie bez RSS,
- dostępność wyników analizy kosztów użyteczności ICUR w wariancie bez RSS (o ile zastosowano tę technikę analityczną),
- dostępność opisu wskazania, to jest wnioskowanych kryteriów włączenia do programu lekowego (w postępowaniach dotyczących tego trybu refundacji),
- czytelność rekomendacji refundacyjnych prezesa AOTMiT (ile z nich posiada zakreślony fragment treści rekomendacji lub uzasadnienia oraz w jakim stopniu).
Wyniki?




Przeprowadzona analiza ukazuje dużą zmienność podejścia agencji do kwestii zakreślania informacji na przestrzeni lat.
Początkowo agencja zakreślała informacje zgodnie z propozycją wnioskodawcy. Skutkowało to wysokim stopniem utajnienia treści, w szczególności wskaźników ekonomicznych. Zdarzały się też postępowania, w których utajniano niemal pełną treść opublikowanych analiz.
Podejście agencji do jawności zaczęło zmieniać się w połowie 2014 roku. Agencja opublikowała wtedy komunikat, w którym zaanonsowała nową interpretację dotyczącą zakresu informacji podlegających utajnieniu ze względu na tajemnicę przedsiębiorstwa. Zakres ten został następnie rozszerzony komunikatem agencji opublikowanym w sierpniu 2015 roku.
- Agencja utajniać będzie w dokumentach opracowywanych na podstawie zleceń dotyczących wniosków refundacyjnych (tj. w analizach weryfikacyjnych Agencji, stanowiskach Rady Przejrzystości, rekomendacjach prezesa Agencji) tylko i wyłącznie fragmenty dotyczące bezpośrednio instrumentów dzielenia ryzyka oraz bezpośrednio cen niezależnie od tego, co wskaże wnioskodawca jako tajemnicę przedsiębiorstwa. W szczególności jawne będą dane na temat bezpieczeństwa stosowania leku, informacje o refundacji w innych krajach, wyniki badań klinicznych, wskaźniki ICUR, ICER, informacje o skuteczności klinicznej i praktycznej, o uzyskiwanych efektach zdrowotnych, o działaniach niepożądanych, dostępne dowody naukowe, wpływ na budżet płatnika publicznego i wyniki badań nigdzie niepublikowanych – czytamy w komunikacie.
Agencja przyjęła zatem podejście ograniczenia ochrony tajemnicy przedsiębiorstwa poprzez zakreślanie minimum informacji - danych o wnioskowanej cenie oraz o instrumentach dzielenia ryzyka (RSS) obniżających rzeczywiste ceny leków względem cen widocznych na liście leków refundowanych.
Od 2018 roku obserwowane jest odejście agencji od praktykowanych przez kilka lat zasad przejrzystości. Analiza postępowań refundacyjnych zainicjowanych w 2019 roku, dla których opublikowano analizy (według stanu BIP na 31 lipca 2019 r.) wskazuje, że:
- 95 proc. postępowań ma utajniony wynik BIA w wariancie bez RSS, co oznacza brak informacji o tym, w jakim stopniu wnioskowana do refundacji terapia wpłynie na obciążenie budżetu płatnika,
- 86 proc. postępowań ma utajniony wyniki ICUR w wariancie bez RSS, na podstawie którego można stwierdzić czy wnioskowana terapia jest kosztowo użyteczna w porównaniu z innymi,
- 74 proc. postępowań ma utajniony opis wnioskowanego programu lekowego, co w praktyce uniemożliwia ocenę prawidłowości opublikowanej dokumentacji klinicznej osobom niebędącym stronom postępowania,
- 85 proc. postępowań ma utajniony fragment rekomendacji lub jej uzasadnienia (zwykle tylko uzasadnienia), a zakres zakreśleń obejmuje średnio 13 proc. treści uzasadnienia (2,8 proc. w 2018 roku, 0,1 proc. w 2017 roku). Coraz częściej zakreślane są pełne akapity, a stopień zakreśleń w indywidualnych przypadkach przekracza nawet 50 proc.
Podejście agencji do zakresu informacji uznawanych za tajemnicę przedsiębiorstwa wprowadzone w 2014 roku, opracowane na podstawie polecenia ministra zdrowia, argumentowane było potrzebą przedstawiania do publicznej wiadomości rzeczowych dowodów i wyjaśnień, które uwiarygadniają wydawane na ich podstawie decyzje refundacyjne.
- Utajnienie określonych pól ma znaczenie dla ochrony interesów wynikających z działalności gospodarczej, ale nie może stać w sprzeczności z demokratyczną zasadą kontroli społecznej władczych decyzji administracji publicznej. Szczególnie w tak wrażliwym społecznie obszarze, jakim jest alokacja środków publicznych na refundację leków, niezwykle ważne jest, by – przy zachowaniu tajemnicy przedsiębiorstwa (w praktyce oznacza to treść porozumień podziału ryzyka i proponowane ceny) – udostępnić wszystkie dane, które konieczne są do prowadzenia szerokiej debaty publicznej na temat sposobu realizacji przez ministra zdrowia zasady równego dostępu obywateli do świadczeń zdrowotnych, sprawiedliwości społecznej i przejrzystości procesu decyzyjnego.
W tej perspektywie jako informację publiczną należy bezwzględnie traktować kluczowe dane z analiz weryfikacyjnych, takie jak wyniki badań klinicznych, skuteczność kliniczna i praktyczna, uzyskiwane efekty zdrowotne, działania niepożądane, a także relacje kosztu uzyskiwanego dodatkowego efektu zdrowotnego w zestawieniu z alternatywnymi technologiami medycznymi – wskazywano.
Wyniki przeprowadzonej analizy wskazują, że mamy do czynienia z najniższym w historii stanem transparentności dowodów stojących za decyzjami refundacyjnymi, a co za tym idzie - utrudnianiem lub wręcz blokowaniem kontroli społecznej, czyli wartości, do której wcześniej się odwoływano.
Źródło:
Sabina Wierzganowska/Getmedi.pl/KL
Sabina Wierzganowska/Getmedi.pl/KL



















