OXIFlame zastąpi ECMO?
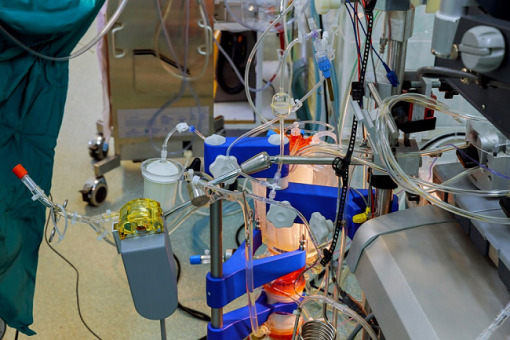
OXIFlame ma szansę stać się następcą ECMO. Czy projekt, którego współtwórcami są naukowcy ze Śląskiego Uniwersytetu Medycznego, czeka światowa kariera?
Oxygen Increased Flow Advanced Membrane zapowiada nową erę w leczeniu pacjentów z ciężką niewydolnością krążeniowo-oddechową. Twórcy projektu mają nadzieję, że właśnie nadszedł czas na następcę pozaustrojowej membranowej oksygenacji krwi ECMO.
Czym jest ECMO?
Pozaustrojowa oksygenacja krwi (ECMO – extracorporeal membrane oxygenation) jest techniką polegającą na utlenowaniu (oksygenacji) krwi i eliminacji z niej dwutlenku węgla w oksygenatorze, z wykorzystaniem krążenia pozaustrojowego.
ECMO stosowane jest tylko u chorych, w potencjalnie odwracalnych stanach zagrożenia życia z bardzo ciężką niewydolnością oddechową i/lub krążeniową, u których nie udało się uzyskać odpowiedzi na dostępne na oddziałach intensywnej terapii konwencjonalne metody leczenia.
ECMO nie leczy serca ani płuc, lecz daje choremu szansę na przeżycie okresu, w którym te narządy są niewydolne. Daje czas lekarzowi na leczenie choroby, która doprowadziła do skrajnej niewydolności krążeniowo-oddechowej.
Wyróżnia się dwa podstawowe schematy podłączenia ECMO żylno-żylne (veno-venous VV ECMO) stosowane jest jako wspomaganie oddychania, natomiast żylno-tętnicze (veno-arterial VA ECMO) stosowane jako wspomaganie serca i/lub oddychania.
VV ECMO stosowane jest u chorych z ciężkim zespołem ostrej niewydolności oddechowej (ARDS), w którym dochodzi do uszkodzenia tzw. bariery pęcherzykowo-włośniczkowej, co powoduje przeciekanie bogato białkowego płynu do układu oddechowego. Zapadnięcie się pęcherzyków powietrznych sprawia, że płuca tracą zdolność spełniania swojej funkcji, czyli wymiany tlenu i dwutlenku węgla, co prowadzi do hipoksji (niedotlenienia).
Wśród przyczyn ARDS wyróżniamy wiele czynników, w tym infekcyjne oraz mechaniczne. Objętość jednego oddechu drastycznie spada. Na tym etapie terapii pacjent jest zaintubowany i wentylowany mechanicznie, ale w związku ze zmniejszeniem objętości oddechowej wytwarzane ciśnienia mogą uszkodzić płuca, a stosowanie tradycyjnego respiratora staje się niewystarczające.
Pozaustrojowe natlenianie w tym przypadku zmniejsza lub eliminuje ryzyko uszkodzenia płuc związane z inwazyjną wentylacją mechaniczną u chorych z ciężkim ARDS.
VA ECMO stosowane jako wspomaganie serca w sytuacji, gdy jest ono niewydolne w przebiegu zawału, zatrzymania krążenia, zatoru płucnego lub po ciężkim zabiegu kardiochirurgicznym. VA ECMO utrzymuje przy życiu pacjenta wówczas, gdy jego własne serce jest niewydolne i pozwala uniknąć uszkodzenia serca związane z dużymi dawkami amin katecholowych, leków podnoszących ciśnienie, utrzymując równocześnie perfuzję tkankową (dopływ krwi do tkanek).
Należy jednak podkreślić, że ECMO jest terapią bardzo inwazyjną, dlatego powinno być stosowane tylko wtedy, gdy nie uda się uzyskać stabilizacji pacjenta przy użyciu konwencjonalnych metod – jak wentylacja mechaniczna lub stosowanie leków podnoszących ciśnienie, a stan zagrożenia życia jest potencjalnie odwracalny.
Stąd bardzo ważna jest właściwa kwalifikacja: właściwy pacjent o właściwym czasie, z odwracalną chorobą.
Ciągłe udoskonalanie
Pierwszy udany bajpas krążeniowo-oddechowy u ludzi został wykonany przez Johna H. Gibbona, Jr. w 1953 roku, ale dopiero w 1971 roku zastosowano pierwowzór ECMO do wspomagania pacjenta z urazem. Chory przeżył trzy dni, urządzenie zajmowało cały pokój, ale jest on uważany za pierwszego pacjenta, który skorzystał z tej technologii. Kilka lat później, w 1975 roku, Robert H. Bartlett zgłosił pierwsze niemowlę, które zostało uratowane dzięki ECMO.
Od tego czasu trwają badania nad udoskonaleniem urządzenia. Pokrycie wnętrza kaniul, drenów i samego oksygenatora heparyną i albuminami umożliwiło redukcję intensywności koniecznej antykoagulacji (z czterokrotnego wydłużenia czasu krzepnięcia do półtorakrotności tej normy). Umożliwiło to wydłużenie pracy ECMO, zredukowano jego wielkość i obecnie składa się ono z oksygenatora ECMO (membrana dyfuzyjna), pompy centryfugalnej, kaniul, zestawu drenów i wymiennika ciepła (ogrzewacza).
Pomimo tak zaawansowanej technologii i licznych modyfikacji jej funkcjonowania wyniki leczenia chorych, którzy wymagają zastosowania ECMO, są nadal dalekie od optymalnych, ponieważ od urządzenia można odłączyć tylko 30–58 proc. zakwalifikowanych chorych, a jeszcze mniej z nich przeżywa czas hospitalizacji. Okres rehabilitacji po leczeniu trwa długo i często nie pozwala na powrót do pełni sił sprzed zachorowania.
Czas OXIFlame?
Wobec licznych problemów z urządzeniem doszło do spotkania ekspertów z trzech różnych dziedzin: uznanej ekspertki ECMO dr n. med. Ewy Trejnowskiej z Kliniki Anestezjologii i Intensywnej Terapii (Śląskie Centrum Chorób Serca w Zabrzu, Wydział Nauk Medycznych w Zabrzu, Śląski Uniwersytet Medyczny w Katowicach), dr. hab. n. med. Szymona Skoczyńskiego, prof. SUM z Katedry i Kliniki Chorób Płuc i Gruźlicy SUM (Wydział Nauk Medycznych w Zabrzu, Śląski Uniwersytet Medyczny w Katowicach, specjalista w zakresie chorób układu oddechowego i patofizjologii oddychania) oraz dr. hab. n. med. Andrzeja Swinarewa, prof. UŚ (specjalista od biomateriałów, Instytut Inżynierii Biomedycznej, Uniwersytet Śląski Katowicach, Instytut Nauk o Sporcie, Akademia Wychowania Fizycznego w Katowicach).
Na dalszym etapie zespół inicjatorów został wsparty przez naukowców i klinicystów reprezentujących wszystkie trzy uczelnie, byli to: Jadwiga Gabor, Hubert Okła, Mateusz Przybyła, Grzegorz Brożek, Agnieszka Skoczyńska, Piotr Knapik, Tomasz Darocha, Konrad Mendrala, Katarzyna Mizia-Stec, Arkadiusz Stanula, Barbara Szpikowska-Sroka, Magdalena Popczyk.
W wyniku prowadzonych prac powstał OXiFlame – całkowicie nowa koncepcja budowy oksygenatora, która pozwala na funkcjonowanie pracy urządzenia w warunkach utlenowania znacznie bardziej zbliżonych do fizjologicznych, obserwowanych w przyrodzie.
Zespół stworzył projekt urządzenia, które zbudowane jest z zupełnie innych niż dotąd materiałów. Stworzone od podstaw materiały charakteryzują się gładką powierzchnią, zmniejszającą prawdopodobieństwo powstawania skrzeplin, dodatkowo, materiał porowaty jest wypełniany cząstkami antykoagulantu.
Taka innowacja sprawia, że stworzony materiał „żyje”, podobnie jak ściana naczynia krwionośnego i podlega interakcji z przepływającą krwią. Cząsteczki antykoagulantu, które w czasie funkcjonowania urządzenia są ścinane z jego powierzchni przez przepływającą krew, są zastępowane przez nowe, które dyfundują (wypływają) na powierzchnię z wnętrza materiału, chroniąc go przed wykrzepianiem. Zjawisko to, wraz z funkcjonowaniem urządzenia, poprawia przepuszczalność dla gazów, która aktualnie, w obecnie funkcjonującym ECMO, pogarsza się wraz z czasem użytkowania.
Przetestowane w technologii „up-initio” materiały umożliwiają też zastosowanie znacznie mniejszych stężeń tlenu niż w obecnie funkcjonujących urządzeniach. Dzięki tej innowacji możliwe będzie ograniczenie obserwowanego w obecnie funkcjonującym ECMO stresu oksydacyjnego, który nasila aktywację śródbłonka naczyń, aktywuje układ krzepnięcia oraz przyczynia się do aktywacji leukocytów ich migracji i uogólnionej reakcji zapalnej. Zjawiska te są odpowiedzialne za aktualnie obserwowane w trakcie terapii ECMO powikłania, takie jak krwawienia, spowodowane między innymi aktywacją układu krzepnięcia w obecnie stosowanym oksygenatorze, lub wykrzepianie w przypadku zbyt małej podaży antykoagulantu grożą zatorami tętniczymi, między innymi udarami mózgu.
Innymi częstym powikłaniami stresu oksydacyjnego są: zakażenia, sepsa, wstrząs septyczny. Stwarza to konieczność częstej wymiany obecnie funkcjonującego oksygenatora w ECMO (rekomendowane przez producentów 14 dni).
Materiał zastosowany w OXiFLAME dzięki zaproponowanej koncepcji pozwala na uniknięcie tych wad. Kolejnym etapem inicjatywy podczas pracy nad OXiFLAME było stworzenie całkowicie nowego oksygenatora, działającego na zasadzie fizjologicznego przeciwprądu, zaczerpniętego z prawidłowej budowy histologicznej płuca czy nerki. Pozwala to na znaczące zmniejszenie podaży tlenu do stężeń niższych niż 50 proc. składu mieszanki oddechowej.
W efekcie możliwe jest znaczne zredukowanie stresu oksyganacyjnego, zredukowanie prawdopodobieństwa wystąpienia powikłań, a przy okazji wydłużenie żywotności urządzenia. Struktura oksygenetora i zastosowane podwójnego obwodu przepływów przez filtry stworzone z tego samego materiału pozwalają na usuniecie skrzeplin z systemu bez konieczności wymiany oksygenatora (obecnie jest to problematyczne technicznie i może stwarzać zagrożenie dla pacjenta). Ewentualne mikroskrzepliny nie znajdą się w głównym nurcie krwi, ponieważ ruch wirowy, pozwoli na ich skuteczne przemieszczenie.
Przyszłość OXIFlame
OXiFlame został po raz pierwszy zaprezentowany na konferencji ELSO-ECMO w Bostonie w 2022 r., gdzie został uznany za najbardziej interesujące doniesienia zjazdowe. Rozwiązanie jest chronione licznymi patentami polskimi. Zostało zgłoszone również do biur patentowych na obszarze Unii Europejskiej i Stanów Zjednoczonych Ameryki Północnej.
– Do szybkiego wdrożenia i przetestowania w warunkach laboratoryjnych i klinicznych konieczna jest współpraca z przemysłem biomedycznym, na którą jesteśmy otwarci – wyjaśnia prof. Skoczyński.

Czym jest ECMO?
Pozaustrojowa oksygenacja krwi (ECMO – extracorporeal membrane oxygenation) jest techniką polegającą na utlenowaniu (oksygenacji) krwi i eliminacji z niej dwutlenku węgla w oksygenatorze, z wykorzystaniem krążenia pozaustrojowego.
ECMO stosowane jest tylko u chorych, w potencjalnie odwracalnych stanach zagrożenia życia z bardzo ciężką niewydolnością oddechową i/lub krążeniową, u których nie udało się uzyskać odpowiedzi na dostępne na oddziałach intensywnej terapii konwencjonalne metody leczenia.
ECMO nie leczy serca ani płuc, lecz daje choremu szansę na przeżycie okresu, w którym te narządy są niewydolne. Daje czas lekarzowi na leczenie choroby, która doprowadziła do skrajnej niewydolności krążeniowo-oddechowej.
Wyróżnia się dwa podstawowe schematy podłączenia ECMO żylno-żylne (veno-venous VV ECMO) stosowane jest jako wspomaganie oddychania, natomiast żylno-tętnicze (veno-arterial VA ECMO) stosowane jako wspomaganie serca i/lub oddychania.
VV ECMO stosowane jest u chorych z ciężkim zespołem ostrej niewydolności oddechowej (ARDS), w którym dochodzi do uszkodzenia tzw. bariery pęcherzykowo-włośniczkowej, co powoduje przeciekanie bogato białkowego płynu do układu oddechowego. Zapadnięcie się pęcherzyków powietrznych sprawia, że płuca tracą zdolność spełniania swojej funkcji, czyli wymiany tlenu i dwutlenku węgla, co prowadzi do hipoksji (niedotlenienia).
Wśród przyczyn ARDS wyróżniamy wiele czynników, w tym infekcyjne oraz mechaniczne. Objętość jednego oddechu drastycznie spada. Na tym etapie terapii pacjent jest zaintubowany i wentylowany mechanicznie, ale w związku ze zmniejszeniem objętości oddechowej wytwarzane ciśnienia mogą uszkodzić płuca, a stosowanie tradycyjnego respiratora staje się niewystarczające.
Pozaustrojowe natlenianie w tym przypadku zmniejsza lub eliminuje ryzyko uszkodzenia płuc związane z inwazyjną wentylacją mechaniczną u chorych z ciężkim ARDS.
VA ECMO stosowane jako wspomaganie serca w sytuacji, gdy jest ono niewydolne w przebiegu zawału, zatrzymania krążenia, zatoru płucnego lub po ciężkim zabiegu kardiochirurgicznym. VA ECMO utrzymuje przy życiu pacjenta wówczas, gdy jego własne serce jest niewydolne i pozwala uniknąć uszkodzenia serca związane z dużymi dawkami amin katecholowych, leków podnoszących ciśnienie, utrzymując równocześnie perfuzję tkankową (dopływ krwi do tkanek).
Należy jednak podkreślić, że ECMO jest terapią bardzo inwazyjną, dlatego powinno być stosowane tylko wtedy, gdy nie uda się uzyskać stabilizacji pacjenta przy użyciu konwencjonalnych metod – jak wentylacja mechaniczna lub stosowanie leków podnoszących ciśnienie, a stan zagrożenia życia jest potencjalnie odwracalny.
Stąd bardzo ważna jest właściwa kwalifikacja: właściwy pacjent o właściwym czasie, z odwracalną chorobą.
Ciągłe udoskonalanie
Pierwszy udany bajpas krążeniowo-oddechowy u ludzi został wykonany przez Johna H. Gibbona, Jr. w 1953 roku, ale dopiero w 1971 roku zastosowano pierwowzór ECMO do wspomagania pacjenta z urazem. Chory przeżył trzy dni, urządzenie zajmowało cały pokój, ale jest on uważany za pierwszego pacjenta, który skorzystał z tej technologii. Kilka lat później, w 1975 roku, Robert H. Bartlett zgłosił pierwsze niemowlę, które zostało uratowane dzięki ECMO.
Od tego czasu trwają badania nad udoskonaleniem urządzenia. Pokrycie wnętrza kaniul, drenów i samego oksygenatora heparyną i albuminami umożliwiło redukcję intensywności koniecznej antykoagulacji (z czterokrotnego wydłużenia czasu krzepnięcia do półtorakrotności tej normy). Umożliwiło to wydłużenie pracy ECMO, zredukowano jego wielkość i obecnie składa się ono z oksygenatora ECMO (membrana dyfuzyjna), pompy centryfugalnej, kaniul, zestawu drenów i wymiennika ciepła (ogrzewacza).
Pomimo tak zaawansowanej technologii i licznych modyfikacji jej funkcjonowania wyniki leczenia chorych, którzy wymagają zastosowania ECMO, są nadal dalekie od optymalnych, ponieważ od urządzenia można odłączyć tylko 30–58 proc. zakwalifikowanych chorych, a jeszcze mniej z nich przeżywa czas hospitalizacji. Okres rehabilitacji po leczeniu trwa długo i często nie pozwala na powrót do pełni sił sprzed zachorowania.
Czas OXIFlame?
Wobec licznych problemów z urządzeniem doszło do spotkania ekspertów z trzech różnych dziedzin: uznanej ekspertki ECMO dr n. med. Ewy Trejnowskiej z Kliniki Anestezjologii i Intensywnej Terapii (Śląskie Centrum Chorób Serca w Zabrzu, Wydział Nauk Medycznych w Zabrzu, Śląski Uniwersytet Medyczny w Katowicach), dr. hab. n. med. Szymona Skoczyńskiego, prof. SUM z Katedry i Kliniki Chorób Płuc i Gruźlicy SUM (Wydział Nauk Medycznych w Zabrzu, Śląski Uniwersytet Medyczny w Katowicach, specjalista w zakresie chorób układu oddechowego i patofizjologii oddychania) oraz dr. hab. n. med. Andrzeja Swinarewa, prof. UŚ (specjalista od biomateriałów, Instytut Inżynierii Biomedycznej, Uniwersytet Śląski Katowicach, Instytut Nauk o Sporcie, Akademia Wychowania Fizycznego w Katowicach).
Na dalszym etapie zespół inicjatorów został wsparty przez naukowców i klinicystów reprezentujących wszystkie trzy uczelnie, byli to: Jadwiga Gabor, Hubert Okła, Mateusz Przybyła, Grzegorz Brożek, Agnieszka Skoczyńska, Piotr Knapik, Tomasz Darocha, Konrad Mendrala, Katarzyna Mizia-Stec, Arkadiusz Stanula, Barbara Szpikowska-Sroka, Magdalena Popczyk.
W wyniku prowadzonych prac powstał OXiFlame – całkowicie nowa koncepcja budowy oksygenatora, która pozwala na funkcjonowanie pracy urządzenia w warunkach utlenowania znacznie bardziej zbliżonych do fizjologicznych, obserwowanych w przyrodzie.
Zespół stworzył projekt urządzenia, które zbudowane jest z zupełnie innych niż dotąd materiałów. Stworzone od podstaw materiały charakteryzują się gładką powierzchnią, zmniejszającą prawdopodobieństwo powstawania skrzeplin, dodatkowo, materiał porowaty jest wypełniany cząstkami antykoagulantu.
Taka innowacja sprawia, że stworzony materiał „żyje”, podobnie jak ściana naczynia krwionośnego i podlega interakcji z przepływającą krwią. Cząsteczki antykoagulantu, które w czasie funkcjonowania urządzenia są ścinane z jego powierzchni przez przepływającą krew, są zastępowane przez nowe, które dyfundują (wypływają) na powierzchnię z wnętrza materiału, chroniąc go przed wykrzepianiem. Zjawisko to, wraz z funkcjonowaniem urządzenia, poprawia przepuszczalność dla gazów, która aktualnie, w obecnie funkcjonującym ECMO, pogarsza się wraz z czasem użytkowania.
Przetestowane w technologii „up-initio” materiały umożliwiają też zastosowanie znacznie mniejszych stężeń tlenu niż w obecnie funkcjonujących urządzeniach. Dzięki tej innowacji możliwe będzie ograniczenie obserwowanego w obecnie funkcjonującym ECMO stresu oksydacyjnego, który nasila aktywację śródbłonka naczyń, aktywuje układ krzepnięcia oraz przyczynia się do aktywacji leukocytów ich migracji i uogólnionej reakcji zapalnej. Zjawiska te są odpowiedzialne za aktualnie obserwowane w trakcie terapii ECMO powikłania, takie jak krwawienia, spowodowane między innymi aktywacją układu krzepnięcia w obecnie stosowanym oksygenatorze, lub wykrzepianie w przypadku zbyt małej podaży antykoagulantu grożą zatorami tętniczymi, między innymi udarami mózgu.
Innymi częstym powikłaniami stresu oksydacyjnego są: zakażenia, sepsa, wstrząs septyczny. Stwarza to konieczność częstej wymiany obecnie funkcjonującego oksygenatora w ECMO (rekomendowane przez producentów 14 dni).
Materiał zastosowany w OXiFLAME dzięki zaproponowanej koncepcji pozwala na uniknięcie tych wad. Kolejnym etapem inicjatywy podczas pracy nad OXiFLAME było stworzenie całkowicie nowego oksygenatora, działającego na zasadzie fizjologicznego przeciwprądu, zaczerpniętego z prawidłowej budowy histologicznej płuca czy nerki. Pozwala to na znaczące zmniejszenie podaży tlenu do stężeń niższych niż 50 proc. składu mieszanki oddechowej.
W efekcie możliwe jest znaczne zredukowanie stresu oksyganacyjnego, zredukowanie prawdopodobieństwa wystąpienia powikłań, a przy okazji wydłużenie żywotności urządzenia. Struktura oksygenetora i zastosowane podwójnego obwodu przepływów przez filtry stworzone z tego samego materiału pozwalają na usuniecie skrzeplin z systemu bez konieczności wymiany oksygenatora (obecnie jest to problematyczne technicznie i może stwarzać zagrożenie dla pacjenta). Ewentualne mikroskrzepliny nie znajdą się w głównym nurcie krwi, ponieważ ruch wirowy, pozwoli na ich skuteczne przemieszczenie.
Przyszłość OXIFlame
OXiFlame został po raz pierwszy zaprezentowany na konferencji ELSO-ECMO w Bostonie w 2022 r., gdzie został uznany za najbardziej interesujące doniesienia zjazdowe. Rozwiązanie jest chronione licznymi patentami polskimi. Zostało zgłoszone również do biur patentowych na obszarze Unii Europejskiej i Stanów Zjednoczonych Ameryki Północnej.
– Do szybkiego wdrożenia i przetestowania w warunkach laboratoryjnych i klinicznych konieczna jest współpraca z przemysłem biomedycznym, na którą jesteśmy otwarci – wyjaśnia prof. Skoczyński.

Źródło:
Śląski Uniwersytet Medyczny
Śląski Uniwersytet Medyczny