Elektroniczna recepta transgraniczna – science fiction czy niedaleka rzeczywistość?

Z uwagi na coraz większą mobilność Europejczyków, nowego wymiaru nabrało świadczenie usług medycznych w ujęciu transgranicznym, w tym możliwość wystawiania recept i ich realizacji przez pacjentów za granicą. Regulacje prawne związane z tą kwestią przewidują wystawianie recept w postaci papierowej.
Tekst Anny Gawrońskiej:
- Wśród przedstawicieli branży ochrony zdrowia na poziomie Unii Europejskiej zarysowuje się dążenie do wypracowania rozwiązania pozwalającego na elektronizację tej procedury.
Elektroniczna recepta nadal postrzegana jest jako symbol innowacji i nowoczesnych rozwiązań w obszarze ochrony zdrowia. Z tego powodu nie brakuje obaw i wątpliwości związanych z przekonaniem o braku zarówno gotowości do wprowadzenia takiego rozwiązania w Polsce, jak i skuteczności i efektywności jego funkcjonowania. Eksperci twierdzą, że obawy nie są w pełni uzasadnione, ponieważ apteki są wyposażone w sprzęt komputerowy i odpowiednie informatyczne programy apteczne. Ponadto wszystkie gabinety lekarskie, przychodnie i inne placówki muszą posiadać nie tylko komputery, lecz także bezpieczne i stabilne łącze internetowe. Odpowiednie wyposażenie, jak również przeszkolenie lekarzy jest konieczne, aby wszystkie strony były przygotowane na realizację elektronicznej recepty.
Wśród różnorodnych czynników technicznych, od których uzależnione jest skuteczne i efektywne funkcjonowanie elektronicznej recepty, główną rolę odgrywa rejestr produktów leczniczych. Na jego podstawie osoba uprawniona do wystawienia recepty będzie tworzyła wykaz produktów leczniczych dla pacjenta. W Polsce referencyjny rejestr powstał w ramach tzw. projektu P2, czyli „Platformy udostępniania on-line przedsiębiorcom usług i zasobów cyfrowych rejestrów medycznych”, zrealizowanego przez Centrum Systemów Informacyjnych Ochrony Zdrowia (CSIOZ). Rejestr ten obejmuje produkty lecznicze dopuszczone do obrotu na terytorium Rzeczypospolitej Polskiej oraz produkty lecznicze wpisane do „Wspólnotowego rejestru produktów leczniczych”.
Prędzej czy później?
Można zatem stwierdzić, że prędzej czy później zaistnieją w Polsce warunki do skutecznego i efektywnego wystawiania i realizacji recept w postaci elektronicznej. Czy jednak taka recepta – wystawiona w Polsce – będzie mogła być zrealizowana w innym kraju Unii Europejskiej przy sprzyjających uwarunkowaniach prawnych? Między innymi to pytanie stało się przedmiotem dyskusji w wielu krajach UE. Mimo jednolitych regulacji prawnych dla członków UE każde z państw charakteryzuje się własnym, bardzo często specyficznym podejściem w zakresie uregulowań krajowych. Ma to z kolei wpływ na sposób opisu i identyfikacji produktów leczniczych przepisywanych pacjentom w ramach określonej farmakoterapii. Takie podejście niesie ze sobą określone konsekwencje w postaci braku jednolitego słownika produktów leczniczych, który umożliwiałby skuteczną realizację elektronicznej recepty wystawionej w innym kraju. Powodem trudności w realizacji recepty elektronicznej w ujęciu transgranicznym jest również różny sposób przepisywania leków. Leki można przepisywać, stosując ich nazwę międzynarodową, chemiczną lub handlową (przy czym należy pamiętać, że nazwy handlowe mogą się różnić w zależności od kraju). Ponadto na terenie UE istnieją różne procedury rejestracji produktów leczniczych i różne sposoby ich dopuszczania do obrotu oraz – co się z tym wiąże – różne metody kodowania danych o produktach. Brak jednolitego podejścia w zakresie identyfikacji produktów leczniczych jest również następstwem stosowania krajowych identyfikatorów i atrybutów leków, rozumianych tylko w danym państwie. Dodatkowym utrudnieniem są różnorodne podejścia w zakresie stosowania zamienników oraz rodzaju dostępności produktów leczniczych (leki OTC a leki Rp). W związku z powyższym na poziomie unijnym coraz częściej obserwuje się trendy standaryzacyjne, zmierzające do ujednolicenia sposobu gromadzenia i wymiany danych o produktach leczniczych.
Działania te wyraźnie odzwierciedlają sygnalizowaną przez przedstawicieli ochrony zdrowia konieczność harmonizacji i standaryzacji określonych rozwiązań i sposobów przebiegu wybranych procesów. Konieczność ta jest rezultatem większej mobilności obywateli UE i dążenia do jak najwyższego poziomu obsługi pacjentów w kontekście świadczenia usług medycznych w ujęciu transgranicznym. Celem takich działań jest zapewnienie bezpieczeństwa farmakoterapii, a co za tym idzie – bezpieczeństwa pacjentów. Idea wypracowania mechanizmu sprzyjającego realizacji elektronicznej recepty transgranicznej przyświecała zainicjowanemu w 2014 r. projektowi o nazwie OpenMedicine. W projekcie uczestniczyło ośmiu partnerów z UE przy wsparciu bardzo licznej grupy ekspertów zewnętrznych, wśród których znaleźli się przedstawiciele takich instytucji, jak Światowa Organizacja Zdrowia (World Health Organization – WHO), Europejska Agencja Leków (European Medicines Agency – EMA) czy amerykański Urząd ds. Żywności i Leków (Food and Drug Administration – FDA).
W rezultacie ich prac powstała koncepcja wspólnego modelu danych oraz wspólnej nomenklatury. Pięć międzynarodowych standardów ISO Punkt wyjścia dla opracowanej koncepcji stanowił zestaw pięciu międzynarodowych standardów ISO w zakresie zharmonizowanego podejścia na rzecz identyfikacji i opisu produktów leczniczych, tzw. ISO IDMP (Identification of Medicinal Products). Normy te – EN ISO 11238, EN ISO 11239, EN ISO 11240, EN ISO 11615 i EN ISO 11616 – stanowią podstawę unikalnej identyfikacji produktów leczniczych, dając organom odpowiedzialnym za nadzór nad tymi produktami narzędzie wykorzystywane w procesie rozwoju, rejestracji i zarządzania cyklem życia produktów leczniczych, a także monitorowania działań niepożądanych i zarządzania ryzykiem. Integralną część tych norm stanowią specyfikacje w zakresie wymiany danych. Warto podkreślić, że normy te bazują na określonych standardach i rozwiązaniach w przedmiotowych obszarach, np. na jednostkach miary (SI), standardzie wymiany danych medycznych (HL7) czy globalnych standardach w zakresie identyfikacji (GS1), a także odwołują się do nich. Zgodnie z Rozporządzeniem Wykonawczym Komisji (UE) nr 520/2012 z dnia 19 czerwca 2012 r. w sprawie działań związanych z nadzorem nad bezpieczeństwem farmakoterapii, o których mowa w rozporządzeniu (WE) nr 726/2004 Parlamentu Europejskiego i Rady i w dyrektywie 2001/83/WE Parlamentu Europejskiego i Rady, w stosunku do branży farmaceutycznej sformułowano wymóg prawny co do posługiwania się terminologią zgodną z normami ISO. Normy te zostały wybrane nie tylko dlatego, że standaryzują podejście w zakresie unikalnej i zharmonizowanej identyfikacji produktów leczniczych dla różnorodnych celów oraz uwspólniają zasady opisu i wymiany danych o lekach. Kolejnym powodem było to, że będą one stanowiły fundament bazy danych produktów leczniczych, tworzonej przez EMA na rzecz monitorowania bezpieczeństwa leków i zgłaszania ich działań niepożądanych.
Trzy poziomy i ujednolicenie
Z praktycznego punktu widzenia każdemu produktowi leczniczemu zostaną nadane uzgodnione identyfikatory, umożliwiające jego jednoznaczną identyfikację na różnych poziomach:
- identyfikator produktu farmaceutycznego: substancja czynna, postać, dawka (pharmaceutical product identifier – PhPID),
- identyfikator produktu leczniczego: podmiot odpowiedzialny, substancja czynna, nazwa handlowa, postać, dawka (medicinal product identifier – MPID),
- identyfikator produktu leczniczego w określonej formie opakowaniowej: podmiot odpowiedzialny, substancja czynna, nazwa handlowa, postać, dawka, liczba sztuk w opakowaniu (packaging identifier – PCID).
Dzięki takiemu ujednoliconemu podejściu możliwa będzie realizacja recepty w postaci elektronicznej transgranicznie wg schematu przedstawionego na rycinie 1.
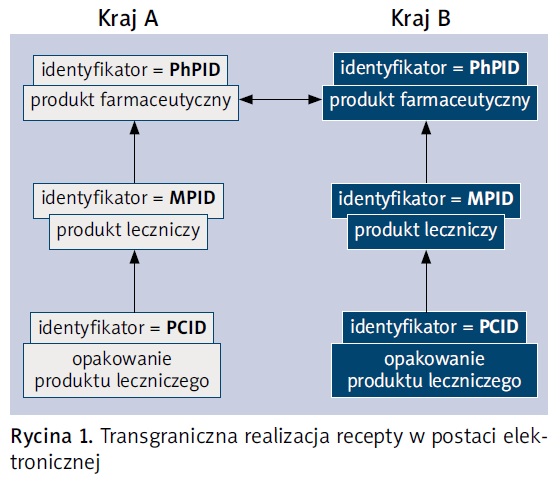
Wspólnym poziomem identyfikacji w UE będzie PhPID. Należy jednak pamiętać, że realizacja proponowanej koncepcji będzie możliwa dopiero w momencie, kiedy wszystkie państwa członkowskie zaimplementują koncepcję ISO IDMP do krajowych słowników leków. Ponadto bazy te będą się musiały komunikować z tworzoną przez EMA bazą europejską. Przewiduje się, że początek implementacji nie nastąpi wcześniej niż w 2018 r. Od tej daty nie tylko wygoda podróżujących pacjentów, lecz także ich bezpieczeństwo powinny wzrosnąć.
dr Anna Gawrońska
Autorka jest ekspertem ds. standardów GS1 w ochronie zdrowia.
Tekst pochodzi z "Menedżera Zdrowia" numer 1/2018. Czasopismo można zamówić na stronie: www.termedia.pl/mz/prenumerata.
Zachęcamy do polubienia profilu "Menedżera Zdrowia" na Facebooku: www.facebook.com/MenedzerZdrowia i obserwowania konta na Twitterze: www.twitter.com/MenedzerZdrowia.
- Wśród przedstawicieli branży ochrony zdrowia na poziomie Unii Europejskiej zarysowuje się dążenie do wypracowania rozwiązania pozwalającego na elektronizację tej procedury.
Elektroniczna recepta nadal postrzegana jest jako symbol innowacji i nowoczesnych rozwiązań w obszarze ochrony zdrowia. Z tego powodu nie brakuje obaw i wątpliwości związanych z przekonaniem o braku zarówno gotowości do wprowadzenia takiego rozwiązania w Polsce, jak i skuteczności i efektywności jego funkcjonowania. Eksperci twierdzą, że obawy nie są w pełni uzasadnione, ponieważ apteki są wyposażone w sprzęt komputerowy i odpowiednie informatyczne programy apteczne. Ponadto wszystkie gabinety lekarskie, przychodnie i inne placówki muszą posiadać nie tylko komputery, lecz także bezpieczne i stabilne łącze internetowe. Odpowiednie wyposażenie, jak również przeszkolenie lekarzy jest konieczne, aby wszystkie strony były przygotowane na realizację elektronicznej recepty.
Wśród różnorodnych czynników technicznych, od których uzależnione jest skuteczne i efektywne funkcjonowanie elektronicznej recepty, główną rolę odgrywa rejestr produktów leczniczych. Na jego podstawie osoba uprawniona do wystawienia recepty będzie tworzyła wykaz produktów leczniczych dla pacjenta. W Polsce referencyjny rejestr powstał w ramach tzw. projektu P2, czyli „Platformy udostępniania on-line przedsiębiorcom usług i zasobów cyfrowych rejestrów medycznych”, zrealizowanego przez Centrum Systemów Informacyjnych Ochrony Zdrowia (CSIOZ). Rejestr ten obejmuje produkty lecznicze dopuszczone do obrotu na terytorium Rzeczypospolitej Polskiej oraz produkty lecznicze wpisane do „Wspólnotowego rejestru produktów leczniczych”.
Prędzej czy później?
Można zatem stwierdzić, że prędzej czy później zaistnieją w Polsce warunki do skutecznego i efektywnego wystawiania i realizacji recept w postaci elektronicznej. Czy jednak taka recepta – wystawiona w Polsce – będzie mogła być zrealizowana w innym kraju Unii Europejskiej przy sprzyjających uwarunkowaniach prawnych? Między innymi to pytanie stało się przedmiotem dyskusji w wielu krajach UE. Mimo jednolitych regulacji prawnych dla członków UE każde z państw charakteryzuje się własnym, bardzo często specyficznym podejściem w zakresie uregulowań krajowych. Ma to z kolei wpływ na sposób opisu i identyfikacji produktów leczniczych przepisywanych pacjentom w ramach określonej farmakoterapii. Takie podejście niesie ze sobą określone konsekwencje w postaci braku jednolitego słownika produktów leczniczych, który umożliwiałby skuteczną realizację elektronicznej recepty wystawionej w innym kraju. Powodem trudności w realizacji recepty elektronicznej w ujęciu transgranicznym jest również różny sposób przepisywania leków. Leki można przepisywać, stosując ich nazwę międzynarodową, chemiczną lub handlową (przy czym należy pamiętać, że nazwy handlowe mogą się różnić w zależności od kraju). Ponadto na terenie UE istnieją różne procedury rejestracji produktów leczniczych i różne sposoby ich dopuszczania do obrotu oraz – co się z tym wiąże – różne metody kodowania danych o produktach. Brak jednolitego podejścia w zakresie identyfikacji produktów leczniczych jest również następstwem stosowania krajowych identyfikatorów i atrybutów leków, rozumianych tylko w danym państwie. Dodatkowym utrudnieniem są różnorodne podejścia w zakresie stosowania zamienników oraz rodzaju dostępności produktów leczniczych (leki OTC a leki Rp). W związku z powyższym na poziomie unijnym coraz częściej obserwuje się trendy standaryzacyjne, zmierzające do ujednolicenia sposobu gromadzenia i wymiany danych o produktach leczniczych.
Działania te wyraźnie odzwierciedlają sygnalizowaną przez przedstawicieli ochrony zdrowia konieczność harmonizacji i standaryzacji określonych rozwiązań i sposobów przebiegu wybranych procesów. Konieczność ta jest rezultatem większej mobilności obywateli UE i dążenia do jak najwyższego poziomu obsługi pacjentów w kontekście świadczenia usług medycznych w ujęciu transgranicznym. Celem takich działań jest zapewnienie bezpieczeństwa farmakoterapii, a co za tym idzie – bezpieczeństwa pacjentów. Idea wypracowania mechanizmu sprzyjającego realizacji elektronicznej recepty transgranicznej przyświecała zainicjowanemu w 2014 r. projektowi o nazwie OpenMedicine. W projekcie uczestniczyło ośmiu partnerów z UE przy wsparciu bardzo licznej grupy ekspertów zewnętrznych, wśród których znaleźli się przedstawiciele takich instytucji, jak Światowa Organizacja Zdrowia (World Health Organization – WHO), Europejska Agencja Leków (European Medicines Agency – EMA) czy amerykański Urząd ds. Żywności i Leków (Food and Drug Administration – FDA).
W rezultacie ich prac powstała koncepcja wspólnego modelu danych oraz wspólnej nomenklatury. Pięć międzynarodowych standardów ISO Punkt wyjścia dla opracowanej koncepcji stanowił zestaw pięciu międzynarodowych standardów ISO w zakresie zharmonizowanego podejścia na rzecz identyfikacji i opisu produktów leczniczych, tzw. ISO IDMP (Identification of Medicinal Products). Normy te – EN ISO 11238, EN ISO 11239, EN ISO 11240, EN ISO 11615 i EN ISO 11616 – stanowią podstawę unikalnej identyfikacji produktów leczniczych, dając organom odpowiedzialnym za nadzór nad tymi produktami narzędzie wykorzystywane w procesie rozwoju, rejestracji i zarządzania cyklem życia produktów leczniczych, a także monitorowania działań niepożądanych i zarządzania ryzykiem. Integralną część tych norm stanowią specyfikacje w zakresie wymiany danych. Warto podkreślić, że normy te bazują na określonych standardach i rozwiązaniach w przedmiotowych obszarach, np. na jednostkach miary (SI), standardzie wymiany danych medycznych (HL7) czy globalnych standardach w zakresie identyfikacji (GS1), a także odwołują się do nich. Zgodnie z Rozporządzeniem Wykonawczym Komisji (UE) nr 520/2012 z dnia 19 czerwca 2012 r. w sprawie działań związanych z nadzorem nad bezpieczeństwem farmakoterapii, o których mowa w rozporządzeniu (WE) nr 726/2004 Parlamentu Europejskiego i Rady i w dyrektywie 2001/83/WE Parlamentu Europejskiego i Rady, w stosunku do branży farmaceutycznej sformułowano wymóg prawny co do posługiwania się terminologią zgodną z normami ISO. Normy te zostały wybrane nie tylko dlatego, że standaryzują podejście w zakresie unikalnej i zharmonizowanej identyfikacji produktów leczniczych dla różnorodnych celów oraz uwspólniają zasady opisu i wymiany danych o lekach. Kolejnym powodem było to, że będą one stanowiły fundament bazy danych produktów leczniczych, tworzonej przez EMA na rzecz monitorowania bezpieczeństwa leków i zgłaszania ich działań niepożądanych.
Trzy poziomy i ujednolicenie
Z praktycznego punktu widzenia każdemu produktowi leczniczemu zostaną nadane uzgodnione identyfikatory, umożliwiające jego jednoznaczną identyfikację na różnych poziomach:
- identyfikator produktu farmaceutycznego: substancja czynna, postać, dawka (pharmaceutical product identifier – PhPID),
- identyfikator produktu leczniczego: podmiot odpowiedzialny, substancja czynna, nazwa handlowa, postać, dawka (medicinal product identifier – MPID),
- identyfikator produktu leczniczego w określonej formie opakowaniowej: podmiot odpowiedzialny, substancja czynna, nazwa handlowa, postać, dawka, liczba sztuk w opakowaniu (packaging identifier – PCID).
Dzięki takiemu ujednoliconemu podejściu możliwa będzie realizacja recepty w postaci elektronicznej transgranicznie wg schematu przedstawionego na rycinie 1.

Wspólnym poziomem identyfikacji w UE będzie PhPID. Należy jednak pamiętać, że realizacja proponowanej koncepcji będzie możliwa dopiero w momencie, kiedy wszystkie państwa członkowskie zaimplementują koncepcję ISO IDMP do krajowych słowników leków. Ponadto bazy te będą się musiały komunikować z tworzoną przez EMA bazą europejską. Przewiduje się, że początek implementacji nie nastąpi wcześniej niż w 2018 r. Od tej daty nie tylko wygoda podróżujących pacjentów, lecz także ich bezpieczeństwo powinny wzrosnąć.
dr Anna Gawrońska
Autorka jest ekspertem ds. standardów GS1 w ochronie zdrowia.
Tekst pochodzi z "Menedżera Zdrowia" numer 1/2018. Czasopismo można zamówić na stronie: www.termedia.pl/mz/prenumerata.
Zachęcamy do polubienia profilu "Menedżera Zdrowia" na Facebooku: www.facebook.com/MenedzerZdrowia i obserwowania konta na Twitterze: www.twitter.com/MenedzerZdrowia.
Źródło:
Anna Gawrońska/Menedżer Zdrowia/KL
Anna Gawrońska/Menedżer Zdrowia/KL



















