FDA ponownie rozpatrzy stosowanie fenylomaślanu sodu i taurursodiolu w leczeniu SLA
Panel doradców FDA odrzucił wniosek o zatwierdzenie doustnego leku AMX0035, twierdząc, że dane z badania kliniczne nie wykazały, że jest on skuteczny w leczeniu stwardnienia zanikowego bocznego. FDA poprosiła firmę o więcej informacji i opóźniła termin podjęcia decyzji w sprawie leku do 29 września.
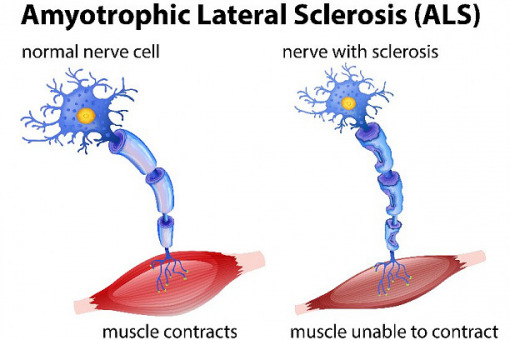
Stwardnienie zanikowe boczne (sclerosis lateralis amyotrophica – SLA), którego przyczyna jest w dużej mierze nieznana, powoduje rozpad komórek nerwowych w mózgu i rdzeniu kręgowym, upośledzając sprawność fizyczną i prowadząc do poważnej niepełnosprawności oraz zgonu.
AMX0035 jest doustną mieszanką dwóch substancji czynnych: fenylomaślanu sodu i taurursodiolu. Trwają badania nad potencjałem AMX0035 w leczeniu SLA, choroby Alzheimera i zespołu Wolframa. AMX0035 został zatwierdzony w Kanadzie w zeszłym miesiącu z pewnymi warunkami (m.in. ujawnienie danych z trwającego obecnie globalnego badania).
Panel zewnętrznych doradców amerykańskiej FDA w marcu głosował 6:4 przeciwko zatwierdzeniu doustnego leku AMX0035, twierdząc, że dane z badań klinicznych nie wykazały, że jest on skuteczny w SLA. FDA poprosiła zatem firmę o więcej informacji i opóźniła termin podjęcia decyzji w sprawie leku do 29 września.
Wniosek do FDA oparto na randomizowanym, kontrolowanym placebo badaniu obejmującym 137 pacjentów z SLA, trwającym 24 tygodnie. Wykazano w nim, że fenylomaślan sodu i taurursodiol powodowały wolniejszy spadek sprawności czynnościowej niż placebo. Niedawno rozpoczęło się większe badanie z udziałem ok. 600 pacjentów z całego świata, które ma się zakończyć dopiero w 2024 r. (badanie PHOENIX).
Opracowanie lek. Damian Matusiak
AMX0035 jest doustną mieszanką dwóch substancji czynnych: fenylomaślanu sodu i taurursodiolu. Trwają badania nad potencjałem AMX0035 w leczeniu SLA, choroby Alzheimera i zespołu Wolframa. AMX0035 został zatwierdzony w Kanadzie w zeszłym miesiącu z pewnymi warunkami (m.in. ujawnienie danych z trwającego obecnie globalnego badania).
Panel zewnętrznych doradców amerykańskiej FDA w marcu głosował 6:4 przeciwko zatwierdzeniu doustnego leku AMX0035, twierdząc, że dane z badań klinicznych nie wykazały, że jest on skuteczny w SLA. FDA poprosiła zatem firmę o więcej informacji i opóźniła termin podjęcia decyzji w sprawie leku do 29 września.
Wniosek do FDA oparto na randomizowanym, kontrolowanym placebo badaniu obejmującym 137 pacjentów z SLA, trwającym 24 tygodnie. Wykazano w nim, że fenylomaślan sodu i taurursodiol powodowały wolniejszy spadek sprawności czynnościowej niż placebo. Niedawno rozpoczęło się większe badanie z udziałem ok. 600 pacjentów z całego świata, które ma się zakończyć dopiero w 2024 r. (badanie PHOENIX).
Opracowanie lek. Damian Matusiak
Źródło:
opracowanie Damian Matusiak
opracowanie Damian Matusiak





