21.06.2021
W SMA potrzebne są różne opcje terapeutyczne

O najnowszych wynikach badań dotyczących leczenia pacjentów z rdzeniowym zanikiem mięśni (spinal muscular atrophy – SMA) oraz o tym, dlaczego stosowanie w niektórych przypadkach łącznie terapii genowej i nusinersenu może przynieść korzyść terapeutyczną, opowiada prof. dr hab. n. med. Maria Mazurkiewicz-Bełdzińska, kierownik Kliniki Neurologii Rozwojowej UCK Gdańskiego Uniwersytetu Medycznego, przewodnicząca Polskiego Towarzystwa Neurologii Dziecięcej.
W 2017 r. uruchomiono w Polsce program wczesnego dostępu do leczenia nusinersenem dla dzieci z SMA 1 między 2. a 15. rokiem życia – EAP (Early Access Program). Na podstawie dostępnych wyników badań wiemy, że lek jest skuteczny w każdej grupie wiekowej. Którzy pacjenci odnoszą największą korzyść z tej terapii?
Program EAP był prowadzony w trzech ośrodkach – w Centrum Zdrowia Dziecka w Warszawie, Górnośląskim Centrum Zdrowia Dziecka w Katowicach i w Klinice Neurologii Rozwojowej UCK Gdańskiego Uniwersytetu Medycznego. Był skierowany do niewielkiej grupy chorych, zanim jeszcze w Polsce został wprowadzony program lekowy. Pacjenci włączani do EAP byli w relatywnie ciężkim stanie, z bardzo słabymi wyjściowo wynikami. Wszyscy odnieśli korzyść z leczenia, u wszystkich nastąpiła poprawa, nie były to jednak tak spektakularne efekty jak u pacjentów, którzy są włączani do leczenia w okresie przedobjawowym albo z lekkimi objawami choroby. W działającym obecnie programie lekowym nusinersenem jest leczonych ok. 700 pacjentów i u wielu z nich obserwujemy spektakularne efekty terapeutyczne.
Ostatnio rozpoczęto dwuletnie badanie kliniczne IV fazy RESPOND, które ma na celu ocenę skuteczności i bezpieczeństwa stosowania nusinersenu u pacjentów z suboptymalną odpowiedzią na lek onasemnogen abeparwowek (Zolgensma). Dlaczego zaplanowano takie badanie?
Prawdopodobnie przyczyną był brak oczekiwanego efektu terapii genowej u niektórych pacjentów. Nie uzyskali oni takiej poprawy w skalach motorycznych po podaniu terapii genowej, aby nie było u nich konieczne ewentualne wspomaganie oddychania czy żywienia. W badaniu RESPOND mają wziąć udział dwie grupy pacjentów. W pierwszej znajdzie się 40 dzieci w wieku do 9 miesięcy z dwoma kopiami genu SMN2 (prawdopodobnie rozwinie się u nich SMA typu 1), które przed ukończeniem 6. miesiąca życia otrzymały onasemnogen abeparwowek. Druga grupa będzie obejmować 20 dzieci, które otrzymają nusinersen w wieku do 36 miesięcy. Badanie to opiera się na hipotezie naukowej Kevina D. Fousta, że onasemnogen abeparwowek, czyli terapia genowa, działa tylko na subpopulację neuronów ruchowych (transdukcja do 60 proc.), a nusinersen może zwiększać stężenie białka SMN w pozostałych, nietransdukowanych neuronach ruchowych, co może przynieść dodatkowe korzyści. Takie są wyniki badań przedklinicznych.
Na konferencji Amerykańskiego Stowarzyszenia Dystrofii Mięśniowych (MDA Clinical and Scientific Conference) w marcu 2021 r. zaprezentowano wyniki badania SPR1NT dotyczące stosowania leku onasemnogen abeparwowek u pacjentów z trzema kopiami SMN2 w okresie przedobjawowym. W najbliższych miesiącach ukaże się też nowa analiza badania NURTURE dla nusinersenu. Jak pani ocenia te badania?
W obydwu byli badani pacjenci w okresie przedobjawowym. W badaniu NURTURE wzięło udział 25 dzieci w wieku między prawie 3 a prawie 5 lat. Jakie były wyniki? 100 proc. z nich siedzi samodzielnie, 96 proc. chodzi bez wsparcia, a 88 proc. chodzi samodzielnie. Jeśli pacjenci mieli trzy kopie genu SMN2, to osiągane przez nich kamienie milowe były takie jak u zdrowych dzieci. Jeśli chodzi o badanie dotyczące pacjentów w okresie przedobjawowym otrzymujących onasemnogen abeparwowek, to większość z nich osiągnęła zdolność samodzielnego siedzenia, a część również samodzielnego chodzenia. Wydaje się, że proces ten przebiega trochę wolniej niż w badaniu NURTURE, ale być może przyczyną jest to, że badanie SPR1NT zaczęło się później i pacjenci mają jeszcze trochę czasu do osiągniecia kamieni milowych rozwoju.
Na tej samej konferencji zaprezentowano wyniki terapii genowej w długookresowym badaniu LTFU studies LT-001 (NCT03421977). Czy zastosowanie terapii łączonej, czyli nusinersenu i terapii genowej, może być potrzebne w przyszłości w SMA?
Na podstawie wyników badania LTFU (Long-Term Follow-Up) wiemy, że 7 z 13 pacjentów, u których zainicjowano terapię genową, poddano następnie leczeniu nusinersenem. To paranoja, że chorzy stosują dwie terapie. Nie wiem, czym to jest spowodowane. My – lekarze nie mamy danych, jak te leki działają razem. Nie wiemy też, co jest lepsze: terapia genowa stosowana samodzielnie, nusinersen stosowany samodzielnie czy może oba te leki stosowane razem. W badaniu tym biorą udział bardzo małe grupy pacjentów, dlatego być może będziemy na ten temat wiedzieć więcej za parę lat. Myślę, że podawanie łącznie terapii genowej i oligonukleotydu antysensownego, czyli nusinersenu, jest warte rozważenia. Nie wiem natomiast, kto miałby za to zapłacić.
Czy zna pani inne opracowania pokazujące skuteczność terapii genowej stosowanej jednocześnie z nusinersenem? Dlaczego w niektórych przypadkach SMA konieczne jest stosowanie obu terapii, aby zapewnić najlepsze efekty?
Jest kilka takich publikacji. Jedną z nich jest praca Kyle’a Kusmika, w której opisano 16 pacjentów (57 proc.) otrzymujących nusinersen mimo podania terapii genowej. Według dostępnych danych z badań klinicznych duża liczba chorych stosuje zarówno onasemnogen abeparwowek, jak i nusinersen. Odsetek ten wynosi od 40 proc. do ponad 60 proc.
Popatrzmy na Polskę. U nas są organizowane zbiórki na terapię genową, ponieważ te leki nie są refundowane i muszą być kupowane z prywatnych środków. Ich cena wynosi 9 mln zł za kurację! Tymczasem wszystkie dzieci, które otrzymały onasemnogen abeparwowek, wcześniej były leczone nusinersenem i po terapii genowej dalej są nim leczone. Czyli jedna kuracja ma potęgować efekt drugiej. Załóżmy, że mamy 10 identycznych pacjentów w grupie leczonej tylko nusinersenem, kolejnych 10 stosujących tylko terapię genową i kolejną grupę 10 chorych, którym podawane są oba leki. My jako lekarze nie wiemy, która z tych grup będzie uzyskiwać najlepsze efekty, ponieważ mamy za mało danych. Być może będzie to ta ostatnia grupa. Jeśli są dane, które pokazują, że terapia genowa plus nusinersen działa super, sama terapia genowa mniej super, a sam nusinersen może trochę lepiej, to wiadomo, że matka bez względu na koszty będzie chciała zapewnić dziecku wszystko, co świat wymyślił. Nie wiem natomiast, czy będzie to mądre, ponieważ ciągle nie mamy danych na temat długoterminowych efektów i niepożądanych skutków stosowania terapii łączonej. Cały czas zadajemy sobie też pytanie, czy nusinersen jest lepszy od terapii genowej.
Dzięki badaniom przesiewowym będzie można zaraz po urodzeniu wychwycić pacjentów z SMA i wdrożyć u nich leczenie. Skoro terapia genowa nie działa u wszystkich chorych, to czy powinni oni mieć możliwość kontynuowania leczenia nusinersenem dostępnym w programie lekowym?
Nie mamy obecnie nic innego poza nusinersenem. Terapia genowa nie jest u nas refundowana i obecnie nie możemy mówić o niej jako o opcji terapeutycznej. Jeśli jednak będzie dostępna, to zadaniem zespołu kwalifikującego do leczenia będzie wybranie najlepszej terapii dla danego pacjenta. Myślę, że największym sukcesem wprowadzenia przesiewu jest to, że możemy się zastanowić, jaki lek podać. Uważam też, że chorzy na SMA w porozumieniu z lekarzem prowadzącym powinni mieć możliwość wyboru najlepszej opcji terapeutycznej. Może to być nusinersen, onasemnogen abeparwowek czy doustny risdiplam, który ma już rejestrację w Europie. Jestem też ogromnie szczęśliwa, że dzięki wprowadzeniu badań przesiewowych będziemy mieli możliwość leczenia pacjentów w okresie przedobjawowym, kiedy efekty są zdecydowanie najlepsze.
-------------------------------------
Bezpieczeństwie i skuteczność trzech leków zarejestrowanych na SMA na podstawie badań klinicznych.
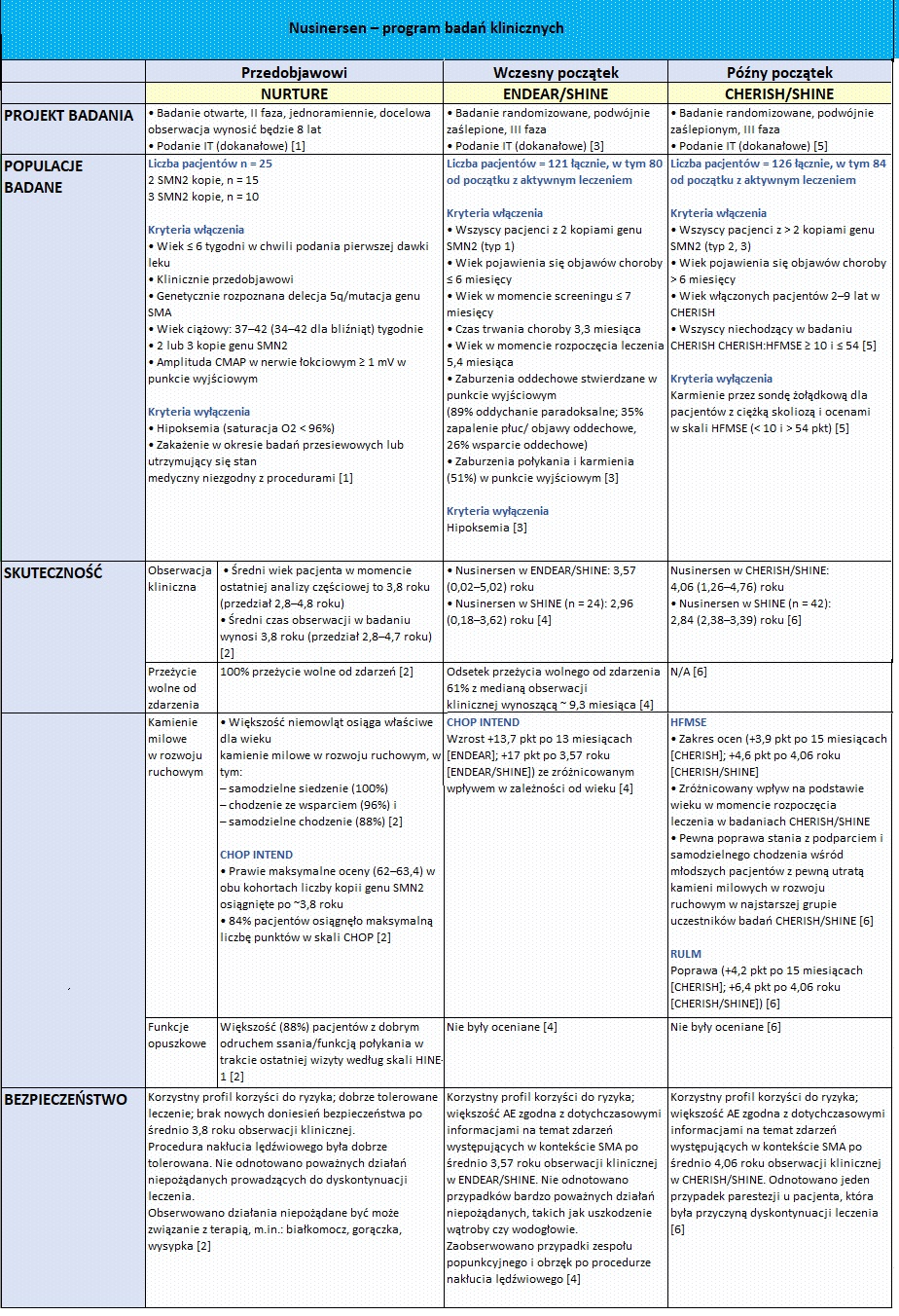
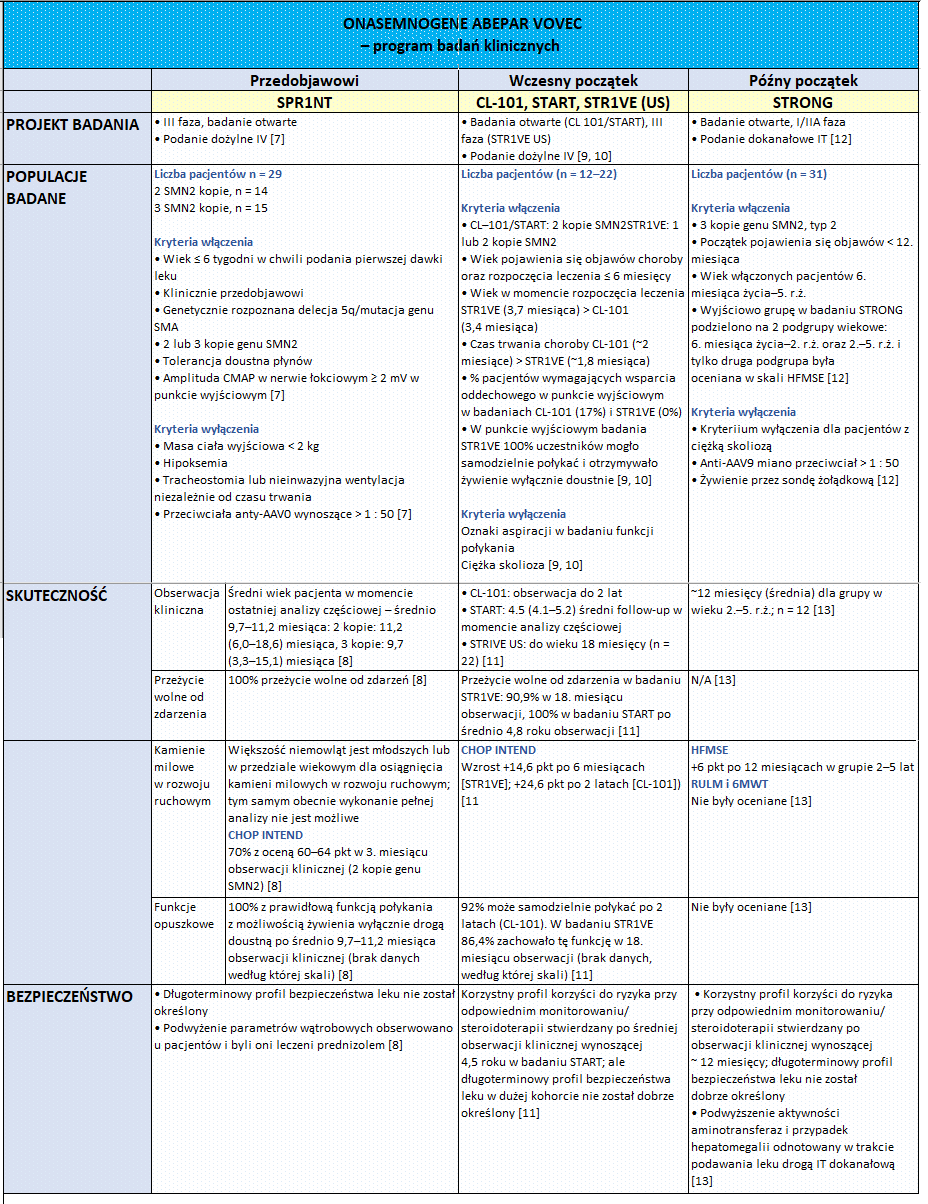
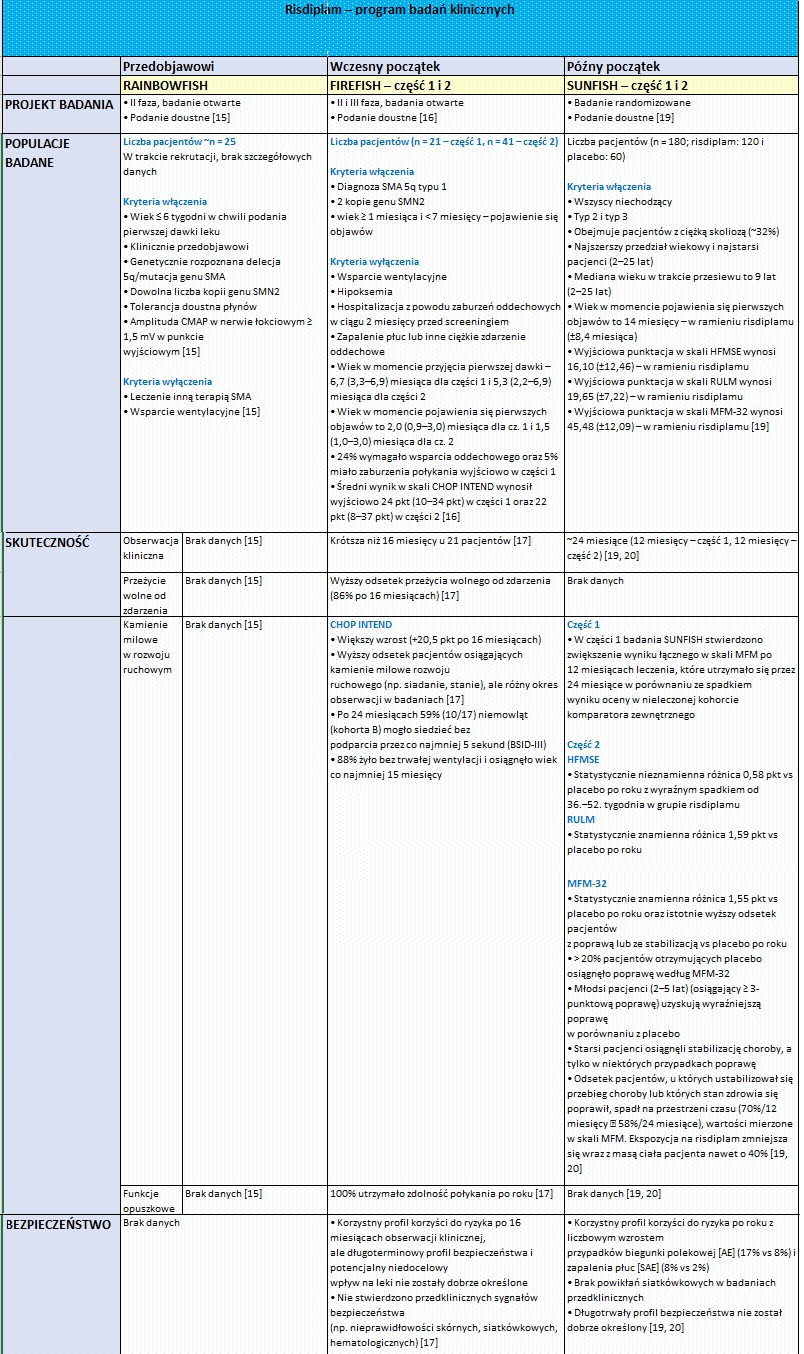
Rdzeniowy zanik mięśni SMA, ang. spinal muscular atrophy) jest ciężką chorobą rzadką, w której dochodzi do nieodwracalnego uszkodzenia neuronów ruchowych, odpowiedzialnych za właściwe funkcjonowanie mięśni szkieletowych. Chorzy mają problemy z poruszaniem się, połykaniem czy oddychaniem. W krańcowym stadium choroby może u nich dojść do inwalidztwa a nawet śmierci. Do niedawna na rdzeniowy zanik mięśni nie było żadnego lekarstwa. Odkąd jednak odkryto, że przyczyną choroby jest niedobór produkcji białka SMN, stopniowo zaczęły pojawiać się kolejne terapie. W ciągu zaledwie 4 ostatnich lat zostały zarejestrowane 3 leki – nusinersen, onasemnogene abeparvovec i risdiplam, z czego jedynie ten pierwszy jest od stycznia 2019 r. refundowany w Polsce. Jak wyglądają najnowsze wyniki badań klinicznych poszczególnych leków u pacjentów przedobjawowych, we wczesnym i późniejszym stadium choroby, na ile terapie te są bezpieczne oraz jakie kamienie milowe osiągnęli stosujący je pacjenci, można się dowiedzieć z poniższego zestawienia.
PIŚMIENNICTWO
1. A Study of Multiple Doses of Nusinersen (ISIS 396443) Delivered to Infants With Genetically Diagnosed and Presymptomatic Spinal Muscular Atrophy (NURTURE). https://clinicaltrials.gov/ct2/show/NCT02386553?term=
nurture+nusinersen&draw=2&rank=1 [access: 1.07.2020].
De Vivo, Bertini E, Swoboda KJ et al. Nusinersen initiated in infants during the presymptomatic stage of spinal muscular atrophy: Interim efficacy and safety results from Phase 2 Nurture study. Neuromuscul Disord. 2019;
29: 842-56.
2. Swoboda KJ, Kirschner J, Finkel RS et al. Nusinersen Effect in Infants Who Initiate Treatment in a Presymptomatic Stage of SMA: NURTURE Results. Presented at Cure SMA 2020. https://curesma2020.biogenscicomm.com/
curesma2020/sma/swoboda [access: 1.07.2020].
3. A Study to Assess the Efficacy and Safety of Nusinersen (ISIS 396443) in Infants With Spinal Muscular Atrophy (ENDEAR). https://clinicaltrials.gov/ct2/show/results/NCT02193074?term=ENDEAR&draw=2&rank=1
[access: 1.07.2020].
Finkel RS, Mercurio E, Darras BT et al. Nusinersen versus Sham Control in Infantile-Onset Spinal Muscular Atrophy. N Engl J Med. 2017; 377: 1723-32.
4. Finkel RS, Mercuri E, Darras BT et al. Nusinersen in Infantile-onset Spinal Muscular Atrophy: Results From Longer-term Treatment From the Open-label SHINE Extension Study. Presented at CureSMA 2020. Doniesienia 2019:
https://aan2019.biogenscicomm.com/AAN2019/Nusinersen/Finkel_P004/index.html [access: 1.07.2020]. Doniesienia 2020: https://curesma2020.biogenscicomm.com/curesma2020/sma/shine [access: 1.07.2020].
5. A Study to Assess the Efficacy and Safety of Nusinersen (ISIS 396443) in Participants With Later-onset Spinal Muscular Atrophy (SMA) (CHERISH). https://clinicaltrials.gov/ct2/show/NCT02292537?term=
cherish&draw=2&rank=2 [access: 1.07.2020]. Mercuri E, Darras BT, Chiriboga CA et at. Nusinersen versus Sham Control in Later-Onset Spinal Muscular Atrophy. N Engl J Med. 2018; 378: 625-35.
6. Chiriboga CA, Darras BT, Farrar MA et al. Longer-term Treatment With Nusinersen: Results in Later-onset Spinal Muscular Atrophy From the SHINE Study. Neurology. 94 (15 suppl). Presented at CureSMA 2020.
Doniesienia 2019: https://aan2019.biogenscicomm.com/AAN2019/Nusinersen/Darras_P063/index.html [access: 1.07.2020]. Doniesienia 2020: https://curesma2020.biogenscicomm.com/curesma2020/sma/shine
[access: 1.07.2020].
7. Pre-Symptomatic Study of Intravenous Onasemnogene Abeparvovec-xioi in Spinal Muscular Atrophy (SMA) for Patients With Multiple Copies of SMN2 (SPR1NT). https://clinicaltrials.gov/ct2/show/NCT03505099?term=
onasemnogene+abeparvovec&draw=2&rank=2 [access: 1.07.2020].
8. Strauss K, Farrar M, Swoboda K et al. Onasemnogene Abeparvovec-xioi Gene Therapy in Presymptomatic Spinal Muscular Atrophy: SPR1NT Study Update. Presented at MDA 2020. https://gateway.on24.com/wcc/
eh/2249690/lp/2335269/strauss_onasemnogene-abeparvovec-xioi-gene-therapy-in-presymptomatic-spinal-muscular-atrophy%3A-spr1nt-study-update [access: 1.07.2020].
9. Long-Term Follow-up Study for Patients From AVXS-101-CL-101 (START). https://clinicaltrials.gov/ct2/show/record/NCT03421977?term=CL+101&draw=2&rank=2 [access: 1.07.2020].
10. Gene Replacement Therapy Clinical Trial for Patients With Spinal Muscular Atrophy Type 1 (STR1VE). https://clinicaltrials.gov/ct2/show/NCT03306277?tem=STR1VE&draw=2&rank=1 [access: 1.07.2020].
11. Day J et al. Onasemnogene Abeparvovec Gene Therapy for Spinal Muscular Atrophy Type 1: Completed Phase 3 US Study (STR1VE) Efficacy and Safety. Presented at MDA 2020; Day et al. Presented at MDA 2020; Muntoni F
et al. Presented at EAN 2019. https://gateway.on24.com/wcc/eh/2249690/lp/2335297/day_onasemnogene-abeparvovec-gene-therapy-for-spinal-muscular-atrophy-type-1%3A-copleed-phase-3-us-study-%28str1ve%29
-efficacy-and-safety [access: 1.07.2020].
12. Study of Intrathecal Administration of Onasemnogene Abeparvovec-xioi for Spinal Muscular Atrophy (STRONG). https://clinicaltrials.gov/ct2/show/NCT03381729?term=onasemnogene+abeparvovec&draw=2&rank=4
[access: 1.07.2020].
13. Finkel RS, Day J, Darras BT et al. One-Time Intrathecal (IT) Administration of AVXS-101 IT Gene Therapy for Spinal Muscular Atrophy: Phase 1 Study (STRONG) Interim Data. Presented at MDA 2020. https://gateway.on24.
com/wcc/eh/2249690/lp/2349668/finkel_one-time-intrathecal-%28it%29-administration-of-avxs-101-it-gene-therapy-for-spinal-muscular-atro phy%3A-phase-1-study-%28strong%29 [access: 1.07.2020].
14. https://smanewstoday.com/2019/10/30/fda-places-partial-hold-on-avxs-101-strong-trial [access: 1.07.2020].
https://www.ema.europa.eu/en/medicines/human/EPAR/zolgensma [access: 1.07.2020].
https://www.ema.europa.eu/en/medicines/human/EPAR/spinraza [access: 1.07.2020].
https://www.novartis.com/news/media-releases/avexis-receives-ec-approval-and activates-%22day-one%22-access-program-zolgensma-only-gene-therapy-spinal-muscular-atrophy-sma [access: 1.07.2020].
https://index.mirasmart.com/AAN2020/PDFfiles/AAN2020-002384.html [access: 1.07.2020].
https://www.novartis.com/sites/www.novartis.com/files/2019-05-novartis-avexis-aan presentation.pdf [access: 1.07.2020].
https://investors.avexis.com/news-releases/news-release-details/zolgensma-data-shows-rapid-significant-clinically-meaningful-benefit-in-SMA [access: 1.07.2020].
https://ec.europa.eu/health/documents/community-register/html/h1443.htm [access: 1.07.2020].
15. A Study of Risdiplam in Infants With Genetically Diagnosed and Presymptomatic Spinal Muscular Atrophy (Rainbowfish). https://clinicaltrials.gov/ct2/show/NCT03779334 [access: 1.03.2021].
16. Investigate Safety, Tolerability, PK, PD and Efficacy of Risdiplam (RO7034067) in Infants With Type1 Spinal Muscular Atrophy (FIREFISH). https://www.clinicaltrials.gov/ct2/show/NCT02913482 [access: 1.03.2021].
17. Doniesienia kongresowe: AAN 2020. https://www.roche.com/investors/agenda/roches-audio-webcast-replay-on-new-aan-2020-data.htm [access: 1.03.2021].
18. A Study to Investigate the Safety, Tolerability, Pharmacokinetics, Pharmacodynamics and Efficacy of Risdiplam (RO7034067) in Type 2 and 3 Spinal Muscular Atrophy (SMA) Participants (SUNFISH). https://www.clinicaltrials.
gov/ct2/show/NCT02908685 [access: 1.03.2021].
19. https://medically.roche.com/en/search/pdfviewer.8dce839c-a6fb-42f9-9226-b0ec55c59a5d.html [access: 1.03.2021].
20. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2020/213535Orig1s000TOC.cfm.
Program EAP był prowadzony w trzech ośrodkach – w Centrum Zdrowia Dziecka w Warszawie, Górnośląskim Centrum Zdrowia Dziecka w Katowicach i w Klinice Neurologii Rozwojowej UCK Gdańskiego Uniwersytetu Medycznego. Był skierowany do niewielkiej grupy chorych, zanim jeszcze w Polsce został wprowadzony program lekowy. Pacjenci włączani do EAP byli w relatywnie ciężkim stanie, z bardzo słabymi wyjściowo wynikami. Wszyscy odnieśli korzyść z leczenia, u wszystkich nastąpiła poprawa, nie były to jednak tak spektakularne efekty jak u pacjentów, którzy są włączani do leczenia w okresie przedobjawowym albo z lekkimi objawami choroby. W działającym obecnie programie lekowym nusinersenem jest leczonych ok. 700 pacjentów i u wielu z nich obserwujemy spektakularne efekty terapeutyczne.
Ostatnio rozpoczęto dwuletnie badanie kliniczne IV fazy RESPOND, które ma na celu ocenę skuteczności i bezpieczeństwa stosowania nusinersenu u pacjentów z suboptymalną odpowiedzią na lek onasemnogen abeparwowek (Zolgensma). Dlaczego zaplanowano takie badanie?
Prawdopodobnie przyczyną był brak oczekiwanego efektu terapii genowej u niektórych pacjentów. Nie uzyskali oni takiej poprawy w skalach motorycznych po podaniu terapii genowej, aby nie było u nich konieczne ewentualne wspomaganie oddychania czy żywienia. W badaniu RESPOND mają wziąć udział dwie grupy pacjentów. W pierwszej znajdzie się 40 dzieci w wieku do 9 miesięcy z dwoma kopiami genu SMN2 (prawdopodobnie rozwinie się u nich SMA typu 1), które przed ukończeniem 6. miesiąca życia otrzymały onasemnogen abeparwowek. Druga grupa będzie obejmować 20 dzieci, które otrzymają nusinersen w wieku do 36 miesięcy. Badanie to opiera się na hipotezie naukowej Kevina D. Fousta, że onasemnogen abeparwowek, czyli terapia genowa, działa tylko na subpopulację neuronów ruchowych (transdukcja do 60 proc.), a nusinersen może zwiększać stężenie białka SMN w pozostałych, nietransdukowanych neuronach ruchowych, co może przynieść dodatkowe korzyści. Takie są wyniki badań przedklinicznych.
Na konferencji Amerykańskiego Stowarzyszenia Dystrofii Mięśniowych (MDA Clinical and Scientific Conference) w marcu 2021 r. zaprezentowano wyniki badania SPR1NT dotyczące stosowania leku onasemnogen abeparwowek u pacjentów z trzema kopiami SMN2 w okresie przedobjawowym. W najbliższych miesiącach ukaże się też nowa analiza badania NURTURE dla nusinersenu. Jak pani ocenia te badania?
W obydwu byli badani pacjenci w okresie przedobjawowym. W badaniu NURTURE wzięło udział 25 dzieci w wieku między prawie 3 a prawie 5 lat. Jakie były wyniki? 100 proc. z nich siedzi samodzielnie, 96 proc. chodzi bez wsparcia, a 88 proc. chodzi samodzielnie. Jeśli pacjenci mieli trzy kopie genu SMN2, to osiągane przez nich kamienie milowe były takie jak u zdrowych dzieci. Jeśli chodzi o badanie dotyczące pacjentów w okresie przedobjawowym otrzymujących onasemnogen abeparwowek, to większość z nich osiągnęła zdolność samodzielnego siedzenia, a część również samodzielnego chodzenia. Wydaje się, że proces ten przebiega trochę wolniej niż w badaniu NURTURE, ale być może przyczyną jest to, że badanie SPR1NT zaczęło się później i pacjenci mają jeszcze trochę czasu do osiągniecia kamieni milowych rozwoju.
Na tej samej konferencji zaprezentowano wyniki terapii genowej w długookresowym badaniu LTFU studies LT-001 (NCT03421977). Czy zastosowanie terapii łączonej, czyli nusinersenu i terapii genowej, może być potrzebne w przyszłości w SMA?
Na podstawie wyników badania LTFU (Long-Term Follow-Up) wiemy, że 7 z 13 pacjentów, u których zainicjowano terapię genową, poddano następnie leczeniu nusinersenem. To paranoja, że chorzy stosują dwie terapie. Nie wiem, czym to jest spowodowane. My – lekarze nie mamy danych, jak te leki działają razem. Nie wiemy też, co jest lepsze: terapia genowa stosowana samodzielnie, nusinersen stosowany samodzielnie czy może oba te leki stosowane razem. W badaniu tym biorą udział bardzo małe grupy pacjentów, dlatego być może będziemy na ten temat wiedzieć więcej za parę lat. Myślę, że podawanie łącznie terapii genowej i oligonukleotydu antysensownego, czyli nusinersenu, jest warte rozważenia. Nie wiem natomiast, kto miałby za to zapłacić.
Czy zna pani inne opracowania pokazujące skuteczność terapii genowej stosowanej jednocześnie z nusinersenem? Dlaczego w niektórych przypadkach SMA konieczne jest stosowanie obu terapii, aby zapewnić najlepsze efekty?
Jest kilka takich publikacji. Jedną z nich jest praca Kyle’a Kusmika, w której opisano 16 pacjentów (57 proc.) otrzymujących nusinersen mimo podania terapii genowej. Według dostępnych danych z badań klinicznych duża liczba chorych stosuje zarówno onasemnogen abeparwowek, jak i nusinersen. Odsetek ten wynosi od 40 proc. do ponad 60 proc.
Popatrzmy na Polskę. U nas są organizowane zbiórki na terapię genową, ponieważ te leki nie są refundowane i muszą być kupowane z prywatnych środków. Ich cena wynosi 9 mln zł za kurację! Tymczasem wszystkie dzieci, które otrzymały onasemnogen abeparwowek, wcześniej były leczone nusinersenem i po terapii genowej dalej są nim leczone. Czyli jedna kuracja ma potęgować efekt drugiej. Załóżmy, że mamy 10 identycznych pacjentów w grupie leczonej tylko nusinersenem, kolejnych 10 stosujących tylko terapię genową i kolejną grupę 10 chorych, którym podawane są oba leki. My jako lekarze nie wiemy, która z tych grup będzie uzyskiwać najlepsze efekty, ponieważ mamy za mało danych. Być może będzie to ta ostatnia grupa. Jeśli są dane, które pokazują, że terapia genowa plus nusinersen działa super, sama terapia genowa mniej super, a sam nusinersen może trochę lepiej, to wiadomo, że matka bez względu na koszty będzie chciała zapewnić dziecku wszystko, co świat wymyślił. Nie wiem natomiast, czy będzie to mądre, ponieważ ciągle nie mamy danych na temat długoterminowych efektów i niepożądanych skutków stosowania terapii łączonej. Cały czas zadajemy sobie też pytanie, czy nusinersen jest lepszy od terapii genowej.
Dzięki badaniom przesiewowym będzie można zaraz po urodzeniu wychwycić pacjentów z SMA i wdrożyć u nich leczenie. Skoro terapia genowa nie działa u wszystkich chorych, to czy powinni oni mieć możliwość kontynuowania leczenia nusinersenem dostępnym w programie lekowym?
Nie mamy obecnie nic innego poza nusinersenem. Terapia genowa nie jest u nas refundowana i obecnie nie możemy mówić o niej jako o opcji terapeutycznej. Jeśli jednak będzie dostępna, to zadaniem zespołu kwalifikującego do leczenia będzie wybranie najlepszej terapii dla danego pacjenta. Myślę, że największym sukcesem wprowadzenia przesiewu jest to, że możemy się zastanowić, jaki lek podać. Uważam też, że chorzy na SMA w porozumieniu z lekarzem prowadzącym powinni mieć możliwość wyboru najlepszej opcji terapeutycznej. Może to być nusinersen, onasemnogen abeparwowek czy doustny risdiplam, który ma już rejestrację w Europie. Jestem też ogromnie szczęśliwa, że dzięki wprowadzeniu badań przesiewowych będziemy mieli możliwość leczenia pacjentów w okresie przedobjawowym, kiedy efekty są zdecydowanie najlepsze.
-------------------------------------
Bezpieczeństwie i skuteczność trzech leków zarejestrowanych na SMA na podstawie badań klinicznych.
Rdzeniowy zanik mięśni SMA, ang. spinal muscular atrophy) jest ciężką chorobą rzadką, w której dochodzi do nieodwracalnego uszkodzenia neuronów ruchowych, odpowiedzialnych za właściwe funkcjonowanie mięśni szkieletowych. Chorzy mają problemy z poruszaniem się, połykaniem czy oddychaniem. W krańcowym stadium choroby może u nich dojść do inwalidztwa a nawet śmierci. Do niedawna na rdzeniowy zanik mięśni nie było żadnego lekarstwa. Odkąd jednak odkryto, że przyczyną choroby jest niedobór produkcji białka SMN, stopniowo zaczęły pojawiać się kolejne terapie. W ciągu zaledwie 4 ostatnich lat zostały zarejestrowane 3 leki – nusinersen, onasemnogene abeparvovec i risdiplam, z czego jedynie ten pierwszy jest od stycznia 2019 r. refundowany w Polsce. Jak wyglądają najnowsze wyniki badań klinicznych poszczególnych leków u pacjentów przedobjawowych, we wczesnym i późniejszym stadium choroby, na ile terapie te są bezpieczne oraz jakie kamienie milowe osiągnęli stosujący je pacjenci, można się dowiedzieć z poniższego zestawienia.



PIŚMIENNICTWO
1. A Study of Multiple Doses of Nusinersen (ISIS 396443) Delivered to Infants With Genetically Diagnosed and Presymptomatic Spinal Muscular Atrophy (NURTURE). https://clinicaltrials.gov/ct2/show/NCT02386553?term=
nurture+nusinersen&draw=2&rank=1 [access: 1.07.2020].
De Vivo, Bertini E, Swoboda KJ et al. Nusinersen initiated in infants during the presymptomatic stage of spinal muscular atrophy: Interim efficacy and safety results from Phase 2 Nurture study. Neuromuscul Disord. 2019;
29: 842-56.
2. Swoboda KJ, Kirschner J, Finkel RS et al. Nusinersen Effect in Infants Who Initiate Treatment in a Presymptomatic Stage of SMA: NURTURE Results. Presented at Cure SMA 2020. https://curesma2020.biogenscicomm.com/
curesma2020/sma/swoboda [access: 1.07.2020].
3. A Study to Assess the Efficacy and Safety of Nusinersen (ISIS 396443) in Infants With Spinal Muscular Atrophy (ENDEAR). https://clinicaltrials.gov/ct2/show/results/NCT02193074?term=ENDEAR&draw=2&rank=1
[access: 1.07.2020].
Finkel RS, Mercurio E, Darras BT et al. Nusinersen versus Sham Control in Infantile-Onset Spinal Muscular Atrophy. N Engl J Med. 2017; 377: 1723-32.
4. Finkel RS, Mercuri E, Darras BT et al. Nusinersen in Infantile-onset Spinal Muscular Atrophy: Results From Longer-term Treatment From the Open-label SHINE Extension Study. Presented at CureSMA 2020. Doniesienia 2019:
https://aan2019.biogenscicomm.com/AAN2019/Nusinersen/Finkel_P004/index.html [access: 1.07.2020]. Doniesienia 2020: https://curesma2020.biogenscicomm.com/curesma2020/sma/shine [access: 1.07.2020].
5. A Study to Assess the Efficacy and Safety of Nusinersen (ISIS 396443) in Participants With Later-onset Spinal Muscular Atrophy (SMA) (CHERISH). https://clinicaltrials.gov/ct2/show/NCT02292537?term=
cherish&draw=2&rank=2 [access: 1.07.2020]. Mercuri E, Darras BT, Chiriboga CA et at. Nusinersen versus Sham Control in Later-Onset Spinal Muscular Atrophy. N Engl J Med. 2018; 378: 625-35.
6. Chiriboga CA, Darras BT, Farrar MA et al. Longer-term Treatment With Nusinersen: Results in Later-onset Spinal Muscular Atrophy From the SHINE Study. Neurology. 94 (15 suppl). Presented at CureSMA 2020.
Doniesienia 2019: https://aan2019.biogenscicomm.com/AAN2019/Nusinersen/Darras_P063/index.html [access: 1.07.2020]. Doniesienia 2020: https://curesma2020.biogenscicomm.com/curesma2020/sma/shine
[access: 1.07.2020].
7. Pre-Symptomatic Study of Intravenous Onasemnogene Abeparvovec-xioi in Spinal Muscular Atrophy (SMA) for Patients With Multiple Copies of SMN2 (SPR1NT). https://clinicaltrials.gov/ct2/show/NCT03505099?term=
onasemnogene+abeparvovec&draw=2&rank=2 [access: 1.07.2020].
8. Strauss K, Farrar M, Swoboda K et al. Onasemnogene Abeparvovec-xioi Gene Therapy in Presymptomatic Spinal Muscular Atrophy: SPR1NT Study Update. Presented at MDA 2020. https://gateway.on24.com/wcc/
eh/2249690/lp/2335269/strauss_onasemnogene-abeparvovec-xioi-gene-therapy-in-presymptomatic-spinal-muscular-atrophy%3A-spr1nt-study-update [access: 1.07.2020].
9. Long-Term Follow-up Study for Patients From AVXS-101-CL-101 (START). https://clinicaltrials.gov/ct2/show/record/NCT03421977?term=CL+101&draw=2&rank=2 [access: 1.07.2020].
10. Gene Replacement Therapy Clinical Trial for Patients With Spinal Muscular Atrophy Type 1 (STR1VE). https://clinicaltrials.gov/ct2/show/NCT03306277?tem=STR1VE&draw=2&rank=1 [access: 1.07.2020].
11. Day J et al. Onasemnogene Abeparvovec Gene Therapy for Spinal Muscular Atrophy Type 1: Completed Phase 3 US Study (STR1VE) Efficacy and Safety. Presented at MDA 2020; Day et al. Presented at MDA 2020; Muntoni F
et al. Presented at EAN 2019. https://gateway.on24.com/wcc/eh/2249690/lp/2335297/day_onasemnogene-abeparvovec-gene-therapy-for-spinal-muscular-atrophy-type-1%3A-copleed-phase-3-us-study-%28str1ve%29
-efficacy-and-safety [access: 1.07.2020].
12. Study of Intrathecal Administration of Onasemnogene Abeparvovec-xioi for Spinal Muscular Atrophy (STRONG). https://clinicaltrials.gov/ct2/show/NCT03381729?term=onasemnogene+abeparvovec&draw=2&rank=4
[access: 1.07.2020].
13. Finkel RS, Day J, Darras BT et al. One-Time Intrathecal (IT) Administration of AVXS-101 IT Gene Therapy for Spinal Muscular Atrophy: Phase 1 Study (STRONG) Interim Data. Presented at MDA 2020. https://gateway.on24.
com/wcc/eh/2249690/lp/2349668/finkel_one-time-intrathecal-%28it%29-administration-of-avxs-101-it-gene-therapy-for-spinal-muscular-atro phy%3A-phase-1-study-%28strong%29 [access: 1.07.2020].
14. https://smanewstoday.com/2019/10/30/fda-places-partial-hold-on-avxs-101-strong-trial [access: 1.07.2020].
https://www.ema.europa.eu/en/medicines/human/EPAR/zolgensma [access: 1.07.2020].
https://www.ema.europa.eu/en/medicines/human/EPAR/spinraza [access: 1.07.2020].
https://www.novartis.com/news/media-releases/avexis-receives-ec-approval-and activates-%22day-one%22-access-program-zolgensma-only-gene-therapy-spinal-muscular-atrophy-sma [access: 1.07.2020].
https://index.mirasmart.com/AAN2020/PDFfiles/AAN2020-002384.html [access: 1.07.2020].
https://www.novartis.com/sites/www.novartis.com/files/2019-05-novartis-avexis-aan presentation.pdf [access: 1.07.2020].
https://investors.avexis.com/news-releases/news-release-details/zolgensma-data-shows-rapid-significant-clinically-meaningful-benefit-in-SMA [access: 1.07.2020].
https://ec.europa.eu/health/documents/community-register/html/h1443.htm [access: 1.07.2020].
15. A Study of Risdiplam in Infants With Genetically Diagnosed and Presymptomatic Spinal Muscular Atrophy (Rainbowfish). https://clinicaltrials.gov/ct2/show/NCT03779334 [access: 1.03.2021].
16. Investigate Safety, Tolerability, PK, PD and Efficacy of Risdiplam (RO7034067) in Infants With Type1 Spinal Muscular Atrophy (FIREFISH). https://www.clinicaltrials.gov/ct2/show/NCT02913482 [access: 1.03.2021].
17. Doniesienia kongresowe: AAN 2020. https://www.roche.com/investors/agenda/roches-audio-webcast-replay-on-new-aan-2020-data.htm [access: 1.03.2021].
18. A Study to Investigate the Safety, Tolerability, Pharmacokinetics, Pharmacodynamics and Efficacy of Risdiplam (RO7034067) in Type 2 and 3 Spinal Muscular Atrophy (SMA) Participants (SUNFISH). https://www.clinicaltrials.
gov/ct2/show/NCT02908685 [access: 1.03.2021].
19. https://medically.roche.com/en/search/pdfviewer.8dce839c-a6fb-42f9-9226-b0ec55c59a5d.html [access: 1.03.2021].
20. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2020/213535Orig1s000TOC.cfm.