Polipragmazja – problem terapeutyczny u pacjentów objętych opieką paliatywną i geriatryczną

Wielolekowość jest problemem powszechnym i narastającym u osób starszych korzystających z opieki geriatrycznej i paliatywnej – publikujemy badania poświęcone związkowi polipragmazji ze schorzeniami charakterystycznymi dla tej grupy wiekowej.
Artykuł Wiktora Czarkowskiego, Sophie Bisch, Katarzyny Mleczko, Piotra Dziadkiewicza, Dominiki Kmity, Michała Wójcika – studentów szóstego roku kierunku lekarskiego na Wydziale Nauk Medycznych, Śląski Uniwersytet Medyczny w Katowicach – oraz Marcina Janeckiego z Zakładu Medycyny i Opieki Paliatywnej Katedry Pielęgniarstwa Śląskiego Uniwersytetu Medyczny w Katowicach:
– W ostatnich 30 latach znacznie zwiększa się nie tylko odsetek, ale również liczba obywateli będących w wieku co najmniej 65 lat. Polscy lekarze coraz częściej mają kontakt ze starszymi pacjentami, którzy stanowią ok. 85 proc. podopiecznych ośrodków paliatywnych1. Prognozy Głównego Urzędu Statystycznego przewidują w tym względzie trwałą tendencję wzrostową2.
Istotne jest więc rozpowszechnianie wiedzy na temat chorób oraz problemów terapeutycznych, które są charakterystyczne dla tej grupy pacjentów.
Definicja polipragmazji i wielolekowści
Jednym z istotnych problemów dotykających starszych pacjentów jest wielolekowość (ang. polypharmacy), czyli przyjmowanie przez pacjenta wielu leków jednocześnie. Przy czym „wielość” najczęściej definiuje się jako zażywanie co najmniej pięciu leków dziennie3. Światowa Organizacja Zdrowia (World Health Organization, WHO) w 2019 r. przyjęła podział wielolekowości na stosowną (ang. appropriate polypharmacy) oraz nieodpowiednią (ang. inappropriate polypharmacy), kiedy co najmniej jeden lek jest przyjmowany niewłaściwie4.
W polskiej literaturze medycznej termin polypharmacy jest tłumaczony zamiennie jako wielolekowość5 lub polipragmazja6, podczas gdy wielolekowość oznacza przyjmowanie przez pacjenta pięciu lub więcej leków5, a polipragmazja to stosowanie zbyt wielu leków lub nieprawidłowe zastosowanie jednego bądź więcej leków6. Oba terminy jednak zwracają uwagę na szkodliwy wpływ nadmiernego reżimu lekowego.
Obecnie starsi pacjenci przyjmują coraz więcej leków7. Analizy przeprowadzone w różnych krajach wykazały, iż narażenie na wielolekowość wzrasta wraz z wiekiem oraz ilością chorób współistniejących8–10. Grupę szczególnie narażoną na polipragmazję stanowią pacjenci leczeni onkologicznie oraz korzystający z opieki paliatywnej11, 12.
Wielolekowość wiąże się z występowaniem licznych powikłań, dlatego przy doborze terapii zawsze należy ocenić bilans oczekiwanych korzyści oraz przewidywanego ryzyka.
Funkcja wydalnicza nerek
Wśród pacjentów powyżej 65 r.ż. ocena funkcji nerek jest wyzwaniem. Przed interpretacją wyników badań laboratoryjnych należy przede wszystkim uwzględnić związane z wiekiem obniżenie współczynnika filtracji kłębuszkowej (eGFR). Do czwartej dekady życia wartości eGFR utrzymują się w okolicy 140 ml/min/1.73 m2 , następnie dochodzi do stopniowego obniżania filtracji kłębuszkowej o około 8 ml/ min/1.73 m2 na każde dziesięć lat13. Kolejnym utrudnieniem w prawidłowej interpretacji czynności nerek jest częste niedożywienie, występowanie stanu zapalnego oraz licznych schorzeń u osób powyżej 65 r.ż.14. Wraz ze zmniejszeniem filtracji kłębuszkowej zwiększa się podatność nerek na uszkodzenia związane ze stosowaniem leków zarówno nefrotoksycznych, jak i leków, które przy prawidłowej czynności nerek nie stanowią zagrożenia. Wśród często stosowanych leków o udokumentowanym niekorzystnym wpływie na funkcję wydalniczą nerek znajdują się m.in. niesteroidowe leki przeciwzapalne (NLPZ), leki układu sercowo-naczyniowego, antybiotyki, leki psychotropowe, leki przeciwwirusowe czy inhibitory pompy protonowej15–20. Stosowanie na co dzień wielu leków przez osoby powyżej 65 r.ż. jest w obecnych czasach powszechnym zjawiskiem. Uwzględniając znaczny udział wyżej wymienionych preparatów w codziennej terapii schorzeń dotykających osoby starsze, należy rozważyć możliwy związek pomiędzy polipragmazją a przyspieszoną utratą prawidłowej funkcji wydalniczej nerek.
W prospektywnym badaniu obserwacyjnym z 2019 r. udowodniono bezpośredni związek między liczbą przyjmowanych leków a zwiększonym tempem obniżania wskaźnika filtracji kłębuszkowej w ciągu 24 miesięcy trwania badania21.
Badanie kliniczno-kontrolne z 2019 r. wykazało zależność pomiędzy występowaniem polipragmazji a upośledzeniem funkcji wydalniczej nerek. Wśród pacjentów badanej grupy liczbę przyjmowanych leków podzielono na polipragmazję (5–9 leków) oraz nadmierną polipragmazję (≥ 10 leków). Wyniki badania pokazały częstsze występowanie obu zjawisk wśród pacjentów grupy badanej w porównaniu z grupą kontrolną22.
W badaniu panelowym z 2017 r. podczas wieloetapowej analizy statystycznej wyników badań zaobserwowano, iż przyjmowanie większej liczby leków (6,8 ± 3,1) jest niezależnym czynnikiem ryzyka dla obniżenia wartości wskaźnika filtracji kłębuszkowej eGFR o > 3 ml/min/1h.73 m2 na r. (OR ≈ 1.2)23.
Wymienione badania wskazują na bezpośredni związek polipragmazji u osób starszych z ryzykiem upośledzenia funkcji wydalniczej nerek. Przeprowadzenie dodatkowych badań potwierdzających to powiązanie może okazać się pomocne w opisaniu wytycznych i sprecyzowaniu działań, jakie należy podjąć, aby zminimalizować ryzyko postępujących uszkodzeń nerek u pacjentów z grupy ryzyka.
Upadki i złamania
Upadki wśród osób starszych są powszechnym i wciąż narastającym problemem, niejednokrotnie prowadzącym do poważnych obrażeń i powikłań. W literaturze najczęściej wymienia się złamania stawu biodrowego oraz urazy wewnątrzczaszkowe24. Szacuje się, że wśród osób po 70 r.ż. rocznie upada jedna trzecia mieszkających we własnych domach i 60 proc. przebywających w domach opieki społecznej25. Do czynników indukujących upadki należy zaliczyć wiek, występowanie chorób przewlekłych, wpływ środowiska oraz problemy geriatryczne, takie jak zespół kruchości czy polipragmazję24.
Szwedzka Narodowa Rada Zdrowia i Opieki Społecznej opublikowała listę leków zwiększających ryzyko upadków (fall risk increasing drugs, FRIDS), na której znajdują się opioidy, leki antypsychotyczne, przeciwlękowe, uspokajające oraz antydepresyjne. Są na niej również leki powodujące hipotensję ortostatyczną, do których należą preparaty rozszerzające naczynia, diuretyki, β-blokery, blokery kanału wapniowego, inhibitory szlaku renina-angiotensyna, leki α-adrenolityczne i agoniści receptora dopaminergicznego. Wśród pacjentów powyżej 80 r.ż., którzy doznali złamania stawu biodrowego, odsetek ponownych upadków wynosił 40 proc. w przypadku leczonych preparatami FRIDS i 20 proc. pośród tych, którym nie zapisywano leków z powyższej listy26.
Obserwuje się wzrastające ryzyko złamań stawu biodrowego proporcjonalnie do wieku, płci i ilości zażywanych leków. W grupie pacjentów powyżej 85 r.ż. zanotowano istotny wzrost incydentów złamań stawu biodrowego wśród osób zażywających dziesięć lub więcej leków na dzień względem pacjentów z pięcioma zalecanymi preparatami w ciągu dnia. Potwierdzono także wzrost ryzyka upadku wśród kobiet27.
Pisząc o upadkach i złamaniach, należy uwzględnić wskaźnik, jakim jest gęstość mineralna kości (bone mineral density, BMD). Opracowano zestawienie leków związanych z ryzykiem kostnym (bone related medication, BRM), w którym wymieniono preparaty przeciwdrgawkowe, glikokortykosteroidy, inhibitory receptora H2, inhibitory pompy protonowej i tiazolidynodiony. Dowiedziono, że liczba pacjentów zażywających przynajmniej jeden lek z listy BRM rośnie znacząco wraz ze zwiększającym się BMI i spadkiem BMD wskazującym na osteopenię lub osteoporozę. Częstość występowania polipragmazji, definiowanej w przytoczonym badaniu jako zażywanie ogółem minimum 5 leków, była istotnie wyższa u pacjentów z osteoporozą w porównaniu z pacjentami z osteopenią lub prawidłowym BMD28.
Ze wzrostem ryzyka upadków w większym stopniu związane jest zjawisko polipragmazji niż liczba współistniejących chorób. W tym miejscu warto przytoczyć mechanizm interakcji lek-lek (drug-drug interaction, DDI). Wykazano, że dołączenie do terapii benzodiazepinami leków wchodzących z nimi w interakcje ponad dwukrotnie zwiększyło ryzyko upadku. Ponadto niektóre środki chemioterapeutyczne, takie jak pochodne platyny, alkaloidy barwinka różyczkowego i taksany, mogą być neurotoksyczne i prowadzić do neuropatii obwodowej, indukującej problemy z równowagą i chodem. Jest to związane z dwu- do trzykrotnie zwiększonym ryzykiem upadku u osób starszych29. Opisane ryzyko istotnie zwiększa także podwojenie dawki chemioterapii neurotoksycznej29.
Występująca zależność między ryzykiem upadków i złamań stawu biodrowego oraz liczbą zażywanych leków wymaga uważności lekarza prowadzącego. W eliminacji opisanego problemu pomocne są listy leków FRIDS i BRM, których znajomość wśród lekarzy zdaje się kluczowa. Wybierając właściwe leczenie, należy także uwzględnić wiek, płeć i BMI pacjenta.
Powikłania krwotoczne oraz zakrzepowe
W praktyce lekarskiej szczególne miejsce zajmują choroby układu sercowo-naczyniowego. W terapii tej grupy schorzeń powszechnie wykorzystywane są leki przeciwpłytkowe oraz antykoagulanty, których stosowanie zwiększa ryzyko powikłań krwotocznych30, 31. W dobrze prowadzonej terapii jest ono odpowiednio mniejsze od korzyści, jakie pacjent odnosi w wyniku leczenia.
Prowadzenie terapii antykoagulacyjnej jest szczególnie trudne u pacjentów ≥ 65 r. ż., ponieważ wraz z wiekiem rośnie zarówno ryzyko prozakrzepowe, jak i krwotoczne32, 33. Zostało to uwzględnione podczas tworzenia skal oceniających ryzyko prozakrzepowe (skala CHA2DS2-VASc), ryzyko powikłań krwotocznych (skale OBRI, HAS-BLED), jak i wzorów do szacowania ryzyka krwawienia34–37. Niektóre z tych skal uwzględniają również przyjmowanie innych leków jako czynnik zwiększający ryzyko krwawienia. Wynika to z rosnącego prawdopodobieństwa interakcji międzylekowych wraz ze wzrostem liczby przyjmowanych preparatów, które mogą zaburzać farmakokinetykę leku antykoagulacyjnego38.
Wyniki badań porównujących skuteczność antagonistów witaminy K vs. NOAC (ang. non-vitamin K antagonist oral anticoagulant) w terapii antykoagulacyjnej oraz wpływ polipragmazji na jej efekt zgodnie wskazują, że NOAC są lekami bezpieczniejszymi i skuteczniejszymi39, 40. Może to wynikać z faktu, że NOAC cechuje większa szerokość okna terapeutycznego41. W obu przypadkach jednak wraz ze wzrostem liczby równocześnie przyjmowanych leków rośnie ryzyko wystąpienia powikłań krwotocznych oraz zakrzepowo-zatorowych39, 40.
Należy zauważyć, że z powodu obaw przed wystąpieniem powikłań krwotocznych wielu starszych pacjentów nie ma wdrożonej odpowiedniej terapii antykoagulacyjnej42. Może również dochodzić do obniżenia wartości wskaźnika INR (podczas terapii warfaryną/acenokumarolem), gdy pacjent jednocześ nie przyjmuje substancje będące induktorami enzymu CYP2C9, suplementy wielowitaminowe zawierające witaminę K czy dziurawiec zwyczajny38.
Prawidłowe prowadzenie terapii przeciwkrzepliwej u pacjentów geriatrycznych może być niezwykle trudne, jednakże pacjenci w każdym przedziale wiekowym odnoszą z niej korzyści43. Aby zminimalizować ryzyko jej powikłań, należy monitorować możliwe interakcje lekowe oraz stosować bezpieczniejsze od VKA leki z grupy NOAC. Stosując NOAC, należy kontrolować wartości eGFR pacjenta, aby uniknąć powikłań związanych ze zbyt wysokim dawkowaniem leku44. W planowaniu leczenia przeciwkrzepliwego można rozważyć również terapię opartą na heparynie i jej pochodnych, które wykazują mniej niekorzystnych interakcji z lekami stosowanymi na przykład w leczeniu bólu45.
Obecnie brakuje badań oceniających wpływ wielolekowości na skuteczność oraz bezpieczeństwo terapii przeciwpłytkowej. Uwzględniając kryteria Beers’a, które opisują wzrost częstości powikłań krwotocznych u pacjentów leczonych aspiryną, należy zachować szczególną ostrożność podczas prowadzenia takiej terapii wśród pacjentów geriatrycznych44.
Zaburzenia funkcji poznawczych
Jednym z istotnych problemów w populacji geriatrycznej są zaburzenia funkcji poznawczych, do których należy otępienie oraz majaczenie46, 47.
Zaobserwowano zależność między przyjmowaniem większej liczby leków a pogorszeniem funkcji poznawczych48, 49. Jest ona tym silniejsza, im dłużej stosowana jest wielolekowość. Wyniki tych badań sugerują, że istnieją zależne od skumulowanej dawki negatywne skutki polipragmazji wpływające na stan funkcji poznawczych48. Może to być wynikiem związanego z polipragmazją wzrostu ryzyka przyjmowania potencjalnie niewłaściwych leków, na przykład środków sedatywnych i psychoaktywnych46, 50, 51. Jest to szczególnie istotne u pacjentów oddziałów intensywnej terapii, którzy przyjmują średnio 12 różnych leków, ponieważ wystąpienie majaczenia wiąże się z trzykrotnie większym ryzykiem zgonu w ciągu sześciu miesięcy w porównaniu z pacjentami, u których ono nie wystąpiło52, 53.
Sedacja z użyciem benzodiazepin przy mechanicznej wentylacji niesie większe ryzyko delirium w porównaniu z innymi lekami sedatywnymi54. Zastosowanie lorazepamu u pacjentów sztucznie wentylowanych, a midazolamu u ciężko chorych dorosłych jest niezależnym czynnikiem rozwoju delirium w dniu następnym55, 56. Ponadto ustalono, że ryzyko to zależy od dawki i zmienia się w zależności od ilości podanego leku. Wynika z tego potrzeba redukcji dziennej dawki benzodiazepin i stosowanie innych substancji charakteryzujących się mniejszym ryzykiem wystąpienia majaczenia, jak deksmedetomidyna57.
Istnieje związek między podaniem tramadolu, petydyny i fentanylu a rozwojem delirium58–60. Brak jest jednak wiarygodnych badań, które porównywałyby działanie poszczególnych preparatów61.
Majaczenie wielokrotnie było łączone z antycholinergicznym działaniem leków62. W badaniu z 2015 r. nie zaobserwowano jednak wzrostu prawdopodobieństwa rozwoju delirium u pacjentów narażonych na leki o właściwościach antycholinergicznych według Anticholinergic Drug Scale63.
Przeprowadzono także badania, które nie potwierdzają związku stosowania większej liczby leków z pogorszeniem funkcji poznawczych64, 65.
Polipragmazja może wywoływać negatywne reakcje u starszych pacjentów, ale nie jest jednoznacznie powiązana z zaburzeniami funkcji poznawczych. Należy zwrócić uwagę na to, że istotny wpływ na wystąpienie działań ubocznych może mieć ekspozycja na określone klasy leków, całkowita ekspozycja na leki, interakcje lekowe oraz przestrzeganie dawkowania danych substancji64.
Depresja
Depresja to zaburzenie psychiczne najczęściej występujące w grupie osób starszych (55–74 lata), ponad 7,5 proc. wśród kobiet oraz ponad 5,5 proc. wśród mężczyzn66, 67.
W badaniu z 2019 r. wykazano współistnienie polipragmazji z depresją, nie zauważono jednak związku przyczynowo-skutkowego68. Zaobserwowano natomiast związek depresji z rozwojem polipragmazji69. Stwarza to potrzebę pogłębionej oceny leczenia stosowanego u starszego pacjenta z depresją ze względu na częstsze występowanie wielochorobowości i tendencje do występowania polipragmazji, która zwiększa ryzyko niepożądanych interakcji między lekami, co może istotnie wpływać na efektywność farmakoterapii70.
Polipragmazja zwiększa prawdopodobieństwo występowania działań ubocznych leków. Może to skutkować nasileniem zaburzeń poznawczych, upośledzeniem codziennego funkcjonowania, koniecznością hospitalizacji i zwiększoną śmiertelnością71. Objawy depresji mogą być efektem niepożądanym stosowania takich leków, jak kortykosteroidy, inhibitory konwertazy angiotensyny, niektóre β-blokery, statyny, selektywne modulatory receptora estrogenowego i niektóre leki przeciwpsychotyczne. Dane często są jednak sprzeczne (opierają się na badaniach obserwacyjnych)72.
Mimo braku mocnych dowodów na to, że polipragmazja powoduje depresję, ordynując leczenie warto wziąć pod uwagę działania niepożądane leków oraz rosnącą liczbę interakcji przy prowadzeniu terapii tego schorzenia.
Nietrzymanie moczu
Nietrzymanie moczu (ang. urinary incontinence, UI) to zjawisko definiowane przez International Continence Society (ICS) jako zgłaszanie przez pacjenta niekontrolowanego oddawania moczu73. Problem ten nasila się z wiekiem i jest uciążliwy nie tylko z punktu widzenia pacjenta, ale także dla systemu ochrony zdrowia74, 75.
Duża liczba leków stosowanych przez starszych pacjentów budzi obawy przed możliwością spotęgowania się objawów nietrzymania moczu. Spośród leków powszechnie stosowanych ICS wyróżniło agonistów receptorów α-adrenergicznych, inhibitory konwertazy angiotensyny, leki antycholinergiczne, blokery kanału wapniowego, inhibitory cholinesterazy, diuretyki, preparaty litu, analgetyki opioidowe, leki psychotropowe, selektywne inhibitory zwrotnego wychwytu serotoniny (SSRI), gabapentynę, glitazony i NLPZ74. Opisywany problem został także ujęty w kryteriach Beers’a z 2019r. oraz w kryteriach STOPP/START, które wskazują na blokery receptorów α-adrenergicznych (szczególnie stosowane z diuretykami pętlowymi), doustne preparaty estrogenu oraz diuretyki pętlowe jako mogące nasilać objawy nietrzymania moczu44, 76.
W dostępnej literaturze wpływowi polipragmazji na nietrzymanie moczu poświęcona jest mała liczba prac, pomimo że problem stosowania przez pacjentów leków mogących nasilać opisywane objawy jest powszechny. Nawet 60,5 proc. pacjentów zgłaszających się do lekarza z objawami nietrzymania moczu stosuje preparaty mogące nasilać te symptomy. Najczęściej są to blokery kanału wapniowego, benzodiazepiny, inne leki o działaniu ośrodkowym, ACE inhibitory oraz preparaty estrogenu77.
Związkowi pomiędzy przyjmowaniem przez pacjenta wielu leków a nietrzymaniem moczu poświęcone są głównie prace obserwacyjne. Wskazują one, że polipragmazja jest jednym z czynników znacząco związanych z obecnością i nasileniem objawów tej choroby oraz że występowanie nietrzymania moczu jest znacząco statystycznie związane z większą liczbą przyjmowanych codziennie leków77–79.
Nie ma jednak badań klinicznych, które potwierdzałyby wyżej opisane obserwacje. International Continence Society mimo wszystko bierze pod uwagę działania niepożądane niektórych leków, możliwość wystąpienia interakcji pomiędzy preparatami oraz wzrastające ryzyko wystąpienia działań niepożądanych wraz z kolejnymi przyjmowanymi przez pacjenta preparatami. Rekomenduje, aby u osób starszych rozpoczynać leczenie nietrzymania moczu od oceny obecnie przyjmowanych leków oraz by przed dodawaniem kolejnych preparatów wyłączyć leki potencjalnie nasilające objawy74.
Polipragmazja a nie stosowanie się do zaleceń i terapia daremna
Pogarszanie stanu zdrowia starszych pacjentów może wynikać z niestosowania się do zaleceń lekarza dotyczących schematu przyjmowania leków (ang. non-adherence). Wielu pacjentów nie rozumie, dlaczego ma zażywać konkretne leki, co może skutkować ich nieodpowiednim stosowaniem lub przedwczesnym odstawieniem80. Badania wykazały, że większa liczba przepisanych leków wiąże się z nieprzestrzeganiem zaleceń dotyczących ich stosowania80, 81. Dodatkowym aspektem, na który należy zwrócić uwagę podczas opieki nad pacjentami starszymi, a już w szczególności nad pacjentami w terminalnej fazie choroby przewlekłej, jest celowość prowadzonej terapii. Jak pokazały badania, ponad połowa pacjentów z zaawansowaną demencją przebywających w jednostkach opieki długoterminowej czy paliatywnej otrzymywała m.in. memantynę, inhibitory cholinesterazy oraz środki hipolipemizujące (o wątpliwej przydatności). Odstąpienie od takiej terapii poprawia jakość życia pacjenta, nie wpływając na jego długość82.
Należy więc mieć na uwadze możliwość wpływu liczby przepisanych pacjentowi leków na skuteczność prowadzonej terapii oraz na jakość i komfort życia u jego kresu.
Podsumowanie
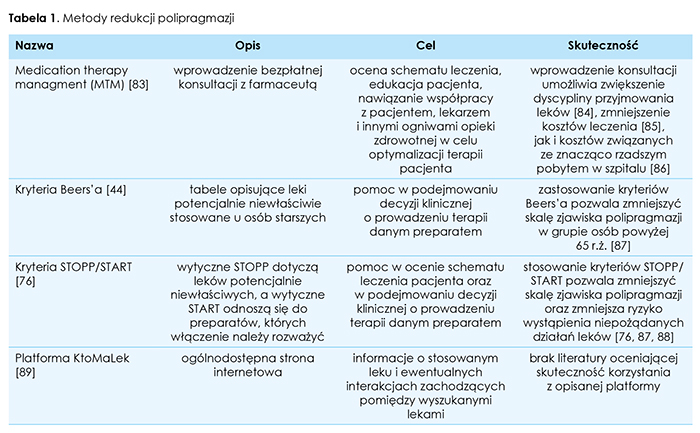
Wielolekowość jest problemem powszechnym i narastającym w grupie osób starszych korzystających z opieki geriatrycznej i paliatywnej. W naszej pracy opisaliśmy badania poświęcone związkowi polipragmazji ze schorzeniami charakterystycznymi dla tej grupy wiekowej. W większości opisywanych przez nas jednostek chorobowych wskazano na związek stosowania wielu leków z występowaniem i zaawansowaniem danej choroby lub wyodrębniono grupy leków nasilające jej objawy. Brakuje jednak dostatecznej ilości badań dostarczających mocne dowody potwierdzające tezę o wpływie polipragmazji na opisane schorzenia. W obliczu prognoz demograficznych przewidujących znaczący wzrost liczby osób w wieku powyżej 65 r.ż. w nadchodzących latach przeprowadzenie takich badań i opracowanie dokładnych wytycznych dotyczących problemu polipragmazji u osób starszych wydaje się koniecznością. Wskazujemy dostępne narzędzia pomocne w codziennej pracy lekarza stykającego się z wielolekowością wśród swoich pacjentów. Rozpowszechnianie wiedzy na temat kryteriów Beers’a, kryteriów STOPP/START a także udostępnianie pacjentom możliwości skorzystania z konsultacji w celu oceny poprawności farmakoterapii to proste a zarazem skuteczne kroki z sukcesem wprowadzone już w wielu państwach.
Piśmiennictwo:
1. NHPCO. Facts and figures table of contents. 2020.
2. GUS. Prognoza ludności rezydującej dla polski na lata 2015–2050.
3. Masnoon N, Shakib S, Kalisch-Ellett L i wsp. What is polypharmacy? A systematic review of definitions. BMC Geriatr 2017; 17: 1-10.
4. World Health Organization. Medication Safety in Polypharmacy. Technical report 2019; 11-14.
5. Jankowska-Polańska B, Uchmanowicz I. Wielolekowość, choroby współistniejące i upadki u chorych z przewlekłą niewydolnością serca w wieku podeszłym. Polypharmacy, comorbidities and falls in elderly patients with chronic heart failure. Geriatria. 2014; 8: 1-12.
6. Duława J, Basiak M. Vademecum medycyny wewnętrznej. Wydawnictwo Lekarskie PZWL; 2015: 290-300.
7. Charlesworth CJ, Smit E, Lee DSH i wsp. Polypharmacy among adults aged 65 years and older in the United States: 1988–2010. J Gerontol Ser A 2015; 70: 989-995.
8. Guthrie B, Makubate B, Hernandez-Santiago V i wsp. The rising tide of polypharmacy and drug-drug interactions: population database analysis 1995–2010. BMC Med 2015; 13: 74.
9. Hovstadius B, Hovstadius K, Åstrand B i wsp. Increasing polypharmacy – an individual-based study of the Swedish population 2005–2008. BMC Clin Pharmacol 2010; 10: 16.
10. Slabaugh SL, Maio V, Templin M i wsp. Prevalence and risk of polypharmacy among the elderly in an outpatient setting: a retrospective cohort study in the Emilia-Romagna Region, Italy. Drugs Aging 2010; 27: 1019-1028.
11. Khaledi AR, Kazemi M, Tahmasebi M. Frequency of polypharmacy in advanced cancer patients consulted with the palliative service of Imam Khomeini Hospital (Tehran), Iran, 2017. Asian Pacific J Cancer Prev 2019; 20: 131-134.
12. Uchida M, Suzuki S, Sugawara H i wsp. A nationwide survey of hospital pharmacist interventions to improve polypharmacy for patients with cancer in palliative care in Japan. J Pharm Heal Care Sci 2019; 5: 1-13.
13. Davies DF, Shock NW. Age changes in glomerular filtration rate, effective renal plasma flow, and tubular excretory capacity in adult males. J Clin Invest 1950; 29: 496-507.
14. Fabre EE, Raynaud-Simon A, Golmard J-L i wsp. Interest and limits of glomerular filtration rate (GFR) estimation with formulae using creatinine or cystatin C in the malnourished elderly population. Arch Gerontol Geriatr 2010; 50: e55-58.
15. Al-Azayzih A, Al-Azzam SI, Alzoubi KH i wsp. Nonsteroidal anti-inflammatory drugs utilization patterns and risk of adverse events due to drug-drug interactions among elderly patients: a study from Jordan. Saudi Pharm J 2020; 28: 504-508.
16. Chao C Ter, Tsai H Bin, Wu CY i wsp. Cumulative cardiovascular polypharmacy is associated with the risk of acute kidney injury in elderly patients. Med (United States) 2015; 94: 1-8.
17. Mizokami F, Mizuno T. Acute kidney injury induced by antimicrobial agents in the elderly: awareness and mitigation strategies. Drugs Aging 2014; 10: 32.
18. Nestsiarovich A, Kerner B, Mazurie AJ i wsp. Comparison of 71 bipolar disorder pharmacotherapies for kidney disorder risk: the potential hazards of polypharmacy. J Affect Disord 2019; 252: 201-211.
19. Guaraldi G, Malagoli A, Calcagno A i wsp. The increasing burden and complexity of multi-morbidity and polypharmacy in geriatric HIV patients: a cross sectional. BMC Geriatr 2018; 18: 1-10.
20. Hart E, Dunn TE, Feuerstein S i wsp. Proton pump inhibitors and risk of acute and chronic kidney disease: a retrospective cohort study. Pharmacother J Hum Pharmacol Drug Ther 2019; 39: 443-453.
21. Ernst R, Fischer K, de Godoi Rezende Costa Molino C i wsp. Polypharmacy and kidney function in community-dwelling adults age 60 years and older: a prospective observational study. J Am Med Dir Assoc 2020; 21: 254-259.e1.
22. Kang H, Hong SH. Risk of kidney dysfunction from polypharmacy among older patients: a nested case-control study of the South Korean senior cohort. Sci Rep 2019; 9: 1-11.
23. Bolmsjö BB, Mölstad S, Gallagher M i wsp. Risk factors and consequences of decreased kidney function in nursing home residents: a longitudinal study. Geriatr Gerontol Int 2017; 17: 791-797.
24. Berková M, Berka Z. Falls: a significant cause of morbidity and mortality in elderly people. Vnitr Lek 2018; 64:1076-1083.
25. American Academy of Family Physicians. GF. Falls in the ElderlyInternet. Vol. 61, American Family Physician. American Academy of Family Physicians; 2000cited 2020 May 17.
26. Correa-Pérez A, Delgado-Silveira E, Martín-Aragón S i wsp. Fall-risk increasing drugs and recurrent injurious falls association in older patients after hip fracture: a cohort study protocol. Ther Adv drug Saf 2019;10: 2042098619868640– 2042098619868640.
27. Lai S-W, Liao K-F, Liao C-C i wsp. Polypharmacy correlates with increased risk for hip fracture in the elderly: a population-based study. Medicine (Baltimore) 2010; 89: 295-299.
28. Vranken L, Wyers CE, Van der Velde RY, i wsp. Comorbidities and medication use in patients with a recent clinical fracture at the fracture liaison service. Osteoporos Int 2018; 29: 397-407.
29. Chen Y, Zhu LL, Zhou Q. Effects of drug pharmacokinetic/ pharmacodynamic properties, characteristics of medication use, and relevant pharmacological interventions on fall risk in elderly patients. Ther Clin Risk Manag 2014; 10: 437-448.
30. Palareti G, Leali N, Coccheri S i wsp. Bleeding complications of oral anticoagulant treatment: an inception-cohort, prospective collaborative study (ISCOAT). Lancet 1996; 348: 423-428.
31. McQuaid KR, Laine L. Systematic review and meta-analysis of adverse events of low-dose aspirin and clopidogrel in randomized controlled trials. Am J Med 2006; 119: 624-638.
32. Stein PD, Hull RD, Kayali F i wsp. Venous thromboembolism according to age. arch intern med 2004; 164: 2260.
33. Fang MC, Go AS, Hylek EM i wsp. Age and the risk of warfarin-associated hemorrhage: the anticoagulation and risk factors in atrial fibrillation study. J Am Geriatr Soc 2006; 54: 1231-1236.
34. Lip GYH, Nieuwlaat R, Pisters R i wsp. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro heart survey on atrial fibrillation. Chest 2010; 137: 263-272.
35. Beyth RJ, Quinn LM, Landefeld CS. Prospective evaluation of an index for predicting the risk of major bleeding in outpatients treated with warfarin. Am J Med 1998; 105: 91-99.
36. Pisters R, Lane DA, Nieuwlaat R i wsp. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro heart survey. Chest 2010; 138: 1093-1100.
37. Shireman TI, Mahnken JD, Howard PA i wsp. Development of a contemporary bleeding risk model for elderly warfarin recipients. Chest 2006; 130: 1390-1396.
38. Russell D Hull, MBBS Ms, David A Garcia M i wsp. Biology of warfarin and modulators of INR control. UpToDate. UpToDate in Waltham. Lawrence LK Leung, MD Jennifer S Tirnauer M (red). https://www.uptodate.com/contents/biology-ofwarfarin-and-modulators-of-inr-control.
39. Piccini JP, Hellkamp AS, Washam JB i wsp. Polypharmacy and the efficacy and safety of rivaroxaban versus warfarin in the prevention of stroke in patients with nonvalvular atrial fibrillation. Circulation 2016; 133: 352-360.
40. Jaspers Focks J, Brouwer MA i wsp. Polypharmacy and effects of apixaban versus warfarin in patients with atrial fibrillation: post hoc analysis of the ARISTOTLE trial. BMJ 2016; 353: i2868.
41. Lawrence LK, Leung M. Direct oral anticoagulants (DOACs) and parenteral direct-acting anticoagulants: dosing and adverse effects. W: UpToDate. UpToDate in Waltham. Pier Mannuccio Mannucci, MD Jennifer S, Tirnauer M (red.). https://www.uptodate.com/contents/direct-oral-anticoagulants-doacs-and-parent eral-direct-acting-anticoagulants-dosing-and-adverse-effects.
42. Scowcroft ACE, Lee S, Mant J. Thromboprophylaxis of elderly patients with AF in the UK: an analysis using the general practice research database (GPRD) 2000–2009. Heart 2013; 99: 127-132.
43. Y.H. LG, Nicolas C, Lauriane P i wsp. Stroke and major bleeding risk in elderly patients aged ≥ 75 years with atrial fibrillation. Stroke 2015; 46: 143-150.
44. Fick DM, Semla TP, Steinman M i wsp. American Geriatrics Society 2019 updated AGS beers criteria® for potentially inappropriate medication use in older adults. J Am Geriatr Soc 2019; 67: 674-694.
45. Jacek Ł, Kotlińska-Lemieszek A. Opieka paliatywna/hospicyjna/medycyna paliatywna. Now Lek 2011; 80: 3-15.
46. Park H-Y, Park J-W, Song HJ i wsp. The association between polypharmacy and dementia: a nested case-control study based on a 12-year longitudinal cohort database in South Korea. PLoS One 2017; 12: e0169463.
47. Inouye SK, Westendorp RGJ, Saczynski JS. Delirium in elderly people. Lancet 2014; 383: 911-922.
48. Rawle MJ, Cooper R, Kuh D i wsp. Associations between polypharmacy and cognitive and physical capability: a British birth cohort study. J Am Geriatr Soc 2018; 66: 916-923.
49. Jyrkkä J, Enlund H, Lavikainen P i wsp. Association of polypharmacy with nutritional status, functional ability and cognitive capacity over a three-year period in an elderly population. Pharmacoepidemiol Drug Saf 2011; 20: 514-522.
50. van den Boogaard M, Pickkers P, Slooter AJC i wsp. Development and validation of PRE-DELIRIC (PREdiction of DELIRium in ICu patients) delirium prediction model for intensive care patients: observational multicentre study. BMJ 2012; 344: e420-e420.
51. Martinez JA, Belastegui A, Basabe I i wsp. Derivation and validation of a clinical prediction rule for delirium in patients admitted to a medical ward: an observational study. BMJ Open 2012; 2: 6-12.
52. Bell CM, Brener SS, Gunraj N i wsp. Association of ICU or hospital admission with unintentional discontinuation of medications for chronic diseases. JAMA 2011; 306: 840-847.
53. Ely EW, Shintani A, Truman B i wsp. Delirium as a predictor of mortality in mechanically ventilated patients in the intensive care unit. JAMA 2004; 291: 1753-1762.
54. Pandharipande PP, Pun BT, Herr DL i wsp. Effect of sedation with dexmedetomidine vs lorazepam on acute brain dysfunction in mechanically ventilated patients the MENDS randomized controlled trial. JAMA 2007; 298: 2644-2653.
55. Pandharipande P, Shintani A, Peterson J. Lorazepam is an independent risk factor for transitioning to delirium in intensive care unit patients. Anesthesiol 2006; 104: 21-26.
56. Zaal IJ, Devlin JW, Hazelbag M i wsp. Benzodiazepine-associated delirium in critically ill adults. Intensive Care Med 2015; 41: 2130-2137.
57. Garpestad E, Devlin JW. Polypharmacy and delirium in critically ill older adults: recognition and prevention. Clin Geriatr Med 2017; 33: 189-203.
58. Brouquet A, Cudennec T, Benoist S i wsp. Impaired mobility, ASA status and administration of tramadol are risk factors for postoperative delirium in patients aged 75 years or more after major abdominal surgery. Ann Surg 2010; 251: 759-765.
59. Marcantonio ER, Juarez G, Goldman L. The relationship of postoperative delirium with psychoactive medications. JAMA 1994; 272: 1518-1522.
60. Pandharipande P, Cotton BA, Shintani A i wsp. Prevalence and risk factors for development of delirium in surgical and trauma intensive care unit patients. J Trauma Inj Infect Crit Care 2008; 65: 34-41.
61. Swart LM, van der Zanden V, Spies PE i wsp. The comparative risk of delirium with different opioids: a systematic review. Drugs and Aging 2017; 34: 437-443.
62. Collamati A, Martone AM, Poscia A i wsp. Anticholinergic drugs and negative outcomes in the older population: from biological plausibility to clinical evidence. Aging Clin Exp Res 2016; 28: 25-35.
63. Wolters AE, Zaal IJ, Veldhuijzen DS i wsp. Anticholinergic medication use and transition to delirium in critically ill patients: a prospective cohort study. Crit Care Med 2015; 43: 1846-1852.
64. Gnjidic D, Hilmer SN, Blyth FM i wsp. Polypharmacy cutoff and outcomes: five or more medicines were used to identify community-dwelling older men at risk of different adverse outcomes. J Clin Epidemiol 2012; 65: 989-995.
65. Wang R, Chen L, Fan L i wsp. Incidence and effects of polypharmacy on clinical outcome among patients aged 80+: A five-year follow-up study. PLoS One 2015; 10: 1-8.
66. Marcus M, Yasamy MT, Ommeren M i wsp. Depression: a global public health concern. World Heal Organ Pap Depress 2012; 6-8.
67. Vos T, Allen C, Arora M i wsp. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the global burden of disease study 2015. Lancet 2016; 388: 1545- 602.
68. Bazargan M, Smith J, Saqib M i wsp. Associations between polypharmacy, self-rated health, and depression in African American older adults; mediators and moderators. Int J Environ Res Public Health 2019; 16: 1-14.
69. Wongpakaran N, Wongpakaran T, Sirirak T i wsp. Predictors of polypharmacy among elderly Thais with depressive and anxiety disorders: Findings from the das study. BMC Geriatr 2018; 18: 1-8.
70. Kok RM, Reynolds III CF. Management of depression in older adults: a review. JAMA 2017; 317: 2114-2122.
71. Fried TR, O’Leary J, Towle V i wsp. Health outcomes associated with polypharmacy in community-dwelling older adults: a systematic review. J Am Geriatr Soc 2014; 62: 2261-2272.
72. Kotlyar M, Dysken M, Adson DE. Update on drug-induced depression in the elderly. Am J Geriatr Pharmacother 2005; 3: 288-300.
73. D’Ancona C, Haylen B, Oelke M i wsp. The International Continence Society (ICS) report on the terminology for adult male lower urinary tract and pelvic floor symptoms and dysfunction. Neurourol Urodyn 2019; 38: 433-477.
74. Abrams P, Cardozo L, Wagg A i wsp. INCONTINENCE. Incontinence. 6th International Consultation on Incontinence, Tokyo, September 2016. 2017.
75. Hannestad YS, Rortveit G, Sandvik H i wsp. A community-based epidemiological survey of female urinary incontinence: the Norwegian EPINCONT Study. J Clin Epidemiol 2000; 53: 1150-1157.
76. O’mahony D, O’Sullivan D, Byrne S i wsp. STOPP/START criteria for potentially inappropriate prescribing in older people: version 2. Age Ageing 2015; 44: 213-218.
77. Kashyap M, Tu LM, Tannenbaum C. Prevalence of commonly prescribed medications potentially contributing to urinary symptoms in a cohort of older patients seeking care for incontinence. BMC Geriatr 2013; 13: 1.
78. Marques LP, Schneider IJC, Giehl M-WC i wsp. Demographic, health conditions, and lifestyle factors associated with urinary incontinence in elderly from FlorianÃtextthreesuperiorpolis, Santa Catarina, Brazil. Rev Bras Epidemiol 2015; 18: 595-606.
79. Ersoy S, Engin VS. Risk factors for polypharmacy in older adults in a primary care setting: a cross-sectional study. Clin Interv Aging 2018; 13: 2003-2011.
80. Pasina L, Brucato AL, Falcone C i wsp. Medication non-adherence among elderly patients newly discharged and receiving polypharmacy. Drugs Aging 2014; 31: 283-289.
81. Gray SL, Mahoney JE, Blough DK. Medication adherence in elderly patients receiving home health services following hospital discharge. Ann Pharmacother 2001; 35: 539-545.
82. Winzelberg GS, Hanson LC. Palliative care: nursing home. W: UpToDate 2020. Givens J, Schmader KE, Silveira MJ, Ritchie Ch (red). https://www.uptodate.com/contents/palliative-care- -nursing-home.
83. Burns A. Medication therapy management in pharmacy practice: core elements of an MTM service model (version 2.0). J Am Pharm Assoc 2008; 48: 341-353.
84. Perlroth D, Marrufo G, Montesinos A i wsp. Medication therapy management in a chronically III Population: final report. Acumen, LCC, Burlingame 2013.
85. Cranor CW, Bunting BA, Christensen DB. The asheville project: long-term clinical and economic outcomes of a community pharmacy diabetes care program. J Am Pharm Assoc 2003; 43: 173-184.
86. Manley HJ, Aweh G, Weiner DE i wsp. Multidisciplinary medication therapy management and hospital readmission in patients undergoing maintenance dialysis: a retrospective cohort study. Am J Kidney Dis 2020; 76:13-21.
87. Cooper JA, Cadogan CA, Patterson SM i wsp. Interventions to improve the appropriate use of polypharmacy in older people: a Cochrane systematic review. BMJ Open 2015; 5.
88. Hill-Taylor B, Walsh KA, Stewart SA i wsp. Effectiveness of the STOPP/START (screening tool of older persons’ potentially inappropriate prescriptions/screening tool to alert doctors to the right treatment) criteria: systematic review and meta-analysis of randomized controlled studies. J Clin Pharm Ther 2016; 41: 158-169.
89. KAMSOFT SA. KtoMaLek.PL

– W ostatnich 30 latach znacznie zwiększa się nie tylko odsetek, ale również liczba obywateli będących w wieku co najmniej 65 lat. Polscy lekarze coraz częściej mają kontakt ze starszymi pacjentami, którzy stanowią ok. 85 proc. podopiecznych ośrodków paliatywnych1. Prognozy Głównego Urzędu Statystycznego przewidują w tym względzie trwałą tendencję wzrostową2.
Istotne jest więc rozpowszechnianie wiedzy na temat chorób oraz problemów terapeutycznych, które są charakterystyczne dla tej grupy pacjentów.
Definicja polipragmazji i wielolekowści
Jednym z istotnych problemów dotykających starszych pacjentów jest wielolekowość (ang. polypharmacy), czyli przyjmowanie przez pacjenta wielu leków jednocześnie. Przy czym „wielość” najczęściej definiuje się jako zażywanie co najmniej pięciu leków dziennie3. Światowa Organizacja Zdrowia (World Health Organization, WHO) w 2019 r. przyjęła podział wielolekowości na stosowną (ang. appropriate polypharmacy) oraz nieodpowiednią (ang. inappropriate polypharmacy), kiedy co najmniej jeden lek jest przyjmowany niewłaściwie4.
W polskiej literaturze medycznej termin polypharmacy jest tłumaczony zamiennie jako wielolekowość5 lub polipragmazja6, podczas gdy wielolekowość oznacza przyjmowanie przez pacjenta pięciu lub więcej leków5, a polipragmazja to stosowanie zbyt wielu leków lub nieprawidłowe zastosowanie jednego bądź więcej leków6. Oba terminy jednak zwracają uwagę na szkodliwy wpływ nadmiernego reżimu lekowego.
Obecnie starsi pacjenci przyjmują coraz więcej leków7. Analizy przeprowadzone w różnych krajach wykazały, iż narażenie na wielolekowość wzrasta wraz z wiekiem oraz ilością chorób współistniejących8–10. Grupę szczególnie narażoną na polipragmazję stanowią pacjenci leczeni onkologicznie oraz korzystający z opieki paliatywnej11, 12.
Wielolekowość wiąże się z występowaniem licznych powikłań, dlatego przy doborze terapii zawsze należy ocenić bilans oczekiwanych korzyści oraz przewidywanego ryzyka.
Funkcja wydalnicza nerek
Wśród pacjentów powyżej 65 r.ż. ocena funkcji nerek jest wyzwaniem. Przed interpretacją wyników badań laboratoryjnych należy przede wszystkim uwzględnić związane z wiekiem obniżenie współczynnika filtracji kłębuszkowej (eGFR). Do czwartej dekady życia wartości eGFR utrzymują się w okolicy 140 ml/min/1.73 m2 , następnie dochodzi do stopniowego obniżania filtracji kłębuszkowej o około 8 ml/ min/1.73 m2 na każde dziesięć lat13. Kolejnym utrudnieniem w prawidłowej interpretacji czynności nerek jest częste niedożywienie, występowanie stanu zapalnego oraz licznych schorzeń u osób powyżej 65 r.ż.14. Wraz ze zmniejszeniem filtracji kłębuszkowej zwiększa się podatność nerek na uszkodzenia związane ze stosowaniem leków zarówno nefrotoksycznych, jak i leków, które przy prawidłowej czynności nerek nie stanowią zagrożenia. Wśród często stosowanych leków o udokumentowanym niekorzystnym wpływie na funkcję wydalniczą nerek znajdują się m.in. niesteroidowe leki przeciwzapalne (NLPZ), leki układu sercowo-naczyniowego, antybiotyki, leki psychotropowe, leki przeciwwirusowe czy inhibitory pompy protonowej15–20. Stosowanie na co dzień wielu leków przez osoby powyżej 65 r.ż. jest w obecnych czasach powszechnym zjawiskiem. Uwzględniając znaczny udział wyżej wymienionych preparatów w codziennej terapii schorzeń dotykających osoby starsze, należy rozważyć możliwy związek pomiędzy polipragmazją a przyspieszoną utratą prawidłowej funkcji wydalniczej nerek.
W prospektywnym badaniu obserwacyjnym z 2019 r. udowodniono bezpośredni związek między liczbą przyjmowanych leków a zwiększonym tempem obniżania wskaźnika filtracji kłębuszkowej w ciągu 24 miesięcy trwania badania21.
Badanie kliniczno-kontrolne z 2019 r. wykazało zależność pomiędzy występowaniem polipragmazji a upośledzeniem funkcji wydalniczej nerek. Wśród pacjentów badanej grupy liczbę przyjmowanych leków podzielono na polipragmazję (5–9 leków) oraz nadmierną polipragmazję (≥ 10 leków). Wyniki badania pokazały częstsze występowanie obu zjawisk wśród pacjentów grupy badanej w porównaniu z grupą kontrolną22.
W badaniu panelowym z 2017 r. podczas wieloetapowej analizy statystycznej wyników badań zaobserwowano, iż przyjmowanie większej liczby leków (6,8 ± 3,1) jest niezależnym czynnikiem ryzyka dla obniżenia wartości wskaźnika filtracji kłębuszkowej eGFR o > 3 ml/min/1h.73 m2 na r. (OR ≈ 1.2)23.
Wymienione badania wskazują na bezpośredni związek polipragmazji u osób starszych z ryzykiem upośledzenia funkcji wydalniczej nerek. Przeprowadzenie dodatkowych badań potwierdzających to powiązanie może okazać się pomocne w opisaniu wytycznych i sprecyzowaniu działań, jakie należy podjąć, aby zminimalizować ryzyko postępujących uszkodzeń nerek u pacjentów z grupy ryzyka.
Upadki i złamania
Upadki wśród osób starszych są powszechnym i wciąż narastającym problemem, niejednokrotnie prowadzącym do poważnych obrażeń i powikłań. W literaturze najczęściej wymienia się złamania stawu biodrowego oraz urazy wewnątrzczaszkowe24. Szacuje się, że wśród osób po 70 r.ż. rocznie upada jedna trzecia mieszkających we własnych domach i 60 proc. przebywających w domach opieki społecznej25. Do czynników indukujących upadki należy zaliczyć wiek, występowanie chorób przewlekłych, wpływ środowiska oraz problemy geriatryczne, takie jak zespół kruchości czy polipragmazję24.
Szwedzka Narodowa Rada Zdrowia i Opieki Społecznej opublikowała listę leków zwiększających ryzyko upadków (fall risk increasing drugs, FRIDS), na której znajdują się opioidy, leki antypsychotyczne, przeciwlękowe, uspokajające oraz antydepresyjne. Są na niej również leki powodujące hipotensję ortostatyczną, do których należą preparaty rozszerzające naczynia, diuretyki, β-blokery, blokery kanału wapniowego, inhibitory szlaku renina-angiotensyna, leki α-adrenolityczne i agoniści receptora dopaminergicznego. Wśród pacjentów powyżej 80 r.ż., którzy doznali złamania stawu biodrowego, odsetek ponownych upadków wynosił 40 proc. w przypadku leczonych preparatami FRIDS i 20 proc. pośród tych, którym nie zapisywano leków z powyższej listy26.
Obserwuje się wzrastające ryzyko złamań stawu biodrowego proporcjonalnie do wieku, płci i ilości zażywanych leków. W grupie pacjentów powyżej 85 r.ż. zanotowano istotny wzrost incydentów złamań stawu biodrowego wśród osób zażywających dziesięć lub więcej leków na dzień względem pacjentów z pięcioma zalecanymi preparatami w ciągu dnia. Potwierdzono także wzrost ryzyka upadku wśród kobiet27.
Pisząc o upadkach i złamaniach, należy uwzględnić wskaźnik, jakim jest gęstość mineralna kości (bone mineral density, BMD). Opracowano zestawienie leków związanych z ryzykiem kostnym (bone related medication, BRM), w którym wymieniono preparaty przeciwdrgawkowe, glikokortykosteroidy, inhibitory receptora H2, inhibitory pompy protonowej i tiazolidynodiony. Dowiedziono, że liczba pacjentów zażywających przynajmniej jeden lek z listy BRM rośnie znacząco wraz ze zwiększającym się BMI i spadkiem BMD wskazującym na osteopenię lub osteoporozę. Częstość występowania polipragmazji, definiowanej w przytoczonym badaniu jako zażywanie ogółem minimum 5 leków, była istotnie wyższa u pacjentów z osteoporozą w porównaniu z pacjentami z osteopenią lub prawidłowym BMD28.
Ze wzrostem ryzyka upadków w większym stopniu związane jest zjawisko polipragmazji niż liczba współistniejących chorób. W tym miejscu warto przytoczyć mechanizm interakcji lek-lek (drug-drug interaction, DDI). Wykazano, że dołączenie do terapii benzodiazepinami leków wchodzących z nimi w interakcje ponad dwukrotnie zwiększyło ryzyko upadku. Ponadto niektóre środki chemioterapeutyczne, takie jak pochodne platyny, alkaloidy barwinka różyczkowego i taksany, mogą być neurotoksyczne i prowadzić do neuropatii obwodowej, indukującej problemy z równowagą i chodem. Jest to związane z dwu- do trzykrotnie zwiększonym ryzykiem upadku u osób starszych29. Opisane ryzyko istotnie zwiększa także podwojenie dawki chemioterapii neurotoksycznej29.
Występująca zależność między ryzykiem upadków i złamań stawu biodrowego oraz liczbą zażywanych leków wymaga uważności lekarza prowadzącego. W eliminacji opisanego problemu pomocne są listy leków FRIDS i BRM, których znajomość wśród lekarzy zdaje się kluczowa. Wybierając właściwe leczenie, należy także uwzględnić wiek, płeć i BMI pacjenta.
Powikłania krwotoczne oraz zakrzepowe
W praktyce lekarskiej szczególne miejsce zajmują choroby układu sercowo-naczyniowego. W terapii tej grupy schorzeń powszechnie wykorzystywane są leki przeciwpłytkowe oraz antykoagulanty, których stosowanie zwiększa ryzyko powikłań krwotocznych30, 31. W dobrze prowadzonej terapii jest ono odpowiednio mniejsze od korzyści, jakie pacjent odnosi w wyniku leczenia.
Prowadzenie terapii antykoagulacyjnej jest szczególnie trudne u pacjentów ≥ 65 r. ż., ponieważ wraz z wiekiem rośnie zarówno ryzyko prozakrzepowe, jak i krwotoczne32, 33. Zostało to uwzględnione podczas tworzenia skal oceniających ryzyko prozakrzepowe (skala CHA2DS2-VASc), ryzyko powikłań krwotocznych (skale OBRI, HAS-BLED), jak i wzorów do szacowania ryzyka krwawienia34–37. Niektóre z tych skal uwzględniają również przyjmowanie innych leków jako czynnik zwiększający ryzyko krwawienia. Wynika to z rosnącego prawdopodobieństwa interakcji międzylekowych wraz ze wzrostem liczby przyjmowanych preparatów, które mogą zaburzać farmakokinetykę leku antykoagulacyjnego38.
Wyniki badań porównujących skuteczność antagonistów witaminy K vs. NOAC (ang. non-vitamin K antagonist oral anticoagulant) w terapii antykoagulacyjnej oraz wpływ polipragmazji na jej efekt zgodnie wskazują, że NOAC są lekami bezpieczniejszymi i skuteczniejszymi39, 40. Może to wynikać z faktu, że NOAC cechuje większa szerokość okna terapeutycznego41. W obu przypadkach jednak wraz ze wzrostem liczby równocześnie przyjmowanych leków rośnie ryzyko wystąpienia powikłań krwotocznych oraz zakrzepowo-zatorowych39, 40.
Należy zauważyć, że z powodu obaw przed wystąpieniem powikłań krwotocznych wielu starszych pacjentów nie ma wdrożonej odpowiedniej terapii antykoagulacyjnej42. Może również dochodzić do obniżenia wartości wskaźnika INR (podczas terapii warfaryną/acenokumarolem), gdy pacjent jednocześ nie przyjmuje substancje będące induktorami enzymu CYP2C9, suplementy wielowitaminowe zawierające witaminę K czy dziurawiec zwyczajny38.
Prawidłowe prowadzenie terapii przeciwkrzepliwej u pacjentów geriatrycznych może być niezwykle trudne, jednakże pacjenci w każdym przedziale wiekowym odnoszą z niej korzyści43. Aby zminimalizować ryzyko jej powikłań, należy monitorować możliwe interakcje lekowe oraz stosować bezpieczniejsze od VKA leki z grupy NOAC. Stosując NOAC, należy kontrolować wartości eGFR pacjenta, aby uniknąć powikłań związanych ze zbyt wysokim dawkowaniem leku44. W planowaniu leczenia przeciwkrzepliwego można rozważyć również terapię opartą na heparynie i jej pochodnych, które wykazują mniej niekorzystnych interakcji z lekami stosowanymi na przykład w leczeniu bólu45.
Obecnie brakuje badań oceniających wpływ wielolekowości na skuteczność oraz bezpieczeństwo terapii przeciwpłytkowej. Uwzględniając kryteria Beers’a, które opisują wzrost częstości powikłań krwotocznych u pacjentów leczonych aspiryną, należy zachować szczególną ostrożność podczas prowadzenia takiej terapii wśród pacjentów geriatrycznych44.
Zaburzenia funkcji poznawczych
Jednym z istotnych problemów w populacji geriatrycznej są zaburzenia funkcji poznawczych, do których należy otępienie oraz majaczenie46, 47.
Zaobserwowano zależność między przyjmowaniem większej liczby leków a pogorszeniem funkcji poznawczych48, 49. Jest ona tym silniejsza, im dłużej stosowana jest wielolekowość. Wyniki tych badań sugerują, że istnieją zależne od skumulowanej dawki negatywne skutki polipragmazji wpływające na stan funkcji poznawczych48. Może to być wynikiem związanego z polipragmazją wzrostu ryzyka przyjmowania potencjalnie niewłaściwych leków, na przykład środków sedatywnych i psychoaktywnych46, 50, 51. Jest to szczególnie istotne u pacjentów oddziałów intensywnej terapii, którzy przyjmują średnio 12 różnych leków, ponieważ wystąpienie majaczenia wiąże się z trzykrotnie większym ryzykiem zgonu w ciągu sześciu miesięcy w porównaniu z pacjentami, u których ono nie wystąpiło52, 53.
Sedacja z użyciem benzodiazepin przy mechanicznej wentylacji niesie większe ryzyko delirium w porównaniu z innymi lekami sedatywnymi54. Zastosowanie lorazepamu u pacjentów sztucznie wentylowanych, a midazolamu u ciężko chorych dorosłych jest niezależnym czynnikiem rozwoju delirium w dniu następnym55, 56. Ponadto ustalono, że ryzyko to zależy od dawki i zmienia się w zależności od ilości podanego leku. Wynika z tego potrzeba redukcji dziennej dawki benzodiazepin i stosowanie innych substancji charakteryzujących się mniejszym ryzykiem wystąpienia majaczenia, jak deksmedetomidyna57.
Istnieje związek między podaniem tramadolu, petydyny i fentanylu a rozwojem delirium58–60. Brak jest jednak wiarygodnych badań, które porównywałyby działanie poszczególnych preparatów61.
Majaczenie wielokrotnie było łączone z antycholinergicznym działaniem leków62. W badaniu z 2015 r. nie zaobserwowano jednak wzrostu prawdopodobieństwa rozwoju delirium u pacjentów narażonych na leki o właściwościach antycholinergicznych według Anticholinergic Drug Scale63.
Przeprowadzono także badania, które nie potwierdzają związku stosowania większej liczby leków z pogorszeniem funkcji poznawczych64, 65.
Polipragmazja może wywoływać negatywne reakcje u starszych pacjentów, ale nie jest jednoznacznie powiązana z zaburzeniami funkcji poznawczych. Należy zwrócić uwagę na to, że istotny wpływ na wystąpienie działań ubocznych może mieć ekspozycja na określone klasy leków, całkowita ekspozycja na leki, interakcje lekowe oraz przestrzeganie dawkowania danych substancji64.
Depresja
Depresja to zaburzenie psychiczne najczęściej występujące w grupie osób starszych (55–74 lata), ponad 7,5 proc. wśród kobiet oraz ponad 5,5 proc. wśród mężczyzn66, 67.
W badaniu z 2019 r. wykazano współistnienie polipragmazji z depresją, nie zauważono jednak związku przyczynowo-skutkowego68. Zaobserwowano natomiast związek depresji z rozwojem polipragmazji69. Stwarza to potrzebę pogłębionej oceny leczenia stosowanego u starszego pacjenta z depresją ze względu na częstsze występowanie wielochorobowości i tendencje do występowania polipragmazji, która zwiększa ryzyko niepożądanych interakcji między lekami, co może istotnie wpływać na efektywność farmakoterapii70.
Polipragmazja zwiększa prawdopodobieństwo występowania działań ubocznych leków. Może to skutkować nasileniem zaburzeń poznawczych, upośledzeniem codziennego funkcjonowania, koniecznością hospitalizacji i zwiększoną śmiertelnością71. Objawy depresji mogą być efektem niepożądanym stosowania takich leków, jak kortykosteroidy, inhibitory konwertazy angiotensyny, niektóre β-blokery, statyny, selektywne modulatory receptora estrogenowego i niektóre leki przeciwpsychotyczne. Dane często są jednak sprzeczne (opierają się na badaniach obserwacyjnych)72.
Mimo braku mocnych dowodów na to, że polipragmazja powoduje depresję, ordynując leczenie warto wziąć pod uwagę działania niepożądane leków oraz rosnącą liczbę interakcji przy prowadzeniu terapii tego schorzenia.
Nietrzymanie moczu
Nietrzymanie moczu (ang. urinary incontinence, UI) to zjawisko definiowane przez International Continence Society (ICS) jako zgłaszanie przez pacjenta niekontrolowanego oddawania moczu73. Problem ten nasila się z wiekiem i jest uciążliwy nie tylko z punktu widzenia pacjenta, ale także dla systemu ochrony zdrowia74, 75.
Duża liczba leków stosowanych przez starszych pacjentów budzi obawy przed możliwością spotęgowania się objawów nietrzymania moczu. Spośród leków powszechnie stosowanych ICS wyróżniło agonistów receptorów α-adrenergicznych, inhibitory konwertazy angiotensyny, leki antycholinergiczne, blokery kanału wapniowego, inhibitory cholinesterazy, diuretyki, preparaty litu, analgetyki opioidowe, leki psychotropowe, selektywne inhibitory zwrotnego wychwytu serotoniny (SSRI), gabapentynę, glitazony i NLPZ74. Opisywany problem został także ujęty w kryteriach Beers’a z 2019r. oraz w kryteriach STOPP/START, które wskazują na blokery receptorów α-adrenergicznych (szczególnie stosowane z diuretykami pętlowymi), doustne preparaty estrogenu oraz diuretyki pętlowe jako mogące nasilać objawy nietrzymania moczu44, 76.
W dostępnej literaturze wpływowi polipragmazji na nietrzymanie moczu poświęcona jest mała liczba prac, pomimo że problem stosowania przez pacjentów leków mogących nasilać opisywane objawy jest powszechny. Nawet 60,5 proc. pacjentów zgłaszających się do lekarza z objawami nietrzymania moczu stosuje preparaty mogące nasilać te symptomy. Najczęściej są to blokery kanału wapniowego, benzodiazepiny, inne leki o działaniu ośrodkowym, ACE inhibitory oraz preparaty estrogenu77.
Związkowi pomiędzy przyjmowaniem przez pacjenta wielu leków a nietrzymaniem moczu poświęcone są głównie prace obserwacyjne. Wskazują one, że polipragmazja jest jednym z czynników znacząco związanych z obecnością i nasileniem objawów tej choroby oraz że występowanie nietrzymania moczu jest znacząco statystycznie związane z większą liczbą przyjmowanych codziennie leków77–79.
Nie ma jednak badań klinicznych, które potwierdzałyby wyżej opisane obserwacje. International Continence Society mimo wszystko bierze pod uwagę działania niepożądane niektórych leków, możliwość wystąpienia interakcji pomiędzy preparatami oraz wzrastające ryzyko wystąpienia działań niepożądanych wraz z kolejnymi przyjmowanymi przez pacjenta preparatami. Rekomenduje, aby u osób starszych rozpoczynać leczenie nietrzymania moczu od oceny obecnie przyjmowanych leków oraz by przed dodawaniem kolejnych preparatów wyłączyć leki potencjalnie nasilające objawy74.
Polipragmazja a nie stosowanie się do zaleceń i terapia daremna
Pogarszanie stanu zdrowia starszych pacjentów może wynikać z niestosowania się do zaleceń lekarza dotyczących schematu przyjmowania leków (ang. non-adherence). Wielu pacjentów nie rozumie, dlaczego ma zażywać konkretne leki, co może skutkować ich nieodpowiednim stosowaniem lub przedwczesnym odstawieniem80. Badania wykazały, że większa liczba przepisanych leków wiąże się z nieprzestrzeganiem zaleceń dotyczących ich stosowania80, 81. Dodatkowym aspektem, na który należy zwrócić uwagę podczas opieki nad pacjentami starszymi, a już w szczególności nad pacjentami w terminalnej fazie choroby przewlekłej, jest celowość prowadzonej terapii. Jak pokazały badania, ponad połowa pacjentów z zaawansowaną demencją przebywających w jednostkach opieki długoterminowej czy paliatywnej otrzymywała m.in. memantynę, inhibitory cholinesterazy oraz środki hipolipemizujące (o wątpliwej przydatności). Odstąpienie od takiej terapii poprawia jakość życia pacjenta, nie wpływając na jego długość82.

Należy więc mieć na uwadze możliwość wpływu liczby przepisanych pacjentowi leków na skuteczność prowadzonej terapii oraz na jakość i komfort życia u jego kresu.
Podsumowanie
Wielolekowość jest problemem powszechnym i narastającym w grupie osób starszych korzystających z opieki geriatrycznej i paliatywnej. W naszej pracy opisaliśmy badania poświęcone związkowi polipragmazji ze schorzeniami charakterystycznymi dla tej grupy wiekowej. W większości opisywanych przez nas jednostek chorobowych wskazano na związek stosowania wielu leków z występowaniem i zaawansowaniem danej choroby lub wyodrębniono grupy leków nasilające jej objawy. Brakuje jednak dostatecznej ilości badań dostarczających mocne dowody potwierdzające tezę o wpływie polipragmazji na opisane schorzenia. W obliczu prognoz demograficznych przewidujących znaczący wzrost liczby osób w wieku powyżej 65 r.ż. w nadchodzących latach przeprowadzenie takich badań i opracowanie dokładnych wytycznych dotyczących problemu polipragmazji u osób starszych wydaje się koniecznością. Wskazujemy dostępne narzędzia pomocne w codziennej pracy lekarza stykającego się z wielolekowością wśród swoich pacjentów. Rozpowszechnianie wiedzy na temat kryteriów Beers’a, kryteriów STOPP/START a także udostępnianie pacjentom możliwości skorzystania z konsultacji w celu oceny poprawności farmakoterapii to proste a zarazem skuteczne kroki z sukcesem wprowadzone już w wielu państwach.
Piśmiennictwo:
1. NHPCO. Facts and figures table of contents. 2020.
2. GUS. Prognoza ludności rezydującej dla polski na lata 2015–2050.
3. Masnoon N, Shakib S, Kalisch-Ellett L i wsp. What is polypharmacy? A systematic review of definitions. BMC Geriatr 2017; 17: 1-10.
4. World Health Organization. Medication Safety in Polypharmacy. Technical report 2019; 11-14.
5. Jankowska-Polańska B, Uchmanowicz I. Wielolekowość, choroby współistniejące i upadki u chorych z przewlekłą niewydolnością serca w wieku podeszłym. Polypharmacy, comorbidities and falls in elderly patients with chronic heart failure. Geriatria. 2014; 8: 1-12.
6. Duława J, Basiak M. Vademecum medycyny wewnętrznej. Wydawnictwo Lekarskie PZWL; 2015: 290-300.
7. Charlesworth CJ, Smit E, Lee DSH i wsp. Polypharmacy among adults aged 65 years and older in the United States: 1988–2010. J Gerontol Ser A 2015; 70: 989-995.
8. Guthrie B, Makubate B, Hernandez-Santiago V i wsp. The rising tide of polypharmacy and drug-drug interactions: population database analysis 1995–2010. BMC Med 2015; 13: 74.
9. Hovstadius B, Hovstadius K, Åstrand B i wsp. Increasing polypharmacy – an individual-based study of the Swedish population 2005–2008. BMC Clin Pharmacol 2010; 10: 16.
10. Slabaugh SL, Maio V, Templin M i wsp. Prevalence and risk of polypharmacy among the elderly in an outpatient setting: a retrospective cohort study in the Emilia-Romagna Region, Italy. Drugs Aging 2010; 27: 1019-1028.
11. Khaledi AR, Kazemi M, Tahmasebi M. Frequency of polypharmacy in advanced cancer patients consulted with the palliative service of Imam Khomeini Hospital (Tehran), Iran, 2017. Asian Pacific J Cancer Prev 2019; 20: 131-134.
12. Uchida M, Suzuki S, Sugawara H i wsp. A nationwide survey of hospital pharmacist interventions to improve polypharmacy for patients with cancer in palliative care in Japan. J Pharm Heal Care Sci 2019; 5: 1-13.
13. Davies DF, Shock NW. Age changes in glomerular filtration rate, effective renal plasma flow, and tubular excretory capacity in adult males. J Clin Invest 1950; 29: 496-507.
14. Fabre EE, Raynaud-Simon A, Golmard J-L i wsp. Interest and limits of glomerular filtration rate (GFR) estimation with formulae using creatinine or cystatin C in the malnourished elderly population. Arch Gerontol Geriatr 2010; 50: e55-58.
15. Al-Azayzih A, Al-Azzam SI, Alzoubi KH i wsp. Nonsteroidal anti-inflammatory drugs utilization patterns and risk of adverse events due to drug-drug interactions among elderly patients: a study from Jordan. Saudi Pharm J 2020; 28: 504-508.
16. Chao C Ter, Tsai H Bin, Wu CY i wsp. Cumulative cardiovascular polypharmacy is associated with the risk of acute kidney injury in elderly patients. Med (United States) 2015; 94: 1-8.
17. Mizokami F, Mizuno T. Acute kidney injury induced by antimicrobial agents in the elderly: awareness and mitigation strategies. Drugs Aging 2014; 10: 32.
18. Nestsiarovich A, Kerner B, Mazurie AJ i wsp. Comparison of 71 bipolar disorder pharmacotherapies for kidney disorder risk: the potential hazards of polypharmacy. J Affect Disord 2019; 252: 201-211.
19. Guaraldi G, Malagoli A, Calcagno A i wsp. The increasing burden and complexity of multi-morbidity and polypharmacy in geriatric HIV patients: a cross sectional. BMC Geriatr 2018; 18: 1-10.
20. Hart E, Dunn TE, Feuerstein S i wsp. Proton pump inhibitors and risk of acute and chronic kidney disease: a retrospective cohort study. Pharmacother J Hum Pharmacol Drug Ther 2019; 39: 443-453.
21. Ernst R, Fischer K, de Godoi Rezende Costa Molino C i wsp. Polypharmacy and kidney function in community-dwelling adults age 60 years and older: a prospective observational study. J Am Med Dir Assoc 2020; 21: 254-259.e1.
22. Kang H, Hong SH. Risk of kidney dysfunction from polypharmacy among older patients: a nested case-control study of the South Korean senior cohort. Sci Rep 2019; 9: 1-11.
23. Bolmsjö BB, Mölstad S, Gallagher M i wsp. Risk factors and consequences of decreased kidney function in nursing home residents: a longitudinal study. Geriatr Gerontol Int 2017; 17: 791-797.
24. Berková M, Berka Z. Falls: a significant cause of morbidity and mortality in elderly people. Vnitr Lek 2018; 64:1076-1083.
25. American Academy of Family Physicians. GF. Falls in the ElderlyInternet. Vol. 61, American Family Physician. American Academy of Family Physicians; 2000cited 2020 May 17.
26. Correa-Pérez A, Delgado-Silveira E, Martín-Aragón S i wsp. Fall-risk increasing drugs and recurrent injurious falls association in older patients after hip fracture: a cohort study protocol. Ther Adv drug Saf 2019;10: 2042098619868640– 2042098619868640.
27. Lai S-W, Liao K-F, Liao C-C i wsp. Polypharmacy correlates with increased risk for hip fracture in the elderly: a population-based study. Medicine (Baltimore) 2010; 89: 295-299.
28. Vranken L, Wyers CE, Van der Velde RY, i wsp. Comorbidities and medication use in patients with a recent clinical fracture at the fracture liaison service. Osteoporos Int 2018; 29: 397-407.
29. Chen Y, Zhu LL, Zhou Q. Effects of drug pharmacokinetic/ pharmacodynamic properties, characteristics of medication use, and relevant pharmacological interventions on fall risk in elderly patients. Ther Clin Risk Manag 2014; 10: 437-448.
30. Palareti G, Leali N, Coccheri S i wsp. Bleeding complications of oral anticoagulant treatment: an inception-cohort, prospective collaborative study (ISCOAT). Lancet 1996; 348: 423-428.
31. McQuaid KR, Laine L. Systematic review and meta-analysis of adverse events of low-dose aspirin and clopidogrel in randomized controlled trials. Am J Med 2006; 119: 624-638.
32. Stein PD, Hull RD, Kayali F i wsp. Venous thromboembolism according to age. arch intern med 2004; 164: 2260.
33. Fang MC, Go AS, Hylek EM i wsp. Age and the risk of warfarin-associated hemorrhage: the anticoagulation and risk factors in atrial fibrillation study. J Am Geriatr Soc 2006; 54: 1231-1236.
34. Lip GYH, Nieuwlaat R, Pisters R i wsp. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro heart survey on atrial fibrillation. Chest 2010; 137: 263-272.
35. Beyth RJ, Quinn LM, Landefeld CS. Prospective evaluation of an index for predicting the risk of major bleeding in outpatients treated with warfarin. Am J Med 1998; 105: 91-99.
36. Pisters R, Lane DA, Nieuwlaat R i wsp. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro heart survey. Chest 2010; 138: 1093-1100.
37. Shireman TI, Mahnken JD, Howard PA i wsp. Development of a contemporary bleeding risk model for elderly warfarin recipients. Chest 2006; 130: 1390-1396.
38. Russell D Hull, MBBS Ms, David A Garcia M i wsp. Biology of warfarin and modulators of INR control. UpToDate. UpToDate in Waltham. Lawrence LK Leung, MD Jennifer S Tirnauer M (red). https://www.uptodate.com/contents/biology-ofwarfarin-and-modulators-of-inr-control.
39. Piccini JP, Hellkamp AS, Washam JB i wsp. Polypharmacy and the efficacy and safety of rivaroxaban versus warfarin in the prevention of stroke in patients with nonvalvular atrial fibrillation. Circulation 2016; 133: 352-360.
40. Jaspers Focks J, Brouwer MA i wsp. Polypharmacy and effects of apixaban versus warfarin in patients with atrial fibrillation: post hoc analysis of the ARISTOTLE trial. BMJ 2016; 353: i2868.
41. Lawrence LK, Leung M. Direct oral anticoagulants (DOACs) and parenteral direct-acting anticoagulants: dosing and adverse effects. W: UpToDate. UpToDate in Waltham. Pier Mannuccio Mannucci, MD Jennifer S, Tirnauer M (red.). https://www.uptodate.com/contents/direct-oral-anticoagulants-doacs-and-parent eral-direct-acting-anticoagulants-dosing-and-adverse-effects.
42. Scowcroft ACE, Lee S, Mant J. Thromboprophylaxis of elderly patients with AF in the UK: an analysis using the general practice research database (GPRD) 2000–2009. Heart 2013; 99: 127-132.
43. Y.H. LG, Nicolas C, Lauriane P i wsp. Stroke and major bleeding risk in elderly patients aged ≥ 75 years with atrial fibrillation. Stroke 2015; 46: 143-150.
44. Fick DM, Semla TP, Steinman M i wsp. American Geriatrics Society 2019 updated AGS beers criteria® for potentially inappropriate medication use in older adults. J Am Geriatr Soc 2019; 67: 674-694.
45. Jacek Ł, Kotlińska-Lemieszek A. Opieka paliatywna/hospicyjna/medycyna paliatywna. Now Lek 2011; 80: 3-15.
46. Park H-Y, Park J-W, Song HJ i wsp. The association between polypharmacy and dementia: a nested case-control study based on a 12-year longitudinal cohort database in South Korea. PLoS One 2017; 12: e0169463.
47. Inouye SK, Westendorp RGJ, Saczynski JS. Delirium in elderly people. Lancet 2014; 383: 911-922.
48. Rawle MJ, Cooper R, Kuh D i wsp. Associations between polypharmacy and cognitive and physical capability: a British birth cohort study. J Am Geriatr Soc 2018; 66: 916-923.
49. Jyrkkä J, Enlund H, Lavikainen P i wsp. Association of polypharmacy with nutritional status, functional ability and cognitive capacity over a three-year period in an elderly population. Pharmacoepidemiol Drug Saf 2011; 20: 514-522.
50. van den Boogaard M, Pickkers P, Slooter AJC i wsp. Development and validation of PRE-DELIRIC (PREdiction of DELIRium in ICu patients) delirium prediction model for intensive care patients: observational multicentre study. BMJ 2012; 344: e420-e420.
51. Martinez JA, Belastegui A, Basabe I i wsp. Derivation and validation of a clinical prediction rule for delirium in patients admitted to a medical ward: an observational study. BMJ Open 2012; 2: 6-12.
52. Bell CM, Brener SS, Gunraj N i wsp. Association of ICU or hospital admission with unintentional discontinuation of medications for chronic diseases. JAMA 2011; 306: 840-847.
53. Ely EW, Shintani A, Truman B i wsp. Delirium as a predictor of mortality in mechanically ventilated patients in the intensive care unit. JAMA 2004; 291: 1753-1762.
54. Pandharipande PP, Pun BT, Herr DL i wsp. Effect of sedation with dexmedetomidine vs lorazepam on acute brain dysfunction in mechanically ventilated patients the MENDS randomized controlled trial. JAMA 2007; 298: 2644-2653.
55. Pandharipande P, Shintani A, Peterson J. Lorazepam is an independent risk factor for transitioning to delirium in intensive care unit patients. Anesthesiol 2006; 104: 21-26.
56. Zaal IJ, Devlin JW, Hazelbag M i wsp. Benzodiazepine-associated delirium in critically ill adults. Intensive Care Med 2015; 41: 2130-2137.
57. Garpestad E, Devlin JW. Polypharmacy and delirium in critically ill older adults: recognition and prevention. Clin Geriatr Med 2017; 33: 189-203.
58. Brouquet A, Cudennec T, Benoist S i wsp. Impaired mobility, ASA status and administration of tramadol are risk factors for postoperative delirium in patients aged 75 years or more after major abdominal surgery. Ann Surg 2010; 251: 759-765.
59. Marcantonio ER, Juarez G, Goldman L. The relationship of postoperative delirium with psychoactive medications. JAMA 1994; 272: 1518-1522.
60. Pandharipande P, Cotton BA, Shintani A i wsp. Prevalence and risk factors for development of delirium in surgical and trauma intensive care unit patients. J Trauma Inj Infect Crit Care 2008; 65: 34-41.
61. Swart LM, van der Zanden V, Spies PE i wsp. The comparative risk of delirium with different opioids: a systematic review. Drugs and Aging 2017; 34: 437-443.
62. Collamati A, Martone AM, Poscia A i wsp. Anticholinergic drugs and negative outcomes in the older population: from biological plausibility to clinical evidence. Aging Clin Exp Res 2016; 28: 25-35.
63. Wolters AE, Zaal IJ, Veldhuijzen DS i wsp. Anticholinergic medication use and transition to delirium in critically ill patients: a prospective cohort study. Crit Care Med 2015; 43: 1846-1852.
64. Gnjidic D, Hilmer SN, Blyth FM i wsp. Polypharmacy cutoff and outcomes: five or more medicines were used to identify community-dwelling older men at risk of different adverse outcomes. J Clin Epidemiol 2012; 65: 989-995.
65. Wang R, Chen L, Fan L i wsp. Incidence and effects of polypharmacy on clinical outcome among patients aged 80+: A five-year follow-up study. PLoS One 2015; 10: 1-8.
66. Marcus M, Yasamy MT, Ommeren M i wsp. Depression: a global public health concern. World Heal Organ Pap Depress 2012; 6-8.
67. Vos T, Allen C, Arora M i wsp. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the global burden of disease study 2015. Lancet 2016; 388: 1545- 602.
68. Bazargan M, Smith J, Saqib M i wsp. Associations between polypharmacy, self-rated health, and depression in African American older adults; mediators and moderators. Int J Environ Res Public Health 2019; 16: 1-14.
69. Wongpakaran N, Wongpakaran T, Sirirak T i wsp. Predictors of polypharmacy among elderly Thais with depressive and anxiety disorders: Findings from the das study. BMC Geriatr 2018; 18: 1-8.
70. Kok RM, Reynolds III CF. Management of depression in older adults: a review. JAMA 2017; 317: 2114-2122.
71. Fried TR, O’Leary J, Towle V i wsp. Health outcomes associated with polypharmacy in community-dwelling older adults: a systematic review. J Am Geriatr Soc 2014; 62: 2261-2272.
72. Kotlyar M, Dysken M, Adson DE. Update on drug-induced depression in the elderly. Am J Geriatr Pharmacother 2005; 3: 288-300.
73. D’Ancona C, Haylen B, Oelke M i wsp. The International Continence Society (ICS) report on the terminology for adult male lower urinary tract and pelvic floor symptoms and dysfunction. Neurourol Urodyn 2019; 38: 433-477.
74. Abrams P, Cardozo L, Wagg A i wsp. INCONTINENCE. Incontinence. 6th International Consultation on Incontinence, Tokyo, September 2016. 2017.
75. Hannestad YS, Rortveit G, Sandvik H i wsp. A community-based epidemiological survey of female urinary incontinence: the Norwegian EPINCONT Study. J Clin Epidemiol 2000; 53: 1150-1157.
76. O’mahony D, O’Sullivan D, Byrne S i wsp. STOPP/START criteria for potentially inappropriate prescribing in older people: version 2. Age Ageing 2015; 44: 213-218.
77. Kashyap M, Tu LM, Tannenbaum C. Prevalence of commonly prescribed medications potentially contributing to urinary symptoms in a cohort of older patients seeking care for incontinence. BMC Geriatr 2013; 13: 1.
78. Marques LP, Schneider IJC, Giehl M-WC i wsp. Demographic, health conditions, and lifestyle factors associated with urinary incontinence in elderly from FlorianÃtextthreesuperiorpolis, Santa Catarina, Brazil. Rev Bras Epidemiol 2015; 18: 595-606.
79. Ersoy S, Engin VS. Risk factors for polypharmacy in older adults in a primary care setting: a cross-sectional study. Clin Interv Aging 2018; 13: 2003-2011.
80. Pasina L, Brucato AL, Falcone C i wsp. Medication non-adherence among elderly patients newly discharged and receiving polypharmacy. Drugs Aging 2014; 31: 283-289.
81. Gray SL, Mahoney JE, Blough DK. Medication adherence in elderly patients receiving home health services following hospital discharge. Ann Pharmacother 2001; 35: 539-545.
82. Winzelberg GS, Hanson LC. Palliative care: nursing home. W: UpToDate 2020. Givens J, Schmader KE, Silveira MJ, Ritchie Ch (red). https://www.uptodate.com/contents/palliative-care- -nursing-home.
83. Burns A. Medication therapy management in pharmacy practice: core elements of an MTM service model (version 2.0). J Am Pharm Assoc 2008; 48: 341-353.
84. Perlroth D, Marrufo G, Montesinos A i wsp. Medication therapy management in a chronically III Population: final report. Acumen, LCC, Burlingame 2013.
85. Cranor CW, Bunting BA, Christensen DB. The asheville project: long-term clinical and economic outcomes of a community pharmacy diabetes care program. J Am Pharm Assoc 2003; 43: 173-184.
86. Manley HJ, Aweh G, Weiner DE i wsp. Multidisciplinary medication therapy management and hospital readmission in patients undergoing maintenance dialysis: a retrospective cohort study. Am J Kidney Dis 2020; 76:13-21.
87. Cooper JA, Cadogan CA, Patterson SM i wsp. Interventions to improve the appropriate use of polypharmacy in older people: a Cochrane systematic review. BMJ Open 2015; 5.
88. Hill-Taylor B, Walsh KA, Stewart SA i wsp. Effectiveness of the STOPP/START (screening tool of older persons’ potentially inappropriate prescriptions/screening tool to alert doctors to the right treatment) criteria: systematic review and meta-analysis of randomized controlled studies. J Clin Pharm Ther 2016; 41: 158-169.
89. KAMSOFT SA. KtoMaLek.PL

Źródło:
Medycyna Paliatywna/Wiktor Czarkowski, Sophie Bisch, Katarzyna Mleczko, Piotr Dziadkiewicz, Dominika Kmita, Michał Wójcik i Marcin Janecki
Medycyna Paliatywna/Wiktor Czarkowski, Sophie Bisch, Katarzyna Mleczko, Piotr Dziadkiewicz, Dominika Kmita, Michał Wójcik i Marcin Janecki



















